修回日期: 2015-11-16
接受日期: 2015-11-23
在线出版日期: 2015-12-18
脑源性神经营养因子是神经营养物质的一种, 近些年发现除了在中枢系统外, 在胃肠也有大量的表达, 对肠神经系统发育有着重要的作用, 参与肠道动力调节和维持内脏敏感性. 本文综述了近年来关于脑源性神经营养因子影响肠道的研究进展, 联系肠易激综合征临床表现和相关发病机制, 讨论其在肠易激综合征中的相关作用, 为临床治疗胃肠道相关疾病提供新思路.
核心提示: 胃肠道内的脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)参与调节肠动力及内脏敏感性, 在肠易激综合征(irritable bowel syndrome)中, "肠动力-BDNF-内脏高敏致痛"三者密切相关, 恢复BDNF表达水平有望成为临床治疗胃肠道相关疾病的新途径.
引文著录: 梁超, 徐斌. 脑源性神经营养因子在肠道中作用的研究进展. 世界华人消化杂志 2015; 23(35): 5649-5654
Revised: November 16, 2015
Accepted: November 23, 2015
Published online: December 18, 2015
Brain-derived neurotrophic factor is a kind of neurotrophic substance. In recent years, besides the central nervous system, brain-derived neurotrophic factor was also found to be expressed abundantly in the gastrointestinal tract, and it plays an important role in the development of the enteric nervous system and in regulating intestinal motility and visceral sensitivity. In this article, we review the role of brain-derived neurotrophic factor in the intestinal tract, and discuss its possible role in the pathogenesis of irritable bowel syndrome, with an aim to provide new ideas for clinical treatment of gastrointestinal diseases.
- Citation: Liang C, Xu B. Advances in understanding role of brain-derived neurotrophic factor in physiological and pathological processes in the intestinal tract. Shijie Huaren Xiaohua Zazhi 2015; 23(35): 5649-5654
- URL: https://www.wjgnet.com/1009-3079/full/v23/i35/5649.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i35.5649
脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)是神经营养因子家族成员之一, 广泛作用于中枢和周围神经元, 在神经元分化、发育存活中发挥重要作用[1-3]. 近些年发现BDNF不仅存在于神经系统, 在胃肠道亦有大量表达, 已有研究表明, BDNF能与P物质、降钙素基因相关肽等调节肠道感觉和动力的因子相互作用[4,5], 增强肠道蠕动, 并与肠道感觉异常、内脏高敏感有关[6,7], 在肠动力及神经元可塑性调节中发挥重要作用. 而越来越多证据表明内脏高敏感和肠动力异常在肠易激综合征(irritable bowel syndrome, IBS)发病机制起重要作用[8,9]. 本文针对BDNF在肠道中作用并联系IBS, 探讨BDNF在IBS发病机制中的作用.
BDNF最先由Brade等[10]从猪脑中提取的, 是一种含量较低的碱性蛋白, 随后的研究不断发现BDNF还在外周组织中表达, 如肠道、胰腺、肝等[11-13]. 人的BDNF基因定位于第11号染色体, 编码由247个氨基酸组成. 与BDNF相结合的受体主要分为两类[14,15]: 一类是高亲和性受体(the receptor tyrosine kinase B, TrkB), 另一类是低亲和性受体(p75 neurotrophin receptor, p75NTR). 在中枢神经系统内, BDNF与TrkB受体结合后, 受体分子二聚化, 其多个酪氨酸残基快速自动磷酸化, 这些活化的蛋白质可以通过激活3种信号通路来发挥其生物学功能[16-19], 其中TrkB-PI3K/Akt及TrkB-MEK/MAPK信号通路主要在神经元的分化、发育存活和突触可塑性调节方面发挥作用. TrkB-PLC/IP3信号传导途径激活后, 可使胞内的Ca2+浓度升高, 升高的Ca2+与其相应的受体结合, 进而引起下游的一系列反应, 包括突触囊泡的释放和离子通道的开放等, 发挥其生物学效应. p75NTR能与NTs结合, 主要介导细胞凋亡信号[20].
早期有学者通过原位杂交来检测肠道BDNF来源[21], 发现肠上皮、环形肌和肌间神经丛有大量BDNF mRNA表达, 但肠上皮细胞并不表达TrkB和P75NTR受体, 故而提示肠上皮可能是BDNF的重要来源, 但不是BDNF的靶器官. 在豚鼠回肠组织, 肌间神经丛和黏膜下神经丛发现大量BDNF及TrkB受体, 在向培养的鼠肠肌间神经丛加入外源性BDNF后, 发现其可以增强突触囊泡簇的密度并且易化突触囊泡内兴奋性神经递质的释放[22]. 在大鼠结肠组织中, 也发现了BDNF及相应的受体[23]. 此外, 在蛙和鱼等其他物种胃肠道内陆续证实了BDNF及受体的存在[24,25]. 在成人肠神经系统内, 通过对P75NTR和Trk族受体免疫组织化学双重标记[26], 结果显示Trk受体阳性表达高于P75NTR, 并与肥大细胞、淋巴结细胞等存在免疫阳性, 且在炎性状态较正常表达更强烈, 说明神经营养因子通过相应受体相互作用, 在维持ENS完整性中发挥重要作用. 因此, 不同物种的肠道内及人的肠系统内都大量存在表达的BDNF及其相应受体, 且可能通过肠道内神经发挥作用.
肠道感觉属于内脏感觉,其传入神经主要分布于黏膜下神经丛和肌间神经丛, 在各级中枢内逐级传递, 最后在大脑中整合. 迷走神经主要传导肠道的非伤害性刺激信息, 而脊神经肠感觉纤维则主要传导伤害性刺激信息. 迷走神经感觉神经元发育、存活都需要多种神经营养因子, 小鼠在BNDF基因敲除后, 出生不久就表现出迷走神经发育异常[27], BDNF的不足可以影响胃肠迷走神经神经节内板末梢(intraganglionic laminar endings, IGLEs)的发育[28], 继而影响迷走神经传入功能. 早期有学者曾提出[29], 肠道某一特定部位BDNF选择性敲除可以用于研究迷走神经感觉神经元在肠道功能调节作用.
在正常健康大鼠背根神经节(dorsal root ganglia, DRG)内,<10%的DRG表达BDNF, 而炎症状态下表达会出现增多[30]. 脊髓后角及DRG是感觉传导的重要站点, BDNF可以通过NGF-EPK和PI3K/Akt信号通路调节感觉神经元的表达, 适量的内源性BDNF可以维持感觉神经通路的正常功能, 但异常升高与慢性疼痛及高敏感密切相关[31]. 在调节内脏感觉上, BDNF可能并非完全单独发挥作用, 可与其他感觉相关因子相互作用. 降钙素基因相关肽(calcitonin gene related peptide, CGRP)被认为是介导内脏感觉中重要因子, 在DRG中, CGRP与TrkB受体存在共表达, BNDF可增强CGRP的表达[32]. 因此, BDNF可以协同CGRP共同参与介导内脏感觉.
肠神经(enteric nervous system, ENS)是存在于胃肠壁内一个独立于大脑之外的完整神经网络, 含有大量的感觉、中间和运动神经元[33,34]. 其中感觉神经元感觉肠壁的张力和肠内容物等, 中间神经元形成了各肠神经元之间的信息链, 运动神经元则改变肠的活动性, 包括黏膜下丛、深肌丛及肌间神经丛, 可局部支配调节胃肠感觉、分泌、运动等多种功能[35]. 早期研究证实外源性BDNF可作用于胚胎干细胞诱导细胞分化为具有神经纤维束的肠神经节, 在ENS生长发育过程中发挥重要作用[36], 维持着ENS的正常发育, 而ENS的异常可直接导致胃肠道功能紊乱. 在小鼠BNDF基因敲除模型中发现[37], BDNF(+/-)小鼠肠动力出现了明显下降. 外源性的BDNF可以改善肠道功能, 且肠动力提高与外源性BDNF呈剂量依赖关系, BDNF在肠道主要通过与TrkB受体相结合, 激活受体后引起PLC磷酸化, 最终引起平滑肌收缩, 其机制可能与调节P物质水平密切相关[38]. 相反, 通过使用TrkB-PLC/IP3通道拮抗剂可以阻断BDNF兴奋肠道作用[39]. 由此可知, BDNF可能具有神经递质的性质, 可增强兴奋性传导运动, 如BDNF显著增强兴奋性神经递质如P物质, 使突触囊泡释放易化增加, 对肠道动力发挥作用.
BDNF作为一种神经递质样或调控其他神经递质的角色, 还可参与调控内脏感觉. 有研究发现, 活化后的TrkB, 可以促进5-HT、CGRP等感觉因子的释放, 影响感觉信号的传导[40], 与内脏敏感性密切相关. 内脏高敏感是指内脏组织对刺激的感受性增强, 表现为引起各种感觉的容量或压力阈值降低, 对一定强度刺激的反应增强. 通过对小鼠结直肠扩张(CRD)发现, 对于伤害性刺激BDNF(+/-)小鼠内脏敏感性较BDNF(+/+)小鼠显著降低, 且在肠炎状态下, BDNF(+/-)小鼠同样表现出低敏感状态[41], 说明一定水平的BDNF与内脏感觉关系密切, BDNF过度的缺失可引起内脏敏感性下降. 另有研究[42]通过在大鼠远端结肠注入三硝基苯磺酸(TNBS)引起肠道高敏, 使结肠感觉阈值显著降低, 但若提前给予BDNF抗体可提高感觉阈值, 相反若提前给予外源性BDNF感觉阈值则呈剂量依赖性下降, BDNF的异常增高还引起肠道敏感性的升高. 因此, 正常状态下BDNF维持内脏感觉的敏感性, 而BDNF水平的异常会改变肠道的敏感性.
IBS是临床常见的功能性胃肠疾病之一, 其发病机制目前尚不完全明确. 许多假说已提出解释IBS发病机制, 包括改变在肠道动力改变、内脏高敏感性、脑-肠调节途径、消化神经免疫功能感染后或炎症后的改变、肠道微生物群落和心理因素等[43-46]. 肠道动力的改变可直接导致胃肠道功能的紊乱, 从而出现便秘或腹泻等常见的临床症状. 此外, 内脏敏感性增高被认为是IBS主要的病理生理基础之一, 也是引起腹痛的重要原因, 因此有学者认为内脏高敏感是IBS的生物学标志[47,48].
有研究通过对大鼠反复避水应激(water avoidance stress, WAS)诱导的IBS模型中发现[49], 反复的WAS可导致肠动力加强, 粪便排除量增加, 此时结肠黏膜BDNF和TrkB受体都出现了表达增多, 若结肠经过BDNF预处理后可通过影响P物质加强环形肌收缩, 使用TrkB抗体处理后则可抑制此过程, 说明反复WAS引起结肠动力增强与内源性BDNF和TrkB受体升高有关. 而通过急慢性联合应激刺激(chronic acute combining stress, CAS)诱导IBS模型中也发现[50], 持续的应激刺激后, 结肠中BDNF表达显著增多, 而海马区BDNF表达下降, 且通过药物治疗恢复后, 海马区BDNF表达升高, 相应结肠部位的表达下降. 因此, IBS中肠动力的异常和内源性BDNF的表达水平密切相关, 另有最新的研究[51]指出IBS尤其是腹泻型(IBS-D)的患者结肠黏膜BDNF表达显著增高, 电镜下黏膜神经纤维超微结构损伤, 且与患者腹部不适的严重成都和频率相关, 此外, BDNF(+/-)小鼠同BDNF(+/+)小鼠相比, 内脏感知降低, 电镜下黏膜神经纤维出现退行性改变, 给予外源性BDNF后, 脊髓背根神经节内TrkB受体呈依赖性表达增加, 结肠感觉阈值呈剂量依赖性下降. 故而得知, IBS-D存在结肠BDNF表达增加, 连同黏膜神经支配的结构改变, 同时与腹部疼痛程度相关, 而BDNF维持内脏的敏感性, 因此, 除肠动力改变与BDNF相关外, 内源性的BDNF异常表达还可导致IBS患者的内脏痛[52]. 相反, 若阻断结肠中BDNF的信号传导, 则可减弱对CRD的反应, 其机制主要通过抑制/减弱BDNF表达继而降低内脏敏感性[40,41]. 因此, 在IBS中, 恢复BDNF表达水平可能是缓解IBS症状的重要因素.
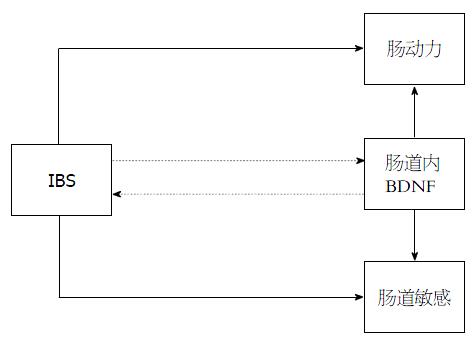
BDNF由神经营养因子家族成员延伸至神经递质样的角色, 在肠道动力和内脏敏感性中有重要调节作用, 因此研究BDNF在肠道相关疾病如IBS等发病机制的作用, 将有利于寻找更有效的治疗方法. 在IBS特别是IBS-D中, "肠动力-BDNF-内脏高敏致痛"三者紧密相关(图1), 恢复BDNF表达水平有望成为临床治疗胃肠道相关疾病的新思路.
脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)是神经营养因子家族成员之一, 广泛作用于中枢和周围神经元, 近些年发现在肠道中亦有大量表达, 与肠道动力和内脏高敏感有关. 而越来越多证据表明内脏高敏感和肠动力异常在肠易激综合征(irritable bowel syndrome, IBS)发病机制起重要作用, 因此本文针对肠道内BDNF并联系在IBS中作用进行深入的探讨.
姜宏, 教授, 青岛大学
BDNF可以调节肠道动力, 同时影响内脏感觉. 其表达异常升高, 不仅引起肠动力加快, 还可引起内脏高敏, 引发内脏痛. 恢复BDNF水平, 有望成为缓解胃肠相关症状的新途径.
诸多研究发现BDNF不仅存在于中枢神经系统, 在胃肠道亦有大量表达, 并能与调节肠道感觉和动力的因子相互作用, 如P物质、降钙素基因相关肽等, 增强肠道蠕动, 同时还影响肠道感觉, 异常升高与内脏高敏感密切相关.
本文通过针对BDNF对肠道动力及内脏感觉等大量文献研究, 并联系IBS, 进一步展开肠道内的BDNF在IBS中变化情况, 为研究IBS发病机制及治疗提供新思路.
本文对肠道内BDNF最新发现进行了相关研究, 为治疗及预防胃肠道疾病相关症状提供理论依据.
本文综述了BDNF对肠道动力、内脏感觉和内脏敏感性调节作用的研究进展, 并以BDNF在肠易激综合征中的调节肠动力和肠敏感作用为例, 总结得出"肠动力-BDNF-内脏高敏致痛"三者紧密相关, 为研究BDNF在肠道相关疾病如IBS等发病机制的作用提供了新的信息.
编辑: 郭鹏 电编:都珍珍
| 1. | Cohen-Cory S, Kidane AH, Shirkey NJ, Marshak S. Brain-derived neurotrophic factor and the development of structural neuronal connectivity. Dev Neurobiol. 2010;70:271-288. [PubMed] [DOI] |
| 2. | Chang DJ, Lee N, Choi C, Jeon I, Oh SH, Shin DA, Hwang TS, Lee HJ, Kim SU, Moon H. Therapeutic effect of BDNF-overexpressing human neural stem cells (HB1.F3.BDNF) in a rodent model of middle cerebral artery occlusion. Cell Transplant. 2013;22:1441-1452. [PubMed] [DOI] |
| 3. | Yang Z, Qiao H, Sun Z, Li X. Effect of BDNF-plasma-collagen matrix controlled delivery system on the behavior of adult rats neural stem cells. J Biomed Mater Res A. 2013;101:599-606. [PubMed] [DOI] |
| 4. | He XP, Pan E, Sciarretta C, Minichiello L, McNamara JO. Disruption of TrkB-mediated phospholipase Cgamma signaling inhibits limbic epileptogenesis. J Neurosci. 2010;30:6188-6196. [PubMed] [DOI] |
| 5. | Chen FX, Yu YB, Yuan XM, Zuo XL, Li YQ. Brain-derived neurotrophic factor enhances the contraction of intestinal muscle strips induced by SP and CGRP in mice. Regul Pept. 2012;178:86-94. [PubMed] [DOI] |
| 6. | Moloney RD, Dinan TG, Cryan JF. Strain-dependent variations in visceral sensitivity: relationship to stress, anxiety and spinal glutamate transporter expression. Genes Brain Behav. 2015;14:319-329. [PubMed] [DOI] |
| 7. | Johansson M, Norrgård O, Forsgren S. Study of expression patterns and levels of neurotrophins and neurotrophin receptors in ulcerative colitis. Inflamm Bowel Dis. 2007;13:398-409. [PubMed] |
| 8. | Lowén MB, Mayer E, Tillisch K, Labus J, Naliboff B, Lundberg P, Thorell LH, Ström M, Engström M, Walter S. Deficient habituation to repeated rectal distensions in irritable bowel syndrome patients with visceral hypersensitivity. Neurogastroenterol Motil. 2015;27:646-655. [PubMed] [DOI] |
| 9. | Bouin M, Plourde V, Boivin M, Riberdy M, Lupien F, Laganière M, Verrier P, Poitras P. Rectal distention testing in patients with irritable bowel syndrome: sensitivity, specificity, and predictive values of pain sensory thresholds. Gastroenterology. 2002;122:1771-1777. [PubMed] |
| 10. | Barde YA, Edgar D, Thoenen H. Purification of a new neurotrophic factor from mammalian brain. EMBO J. 1982;1:549-553. [PubMed] |
| 11. | Cruz CD. Neurotrophins in bladder function: what do we know and where do we go from here? Neurourol Urodyn. 2014;33:39-45. [PubMed] [DOI] |
| 12. | Steinkamp M, Schulte N, Spaniol U, Pflüger C, Hartmann C, Kirsch J, von Boyen GB. Brain derived neurotrophic factor inhibits apoptosis in enteric glia during gut inflammation. Med Sci Monit. 2012;18:BR117-BR122. [PubMed] |
| 13. | Lucini C, Maruccio L, De Girolamo P, Castaldo L. Brain-derived neurotrophic factor in higher vertebrate pancreas: immunolocalization in glucagon cells. Anat Embryol (Berl). 2003;206:311-318. [PubMed] |
| 14. | Luikart BW, Parada LF. Receptor tyrosine kinase B-mediated excitatory synaptogenesis. Prog Brain Res. 2006;157:15-24. [PubMed] |
| 15. | Xu R, Duan SR, Zhao JW, Wang CY. Changes in expression of BDNF and its receptors TrkB and p75NTR in the hippocampus of a dog model of chronic alcoholism and abstinence. Braz J Med Biol Res. 2015;48:703-710. [PubMed] [DOI] |
| 16. | Andero R, Choi DC, Ressler KJ. BDNF-TrkB receptor regulation of distributed adult neural plasticity, memory formation, and psychiatric disorders. Prog Mol Biol Transl Sci. 2014;122:169-192. [PubMed] [DOI] |
| 17. | Huang EJ, Reichardt LF. Trk receptors: roles in neuronal signal transduction. Annu Rev Biochem. 2003;72:609-642. [PubMed] |
| 19. | Minichiello L, Calella AM, Medina DL, Bonhoeffer T, Klein R, Korte M. Mechanism of TrkB-mediated hippocampal long-term potentiation. Neuron. 2002;36:121-137. [PubMed] |
| 20. | Skeldal S, Sykes AM, Glerup S, Matusica D, Palstra N, Autio H, Boskovic Z, Madsen P, Castrén E, Nykjaer A. Mapping of the interaction site between sortilin and the p75 neurotrophin receptor reveals a regulatory role for the sortilin intracellular domain in p75 neurotrophin receptor shedding and apoptosis. J Biol Chem. 2012;287:43798-43809. [PubMed] [DOI] |
| 21. | Lommatzsch M, Braun A, Mannsfeldt A, Botchkarev VA, Botchkareva NV, Paus R, Fischer A, Lewin GR, Renz H. Abundant production of brain-derived neurotrophic factor by adult visceral epithelia. Implications for paracrine and target-derived Neurotrophic functions. Am J Pathol. 1999;155:1183-1193. [PubMed] |
| 22. | Boesmans W, Gomes P, Janssens J, Tack J, Vanden Berghe P. Brain-derived neurotrophic factor amplifies neurotransmitter responses and promotes synaptic communication in the enteric nervous system. Gut. 2008;57:314-322. [PubMed] |
| 23. | Jardí F, Martínez V, Vergara P. NGF is involved in oral ovalbumin-induced altered colonic contractility in rats: evidence from the blockade of TrkA receptors with K252a. Neurogastroenterol Motil. 2012;24:e580-e590. [PubMed] [DOI] |
| 24. | Maruccio L, Castaldo L, de Girolamo P, Lucini C. Neurotrophin and Trk receptor-like immunoreactivity in the frog gastrointestinal tract. Histol Histopathol. 2004;19:349-356. [PubMed] |
| 25. | Radaelli G, Domeneghini C, Arrighi S, Castaldo L, Lucini C, Mascarello F. Neurotransmitters, neuromodulators, and neurotrophin receptors in the gut of pantex, a hybrid sparid fish (Pagrus major x Dentex dentex). Localizations in the enteric nervous and endocrine systems. Histol Histopathol. 2001;16:845-853. [PubMed] |
| 26. | Kondyli M, Varakis J, Assimakopoulou M. Expression of p75NTR and Trk neurotrophin receptors in the enteric nervous system of human adults. Anat Sci Int. 2005;80:223-228. [PubMed] |
| 27. | Murphy MC, Fox EA. Mice deficient in brain-derived neurotrophic factor have altered development of gastric vagal sensory innervation. J Comp Neurol. 2010;518:2934-2951. [PubMed] [DOI] |
| 28. | Biddinger JE, Fox EA. Reduced intestinal brain-derived neurotrophic factor increases vagal sensory innervation of the intestine and enhances satiation. J Neurosci. 2014;34:10379-10393. [PubMed] [DOI] |
| 29. | Fox EA. A genetic approach for investigating vagal sensory roles in regulation of gastrointestinal function and food intake. Auton Neurosci. 2006;126-127:9-29. [PubMed] |
| 30. | Lin YT, Ro LS, Wang HL, Chen JC. Up-regulation of dorsal root ganglia BDNF and trkB receptor in inflammatory pain: an in vivo and in vitro study. J Neuroinflammation. 2011;8:126. [PubMed] [DOI] |
| 31. | Qiao LY. Neurotrophin signaling and visceral hypersensitivity. Front Biol (Beijing). 2014;9:216-224. [PubMed] |
| 32. | Qiao LY, Grider JR. Up-regulation of calcitonin gene-related peptide and receptor tyrosine kinase TrkB in rat bladder afferent neurons following TNBS colitis. Exp Neurol. 2007;204:667-679. [PubMed] |
| 33. | Mazzuoli-Weber G, Schemann M. Mechanosensitivity in the enteric nervous system. Front Cell Neurosci. 2015;9:408. [PubMed] [DOI] |
| 34. | Uesaka T, Nagashimada M, Enomoto H. Neuronal Differentiation in Schwann Cell Lineage Underlies Postnatal Neurogenesis in the Enteric Nervous System. J Neurosci. 2015;35:9879-9888. [PubMed] [DOI] |
| 35. | Burns AJ, Roberts RR, Bornstein JC, Young HM. Development of the enteric nervous system and its role in intestinal motility during fetal and early postnatal stages. Semin Pediatr Surg. 2009;18:196-205. [PubMed] [DOI] |
| 36. | Takaki M, Nakayama S, Misawa H, Nakagawa T, Kuniyasu H. In vitro formation of enteric neural network structure in a gut-like organ differentiated from mouse embryonic stem cells. Stem Cells. 2006;24:1414-1422. [PubMed] |
| 37. | Grider JR, Piland BE, Gulick MA, Qiao LY. Brain-derived neurotrophic factor augments peristalsis by augmenting 5-HT and calcitonin gene-related peptide release. Gastroenterology. 2006;130:771-780. [PubMed] |
| 38. | Al-Qudah M, Anderson CD, Mahavadi S, Bradley ZL, Akbarali HI, Murthy KS, Grider JR. Brain-derived neurotrophic factor enhances cholinergic contraction of longitudinal muscle of rabbit intestine via activation of phospholipase C. Am J Physiol Gastrointest Liver Physiol. 2014;306:G328-G337. [PubMed] [DOI] |
| 39. | Chen F, Yu Y, Wang P, Dong Y, Wang T, Zuo X, Li Y. Brain-derived neurotrophic factor accelerates gut motility in slow-transit constipation. Acta Physiol (Oxf). 2014;212:226-238. [PubMed] [DOI] |
| 40. | Wang P, Chen FX, Du C, Li CQ, Yu YB, Zuo XL, Li YQ. Increased production of BDNF in colonic epithelial cells induced by fecal supernatants from diarrheic IBS patients. Sci Rep. 2015;5:10121. [PubMed] [DOI] |
| 41. | Yang J, Yu Y, Yu H, Zuo X, Liu C, Gao L, Chen ZY, Li Y. The role of brain-derived neurotrophic factor in experimental inflammation of mouse gut. Eur J Pain. 2010;14:574-579. [PubMed] [DOI] |
| 42. | Delafoy L, Gelot A, Ardid D, Eschalier A, Bertrand C, Doherty AM, Diop L. Interactive involvement of brain derived neurotrophic factor, nerve growth factor, and calcitonin gene related peptide in colonic hypersensitivity in the rat. Gut. 2006;55:940-945. [PubMed] |
| 43. | Brown H, Cartwright R. Re: The Relationship Between Irritable Bowel Syndrome, Functional Dyspepsia, Chronic Fatigue and Overactive Bladder Syndrome: A Controlled Study 6 Years After Acute Gastrointestinal Infection. Eur Urol. 2015;68:1099-1100. [PubMed] [DOI] |
| 44. | Wernersson R, Carlsson J. [Posttraumatic stress disorder is correlated to irritable bowel syndrome]. Ugeskr Laeger. 2015;177:1248-1252. [PubMed] |
| 45. | Fukudo S. Gut microbiota in irritable bowel syndrome. Nihon Shokakibyo Gakkai Zasshi. 2015;112:1956-1965. [PubMed] [DOI] |
| 46. | Le Nevé B, Brazeilles R, Derrien M, Tap J, Guyonnet D, Ohman L, Törnblom H, Simrén M. Lactulose Challenge Determines Visceral Sensitivity and Severity of Symptoms in Patients With Irritable Bowel Syndrome. Clin Gastroenterol Hepatol. 2015; Oct 19. [Epub ahead of print]. [PubMed] [DOI] |
| 47. | van Diest SA, Stanisor OI, de Jonge WJ, Boeckxstaens GE, van den Wijngaard RM. Visceral hypersensitivity in IBS: from bench to bedside. J Pediatr Gastroenterol Nutr. 2011;53 Suppl 2:S34-S35. [PubMed] |
| 48. | Theodorou V, Ait Belgnaoui A, Agostini S, Eutamene H. Effect of commensals and probiotics on visceral sensitivity and pain in irritable bowel syndrome. Gut Microbes. 2014;5:430-436. [PubMed] [DOI] |
| 49. | Quan X, Luo H, Fan H, Tang Q, Chen W, Cui N, Yu G, Xia H. Brain-Derived Neurotrophic Factor Contributes to Colonic Hypermotility in a Chronic Stress Rat Model. Dig Dis Sci. 2015;60:2316-2326. [PubMed] [DOI] |
| 50. | Yu Y, Wu S, Li J, Wang R, Xie X, Yu X, Pan J, Xu Y, Zheng L. The effect of curcumin on the brain-gut axis in rat model of irritable bowel syndrome: involvement of 5-HT-dependent signaling. Metab Brain Dis. 2015;30:47-55. [PubMed] [DOI] |
| 51. | Yu YB, Zuo XL, Zhao QJ, Chen FX, Yang J, Dong YY, Wang P, Li YQ. Brain-derived neurotrophic factor contributes to abdominal pain in irritable bowel syndrome. Gut. 2012;61:685-694. [PubMed] [DOI] |
| 52. | Joo YE. Increased Expression of Brain-derived Neurotrophic Factor in Irritable Bowel Syndrome and Its Correlation With Abdominal Pain (Gut 2012; 61: 685-694). J Neurogastroenterol Motil. 2013;19:109-111. [PubMed] [DOI] |