修回日期: 2015-11-04
接受日期: 2015-11-17
在线出版日期: 2015-12-18
目的: 观察内源性硫化氢(hydrogen sulfide, H2S)在不同程度肝硬化心肌病(cirrhotic cardiomyopathy, CCM)大鼠心肌组织中的变化, 探讨其在CCM发病中的价值.
方法: 40只SPF级♂SD大鼠, 体质量220-250 g, 随机分为空白对照组(9只, N组), 余31只为模型组. N组给予标准颗粒饲料喂养, 饮自来水. 模型组大鼠给予60%四氯化碳(carbon tetrachloride, CCl4)橄榄油溶液皮下注射, 以3 mL/kg, 2次/wk, 首剂加倍, 同时第l、2周以100 mL/L乙醇为唯一饮用水, 第3、4周改200 mL/L乙醇为唯一饮用水, 第5周开始用300 mL/L乙醇为唯一饮用水. 造模至12 wk时, 取9只模型大鼠(模型组1, M1组)处死取材. 其余动物继续注射60%CCl4橄榄油溶液, 饮用300 mL/L乙醇造模2 wk, 实验结束剩余模型大鼠为模型组2(M2组). N组、M2组大鼠于14 wk末处死取材. 常规检测各组动物肝功能血清丙氨酸转移酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate transaminase, AST)、总蛋白(total protein, TP). 检测心肌组织H2S含量. 检测心肌及肝脏组织病理学.
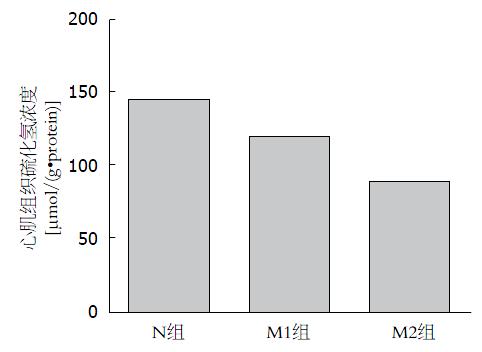
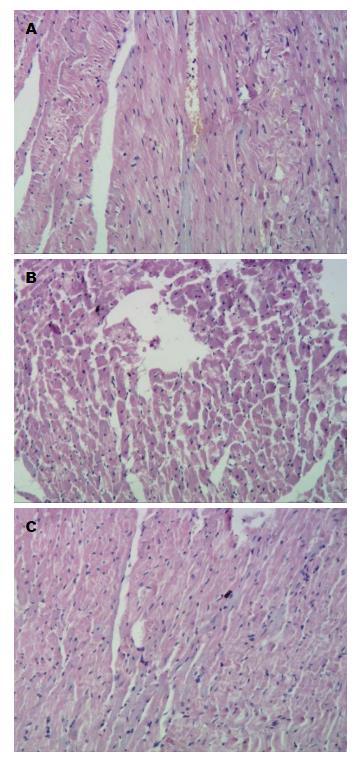
结果: (1)肝功能: M1组、M2组ALT、AST上升, TP下降, 与N组比较有显著差异(P<0.01); M2组ALT、AST上升较M1组明显, 差异具有显著性(P<0.01); (2)心肌组织H2S: 与N组比较, M1组心肌组织H2S下降达18%, 差异具有显著性(P<0.05), M2组下降达38%, 差异具有显著性(P<0.01), M2组较M1组明显, 差异具有显著性(P<0.05); (3)肝脏病理学: N组为正常肝组织, M1组、M2组为肝硬化, M2组肝硬化程度较M1组严重; (4)心肌病理学: N组为正常心肌组织, 排列整齐; M1组心肌细胞大致正常, 但心肌水肿; M2组心肌水肿坏死.
结论: 肝硬化发生发展中, 内源性H2S浓度的下降使其对心肌保护作用逐渐减弱, 这可能是CCM产生的原因之一.
核心提示: 本研究通过四氯化碳皮下注射联合饮用乙醇建立肝硬化后肝硬化心肌病(cirrhotic cardiomyopathy, CCM)动物模型, 观察心脏组织硫化氢(hydrogen sulfide, H2S)变化, 发现内源性H2S浓度的下降使其对心肌保护作用逐渐减弱, 这可能是CCM产生的原因之一.
引文著录: 雷旭, 殷华, 柏杏丽, 严文婷, 杨光敏, 桂兰兰, 谭华炳. 气体信号分子硫化氢在肝硬化心肌病大鼠心肌组织中的变化. 世界华人消化杂志 2015; 23(35): 5606-5612
Revised: November 4, 2015
Accepted: November 17, 2015
Published online: December 18, 2015
AIM: To observe the changes of endogenous hydrogen sulfide (H2S) in myocardial tissue of rats with cirrhotic cardiomyopathy (CCM) of different severities, in order to investigate the role of H2S in the pathogenesis of CCM.
METHODS: Forty SPF-grade male SD rats, weighing 220-250 g, were randomly divided into a blank control group (group N, n = 9) and a CCM model group (group M, n = 31). Group N was fed an ordinary diet and given tap water. Group M was subcutaneously injected with CCl4 (3 mL/kg, given double dose for the first time) twice a week and given 100 mL/L ethanol in drinking water in the first two weeks, and 200 mL/L ethanol was given for the next two weeks. From the fifth week, rats with CCM started to drink 300 mL/L ethanol. At the end of the twelfth week, 9 rats (group M1) were randomly selected from group M and killed, while the rest (group M2) were killed at the fourteen week. Alanine aminotransferase (ALT), aspartate transaminase (AST), and total protein (TP) were detected. The concentration of H2S in the myocardium was measured. Myocardial and liver pathology was assessed.
RESULTS: The levels of ALT and AST significantly increased and TP significantly decreased in the M1 and M2 groups compared with group N (P < 0.01). ALT and AST levels were also significantly higher in group M2 than in group M1. Compared with group N, the concentration of H2S in groups M1 and M2 declined by up to 18% (P < 0.05) and 38% (P < 0.01), respectively, and the decrease was more significant in group M2 than in group M1 (P < 0.05). Group N had normal liver tissue, and groups M1 and M2 had hepatic cirrhosis, which was more severe in group M2. Group N had normal myocardial tissue. Myocardial cells were grossly normal but myocardial edema was seen in group M1. Myocardial edema and necrosis were observed in group M2.
CONCLUSION: In the process of liver cirrhosis, the protection on the myocardium becomes weak with the decreased level of endogenous hydrogen sulfide, which may play a crucial role in the pathogenesis of CCM.
- Citation: Lei X, Yin H, Bai XL, Yan WT, Yang GM, Gui LL, Tan HB. Changes of endogenous hydrogen sulfide in myocardial tissue of rats with cirrhotic cardiomyopathy. Shijie Huaren Xiaohua Zazhi 2015; 23(35): 5606-5612
- URL: https://www.wjgnet.com/1009-3079/full/v23/i35/5606.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i35.5606
肝硬化性心肌病(cirrhotic cardiomyopathy, CCM)是一个即年老又年青的疾病. 早在1953年Kowalshi等就发现肝硬化患者中约有1/3存在心功能的异常, 但由于患者通常情况下不出现心衰症状, 没有引起临床重视. 近年来, 随着基础研究的进展、肝脏移植等手术的开展, 其病理生理和临床重要性日益受到重视. 大多数肝硬化患者心肌收缩力呈现标准基线, 但基础心输出量在不同程度上有所增加, 血管压力反应下降, 导致基础心输出量增加、外周血管阻力下降和动脉压下降、心室的舒张性和/或收缩性减弱等一系列改变, 此时被称为CCM[1]. 一旦对此类患者行肝移植、外科门体分流术、经颈静脉肝内门体分流术等, 即可诱导心力衰竭的出现[2], 肝移植术中观察到异常心脏反应, 也可能是CCM的一个隐匿性表现[3]. 既往临床上发现, CCM患者存在心脏功能(以左室舒张功能)下降和心电图异常[4-8]. 近来有关专家认为, CCM可能是腹水、曲张静脉破裂出血、大手术或肝移植术后死亡率增加的重要原因[9]. 中国是病毒性肝炎大国, 存在大量的终末期肝病患者, 防止腹水、曲张静脉破裂出血、肝脏移植手术过程中因CCM导致的死亡率增加是一个不容忽视的社会和医学问题.
神经-内分泌-气体信号分子在心血管疾病发病中的作用已经得到公认. 硫化氢(hydrogen sulfide, H2S)是新近发现的气体信号分子, 在几乎所有的组织中都能产生, 产生率较高的是脑、心血管、肝和肾[10]. 肝硬化大鼠和人肝组织和血浆H2S浓度下降, 与疾病程度相关[11,12]. 既往研究发现在心血管病发生发展过程中有H2S浓度的改变, 但H2S在CCM发病过程中的变化及其意义, 国内外未见报道. 本研究通过四氯化碳(carbon tetrachloride, CCl4)皮下注射联合饮用乙醇建立肝硬化后CCM动物模型, 观察心肌组织H2S变化.
健康♂SPF级SD大鼠40只, 体质量220-250 g, 湖北医药学院实验动物中心提供[许可证号: SCXK(鄂)2011-0008, No. 00018275], 实验场地湖北省十堰市东风总医院动物实验中心[许可证号: SYXK(鄂)2009-0026, No. 00023725], 标准颗粒饲料由湖北医药学院动物实验中心提供, 动物自由进食、饮自来水, 给予标准颗粒饲料喂养, 室温18 ℃-22 ℃, 相对湿度40%-60%, 自然光照环境中适应性饲养1 wk后进行实验. 分析纯CCl4购自北京瑞尔欣德科技有限公司, 橄榄油为市售食用高级橄榄油, 使用时用橄榄油配制成60%CCl4溶液. 乙醇(分析纯)购自上海中试化工总公司, 临用前用蒸馏水配制成实验所需的浓度. 血清丙氨酸转移酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate transaminase, AST)、总蛋白(total protein, TP)含量采用Hitch7600全自动生化分析仪检测, 由十堰市人民医院检验科提供设备及其专用试剂, 并实施检测. 心肌H2S检测设备、试剂由北京大学生理与病理学系提供全套专用设备, 并实施检测. 冷冻低温离心机(上海中科生物医学高科技开发有限公司, DL-45R-L); 紫外光分光光度计(北京, 北方华粤贸易有限公司); 德国产组织匀浆机. Olympus DP-70显微摄影系统(日本奥林巴斯公司产品).
1.2.1 实验动物的分组: SD大鼠购入后, 普通饲料饲养观察1 wk, 动物无死亡及不良反应. 按照实验设计将40只SD大鼠随机抽出9只为空白组(N组), 余31只为模型组.
1.2.2 CCM大鼠造模: 参照文献[13,14]给予大鼠皮下注射60%CCl4橄榄油溶液, 以3 mL/kg, 2次/wk, 首剂加倍, 同时第l、2周以100 mL/L乙醇为唯一饮用水, 第3、4周改200 mL/L乙醇, 第5周开始用300 mL/L乙醇, 第12周末即可制成肝硬化大鼠模型. 造模至12 wk期间, 大鼠死亡6只, 实有大鼠25只, 取9只模型大鼠(模型组1, M1)处死, 按标本采集处理方式采集肝组织、心脏组织, 采集血浆. 其余动物继续注射60%CCl4橄榄油溶液, 饮用300 mL/L乙醇造模2 wk, 期间大鼠死亡6只, 实验结束实有模型大鼠(模型组2, M2)10只.
1.2.3 动物状况与数量: N组9只毛发光亮, 食欲好, 活动良好, 对外界反应灵敏. 模型组(M1, M2)大鼠毛发凌乱, 无光泽, 食欲差, 精神萎靡, 活动少, 对外界反应迟钝.
1.2.4 标本采集与处理: N组、M2组标本采集时间为第14周末. M1组标本采集时间为第12周末. 末次给药后禁食12 h. 用35 g/L的戊巴比妥钠(35 g/kg)腹腔注射麻醉动物. 开腹, 腹主动脉取血, 低温离心, 取血浆, -70 ℃保存待检. 按照实验设计在肝脏最大叶内1 cm取0.5 cm×0.5 cm×0.5 cm的组织各3份, 在心尖处取0.5 cm×0.5 cm×0.5 cm组织各3份, 1份用40 g/L甲醛固定, 按照常规制成石蜡切片; 另2份参照文献方法, 制备肝脏、心肌组织匀浆液, -70 ℃冷存待检. 所有标本均同步检测.
1.2.5 标本的检测: (1)肝功能检测: 采用Hitch7600生化分析仪检测各组血清中ALT、AST、TP的含量, 由十堰市人民医院检验科提供设备及其专用试剂; (2)心肌组织H2S检测: 参照文献[15-17]方法制备心肌组织匀浆液. 将标准品、组织匀浆液在酶标包被板上准确加样50 μL; 37 ℃温育30 min后洗涤; 加入酶标试剂50 μL, 37 ℃温育30 min后洗涤; 加入显色剂, 37 ℃避光显色10 min; 加终止液50 μL; 于酶标仪测定各孔450 nm波长的吸光度(A)值. 以标准品浓度作横坐标, 对应A值作纵坐标, 绘制出标准品线性回归曲线, 按曲线方程计算各样本浓度值. 由北京大学医学部生理学系检测; (3)肝组织病理学变化: 在肝脏最大叶, 取肝组织0.5 cm, 多聚甲醛常规固定制作切片, 约4 μm厚, 60 ℃恒温烤片后, 脱腊, 苏木素-伊红染色, 脱水, 中性树胶封片后在镜下观察肝组织病理改变等; (4)心肌组织病理学变化, 具体操作方法与肝组织病理学切片方法一致.
统计学处理 本文结果部分的数据, 计量资料统计描述用mean±SD表示, 两组间数据处理采用t检验; 并应用SPSS17.0软件对实验数据进行统计学分析, 检验水准α = 0.01, 或α = 0.05, 以P<0.05为差异具有统计学意义.
与N组相比, M1组、M2组ALT、AST上升, TP下降, 与N组比较有显著差异(P<0.01); M2组ALT、AST上升较M1组明显, 差异具有显著性(P<0.01)(表1).
肝脏大体观显示, N组为正常肝组织, M1组、M2组为肝硬化, M2组肝硬化程度较M1组严重.
心脏大体观显示, N组为正常心肌组织, 心肌细胞排列整齐; M1组心肌细胞大致正常, 但心肌水肿; M2组心肌细胞水肿坏死(图2).
当前, CCM对肝硬化预后的影响越来越引起临床的重视, CCM对肝硬化治疗效果的影响越来越受到医患双方的重视. 探索CCM发病的病理生理过程, 通过干预CCM发病的病理生理过程抑制CCM的发展, 提高生活质量, 成为CCM研究的热点.
要研究CCM的发病机制, 就必须制备稳定的CCM模型, 制备CCM的基础就是制备肝硬化动物模型. 目前制备肝硬化动物模型的方法较多, 有CCl4诱导的肝硬化模型(单纯CCl4, CCl4联合苯巴比妥, 或联合乙醇、或复合法)、DMNA诱导的肝硬化模型、DEN诱导的肝硬化模型, 但以CCl4联合乙醇最为常用. 该方法制成的肝硬化模型与人类酒精性肝硬化病理特点相似, 并且比单纯应用乙醇制造肝硬化造模时间缩短[18], 而CCM最早就是在酒精性肝硬化患者中发现的. 因此, 本研究选择该模型. CCl4经皮下注射后, 迅速被机体吸收, 可直接溶解肝细胞膜, 经肝细胞细胞色素P450依赖性混合功能氧化酶的代谢生成三氯化碳(CCl3), 启动脂质过氧化反应, 引起肝细胞损伤[19]. 乙醇能诱导P450活性从而增加CCl4肝毒性[20], 加剧肝细胞的损伤、坏死, 形成肝硬化模型, 随着肝硬化程度的加重, CCM逐渐形成.
本研究的肝脏病理学检测发现空白组为正常肝组织, M1组为肝硬化模型, M2组为严重肝硬化, 通过延长造模时间的方法, 建立类似于临床Child-Pugh B级、Child-Pugh C级的肝硬化模型. 心脏病理学大体观发现与正常动物相比, M1组心脏稍苍白, M2组明显苍白. HE染色发现空白组为正常心肌组织, 排列整齐; M1组心肌细胞大致正常, 但心肌水肿; M2组心肌水肿坏死; 说明CCM造模成功. 课题组认为实验大鼠心肌病理学改变主要与大鼠肝硬化的形成有关, 而与CCl4和酒精的直接作用无关. 张云巍等[21]研究认为本方法制备的肝硬化大鼠模型主要引起肝脏的病理学改变, 对其他重要脏器的影响较小, 发生的改变与人类发生肝硬化时重要脏器的病理学改变基本一致.
肝功能检测发现ALT、AST上升, M2组较M1组差异具有显著性, 也说明不同程度肝硬化模型形成. 在此基础上, 课题组对心肌组织H2S浓度进行了检测, 结果发现, M1组、M2组心肌组织H2S显著下降, M2组下降较M1组更明显, 具有显著差异.
H2S在心血管系统具有多种生理和病理调节作用, 被认为是心血管功能调节的新型气体信号分子[22], 参与诸多心血管疾病的发病与转归. 血管内H2S主要有由平滑肌细胞产生, 发挥舒血管效应, 其机制可能有: (1)兴奋ATP敏感性钾通道, 增加该通道的电流, 使细胞膜出现超极化[23]; (2)激活cAMP/PKA信号通路, 提高胞内钙离子浓度[24]; (3)抑制细胞色素C氧化酶[25]; (4)抑制平滑肌细胞增殖, 下调凋亡抑制因子, 诱导血管平滑肌的凋亡[26,27]. 大量动物实验研究[28-31]发现H2S可通过抗氧化损伤、舒张血管、抑制细胞凋亡、抗炎等作用对体外或体内的多种心肌损伤模型起到保护作用. 本研究发现的心肌组织H2S的变化, 说明CCM大鼠抗氧化损伤、舒张血管、抑制细胞凋亡、抗炎等作用下降, 对抗心肌损伤作用下降.
既往研究[32]发现, 给予外源性H2S供体NaHS升高肝硬化大鼠门静脉血浆中H2S的含量, 可以抑制门静脉高压的形成, 而予以外源性H2S合成酶CSE抑制剂PPG, 明显加重肝硬化大鼠门脉高压, 说明H2S/CSE体系对于肝硬化门静脉高压有抑制作用, 而这种作用可能与其对心血管功能及结构的调节有关. 随着肝硬化病程的进展, 为降低门脉压力, 减轻血管阻力, 内源性H2S首先被消耗, 由于内源性H2S含量的减少, 其心肌保护作用减弱. 肝硬化患者体内高水平内毒素作用于心肌细胞, 引起心肌的损伤, 且随着肝脏病变程度加重, 心脏损伤亦加重, 逐渐出现心功能的异常. 由于H2S在心肌的生成酶与肝组织的生成酶不一致, 给予外源性供体NaHS对CCM的影响有待进一步观察.
在CCM的进展过程中, 内源性H2S浓度的下降使其对心肌保护作用逐渐减弱, 本研究只是发现了H2S含量在心肌减少这种现象, 至于发生原因以及能否通过干预H2S的变化影响CCM的进展和疗效, 有待进一步研究.
肝硬化患者中约有1/3存在心功能的异常, 但由于患者通常情况下不出现心衰症状, 没有引起临床重视. 近年来, 随着基础研究的进展、肝脏移植等手术的开展, 肝硬化心肌病(cirrhotic cardiomyopathy, CCM)的病理生理和临床重要性日益受到重视.
颜学兵, 教授, 主任医师, 徐州医学院附属医院感染病科
CCM对肝硬化预后的影响越来越引起临床的重视, CCM对肝硬化治疗效果的影响越来越受到医患双方的重视. 探索CCM发病的病理生理过程, 通过干预CCM发病的病理生理过程抑制CCM的发展, 提高生活质量, 成为CCM研究的热点.
中国是病毒性肝炎大国, 存在大量的终末期肝病患者, 防止腹水、曲张静脉破裂出血、肝脏移植手术过程中因CCM导致的死亡是一个不容忽视社会和医学问题.
CCM: 大多数肝硬化患者心肌收缩力呈现标准基线, 但基础心输出量在不同程度上有所增加, 血管压力反应下降, 导致基础心输出量增加、外周血管阻力下降和动脉压下降、心室的舒张性和/或收缩性减弱等一系列改变.
本文设计尚合理, 有一定研究价值.
编辑: 于明茜 电编:都珍珍
| 1. | Mandell MS, Tsou MY. Cardiovascular dysfunction in patients with end-stage liver disease. J Chin Med Assoc. 2008;71:331-335. [PubMed] [DOI] |
| 2. | Baik SK, Fouad TR, Lee SS. Cirrhotic cardiomyopathy. Orphanet J Rare Dis. 2007;2:15. [PubMed] [DOI] |
| 3. | Ripoll C, Catalina MV, Yotti R, Olmedilla L, Pérez-Peña J, Lo Iacono O, Rincón D, García-Fernández MA, Bermejo J, Bañares R. Cardiac dysfunction during liver transplantation: incidence and preoperative predictors. Transplantation. 2008;85:1766-1772. [PubMed] [DOI] |
| 5. | 王 风雷, 雷 飞飞, 杜 卫星, 李 刚, 李 儒贵, 李 芳, 李 金科, 谭 华炳. 肝炎后肝硬化患者心电图改变与Child-Pugh分级及预后的相关性. 中国药物与临床. 2013;13:196-197. |
| 7. | 雷 旭, 谭 华炳. 肝硬化性心肌病诊治研究进展. 中西医结合心脑血管病杂. 2014;12:1394-1396. |
| 9. | Liu H, Gaskari SA, Lee SS. Cardiac and vascular changes in cirrhosis: pathogenic mechanisms. World J Gastroenterol. 2006;12:837-842. [PubMed] [DOI] |
| 10. | Doeller JE, Isbell TS, Benavides G, Koenitzer J, Patel H, Patel RP, Lancaster JR, Darley-Usmar VM, Kraus DW. Polarographic measurement of hydrogen sulfide production and consumption by mammalian tissues. Anal Biochem. 2005;341:40-51. [PubMed] [DOI] |
| 14. | 朱 建忠, 刘 冀, 王 国明, 隋 月林, 刘 建辉, 王 娟, 刘 志金, 石 葛明. 经皮下注射CCl4结合饮用乙醇致大鼠肝硬化模型的研究. 现代中西医结合. 2014;23:1046-1048. |
| 15. | 闵 怀臻, 贺 琴, 李 金科, 任 永生, 谭 华炳. 绞股蓝皂苷对2型糖尿病并非酒精性脂肪性肝病大鼠肝组织TNF-α mRNA表达和血硫化氢的影响. 湖北医药学院学报. 2013;32:317-324. |
| 19. | Iwaisako K, Jiang C, Zhang M, Cong M, Moore-Morris TJ, Park TJ, Liu X, Xu J, Wang P, Paik YH. Origin of myofibroblasts in the fibrotic liver in mice. Proc Natl Acad Sci U S A. 2014;111:E3297-E3305. [PubMed] [DOI] |
| 20. | Roman S, Zepeda-Carrillo EA, Moreno-Luna LE, Panduro A. Alcoholism and liver disease in Mexico: genetic and environmental factors. World J Gastroenterol. 2013;19:7972-7982. [PubMed] [DOI] |
| 23. | Zhao W, Zhang J, Lu Y, Wang R. The vasorelaxant effect of H(2)S as a novel endogenous gaseous K(ATP) channel opener. EMBO J. 2001;20:6008-6016. [PubMed] [DOI] |
| 24. | Lee SW, Hu YS, Hu LF, Lu Q, Dawe GS, Moore PK, Wong PT, Bian JS. Hydrogen sulphide regulates calcium homeostasis in microglial cells. Glia. 2006;54:116-124. [PubMed] [DOI] |
| 25. | Kiss L, Deitch EA, Szabó C. Hydrogen sulfide decreases adenosine triphosphate levels in aortic rings and leads to vasorelaxation via metabolic inhibition. Life Sci. 2008;83:589-594. [PubMed] [DOI] |
| 26. | Du J, Hui Y, Cheung Y, Bin G, Jiang H, Chen X, Tang C. The possible role of hydrogen sulfide as a smooth muscle cell proliferation inhibitor in rat cultured cells. Heart Vessels. 2004;19:75-80. [PubMed] [DOI] |
| 27. | Oh GS, Pae HO, Lee BS, Kim BN, Kim JM, Kim HR, Jeon SB, Jeon WK, Chae HJ, Chung HT. Hydrogen sulfide inhibits nitric oxide production and nuclear factor-kappaB via heme oxygenase-1 expression in RAW264.7 macrophages stimulated with lipopolysaccharide. Free Radic Biol Med. 2006;41:106-119. [PubMed] [DOI] |
| 28. | 潘 璐璐, 张 园海, 岳 亚延, 周 爱华, 张 营营, 王 丹, 钱 燕, 禇 茂平. 硫化氢对柯萨奇病毒感染的病毒性心肌炎小鼠的保护作用. 中华微生物学和免疫学杂志. 2013;33:692-699. |
| 29. | 邓 生琼, 周 显琎, 王 珺, 龚 坚, 徐 增光. 硫化氢对氧化损伤心肌细胞凋亡的影响. 武汉大学学报(医学版). 2009;30:61-65. |
| 31. | Geng B, Chang L, Pan C, Qi Y, Zhao J, Pang Y, Du J, Tang C. Endogenous hydrogen sulfide regulation of myocardial injury induced by isoproterenol. Biochem Biophys Res Commun. 2004;318:756-763. [PubMed] [DOI] |