修回日期: 2015-10-18
接受日期: 2015-10-26
在线出版日期: 2015-11-18
目的: 探讨非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)大鼠肝内神经酰胺水平与肝细胞脂质沉积之间的关系.
方法: 将♂SD大鼠随机分为正常对照组、NAFLD模型组和多球壳菌素组, NAFLD模型组采用高脂肪饲料喂养, 多球壳菌素组除了高脂肪饲料喂养外还给予多球壳菌素喂养, 正常对照组大鼠则喂养普通饲料. 喂养12 wk后分别采用酶检测法、HE染色和高效液相色谱串联质谱法(high performance liquid chromatography tandem mass spectrometry, HPLC/MS)检测各组大鼠的肝组织脂质含量、脂质变性程度以及神经酰胺水平.
结果: NAFLD模型组大鼠肝组织中的甘油三酯和游离脂肪酸含量明显高于正常对照组和多球壳菌素组(P<0.05), 而且模型组大鼠肝组织标本的脂肪变性程度均明显高于正常对照组和多球壳菌素组(P<0.05); 与肝细胞内脂质沉积增加相应的是NAFLD模型组大鼠的肝内神经酰胺(主要是C24:0和C16:0神经酰胺)水平也明显高于正常对照组和多球壳菌素组(P<0.05).
结论: 神经酰胺参与了NAFLD大鼠肝细胞内的脂质沉积过程, 抑制神经酰胺的合成则有助于减轻肝细胞内的脂质沉积程度.
核心提示: 本文通过动物实验发现神经酰胺参与了非酒精性脂肪肝(non-alcoholic fatty liver disease)大鼠肝细胞内的脂质沉积过程, 抑制神经酰胺的合成则有助于减轻肝细胞内的脂质沉积程度. 但具体机制尚需更深入的研究.
引文著录: 胡杨, 刘朝霞, 傅念, 吴清, 阳学风, 刘浩雷. 神经酰胺在非酒精性脂肪肝大鼠肝细胞脂质沉积中的作用. 世界华人消化杂志 2015; 23(32): 5196-5200
Revised: October 18, 2015
Accepted: October 26, 2015
Published online: November 18, 2015
AIM: To evaluate the role of ceramide in hepatic lipid accumulation in rats with non-alcoholic fatty liver disease (NAFLD).
METHODS: Male SD animals were randomly divided into three groups: a control group, an NAFLD model group and a myriocin group. The NAFLD model group was fed a high-fat diet, the myriocin group was fed a high-fat diet and treated with myriocin, and the control group was fed a standard rodent diet only. After 12 wk, the liver tissues of rats in the three groups were measured for lipids levels, the extent of hepatic steatosis and ceramide levels by enzyme assay, HE staining and high performance liquid chromatography tandem mass spectrometry (HPLC/MS), respectively.
RESULTS: Compared with the control and myriocin groups, the levels of hepatic lipids, such as triglyceride and free fat acids, in the NAFLD model group were significantly increased (P < 0.05), and the extent of hepatic steatosis in the NAFLD model group was significantly higher as well (P < 0.05). Corresponding to lipid accumulation, the levels of ceramides in rat liver, mainly C24:0 and C16:0 ceramides, were significantly higher in the NAFLD model group than in the control group and myriocin group (P < 0.05).
CONCLUSION: Ceramide contributes to hepatic lipid accumulation in rats with NAFLD, and inhibition of ceramide synthesis can reduce the extent of hepatic steatosis.
- Citation: Hu Y, Liu ZX, Fu N, Wu Q, Yang XF, Liu HL. Role of ceramide in hepatic lipid accumulation in rats with non-alcoholic fatty liver disease. Shijie Huaren Xiaohua Zazhi 2015; 23(32): 5196-5200
- URL: https://www.wjgnet.com/1009-3079/full/v23/i32/5196.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i32.5196
肝细胞内脂质沉积是非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)形成和发展的一个先决条件[1], 如果能早期对肝细胞脂质沉积进行干预, 则可能使NAFLD的病情得以缓解甚至是逆转. 近年来, 有研究发现高脂肪饲料喂养大鼠的肝内神经酰胺含量明显增加, 提示肝细胞脂质沉积与神经酰胺的生成可能存在一定的关系[2]. 然而, 神经酰胺的增加是否只是肝细胞脂质沉积的"伴随"现象, 还是参与了脂质沉积过程尚不明确. 为此, 我们采用了神经酰胺从头合成抑制剂多球壳菌素对NAFLD大鼠模型进行干预, 观察大鼠肝内脂质及神经酰胺水平的变化, 探讨神经酰胺与肝细胞脂质沉积之间的关系.
♂SD大鼠购自购自上海西普尔-必凯实验动物有限公司; 高脂肪饲料购自南通特洛菲饲料科技有限公司; 多球壳菌素购自美国Cayman公司; C16、C17、C18和C24神经酰胺标准品购自美国Avanti公司. 液相色谱条件为: 分析柱: Zorbax SB C8(2.1 mm×150.0 mm, 3.5 µm); 柱温: 35 ℃; 流动相: 甲醇2 mmol/L醋酸铵(0.1%甲酸)和质谱条件如下: ESI离子源, 负离子模式. 离子源参数如下: 气体温度: 325 ℃; 气体流速: 5 L/min; 雾化器压力: 45 Psi; 鞘气温度: 350 ℃; 鞘气流速: 11 L/min; 毛细管电压: 3500 V(+).
1.2.1 分组和造模: 36只健康♂SD大鼠(体质量200 g±20 g)按体质量随机分为3组: 正常对照组, NAFLD模型组和多球壳菌素组. 除正常对照组外, 其余2组皆进行适应性饲养1 wk后喂饲高脂饲料(包含80.5%基础饲料, 2%胆固醇, 7%猪油, 10%蛋黄粉及其0.5%胆盐)进行造模, 共12 wk. 多球壳菌素组大鼠于造模第1周开始予多球壳菌素灌胃, 剂量为6 mg/(kg•d), 每天1次. 对照组和NAFLD组大鼠给予等体积生理盐水灌胃. 造模12 wk后麻醉处死大鼠, 取大鼠肝脏组织作病理切片HE染色, 光镜下对大鼠肝组织脂肪沉积情况进行观察, 其判断标准符合《非酒精性脂肪性肝病诊疗指南》[3].
1.2.2 肝脂质含量的检测: 按王咏波等[4]的方法检测同质量肝组织中的甘油三酯(triglyceride, TG)、胆固醇(total cholesterol, TC)和游离脂肪酸(free fat acid, FFA).
1.2.3 肝组织标本HE染色: 留取肝组织标本, 经固定、包埋、切片和HE染色. 按肝细胞脂肪变性占肝组织标本量的范围分为4度(F0-4)[3].
1.2.4 HPLC/MS检测大鼠肝组织神经酰胺水平: 将2 mL甲醇分别加入C16、C17、C18和C24神经酰胺标准品中, 振荡混匀后使其彻底溶解, 置于-20 ℃冰箱备用, 使用时根据不同的浓度稀释. 称量同质量肝组织(湿质量50 mg)于EP管中, 加1 mL氯仿和甲醇的混合液(V:V = 2:1), 用BCA法测定蛋白浓度; 然后加入1 µg C17神经酰胺标准品作为内参; 收集下层氯仿层, 冷冻干燥后加入1 mL甲醇, 旋锅震荡混匀后置于-20 ℃冰箱保存待测. 检测时先设定液相色谱条件和质谱条件, 再将各个不同浓度的神经酰胺标准品溶液进样, 并绘制各个神经酰胺的标准曲线, 计算线性回归方程和相关系数. 然后将不同组别的脂类提取液1.5 µL进样, 记录色谱图和峰值起止时间、保留时间、峰值面积和峰值高度等数据. 最后按照线性回归方程计算出不同实验组肝组织内的神经酰胺含量.
统计学处理 采用SPSS18.0统计学软件进行统计分析, 计量资料用mean±SD表示, t检验各组间的差异; 等级资料采用秩和检验. P<0.05表示差异有统计学意义.
大鼠肝组织中的TG、TC和FFA含量测定结果如表1, 结果显示NAFLD模型组大鼠肝组织中脂质成分主要是TG和FFA, 此两种脂质含量较正常对照组显著增加(P<0.05), 而多球壳菌素能显著降低NAFLD模型组大鼠肝组织中的TG和FFA水平(P<0.05).
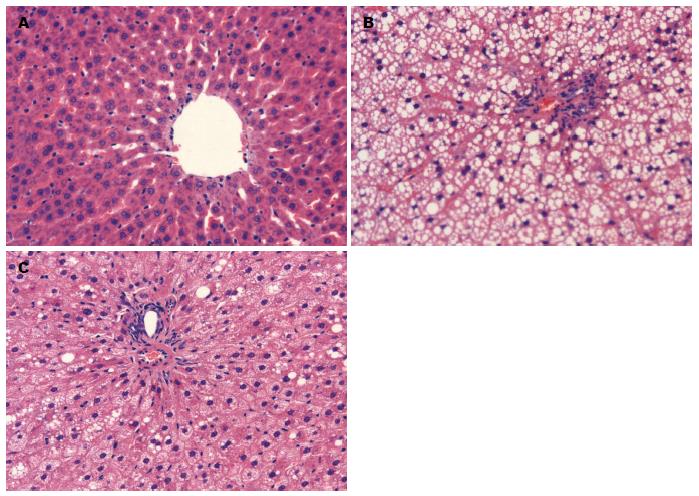
正常对照组肝组织结构正常, 成条索状分布, 肝窦清晰可见. NAFLD模型组肝组织出现弥漫性肝细胞脂肪变, 肝细胞浆内脂肪滴明显增大, 将胞核挤至一边. 多球壳菌素组可见散在肝细胞中含有脂肪滴, 肝细胞索排列基本整齐(图1). 通过对各组大鼠肝组织脂肪变程度分级比较, 结果显示NAFLD模型组脂肪变程度明显高于正常对照组和多球壳菌素组(P<0.05)(表2).
对大鼠肝组织神经酰胺进行HPLC/MS检测, 结果显示NAFLD模型组大鼠肝组织中的主要神经酰胺种类是C24:0和C16:0, 此二种神经酰胺水平均明显高于正常对照组(P<0.05); 而喂养多球壳菌素的大鼠肝组织中神经酰胺水平则明显低于NAFLD模型组(P<0.05), 甚至低于正常对照组, 虽然正常对照组和多球壳菌素组之间差异无统计学意义(P>0.05)(表3).
肝细胞脂质沉积是NAFLD主要病理特征之一, 也是NAFLD形成和发展的先决条件之一. 因此, 有效的抑制肝细胞脂质沉积是防治NAFLD的重要途径. 本研究采用高脂肪饲料诱导NAFLD大鼠模型, 肝内脂质含量明显高于正常对照组, 肝细胞脂肪变程度也与人类NAFLD相似, 说明NAFLD造模成功. NAFLD大鼠肝内脂质成分检测则显示主要是游离脂肪酸和甘油三酯, 与文献[5]报道相符合.通过给NAFLD大鼠喂服神经酰胺从头合成抑制剂多球壳菌素后肝内脂质含量和肝脂肪变程度均明显得以改善, 说明抑制神经酰胺合成能减轻NAFLD大鼠肝内脂肪沉积. 本实验还采用HPLC/MS检测了大鼠肝内神经酰胺含量. 由于大鼠肝内神经酰胺种类主要是C24:0, C16:0和C18:0[6], 本研究未对其他种类的神经酰胺进行检测. 检测结果显示NAFLD模型组大鼠肝内神经酰胺主要是C24:0和C16:0, 其水平明显高于正常对照组, 而多球壳菌素组大鼠的神经酰胺水平则明显减少, 说明多球壳菌素能有效的抑制NAFLD大鼠肝内神经酰胺的生成. 由于多球壳菌素能特异性的抑制神经酰胺从头合成途径的主要限速酶丝氨酸棕榈酰转移酶(serine palmitoyl-CoA transferase, SPT)[7], 因此也说明NAFLD大鼠肝内的神经酰胺主要来自于从头合成途径. 通过对大鼠肝内脂质含量, 肝细胞脂肪变程度以及神经酰胺水平的检测, 我们发现神经酰胺水平与肝细胞脂质沉积具有很好的相关性, 人为的降低神经酰胺水平则能使大鼠肝细胞脂质沉积程度得以改善.
神经酰胺是一类主要分布于细胞膜的鞘脂类物质, 他作为第二信使参与了细胞的凋亡、分化和增殖[8]. 研究[9,10]发现神经酰胺能诱导胰岛素抵抗、促进线粒体活性氧的生成[11]以及肝细胞凋亡[12]. 通过我们的研究发现神经酰胺能促进肝细胞脂质沉积的形成, 其可能机制是细胞内的神经酰胺能激活神经酰胺活化的蛋白磷酸酶即蛋白磷酸酶2A(protein phosphatase 2A, PP2A)[13-15], PP2A能抑制腺苷酸活化蛋白激酶(AMP-activated protein kinase, AMPK), AMPK是细胞内的能量代谢调节器, AMPK能减少脂肪的合成, 促进脂肪酸β氧化, AMPK受抑制则使细胞内脂肪合成增加, 造成脂肪沉积[16]. 然而其具体作用机制仍不明确, 有待进一步研究.
肝细胞内脂质沉积是非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)形成和发展的一个先决条件, 如果能早期对NAFLD患者肝内脂质沉积进行干预, 则可能使NAFLD患者的病情得以缓解甚至是逆转.
刘绍能, 主任医师, 中国中医科学院广安门医院消化科
近年来的研究发现神经酰胺可能参与了NAFLD的发病, 目前主要集中于神经酰胺在胰岛素抵抗、氧化应激、炎症反应和细胞凋亡等病理过程中的作用, 但是对NAFLD肝内脂质沉积的研究不多.
国外学者发现神经酰胺能激活蛋白磷酸酶2A(protein phosphatase 2A, PP2A), PP2A又对腺苷酸活化蛋白激酶(AMP-activated protein kinase, AMPK)具有抑制作用. AMPK的生理作用在于减少脂肪的合成, 促进脂肪酸β氧化, AMPK受抑制则使细胞内脂肪合成增加, 造成脂肪沉积. 该机制可能是神经酰胺诱发NAFLD大鼠肝细胞脂质沉积的原因之一.
通过采用酶检测法、HE染色和高效液相色谱串联质谱法检测正常对照组, 模型组和多球壳菌素组大鼠的肝组织脂质含量、脂质变性程度以及神经酰胺水平, 表明神经酰胺能促进NAFLD大鼠肝细胞内脂质沉积.
神经酰胺合成抑制剂可能有助于改善NAFLD患者肝内脂质沉积的程度, 抑制NAFLD病情的进一步发展.
神经酰胺: 是由长链脂肪酸和鞘氨醇链接而成的鞘脂类物质. 他除了是细胞膜的组成成分, 还作为第二信使参与了细胞增殖, 分化和凋亡等信号通路的传导.
多球壳菌素是神经酰胺的阻滞剂, 作者用高脂肪饲料喂养复制大鼠脂肪肝模型, 并用神经酰胺阻滞剂多球壳菌素处理大鼠, 与正常组及模型组进行比较, 证实神经酰胺参与了NAFLD大鼠肝细胞内的脂质沉积过程, 减少神经酰胺有助于减轻肝细胞内的脂质沉积程度. 实验设计合理, 结果可信, 论文写作规范, 有一定的可读性.
编辑: 郭鹏 电编: 闫晋利
| 2. | Chocian G, Chabowski A, Zendzian-Piotrowska M, Harasim E, Łukaszuk B, Górski J. High fat diet induces ceramide and sphingomyelin formation in rat's liver nuclei. Mol Cell Biochem. 2010;340:125-131. [PubMed] [DOI] |
| 5. | Jackson WD, Book LS. Nonalcoholic fatty liver disease and dyslipidemia: the beleagured hepatocyte. J Pediatr Gastroenterol Nutr. 2015;60:287. [PubMed] [DOI] |
| 6. | Kasumov T, Huang H, Chung YM, Zhang R, McCullough AJ, Kirwan JP. Quantification of ceramide species in biological samples by liquid chromatography electrospray ionization tandem mass spectrometry. Anal Biochem. 2010;401:154-161. [PubMed] [DOI] |
| 7. | Lowther J, Naismith JH, Dunn TM, Campopiano DJ. Structural, mechanistic and regulatory studies of serine palmitoyltransferase. Biochem Soc Trans. 2012;40:547-554. [PubMed] [DOI] |
| 8. | Castro BM, Prieto M, Silva LC. Ceramide: a simple sphingolipid with unique biophysical properties. Prog Lipid Res. 2014;54:53-67. [PubMed] [DOI] |
| 9. | Sajan MP, Ivey RA, Lee MC, Farese RV. Hepatic insulin resistance in ob/ob mice involves increases in ceramide, aPKC activity, and selective impairment of Akt-dependent FoxO1 phosphorylation. J Lipid Res. 2015;56:70-80. [PubMed] [DOI] |
| 10. | Chaurasia B, Summers SA. Ceramides - Lipotoxic Inducers of Metabolic Disorders. Trends Endocrinol Metab. 2015;26:538-550. [PubMed] [DOI] |
| 11. | Longato L, Tong M, Wands JR, de la Monte SM. High fat diet induced hepatic steatosis and insulin resistance: Role of dysregulated ceramide metabolism. Hepatol Res. 2012;42:412-427. [PubMed] [DOI] |
| 12. | Pagadala M, Kasumov T, McCullough AJ, Zein NN, Kirwan JP. Role of ceramides in nonalcoholic fatty liver disease. Trends Endocrinol Metab. 2012;23:365-371. [PubMed] [DOI] |
| 13. | Zhang QJ, Holland WL, Wilson L, Tanner JM, Kearns D, Cahoon JM, Pettey D, Losee J, Duncan B, Gale D. Ceramide mediates vascular dysfunction in diet-induced obesity by PP2A-mediated dephosphorylation of the eNOS-Akt complex. Diabetes. 2012;61:1848-1859. [PubMed] [DOI] |
| 14. | Bharath LP, Ruan T, Li Y, Ravindran A, Wan X, Nhan JK, Walker ML, Deeter L, Goodrich R, Johnson E. Ceramide initiated protein phosphatase 2A activation contributes to arterial dysfunction in vivo. Diabetes. 2015; Aug 7. [Epub ahead of print]. [PubMed] |
| 15. | Oaks J, Ogretmen B. Regulation of PP2A by Sphingolipid Metabolism and Signaling. Front Oncol. 2014;4:388. [PubMed] [DOI] |
| 16. | Carling D, Mayer FV, Sanders MJ, Gamblin SJ. AMP-activated protein kinase: nature's energy sensor. Nat Chem Biol. 2011;7:512-518. [PubMed] [DOI] |