修回日期: 2015-10-18
接受日期: 2015-10-26
在线出版日期: 2015-11-18
目的: 研究年龄因素对急性酒精性肝损伤和肝细胞凋亡的影响.
方法: 月龄为1、6、18 mo的SD大鼠每组各15只, 随机分成实验组(n = 10)和对照组(n = 5), 实验组每只大鼠以15 g/kg 400 mL/L乙醇一次性灌胃, 对照组以等比例生理盐水一次性灌胃. 灌胃48 h后取大鼠血液和肝脏组织分别行肝功能和ELISA检测肝脏炎症因子表达及TUNEL检测肝细胞凋亡情况. 并进一步研究酒精刺激后肝细胞中Bcl-2、Bax、Caspase3等在凋亡通路中的表达情况, 研究年龄因素对急性酒精性肝损伤和肝细胞凋亡的影响及可能机制.
结果: 对照组内, 不同年龄组间肝功能、炎症指标无明显差异, 月龄为1 mo和6 mo组肝细胞凋亡率无明显差异, 18 mo组高于其他两组. 实验组内不同年龄组的肝功能、炎症因子表达和肝细胞凋亡率均显著高于对照组. 且不同年龄组间不尽相同: 实验组6 mo的炎症因子表达高于其他组. 而实验组内月龄为1 mo的大鼠细胞凋亡率最高, 6 mo次之, 18 mo较低. 进一步研究显示Bcl-2、Bax、Caspase3在不同年龄实验组中表达不同, 但同凋亡结果相一致.
结论: 生理状态下, 肝功能、炎症因子与年龄大多无显著相关性, 肝细胞凋亡率在老年时有所增加. 急性过量饮酒可引起肝脏损伤和凋亡, 且损伤程度和凋亡与年龄呈相关性: 月龄为6 mo组肝脏损伤较重, 而1 mo组凋亡率更高. 这可能与不同年龄大鼠在酒精刺激下肝脏炎症细胞的激活量及肝细胞凋亡通路的激活不同有关.
核心提示: 建立月龄为1、6、18 mo的不同年龄阶段的SD大鼠急性酒精肝损伤的动物模型, 评估不同年龄相同条件下急性酒精性肝损伤程度及肝细胞凋亡的差异, 探讨年龄因素在酒精性肝损伤中的意义和可能的凋亡机制.
引文著录: 邱媛媛, 王伟恒, 胡江峰, 沈思, 朱樑. 年龄因素对急性酒精性肝损伤和肝细胞凋亡的影响. 世界华人消化杂志 2015; 23(32): 5123-5132
Revised: October 18, 2015
Accepted: October 26, 2015
Published online: November 18, 2015
AIM: To evaluate the effect of age on acute alcoholic liver injury and hepatocyte apoptosis.
METHODS: Three age groups of SD rats (1-month, 6-month and 18-month-old rats; n = 15 each) were randomly divided into an experimental group (n = 10) and a control group (n = 5).The experimental group was intragastrically given alcohol (40% V/V, 15 g/kg), and the control group was given equal volume of normal saline. All the rats were sacrificed at 48 h to collect liver tissue and blood samples. Blood samples were tested for liver function, and the hepatic tissues were used for light microscopy, TUNEL, and ELISA for inflammatory cytokine measurement. RT-PCR was used to detect the mRNA expression of Bcl-2, Bax, and Caspase3.
RESULTS: In the control group, different age groups showed no significant difference in inflammation or liver function, although the liver cell apoptosis rate increased in the 18-month age group. The experiment group showed significant differences in inflammation and liver function compared to the control group. In the experiment groups, the above indexes also showed significant differences among different age groups, with the 1-month group having the highest levels, which is consistent with the degree of damage.
CONCLUSION: Under physiological conditions, liver function and inflammatory factors have no correlation with age, while apoptosis rate increases with age. Acute excessive alcohol consumption can cause liver damage, and the extent of damage is correlated with age, which may be related with different extents of inflammation and apoptosis in different age groups.
- Citation: Qiu YY, Wang WH, Hu JF, Shen S, Zhu L. Impact of age on acute alcohol induced liver injury and hepatocyte apoptosis. Shijie Huaren Xiaohua Zazhi 2015; 23(32): 5123-5132
- URL: https://www.wjgnet.com/1009-3079/full/v23/i32/5123.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i32.5123
过量饮酒可引起多器官损伤[1], 其中以肝脏损伤最为显著. 酒精性肝病(alcohol liver disease, ALD)[2]是导致终末期肝病的主要原因之一. 过量饮酒不仅可直接影响肝脏代谢[3], 还可以同病毒性肝炎[4]、肥胖协同促进肝脏损伤, 构成肝脏疾病的百慕大三角[5]. ALD在严重影响患者身体健康的同时, 也给社会和家庭带来了巨大的经济负担[6]. 流行病学调查发现人群酗酒率有向低龄化和高龄化蔓延的趋势[7], 在酒文化盛行的今天, 研究不同年龄酒精摄入对肝脏的影响, 具有重要意义.
个体在不同年龄阶段, 肝脏功能可由于功能性酶[8]、调节性蛋白的表达差异发生改变[9]. 有学者[10]综述了在老年人群中的肝病特点, 表明虽然肝脏在衰老中的作用有限, 但在罹患肝脏疾病时, 多可表现出如转氨酶无症状升高等特殊现象. 不同年龄的个体对酒精的代谢和反应不尽相同. 酒精引起的肝脏损伤除乙醇代谢过程及其产物造成的直接损伤外[11], 还包括肝细胞损伤后引起的炎症级联反应及免疫损伤等复杂的病理过程. 乙醇进入体内后, 主要通过肝脏的乙醇脱氢酶(alcohol dehydrogenase, ADH), 过氧化氢酶(catalase, CAT)进行代谢. 而当体内乙醇浓度过高时, 还可启动内质网中微粒体乙醇氧化代谢系统(microsomal ethanol oxidizing system, MEOS)进行代谢. MEOS代谢过程需要氧与细胞色素P450的参与[12,13]. 而这些关键性酶, 在不同年龄大鼠中的表达及活性不尽相同[14].
基于以上背景我们猜测, 因不同年龄阶段的肝脏整体功能不同, 在急性酒精刺激下, 所受到的损伤也可能有所差异. 在实验中, 我们使用月龄为1、6、18 mo的SD大鼠为研究对象进行急性酒精灌胃处理, 通过比较肝功能、检测肝脏组织炎症及凋亡指标, 进行损伤的评估. 同时检测了凋亡通路中Bcl-2和Bax的表达, 以解释差异出现的可能原因. 以此来研究年龄因素在急性酒精性肝损伤中的意义和可能机制.
实验动物均购自中国人民解放军第二军医大学实验动物中心(动物许可证编号: 2008001647623)月龄为1、6、18 mo的清洁级♂SD大鼠, 所有操作均符合动物伦理要求. 400 mL/L乙醇由南京化学试剂有限公司提供的95%的医用级乙醇用双蒸水稀释而成. 兔抗大鼠白介素(interleukin, IL)-1β抗体(Cst, 美国)、Caspase3抗体(Abcam, 美国)、小鼠抗大鼠GAPDH(威奥, 1:2000)、IL-1β、肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)、IL-6 ELISA试剂盒(R&D, 美国)、TUNEL检测试剂盒(碧云天)、HRB羊抗小鼠二抗(Jackson, 美国)、HRB羊抗兔二抗(Jackson, 美国)、DAB辣根过氧化物酶显色试剂盒(碧云天, 中国)、全自动生化分析仪(强生)、倒置显微镜(奥林巴斯)、酶标仪(BioTek)、DNA提取试剂盒、总RNA抽提试剂盒(碧云天, 中国)、荧光定量仪: Gene Amp 5700 Sequence Detector、实时定量PCR检测(real-time quantitative PCR, qRT-PCR)扩增仪及配套分析软件Gene Amp 5700 SDS(Perkin-Elmer公司, 美国)、PCR引物由上海生物工程股份公司设计合成.
1.2.1 动物模型建立及分组: 将实验动物按照年龄将月龄为1、6、18 mo的大鼠分为3组, 各15只, 每组随机分成对照组5只和实验组10只. 参照已有文献[15], 使用400 mL/L乙醇以15 g/kg体质量比例一次性灌胃. 在操作中, 若动物出现呛咳表示灌至动物气道, 则该实验对象予以排除. 出现醉酒症状后, 将大鼠舌头拉出以防窒息. 对照组按照相同比例一次性灌注生理盐水. 大鼠灌胃前12 h禁食, 6 h禁饮. 灌胃48 h后麻醉动物, 心脏取血用于肝功能检测. 取适量肝脏组织经多聚甲醛固定或液氮内冷冻保存, 用于形态学、qRT-PCR、Western blot及ELISA检测备用.
1.2.2 肝脏病理学观察: 各组肝脏标本经4%多聚甲醛固定24 h后, 经脱水石蜡包埋, 切片贴片后, 苏木精-伊红染色, 光学显微镜下肝脏病理形态学观察.
1.2.3 血液肝功能检测: 各组大鼠麻醉后, 打开胸腔, 暴露心脏, 用5 mL促凝管心脏取血3 mL, 并来回轻微摇晃混匀于4 ℃促凝1 h后, 4 ℃低温离心机2000 g离心15 min后取上层血清-80 ℃保存, 待收集齐样本于中国人民解放军第二军医大学附属长征医院检验科采用强生950型全自动生化分析仪行肝功能测定. 肝功能项目包括: 丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase, AST). 考虑到酒精干预后, 肝损伤发生的必然性, 此次研究的目的主要集中在年龄差异在急性酒精性肝脏损伤中的意义, 因此只针对实验组各年龄阶段个体间进行相关指标的比较.
1.2.4 肝脏炎症因子指标检测: 各组肝脏标本称质量后加入一定量的PBS, 组织匀浆后离心取上清液, 严格按照ELISA试剂盒说明书操作, 检测IL-1β、TNF-α、IL-6, 每个样本均有复孔, 并重复测量3次, 测量结果取均值.
1.2.5 肝脏凋亡检测: (1)TUNEL法检测肝细胞凋亡: 肝脏组织经多聚甲醛固定后, 石蜡包埋, 切片贴片脱蜡后, 按照TUNEL检测试剂盒说明书操作. 凋亡细胞细胞核为深浅不一的棕黄色或棕褐色, 非凋亡细胞核呈蓝色. 在高倍光镜下, 随机选取10个视野, 计算每个视野中凋亡细胞占总细胞的比例, 求平均值计算出凋亡率; (2)Western blot检测Caspase3蛋白的表达: 提取肝脏组织蛋白质样品, BCA法进行蛋白质定量. 经凝胶电泳分离后转膜, 封闭加兔抗大鼠Caspase3抗体(1:1000)4 ℃孵育过夜, 以1:2000比例稀释兔二抗室温孵育1 h后常规曝光显影, 定影扫描.
1.2.6 采用qRT-PCR测定各组肝脏标本中Bcl-2、Bax、Caspase3 mRNA的表达: 将待测的肝脏标本组化匀浆后, 使用TRIzol试剂盒抽提总RNA, 并逆转录RNA为cDNA. 纯度测定合格后, 使用MyiQTM(Bio-Rad)仪器, SYBR Green Realtime PCR master Mix试剂盒(TOYOBO Biotech, Osaka, Japan)完成qRT-PCR的测定, 内参选择GAPDH, 分别独立重复3次. 在数据处理过程中使用对照组配对矫正. 定量PCR引物序列如表1.
| 名称 | 引物序列 | 大小(bp) |
| GAPDH | F: 5'-GAAGGCTGGGGCTCATTG-3' | 258 |
| R: 5'-AGGGGCCATCCACAGTCTTCPF-3' | ||
| Caspase3 | F: 5'-CATGCACATCCTCACTCGTG-3' | 158 |
| R: 5'-CCCACTCCCAGTCATTCCTT-3' | ||
| Bcl-2 | F: 5'-CTTCAGGGATGGGGTGAACT-3' | 174 |
| R: 5'-CAGCCTCCGTTATCCTGGAT-3' | ||
| Bax | F: 5'-GAGACACCTGAGCTGACCT-3' | 111 |
| R: 5'-CTGCAGCTCCATGTTGTTGT-3' |
统计学处理 所得到的数据使用SPSS21.0进行单因素ANOVA方差分析比较, 多组间差异使用Student-Newman-Keuls进行比较, P<0.05为差异有统计学意义.
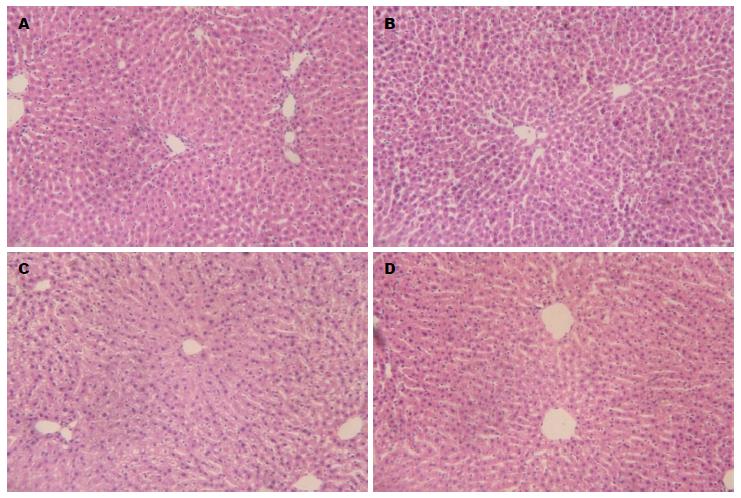
所有实验对象经酒精灌胃30 min内, 均出现流涎、体态呆板、精神萎靡、嗜睡、食欲减退和行动迟缓等现象, 并于8-12 h后逐渐恢复. 其中月龄为18 mo的大鼠恢复相对迟缓. 实验组肝脏取材HE染色显示: 肝小叶结构紊乱, 炎症细胞浸润, 肝细胞变性水肿, 出现点状坏死, 其中以实验组月龄为6 mo大鼠为重, 而生理盐水灌胃对照各组肝组织未见明显异常(图1).
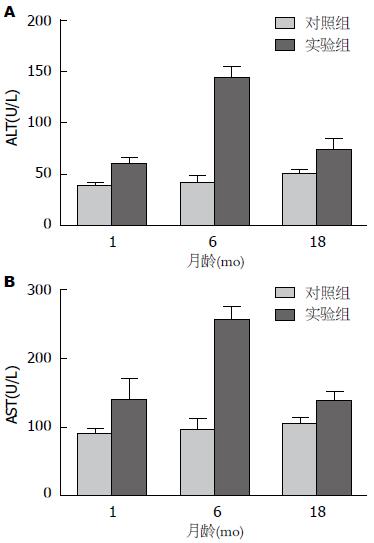
对照组肝功能指标显示, 不同年龄大鼠肝功能指标无明显差异(P>0.05). 实验组结果显示, 乙醇灌胃48 h后, 各年龄组肝功能指标均明显劣于对照组(P<0.05), 其中, ALT、AST基本呈现了中间高两头低的特殊形态, 月龄为6 mo的大鼠ALT和AST水平明显高于其他各组(P<0.05)(图2).
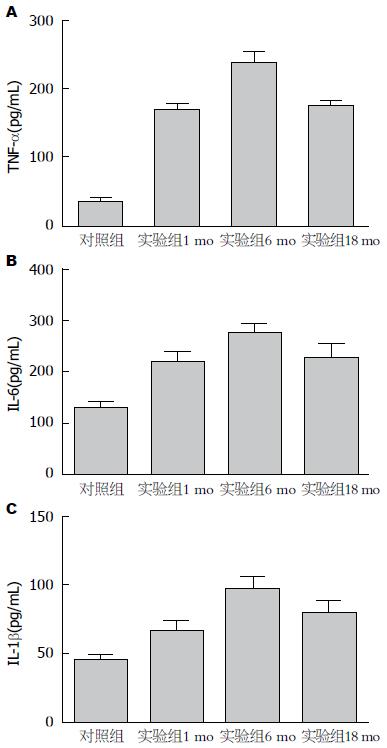
肝组织匀浆ELISA检测炎症因子指标显示, 对照组各年龄阶段的炎症因子表达均处于较低水平且无明显差异(P>0.05). 实验组各年龄阶段的炎症因子水平均明显高于对照组(P<0.05). 其中实验组中以月龄为6 mo的大鼠肝脏炎症因子水平最高, 明显高于其他组(P<0.05)(图3).
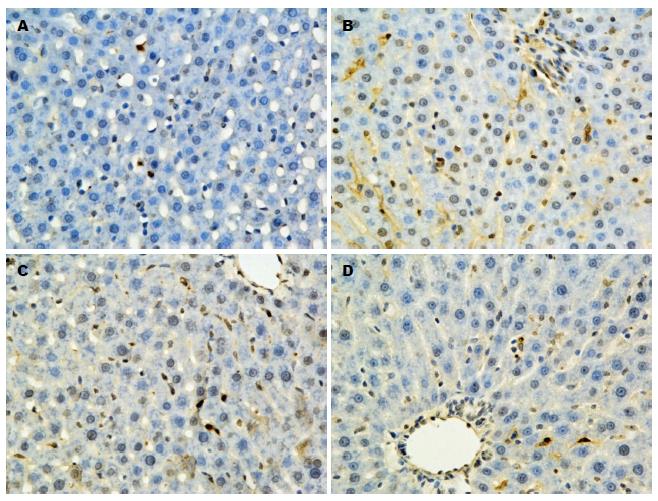
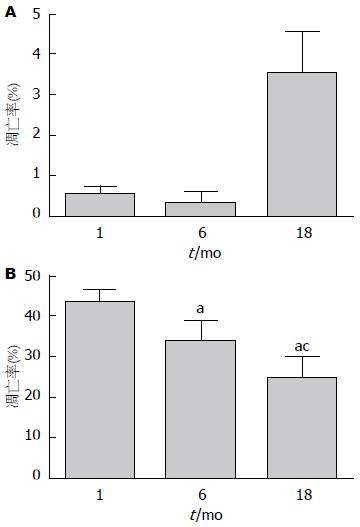
2.4.1 TUNEL法检测肝细胞凋亡: TUNEL法检测肝细胞凋亡显示, 实验组和对照组均可见棕黄色、棕褐色凋亡细胞核, 但对照组棕黄色细胞核出现率很低, 而实验组各组棕黄色凋亡细胞核出现率明显高于对照组(图4). 经随机挑选高倍视野计算凋亡指数来看, 对照组月龄为1 mo和6 mo无明显的差异(P>0.05), 18 mo高于1 mo和6 mo两组(P<0.05). 而实验组内月龄为1 mo的大鼠细胞凋亡率最高, 6 mo次之, 18 mo凋亡率较低(P<0.05)(图5).
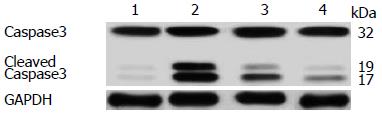
2.4.2 Western b1ot检测Caspase3蛋白的表达: 肝脏组织经蛋白提取后Western b1ot检测Caspase3蛋白显示, 活化的Caspase3的蛋白含量与TUNEL染色结果基本相符. 对照组内Caspase3的表达无明显差异(P>0.05), 实验组与对照组相比活化后Caspase3的表达含量均有显著的升高(P<0.05), 且实验组内月龄为1 mo表达量最高, 6 mo次之, 18 mo较低, 差异有统计学意义(P<0.05). 酒精刺激后肝细胞凋亡率随着年龄增长而降低(图6).
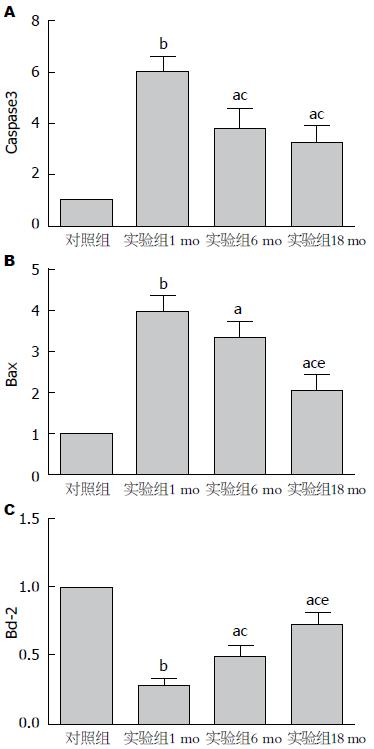
肝脏组织的qRT-PCR结果显示, 对照组内各年龄阶段的Bcl-2、Bax、Caspase3基因表达无明显差异, 而实验组内Bcl-2、Bax、Caspase3基因表达均有显著差异(P<0.05), 其中Caspase3、Bax基因的表达呈现出随年龄增高而降低的趋势, 抗凋亡Bcl-2基因表达则趋势相反, 随着年龄的增加, 表达量增加(图7).
本实验以不同年龄阶段SD大鼠作为研究对象, 通过观察急性酒精摄取后, 不同年龄大鼠肝脏损伤情况, 尝试说明年龄因素在急性酒精肝脏损伤中的意义. 本实验通过检测肝功能和肝脏标本组织学来评价肝脏损伤情况, 还从分子生物学角度检测了肝脏组织的炎症及凋亡情况, 试图从凋亡通路角度出发, 通过比较Bax和Bcl-2的表达尝试解释年龄因素造成不同损伤的可能原因. 整体上, 从多个角度对年龄因素在酒精性肝损伤中的意义进行了研究, 具有一定的说服力.
肝脏作为人体的代谢中心, 在生理状况下就存在着损伤、修复、再损伤的代谢平衡过程. 而在强烈的损伤发生的情况之下, 此代谢平衡可能会发生失衡, 出现肝细胞的损伤和肝功能的异常. 而目前评价肝脏损伤且广泛应用于临床的指标是血液肝功能检测. 由于肝脏极强的再生能力[16], 在肝损伤早期, 此项检测的敏感性和特异性不高, 只有在肝损伤进展到一定程度时才会出现肝功能的明显异常. 而ALT、AST可以作为肝细胞损伤的敏感指标[17], 在本次急性酒精性肝脏损伤模型的实验中, 可选取作为反应肝细胞损伤的经典指标, 用来评估肝细胞损伤的严重程度. 血清总胆汁酸[18]和总胆红素常被用于评价慢性肝损伤肝功能异常, 并不能用于本次急性酒精性肝损伤的评价中. 碱性磷酸酶(alkaline phosphatase, ALP)的肝同种型已经被作为肝脏疾病的经典指标, ALP是一种抗炎类因子[19], 可作为年轻个体损伤后应激或年老个体多器官损伤后的反应, 但对急性细胞损伤的特异性不强, 故未采用.
肝脏细胞的凋亡和坏死是肝脏损伤的关键性病理特征[20]. 其中炎症因子和凋亡通路扮演了重要的角色. 乙醇摄入可通过影响炎症因子的产生引发肝脏组织炎症[21], 且短期大量的酒精摄入可导致炎症细胞过度活化, 引起包括TNF-α、IL-1β和IL-6在内的大量炎症因子产生, 造成肝细胞炎症进一步加重, 引起肝细胞凋亡坏死[22]. 在肝脏的炎症反应过程中, TNF-α是ALD发病过程中关键性炎症因子. 肠道内毒素入血增多和氧化应激均可激活肝脏内的Kupffer细胞并产生大量的TNF-α等炎症因子. TNF-α既是核因子-κB(nuclear factor-κB, NF-κB)调节产物, 又是NF-κB的激活剂, 在ALD发病机制中尤其是炎症级联反应中发挥着关键作用[23]. 而IL-1β和IL-6作为炎症反应的主要效应分子在机体炎症过程中大量产生, 可以诱导肝脏急性期蛋白的合成及细胞损伤的发生. 在使用炎症因子TNF-α、IL-1β和IL-6指标评价肝脏损伤过程中, 实验组炎症因子的表达量显著高于对照组, 原因在于酒精入血后, 致炎因素激活了肝脏的Kupffer等炎症细胞[24], 引起炎症瀑布级联反应, 导致炎症因子大量释放造成肝脏细胞损伤. 从酒精大量摄入后的肝脏损伤炎症因子角度看, ELISA结果显示出年龄梯度中间高两边低的趋势, 实验组月龄为6 mo的大鼠中炎症指标的异常增高. 这可能是由于月龄为6 mo的大鼠过强的炎症反应和继发性免疫损伤造成的. 推断的理由在于: 一方面已有明确的研究表明B淋巴细胞活性[25]、IgM相关B淋巴细胞功能[26]乃至调节性T淋巴细胞活性[27]均显著受到年龄因素的影响. 同时也有研究[28]表明免疫调节功能在多种疾病模型中同年龄关系密切. 特别是在T淋巴细胞介导的炎症反应中, 年龄因素在糖尿病、肥胖、心血管疾病中均起到了至关重要的作用[29]. 在面对相同的手术损伤时, 不同年龄的大鼠局部炎症反应的强度不同[30]. 虽然肝脏具有同其他器官不同的修复特点, 且急性酒精刺激同一般性损伤不尽相同, 但其炎症应激应具有类似的过程. 因此我们推断, 6 mo组炎症指标的异常增高, 可能同年龄相关的炎症反应强度和免疫功能差异有关, 但仍待进一步实验证明.
酒精直接刺激所导致的肝脏损伤包括肝细胞坏死和肝细胞凋亡. 细胞凋亡是细胞为维持内环境的稳态, 由基因控制的细胞自主的程序性死亡过程. 生理状态下, 机体的器官在不同时期和状态下凋亡会有所不同. 已有研究表明: 年老个体的肝细胞凋亡水平在未干预前即高于年轻个体[31], 这与对照组实验结果相符. 酒精刺激后肝细胞凋亡率与年龄呈负相关, 年龄越大凋亡率越低. 这可能的解释是, 年龄越小的细胞活性越高, 抵抗损伤的能力越大, 酒精刺激后所引起的细胞坏死较少, 而酒精直接刺激及炎症因子间接激活凋亡通路, 导致细胞凋亡的异常增高. 相关研究已表明, 在炎症引起的凋亡过程中IL-1β可作为凋亡通路的上游信号[32], 引起凋亡的产生[33]. 因此除外炎症反应不同引起的凋亡差异外, 一定存在其他年龄相关影响凋亡发生的因素. 进一步研究发现Bax和Bcl-2两个凋亡上游分子表达情况同凋亡指标相一致, 因此可基本排除由于凋亡检测导致的错误结果. 同时也说明其不同凋亡结果可能是由于上游分子的表达不同引起的. 年龄因素不仅可直接引起损伤后的凋亡差异[34], 也可通过影响年龄相关性氧化应激指标, 导致继发性损伤的不同[35]. 因此或可解释凋亡峰值向年幼个体偏移的现象. 此外, 在比较48 h后肝脏损伤指标的过程中, 个体自我修复功能的年龄差异作用不可忽视[36]. 因此, 虽然总的结果显示出较为一致的损伤趋势, 但限于此次实验样本数量仍偏少, 研究内容仍处于表面现象. 年龄因素对于个体的影响是全面而深远的, 很难通过单一器官或数个指标的研究揭示其中的奥秘.
实验中存在的局限在于: 限制于大鼠肝脏取材的困难, 无法通过酒精干预前获取足够的血液和肝组织作为自身对照, 因此需要同批次相近的其他个体进行矫正, 存在较大误差. 同时, 由于年龄因素具有其特殊性, 会不可逆的影响全身各个组织器官[37]. 肝脏作为人体的代谢中心, 不仅直接受到年龄因素的影响[38], 还间接受到因年龄因素而发生功能改变的其他器官代谢改变的影响. 因此, 此次实验虽然从多方面研究了年龄因素在酒精性肝损伤中的影响, 但无法排除由于同年龄相关的其他因素造成的混杂偏移, 无法更进一步从机制上对该现象进行阐释.
总之, 本实验多层次多角度的论证了年龄因素对急性酒精性肝损伤和肝细胞凋亡的影响. 证实了相同体质量比的酒精灌胃处理后, 不同年龄大鼠肝脏对酒精刺激的敏感性不同, 在一定程度上说明了年龄因素在酒精性肝损伤中的意义和可能的凋亡机制. 但有关年龄因素影响酒精性肝脏炎症和细胞凋亡变化最终导致肝损伤程度不同的具体机制, 仍有待进一步研究.
感谢邓国英在本次试验中给予的大力帮助.
随着酗酒人数的增加, 由过量饮酒引起的酒精性肝病(alcohol liver disease, ALD)在全世界范围内发病率不断升高. 肝脏作为酒精代谢的中心其功能会随着年龄不断变化. 因此研究酒精在不同年龄阶段所引起的肝脏损伤差异具有重要的社会意义.
戴朝六, 教授, 中国医科大学第二临床学院(盛京医院)肝胆外科
肝脏作为酒精代谢的中心, 在代谢酒精的同时本身也会受到损伤. 而酒精性肝损伤的具体机制至今仍不十分明了. 因此研究不同条件下酒精性肝损伤的差异及可能机制, 为以后预防和治疗酒精性肝损伤提供理论基础.
有关酒精性肝损伤的机制错综复杂, 包括炎症反应, 过氧化损伤内毒素损伤等. 而随着年龄增长肝细胞的基因和蛋白表达会发生变化, 肝脏的某些功能也会随之变化. 而年龄因素在酒精性肝损伤中的作用尚不清楚.
本研究首次将年龄作为急性酒精性肝损伤的影响因素, 通过评估不同年龄阶段SD大鼠的急性酒精性肝损伤程度, 研究年龄对急性酒精性肝损伤的影响及可能机制.
研究年龄因素对动物急性酒精性肝损伤程度及细胞凋亡的影响, 为预防和治疗ALD提供参考.
酒精性肝病: 是一种由于长期大量饮酒导致的肝脏疾病, 初期通常表现为脂肪肝, 进而可发展成酒精性肝炎、肝纤维化和肝硬化, 是我国常见的肝脏疾病之一. 近年来占同期肝病住院患者的比例不断上升, 严重危害人民身心健康.
本实验选题符合该领域的研究方向与关心的热点问题, 设计合理, 具有一定的参考价值.
编辑: 于明茜 电编: 闫晋利
| 1. | Sethi SK. Reproducible plaquing system for rhinovirus serotypes in HeLa cells--agarose suspension. Acta Virol. 1978;22:60-65. [PubMed] |
| 2. | Shukla SD, Lim RW. Epigenetic effects of ethanol on the liver and gastrointestinal system. Alcohol Res. 2013;35:47-55. [PubMed] |
| 3. | Gika HG, Wilson ID. Global metabolic profiling for the study of alcohol-related disorders. Bioanalysis. 2014;6:59-77. [PubMed] [DOI] |
| 4. | Gilligan TJ, Schwarz G. The self-association of adenosine-5'-triphosphate studied by circular dichroism at low ionic strengths. Biophys Chem. 1976;4:55-63. [PubMed] [DOI] |
| 5. | Zakhari S. Bermuda Triangle for the liver: alcohol, obesity, and viral hepatitis. J Gastroenterol Hepatol. 2013;28 Suppl 1:18-25. [PubMed] [DOI] |
| 6. | Stevenson M, Lloyd-Jones M, Morgan MY, Wong R. Non-invasive diagnostic assessment tools for the detection of liver fibrosis in patients with suspected alcohol-related liver disease: a systematic review and economic evaluation. Health Technol Assess. 2012;16:1-174. [PubMed] [DOI] |
| 7. | Mathurin P, Bataller R. Trends in the management and burden of alcoholic liver disease. J Hepatol. 2015;62:S38-S46. [PubMed] [DOI] |
| 8. | Majaw T, Sharma R. Arginase I expression is upregulated by dietary restriction in the liver of mice as a function of age. Mol Cell Biochem. 2015;407:1-7. [PubMed] [DOI] |
| 9. | Kireev RA, Cuesta S, Ibarrola C, Bela T, Moreno Gonzalez E, Vara E, Tresguerres JA. Age-related differences in hepatic ischemia/reperfusion: gene activation, liver injury, and protective effect of melatonin. J Surg Res. 2012;178:922-934. [PubMed] [DOI] |
| 10. | Bruguera M. [Liver diseases in the elderly]. Gastroenterol Hepatol. 2014;37:535-543. [PubMed] [DOI] |
| 11. | Penny SM. Alcoholic liver disease. Radiol Technol. 2013;84:577-92; quiz 593-5. [PubMed] |
| 12. | Beier JI, Arteel GE, McClain CJ. Advances in alcoholic liver disease. Curr Gastroenterol Rep. 2011;13:56-64. [PubMed] [DOI] |
| 13. | You M, Crabb DW. Recent advances in alcoholic liver disease II. Minireview: molecular mechanisms of alcoholic fatty liver. Am J Physiol Gastrointest Liver Physiol. 2004;287:G1-G6. [PubMed] [DOI] |
| 14. | Kawase A, Ito A, Yamada A, Iwaki M. Age-related changes in mRNA levels of hepatic transporters, cytochrome P450 and UDP-glucuronosyltransferase in female rats. Eur J Drug Metab Pharmacokinet. 2015;40:239-244. [PubMed] [DOI] |
| 15. | Chang B, Sang L, Wang Y, Tong J, Zhang D, Wang B. The protective effect of VSL#3 on intestinal permeability in a rat model of alcoholic intestinal injury. BMC Gastroenterol. 2013;13:151. [PubMed] [DOI] |
| 16. | Montenegro WS, Malafaia O, Nassif PA, Moreira LB, Prestes MA, Kume MH, Jurkonis LB, Cella IF. Evaluation of liver regeneration with use of diet supplemented with L-arginine. Acta Cir Bras. 2014;29:603-607. [PubMed] [DOI] |
| 17. | van Beek JH, de Moor MH, de Geus EJ, Lubke GH, Vink JM, Willemsen G, Boomsma DI. The genetic architecture of liver enzyme levels: GGT, ALT and AST. Behav Genet. 2013;43:329-339. [PubMed] [DOI] |
| 18. | Akamatsu K, Tanaka A, Taketa K. [Studies of serum bile acid determination by enzyme method and serum total bile acid in liver diseases]. Nihon Shokakibyo Gakkai Zasshi. 1977;74:340-350. [PubMed] |
| 19. | Moss AK, Hamarneh SR, Mohamed MM, Ramasamy S, Yammine H, Patel P, Kaliannan K, Alam SN, Muhammad N, Moaven O. Intestinal alkaline phosphatase inhibits the proinflammatory nucleotide uridine diphosphate. Am J Physiol Gastrointest Liver Physiol. 2013;304:G597-G604. [PubMed] [DOI] |
| 20. | Wlodzimirow KA, Eslami S, Abu-Hanna A, Nieuwoudt M, Chamuleau RA. Acute liver failure: what is it? Hepatology. 2012;55:1306-1307. [PubMed] [DOI] |
| 21. | Kawaratani H, Tsujimoto T, Douhara A, Takaya H, Moriya K, Namisaki T, Noguchi R, Yoshiji H, Fujimoto M, Fukui H. The effect of inflammatory cytokines in alcoholic liver disease. Mediators Inflamm. 2013;2013:495156. [PubMed] |
| 22. | Nordmann R, Ribière C, Rouach H. Implication of free radical mechanisms in ethanol-induced cellular injury. Free Radic Biol Med. 1992;12:219-240. [PubMed] [DOI] |
| 23. | Harada H, Hines IN, Flores S, Gao B, McCord J, Scheerens H, Grisham MB. Role of NADPH oxidase-derived superoxide in reduced size liver ischemia and reperfusion injury. Arch Biochem Biophys. 2004;423:103-108. [PubMed] [DOI] |
| 24. | Enomoto N, Ikejima K, Yamashina S, Enomoto A, Nishiura T, Nishimura T, Brenner DA, Schemmer P, Bradford BU, Rivera CA. Kupffer cell-derived prostaglandin E(2) is involved in alcohol-induced fat accumulation in rat liver. Am J Physiol Gastrointest Liver Physiol. 2000;279:G100-G106. [PubMed] |
| 25. | Martin V, Bryan Wu YC, Kipling D, Dunn-Walters D. Ageing of the B-cell repertoire. Philos Trans R Soc Lond B Biol Sci. 2015;370. [PubMed] |
| 26. | Martin V, Wu YC, Kipling D, Dunn-Walters DK Age-related aspects of human IgM(+) B cell heterogeneity. Ann N Y Acad Sci. 2015; Jul 7. [Epub ahead of print]. [PubMed] |
| 27. | Raynor J, Karns R, Almanan M, Li KP, Divanovic S, Chougnet CA, Hildeman DA. IL-6 and ICOS Antagonize Bim and Promote Regulatory T Cell Accrual with Age. J Immunol. 2015;195:944-952. [PubMed] [DOI] |
| 28. | Ruan QW, Yu ZW, Bao ZJ, Ma YX. [The relationship between the polymorphism of immunity genes and both aging and age-related diseases]. Yi Chuan. 2013;35:813-822. [PubMed] [DOI] |
| 29. | Macaulay R, Akbar AN, Henson SM. The role of the T cell in age-related inflammation. Age (Dordr). 2013;35:563-572. [PubMed] [DOI] |
| 30. | Sánchez-Hidalgo JM, Naranjo A, Ciria R, Ranchal I, Aguilar-Melero P, Ferrín G, Valverde A, Rufián S, López-Cillero P, Muntané J. Impact of age on liver regeneration response to injury after partial hepatectomy in a rat model. J Surg Res. 2012;175:e1-e9. [PubMed] [DOI] |
| 31. | Mach J, Huizer-Pajkos A, Kane A, Jones B, McKenzie C, Mitchell SJ, de Cabo R, Cogger VC, Le Couteur DG, Hilmer SN. The effect of aging on mitochondrial and cytosolic hepatic intrinsic death pathway and apoptosis associated proteins in Fischer 344 rats. Exp Gerontol. 2015;67:54-61. [PubMed] [DOI] |
| 32. | Chang YW, Zhao YF, Cao YL, Gu W, Pang J, Zhan HS. Bufalin exerts inhibitory effects on IL-1β-mediated proliferation and induces apoptosis in human rheumatoid arthritis fibroblast-like synoviocytes. Inflammation. 2014;37:1552-1559. [PubMed] [DOI] |
| 33. | Huang Y, Wu D, Fan W. Protection of ginsenoside Rg1 on chondrocyte from IL-1β-induced mitochondria-activated apoptosis through PI3K/Akt signaling. Mol Cell Biochem. 2014;392:249-257. [PubMed] [DOI] |
| 34. | Zingarelli B, Chima R, O'Connor M, Piraino G, Denenberg A, Hake PW. Liver apoptosis is age dependent and is reduced by activation of peroxisome proliferator-activated receptor-gamma in hemorrhagic shock. Am J Physiol Gastrointest Liver Physiol. 2010;298:G133-G141. [PubMed] [DOI] |
| 35. | Tevzadze N, Gujabidze N, Giorgadze S, Rukhadze R. The age related changes of nitric oxide and apoptosis in experiment. Georgian Med News. 2009;87-90. [PubMed] |
| 36. | Shirabe K, Motomura T, Takeishi K, Morita K, Kayashima H, Taketomi A, Ikegami T, Soejima Y, Yoshizumi T, Maehara Y. Human early liver regeneration after hepatectomy in patients with hepatocellular carcinoma: special reference to age. Scand J Surg. 2013;102:101-105. [PubMed] [DOI] |
| 37. | Hansen S, Baptiste KE, Fjeldborg J, Horohov DW. A review of the equine age-related changes in the immune system: comparisons between human and equine aging, with focus on lung-specific immune-aging. Ageing Res Rev. 2015;20:11-23. [PubMed] [DOI] |
| 38. | Sheedfar F, Di Biase S, Koonen D, Vinciguerra M. Liver diseases and aging: friends or foes? Aging Cell. 2013;12:950-954. [PubMed] [DOI] |