修回日期: 2015-10-09
接受日期: 2015-10-19
在线出版日期: 2015-11-08
目的: 检测肝细胞肝癌(hepatocellular carcinoma, HCC)癌组织、癌旁组织(adjacent normal liver tissue, ANLT)及不同侵袭能力细胞系中极性蛋白AF-6 mRNA的表达情况, 分析其在不同组织及不同细胞系中的表达差异及意义.
方法: 利用实时定量PCR检测(real-time quantitative, qRT-PCR)检测AF-6 mRNA在30对癌组织、ANLT和4种细胞系(L02、HepG2、MHCC97-H和HCCLM3)中的表达情况.
结果: AF-6 mRNA在93.3%(28/30)的HCC中呈低表达; 正常肝细胞株L02中AF-6 mRNA含量明显高于肝癌细胞株(P<0.05); 高侵袭转移能力的细胞系MHCC97-H及HCCLM3只有极低的AF-6 mRNA表达, 且明显低于低侵袭转移能力的细胞系HepG2(P<0.05).
结论: AF-6 mRNA在肝癌中的低表达可能与高侵袭能力相关, 提示AF-6 mRNA在将来可能会成为治疗侵袭性HCC的潜在靶点.
核心提示: 通过研究AF-6 mRNA在肝细胞癌及癌旁组织(adjacent normal liver tissue, ANLT)的表达, 发现AF-6 mRNA在肝细胞癌组织的表达明显低于ANLT, 另外在高侵袭细胞的表达明显低于低侵袭细胞和正常肝细胞, 推测AF-6在肝癌中的低表达可能与高侵袭能力相关.
引文著录: 吴天春, 冯留顺, 李捷, 李德旭. 极性蛋白AF-6 mRNA在肝细胞肝癌中的表达及其对侵袭的影响. 世界华人消化杂志 2015; 23(31): 5045-5049
Revised: October 9, 2015
Accepted: October 19, 2015
Published online: November 8, 2015
AIM: To detect the expression of polarity protein AF-6 mRNA in hepatocellular carcinoma (HCC), tumor-adjacent hepatic tissue and cell lines with different invasive abilities, and analyze the clinical significance of AF-6 mRNA expression in different tissues and cell lines.
METHODS: Real-time quantitative PCR was used to detect the expression of AF-6 mRNA in 30 pairs of tumor tissue and adjacent tissues and four cell lines.
RESULTS: The expression of AF-6 mRNA was low in 93.3% (28/30) of HCC specimens. AF-6 mRNA expression was significantly higher in the normal liver cell line L02 than in hepatoma cell lines (P < 0.05). The expression of AF-6 mRNA was significantly lower in MHCC97-H and HCCLM3 cell lines with high invasion and metastasis ability than in HepG2 cell line low invasion and metastasis ability (P < 0.05).
CONCLUSION: The low expression of AF-6 mRNA in HCC may associate with high invasiveness. AF-6 mRNA may become a potential target for the treatment of invasive HCC in the future.
- Citation: Wu TC, Feng LS, Li J, Li DX. Expression of AF-6 mRNA in hepatocellular carcinoma: Effect on invasion. Shijie Huaren Xiaohua Zazhi 2015; 23(31): 5045-5049
- URL: https://www.wjgnet.com/1009-3079/full/v23/i31/5045.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i31.5045
肝细胞癌(hepatocellular carcinoma, HCC)是5大常见恶性肿瘤之一, 全球每年有超过50万HCC新发病例, 其中一半以上发生在我国[1]. HCC患者术后的复发转移率极高是导致患者预后差的主要原因[2], 但是到目前为止仍没有有效的治疗方法遏制HCC术后的复发转移. 因此, 研究HCC复发转移中潜在的分子机制在改善HCC患者预后中可能具有重要的意义. AF-6被认为是细胞紧密连接的成分, 是一种极性蛋白, 在维持细胞发育、维持顶-底性、损伤修复及组织完整性等过程中所必需的[3]. 研究[4]显示, 极性蛋白的异常表达及错误定位均与肿瘤紧密相关. 近期有文献报道, AF-6 mRNA与胰腺癌的侵袭转移能力密切相关, 但其在HCC中的表达及其在HCC侵袭转移中的作用, 至今尚不清楚, 有待于进一步的探讨.
选取郑州大学第一附属医院肝胆外科2014-01-01/2014-12-31收集的30例HCC组织及相应癌旁组织(adjacent normal liver tissue, ANLT)标本进行相关实验; 正常肝细胞株L02、肝癌HepG2、MHCC97-H及HCCLM3细胞系源于本实验室保存, 购自上海生命技术科学院. 主要试剂和工具酶: 采用罗氏公司Faststart Universal SYBRGreen Master(ROX)瑞士试剂盒, Taq DNA聚合酶购自Gibco公司; AF-6基因PCR引物由上海生物工程公司合成; 本研究经相关患者知情同意并报医院伦理委员会批准.
1.2.1 细胞系的培养: 为保证实验所需各个细胞株的生长质量和数量, 将保存的人肝L02细胞及肝癌HepG2、MHCC97-H及HCCLM3细胞系分别予以复苏、培养、传代及冻存.
1.2.2 肝癌组织标本和细胞株总RNA的提取: 将研磨好的新鲜肝癌及ANLT标本, 或收获的细胞株, 加入1.0 mL的裂解液, 用移液器吹打几次; 加入0.2 mL的氯仿, 剧烈振荡15 s, 室温放置3 min; 4 ℃下10000 g离心15 min, 将上层水相转移到新管中, 加0.5 mL异丙醇沉淀RNA, 室温放置10 min; 4 ℃ 10000 g离心10 min, 移去上清; 加1.0 mL 750 mL/L乙醇洗涤RNA沉淀, 4 ℃下7500 g离心5 min, 弃去上清; 室温放置干燥RNA沉淀10 min; 加入100 μL无RNA酶水使RNA充分溶解后置于-80 ℃冰箱中保存.
1.2.3 cDNA合成: 分别加入1 μL对应编号的总RNA, 65 ℃孵育5 min后, 将4 μL 5×RT缓冲剂+2 μL dNTP混合物+1 μL RNA酶抑制剂+1 μL Rever Tra Ace加入前面12 μL反应体系中, 再次将排管置入PCR仪中进行逆转录扩增; 条件设置为42 ℃、20 min, 99 ℃、5 min, 4 ℃、5 min. 逆转录扩增结束后立即置于4 ℃保存.
1.2.4 实时定量PCR检测: 按照实时定量PCR检测(real-time quantitative PCR, qRT-PCR)引物设计原则, 根据GeneBank数据库中人AF-6基因的序列, 以人GAPDH为内参, 交由上海生工生物技术公司合成. AF-6的引物为: 上游: F1-GCCAAGTGACAAAGGGAT, 下游: R1-TAACTGAAGGCGGTAAAG; GAPDH的引物为: 上游: F66-AGGTCGGAGTCAACGGATT
TG, 下游: R597-GTGATGGCATGGACTGTGGT; 按照试剂盒说明书操作加样, 于各孔内加入2 μL编号的cDNA; 将加好样并密封完全的96孔板平整放入仪器内, 设置好反应条件后启动PCR反应; 具体条件为: 95 ℃预变性10 min, 95 ℃变性15 s, 60 ℃退火60 s, 72 ℃延伸30 s, 共40个循环, 72 ℃ 10 min; 每个样本做3个复孔; 检测结果采用目的基因与内参照的比值表示分析AF-6 mRNA的相对表达量.
统计学处理 采用SPSS17.0统计学软件; 计数资料以构成以百分比表示, 采用独立样本t检验; 当数据满足正态且方差齐性时, 采用独立样本t检验; 当数据满足正态但方差不齐时, 采用校正t检验; 所有检验均为双侧检验, P<0.05为差异具有统计学意义.
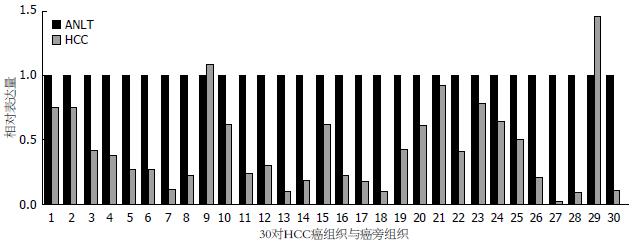
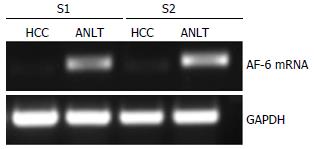
利用qRT-PCR检测HCC组织标本中AF-6 mRNA表达水平; 将30例HCC组织及相应的ANLT进行配对对比研究; 将AF-6在ANLT中的mRNA表达水平设为1, 计算AF-6 mRNA在各例HCC组织中的相对表达量; 当HCC组织中AF-6 mRNA的相对表达量>1.0时, 提示高表达; 当<1.0时, 提示低表达. 结果显示: 30对组织标本中, AF-6在肝癌组织中的mRNA相对低表达者28例, 占93.3%; 其中相对表达量为0.339, 即ANLT中AF-6 mRNA的表达水平是HCC的2.95倍; AF-6在HCC中的mRNA表达水平显著低于ANLT(P<0.05, 图1).
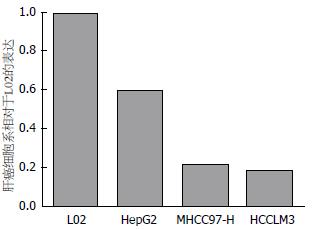
分别提取正常肝细胞系L02和3种不同侵袭能力肝癌细胞系HepG2、MHCC97-H和HCCLM3, 采用qRT-PCR技术检测4种细胞系中AF-6 mRNA表达水平(所有细胞实验重复3次); 以L02为对照, 设其相对表达量为1, 计算各细胞系AF-6 mRNA的相对表达量, 结果显示: AF-6在HCC细胞系中的mRNA表达含量明显低于正常肝细胞系, 低侵袭潜能的HCC细胞系HepG2的mRNA的相对表达值为0.60; 高侵袭潜能HCC细胞系MHCC97-H和HCCLM3中mRNA的相对表达值分别为0.22、0.18(P<0.05, 图2, 3).
新近的资料表明, 肝癌在全球范围所有恶性肿瘤中的死亡率高居第3位[5], 虽然少数患者得到早期确诊并及时手术且获得较长的生存机会, 但是总体上HCC患者死亡率仍居高不下, HCC患者术后复发转移率极高是首要原因. 有研究[6]表明, HCC患者术后5年内复发转移可能性达80%; 由此可见, HCC术后的复发转移是导致其手术疗效欠佳、术后5年生存率持续较低的主要原因, 因此对HCC术后潜在的复发转移分子机制进行研究, 寻找能够遏制HCC复发转移的潜在靶点迫在眉睫[7,8].
目前, 已知可能参与肝细胞肝癌侵袭转移的分子生物学机制有肝癌细胞基因型的改变; 肝细胞表面结合黏附能力增强, 促进局部新生血管形成; 细胞代谢功能及癌细胞与宿主、癌细胞与细胞间质之间相互作用等[9-11]. AF-6基因在多种癌症中异常表达, 包括白血病、卵巢和乳腺癌[11-16]. 研究[4]表明, AF-6在胰腺癌中呈低表达, 通过激活Snail通路促进胰腺癌的复发转移; 因此, 我们假设AF-6在HCC患者具有相同的分子生物学特性, 从而参与到HCC的侵袭转移中.
为了证实我们的假设, 我们采用qRT-PCR技术检测HCC及ANLT标本中AF-6 mRNA的表达水平, 将HCC及ANLT配对进行对比研究, 结果显示30对HCC组织标本中, AF-6 mRNA在93.3%的HCC组织中相对低表达, 和之前在卵巢癌及乳腺癌等同类型的研究表现出一致性, 提示AF-6 mRNA可能与肝癌的发生相关; qRT-PCR技术检测正常肝细胞系L02和HCC细胞系(HepG2、MHCC97-H及HCCLM3)的AF-6 mRNA表达水平, 显示AF-6 mRNA在HCC细胞系中的mRNA表达含量明显低于正常肝细胞系, 这在同类研究中同样表现出一致性, 提示AF-6可能与肝癌的侵袭转移相关; 据此, 我们推测, AF-6可能与HCC的复发转移相关; AF-6 mRNA在HCC组织与细胞中均呈显著低表达, AF-6 mRNA的表达水平与肝癌细胞的侵袭转移潜能存在负相关; AF-6 mRNA表达水平在侵袭转移潜能依次降低的HCCLM3、MHCC97-H及HepG2细胞系中的表达水平却是依次升高; AF-6 mRNA表达水平与肝癌侵袭转移潜能负相关, 提示AF-6可能对HCC侵袭转移有抑制作用; 但是, 我们的研究也存在一些不足, 如样本量小, 蛋白水平的表达未予探讨, 这些问题仍然需要进一步的研究.
总之, AF-6 mRNA在肝癌中的低表达可能与高侵袭能力相关, AF-6 mRNA及其转录产物在将来可能会成为基因、分子水平治疗侵袭性HCC的潜在靶点.
肝细胞癌(hepatocellular carcinoma, HCC)患者术后的复发转移率极高是导致患者预后差的主要原因, 但是到目前为止仍没有有效的治疗方法遏制肝细胞癌术后的复发转移; 因此, 研究肝细胞癌复发转移中潜在的分子机制在改善肝细胞癌患者预后中可能具有重要的意义.
庹必光, 教授, 遵义医学院附属医院消化科
对肝细胞癌术后潜在的复发转移分子机制进行研究, 从而寻找AF-6 mRNA及其转录产物在将来可能会成为基因、分子水平治疗侵袭性肝细胞癌的潜在靶点, 但是由于时间和资金等原因, 分子水平尚未探讨, 亟待进一步解决.
上海生命科学院詹丽杏教授团队的研究发现AF-6通过抑制Dvl2-FOXE1复合物对Snail转录调控, 揭示了其在抑制胰腺癌转移的重要作用及机制, 我们假设AF-6在肝细胞癌患者具有相同的分子生物学特性, 从而参与到肝细胞癌的侵袭转移中.
关于AF-6在肝细胞癌的研究尚未见报道; 作者研究了AF-6 mRNA在肝细胞癌及癌旁组织(adjacent normal liver tissue, ANLT)的表达, 推测AF-6 mRNA在肝癌中的低表达可能与高侵袭能力相关.
研究肝细胞癌复发转移的分子机制, 使AF-6 mRNA及其转录产物在将来可能会成为基因、分子水平治疗侵袭性肝细胞癌的潜在靶点.
极性蛋白AF-6: 细胞极性是细胞发育、维持顶-底极性、损伤修复及组织完整性等生理过程所必需的, 主要是由一系列的极性蛋白调控. AF-6是细胞紧密连接的成分, 是一种极性蛋白, 研究显示, 极性蛋白的异常表达及错误定位均与肿瘤紧密相关.
作者发现AF-6 mRNA在肝细胞癌及ANLT的表达, 发现AF-6 mRNA在肝细胞癌组织的表达明显低于ANLT, 另外在高侵袭细胞的表达明显低于低侵袭细胞和正常肝细胞, 推测AF-6在肝癌中的低表达可能与高侵袭能力相关, 该研究有一定新颖性及临床意义. 但为了明确AF-6的作用还需进一步做: (1) AF-6蛋白质的表达, 看是否和mRNA的结果一致; (2)进一步通过AF-6 的siRNA或过表达, 看AF-6是否与肝细胞癌细胞的侵袭有关.
编辑: 于明茜 电编: 都珍珍
| 1. | El-Serag HB. HepatocellμLar carcinoma. N Engl J Med. 2011;365:1118-1127. |
| 2. | Imamura H, Matsuyama Y, Tanaka E, Ohkubo T, Hasegawa K, Miyagawa S, Sugawara Y, Minagawa M, Takayama T, Kawasaki S. Risk factors contributing to early and late phase intrahepatic recurrence of hepatocellular carcinoma after hepatectomy. J Hepatol. 2003;38:200-207. [PubMed] [DOI] |
| 3. | Zhadanov AB, Provance DW, Speer CA, Coffin JD, Goss D, Blixt JA, Reichert CM, Mercer JA. Absence of the tight junctional protein AF-6 disrupts epithelial cell-cell junctions and cell polarity during mouse development. Curr Biol. 1999;9:880-888. [PubMed] [DOI] |
| 4. | Xu Y, Chang R, Peng Z, Wang Y, Ji W, Guo J, Song L, Dai C, Wei W, Wu Y. Loss of polarity protein AF6 promotes pancreatic cancer metastasis by inducing Snail expression. Nat Commun. 2015;6:7184. [PubMed] [DOI] |
| 5. | Lindsey A. Torre, Freddie B, Rebecca L, Siegel, Jacques F, Joannie LT, Ahmedin J. Global cancer statistics 2012. CA Cancer J Clin. 2015;65:87-108. |
| 6. | Tung-Ping Poon R, Fan ST, Wong J. Risk factors, prevention, and management of postoperative recurrence after resection of hepatocellular carcinoma. Ann Surg. 2000;232:10-24. [PubMed] [DOI] |
| 10. | Park JW, Lee YS, Kim JS, Lee SK, Kim BH, Lee JA, Lee NO, Kim SH, Hong EK. Downregulation of discoidin domain receptor 2 decreases tumor growth of hepatocellular carcinoma. J Cancer Res Clin Oncol. 2015;141:1973-1983. [PubMed] [DOI] |
| 12. | Saha V, Lillington DM, Shelling AN, Chaplin T, Yaspo ML, Ganesan TS, Young BD. AF6 gene on chromosome band 6q27 maps distal to the minimal region of deletion in epithelial ovarian cancer. Genes Chromosomes Cancer. 1995;14:220-222. [PubMed] [DOI] |
| 13. | Prasad R, Gu Y, Alder H, Nakamura T, Canaani O, Saito H, Huebner K, Gale RP, Nowell PC, Kuriyama K. Cloning of the ALL-1 fusion partner, the AF-6 gene, involved in acute myeloid leukemias with the t(6; 11) chromosome translocation. Cancer Res. 1993;53:5624-5628. [PubMed] |
| 14. | Letessier A, Garrido-Urbani S, Ginestier C, Fournier G, Esterni B, Monville F, Adélaïde J, Geneix J, Xerri L, Dubreuil P. Correlated break at PARK2/FRA6E and loss of AF-6/Afadin protein expression are associated with poor outcome in breast cancer. Oncogene. 2007;26:298-307. [PubMed] [DOI] |