修回日期: 2015-09-16
接受日期: 2015-09-28
在线出版日期: 2015-10-28
目的: 研究威灵仙多糖对实验性非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)大鼠血清白介素17(interleukin 17, IL-17)水平、肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)水平和脏脏病理改变的干预作用, 并探讨血清IL17水平与TNF-α水平的相关性.
方法: 采用高脂饲料饲养SD大鼠建立实验性NASH大鼠模型, 通过检测实验性NASH大鼠模型组、威灵仙多糖组、易善复组及空白组空腹IL-17、TNF-α的含量及观察评估肝脏脂肪变分度、肝脏炎症分级后, 统计分析各组血清IL17水平、血清TNF-α水平的差异和肝脏病理改变, 并探讨血清IL17水平和TNF-α水平的相关性.
结果: 威灵仙多糖组NASH大鼠与模型组相比, 肝脏脂肪变、肝脏炎症程度均减轻(均P<0.05), 血清IL-17、TNF-α水平均明显降低(均P<0.01); 威灵仙多糖组NASH大鼠与易善复组相比, 肝脏脂肪变、肝脏炎症、血清TNF-α、IL-17水平均相当(均P>0.05).
结论: 威灵仙多糖可有效治疗NASH大鼠, 疗效与易善复相当, 其主要机制之一可能是降低NASH大鼠血清IL-17及TNF-α水平、并改善NASH大鼠肝脏病理改变.
核心提示: 高脂饮食诱导的非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)大鼠血清白介素17(interleukin 17, IL-17)及血清肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)水平均明显升高, 且呈正相关, 并存在明显的肝脏脂肪变和肝脏炎症; 威灵仙多糖能有效降低高脂饮食诱导的NASH大鼠血清IL-17及TNF-α水平、改善NASH大鼠肝脏病理改变, 或
引文著录: 叶江锋, 琚坚, 王伟, 赵钰鑫. 威灵仙多糖对实验性NASH大鼠血清IL-17、TNF-α水平和肝脏病理改变的干预作用. 世界华人消化杂志 2015; 23(30): 4864-4870
Revised: September 16, 2015
Accepted: September 28, 2015
Published online: October 28, 2015
AIM: To investigate the effect of Clematis polysaccharide on serum levels of interleukin-17 (IL-17) and tumor necrosis factor alpha (TNF-α) and hepatic pathological changes in rats with non-alcoholic steatohepatitis (NASH), and to analyze the correlation between serum levels of IL-17 and TNF-α.
METHODS: A rat model of NASH was established by feeding SD rats a high-fat diet. The levels of fasting IL-17 and TNF-α were tested, and the liver fatty degeneration grade and liver inflammation grade were assessed for NASH model rats, NASH rats treated with Clematis polysaccharide, NASH rats treated with polyene phosphatidylcholine, and normal rats. The differences in fasting IL-17 and TNF-α levels and hepatic pathological changes among all groups were compared, and the correlation between serum levels of IL-17 and TNF-α was analyzed.
RESULTS: Compared with the model group, NASH rats treated with Clematis polysaccharide had milder liver fatty degeneration and liver inflammation (P < 0.05 for both) and lower serum levels of IL-17 and TNF-α (P < 0.01 for both). Compared with the polyene phosphatidylcholine group, NASH rats treated with Clematis polysaccharide had a similar liver fatty degeneration grade and liver inflammation grade, and similar serum IL-17 and TNF-α levels (P > 0.05 for all).
CONCLUSION: Clematis polysaccharide is effective in NASH rats, its therapeutic effect is equivalent to that of polyene phosphatidylcholine, and the underlying mechanism may be associated with reducing serum IL-17 and TNF-α levels, and improving hepatic pathological change.
- Citation: Ye JF, Ju J, Wang W, Zhao YX. Effect of Clematis polysaccharide on serum IL-17 and TNF-α levels and hepatic pathological changes in rats with non-alcoholic steatohepatitis. Shijie Huaren Xiaohua Zazhi 2015; 23(30): 4864-4870
- URL: https://www.wjgnet.com/1009-3079/full/v23/i30/4864.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i30.4864
非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)是以无过量饮酒史(或酒精摄入量<20 g/d)为前提条件, 并以肝细胞脂肪变性、气球样变、弥散性肝小叶轻度炎症和/或肝中央静脉、肝窦周围胶原沉积等为病理特征的慢性肝脏炎性疾病[1,2]. NASH是与胰岛素抵抗和遗传易感性密切相关的获得性代谢疾病, 作为单纯性脂肪肝发展为肝纤维化的关键病理阶段, 常见于肥胖、2型糖尿病、高脂血症等患者[3,4]. NASH是全球范围内慢性肝脏疾病越来越常见的原因, 即使在没有形成肝硬化的情况下, 该病也与增加肝脏相关的死亡率和肝细胞癌有关系[5-7]. NASH若不给予及时有效的治疗, 肝脏组织受损严重, 则有进展为肝硬化、甚至肝癌的可能[8,9]. 有研究[10]显示, NASH患者的10-15年肝硬化发生率高达15%-25%. 在治疗上, 经基础治疗无效者和肝活检证实为NASH及病程呈慢性进展性者, 可采用针对肝病的药物进行辅助治疗, 以抗氧化、抗炎、抗肝纤维化为主, 可依药物性能、疾病活动及病理检查结果, 合理选用烯磷脂酰胆碱(易善复)、维生素 E、水飞蓟宾及熊去氧胆酸等相关药物, 但不宜同时应用多种药物[11]. 威灵仙多糖是毛茛科植物威灵仙(Clematis chinensis Osbeck)的活性成分之一, 具有抗氧化和抗肿瘤等功效[12,13]. 本文旨在探讨威灵仙多糖对实验性NASH大鼠模型血清白介素17(interleukin 17, IL-17)水平、血清肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)及肝脏脂肪变分度、肝脏炎症分级的影响, 并与易善复进行对比, 探讨应用威灵仙多糖治疗NASH的价值.
清洁级健康♂SD大鼠50只, 平均体质量70 g±10 g, 购自昆明医科大学动物实验中心: SCXK(滇)2005-0008, 大鼠饲养于昆明医科大学动物实验中心. 所有大鼠分笼放在室温22 ℃±2 ℃, 湿度50%±5%, 通风良好, 自然昼夜光线, 安静环境下饲养, 期间大鼠自由进食、饮水. 猪油购自昆明市农贸市场; 蛋黄粉、胆固醇、胆酸钠购自上海源叶生物科技有限公司; 威灵仙多糖(纯度 = 61.5%)购自安徽大学生命科学院; 多烯磷脂酰胆碱胶囊(228 mg/粒)购自赛诺菲(北京)制药有限公司; 戊巴比妥钠购自上海西塘生物科技有限公司; 福尔马林溶液购自上海远慕生物科技有限公司; 大鼠血IL-17检测试剂盒采用美国eBioscience公司产品(85-BMS635 IL-17 Platinum ELISA 96tests); TNF-α检测试剂盒采用美国Raybiotech公司产品(ELR-TNF-α-001 96T); 主要仪器设备: LT202精密电子天平200 g/0.01 g、B600B型医用低速离心机、7020全自动生化分析仪、石蜡切片机、光学显微镜、SHH420恒温水浴箱、Mix Ⅱ Type 37600涡旋混匀器、连续波长酶标仪.
1.2.1 造模阶段实验动物分组: 从50只清洁级健康♂SD大鼠中随机抽取14只组成空白组, 剩余的36只作为模型组.
1.2.2 NASH大鼠模型的建立: 空白组予普通饲料喂养16 wk; 模型组予高脂饲料(饲料配比: 82.5%普通饲料+10%猪油+5%蛋黄粉+2%胆固醇+0.5%胆酸钠)喂养16 wk. 然后在造模期间的第4周末随机选择空白组和模型组各1只、第8周末各1只、第12周末各2只、第16周末各2只, 下腔静脉取血测定空腹IL17、TNF-α的值; 于肝右叶中央部位取适量肝组织, 行HE染色后在光镜下观察肝脏脂肪变、炎症情况, 统计分析空白组和模型组大鼠血清中空腹血清IL-17、TNF-α水平的差异, 最后根据检测及观察的相关指标来判断实验性NASH大鼠模型成功建立[14].
1.2.3 药物干预阶段实验动物分组: 实验性NASH大鼠模型成功建立后, 将余下的30只原模型组大鼠随机分为模型组、易善复组和威灵仙多糖组, 每组分别10只; 余下的8只原空白组大鼠作为空白组. 药物干预: 模型组、易善复组、威灵仙多糖组、空白组依次分别予0.9%氯化钠注射液、易善复[195.4 mg/(kg•d)]、威灵仙多糖[50 mg/(kg•d)][12]、0.9%氯化钠注射液配成3 mL溶液, 灌胃干预8 wk.
1.2.4 大鼠血清采集及指标测定: 剖杀大鼠前禁食禁饮24 h, 3%戊巴比妥钠0.10-0.15 mL/100 g行腹腔麻醉, 然后下腔静脉采血测定IL17、TNF-α水平. 血清IL17与TNF-α测定步骤严格按照大鼠血清ELISA试剂盒说明书进行操作.
1.2.5 大鼠肝脏病理结果判定: 摘取全部肝脏、滤纸拭干称质量后, 于肝右叶中央部适量取材一块置于40 g/L甲醛溶液中固定, 行石蜡切片, HE染色观察评估肝细胞脂肪变分度和肝脏炎症分级, 评判标准如下: 根据《非酒精性脂肪肝诊疗指南(2006)》[15]评估肝细胞脂肪变分度; 根据《肝纤维化诊断及疗效评估共识》[16]评估肝脏炎症分级.
统计学处理 采用SPSS22.0软件进行统计分析. 定量资料采用mean±SD表示, 符合正态分布采用t检验和单因素方差分析; 相关性分析非正态分布采用Spearson相关性分析; 等级资料的统计方法采用秩和检验. P<0.05表示差异具有统计学意义.
造模阶段: 模型组大鼠逐渐出现皮毛光泽度变差, 活动量减少, 食欲降低, 大便质软、稀, 饮水增多, 而空白组大鼠普遍毛发光整, 活动力强, 进食饮水量无异常, 大便性状正常. 干预阶段: 经灌胃干预后, 易善复组、威灵仙多糖组大鼠食欲欠佳, 活动力, 皮毛不光整情况较模型组有所改善; 但各组大鼠体质量增加都相对放缓; 空白组大鼠进食饮水量无异常、活动力正常、毛发较为光整. 模型组、易善复组、威灵仙多糖组大便性状仍旧软、稀, 饮水仍较多, 三组间无明显差别且与造模期间无明显区别; 空白组大便性状正常.
干预结束后, 空白组血清IL-17、TNF-α的含量与模型组相比, 差异具有显著统计学意义(P<0.01), 而分别与易善复组、威灵仙多糖组相比, 差异不具有统计学意义(均P>0.05); 模型组血清IL-17、TNF-α的含量分别与易善复组、威灵仙多糖组相比, 差异具有显著统计学意义(P<0.01); 易善复组血清IL-17、TNF-α的含量与威灵仙多糖组相比, 差异不具有统计学意义(P>0.05)(表1).
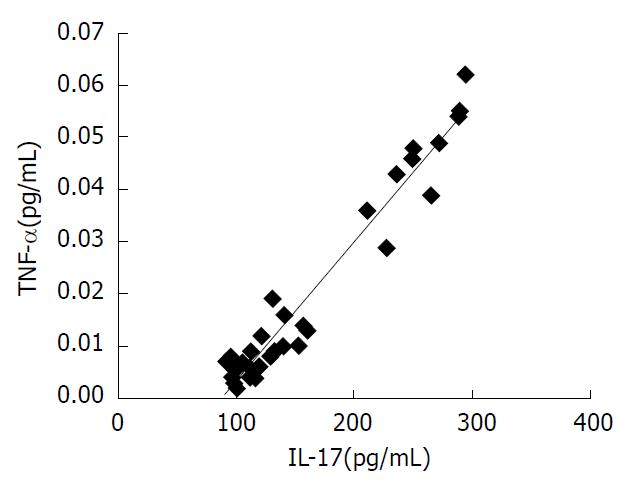
IL-17和TNF-α的相关性分析采用Spearson相关性分析, r = 0.882, P<0.001, 提示IL-17与TNF-α正相关(图1).
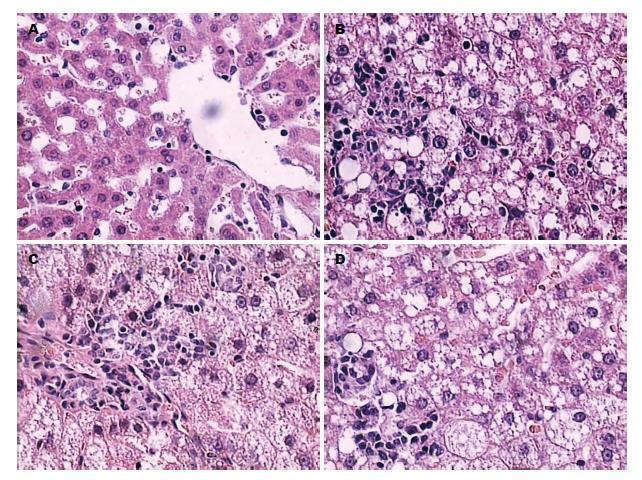
空白组: 肝板结构正常, 肝窦存在, 窦内及汇管区个别炎症细胞(淋巴细胞及浆细胞)浸润. 模型组: 肝板结构消失, 部分肝窦闭锁, 部分肝窦扩张, 大量红细胞外渗, 肝细胞重度脂肪变性及细胞气球样变性, 肝小叶内及汇管区大量慢性炎症细胞(淋巴细胞及浆细胞)浸润, 点状坏死灶明显. 易善复组: 肝板结构消失, 部分肝窦闭锁, 红细胞外渗, 肝细胞广泛脂肪变性, 部分细胞气球样变性, 可见个别点状坏死灶. 威灵仙多糖组: 肝板结构消失, 肝细胞广泛脂肪变性, 部分细胞气球样变性, 可见个别点状坏死灶, 汇管区慢性炎症细胞(淋巴细胞及浆细胞)浸润(图2).
干预结束后, 空白组肝脏脂肪变性分度、炎症分级与模型组、易善复组、威灵仙多糖组相比, 差异具有显著统计学意义(P<0.01); 模型组肝脏脂肪变性分度、炎症分级与易善复组相比, 差异具有显著统计学意义(P<0.01); 模型组肝脏脂肪变性分度、炎症分级与威灵仙多糖相比, 差异具有统计学意义(P<0.05); 易善复组肝脏脂肪变性分度、炎症分级与威灵仙多糖组相比, 差异不具有统计学意义(P>0.05)(表2).
| 分组 | n | 干预后肝脏脂肪变性分度(度) | 干预后肝脏炎症分级(级) |
| 空白组 | 8 | 4.5 | 6.0 |
| 模型组 | 10 | 30.5b | 29.9b |
| 易善复组 | 10 | 18.5bd | 18.25bd |
| 威灵仙多糖组 | 10 | 21.5bc | 21.15bc |
NASH是以肝细胞丧失、脂肪变性、气球样变、炎性坏死及纤维化形成为特征的病理状态. NASH常见于2型糖尿病、高血压、高脂血症及肥胖患者. 研究[17]表明胰岛素抵抗、氧应激及脂质过氧化损伤、炎症细胞因子、抵抗素、瘦素、脂联素、过氧化物酶增殖激活的受体-α(peroxisome proliferator activated receptors-α, PPAR-α)等脂肪因子、细胞凋亡、细胞核因子-κB(nuclear factor-κB, NF-κB)、肝组织固醇调节元件结合蛋白-1C(sterol regulatory element binding protein-1c, SREBP-1c)、肠源性内毒素血症以及铁超载等都参与了NASH发病机制.
威灵仙是毛茛科植物威灵仙(Clematis chinensis Osbeck)的干燥块根, 是我国一种传统中药, 具有祛风除湿、通络止痛之功效[18]. 威灵仙含有多糖、皂苷等多种重要活性成分, 随着现代药理研究的深入, 威灵仙多糖显示出解痉[19] 、镇痛抗炎[20,21]、抗菌杀菌[22]、抗肿瘤作用[23]、利胆作用[23]、降血压作用[24]、抗利尿作用[24], 有学者对其皂苷等进行过研究[25], 也有学者对多糖进行研究后发现, 多糖在体内外均有较强的抗氧化作用、在体内能抑制肿瘤的生长, 增加小鼠机体的免疫力[26].
人白介素17(human interleukin-17, hIL-17)即细胞毒T淋巴细胞抗原8(cytotoxic T lymphocytes antigen 8, CTLA-8)是近年发现的新的细胞因子, 他主要表达于激活的CD4+的T淋巴细胞, IL-17家族可诱导多种趋化因子以及前炎性因子分泌, 可以参与免疫调节及炎性反应. IL-17由Th17细胞分泌, 是一重要的炎症介质, 可诱导其他炎症细胞因子(如IL-6)、TNF、趋化因子[如单核细胞趋化蛋白-1(monocyte chemotactic protein 1, MCP-1)、MCP-2]和基质金属蛋白酶(matrix metalloproteinases, MMPs)的表达, 引起炎症细胞浸润和组织损伤[27].
汤艳丽等[28]发现: IL-17明显增加了脂肪变性肝细胞内脂滴形成; 而Tang等[29]通过用高脂肪饮食饲养小鼠8 wk, 成功在小鼠肝脏造出脂肪肝模型, 研究发现: 饲养8 wk高脂肪小鼠肝内Th17细胞是正常组的两倍, 但两组小鼠脾内Th17细胞却无明显差异; 同时实验组中肝内Th17细胞比例明显高于实验组和对照组中脾内Th17细胞. 这表明高脂肪饮食介导的脂肪肝中Th17细胞可能参与非酒精脂肪肝病, 且具有器官特异性; 研究同时还发现: Th17细胞和IL-17与非酒精性脂肪性肝的脂肪变性和炎性反应有关, 而且促进单纯性脂肪肝发展到脂肪性肝炎, 与Harley等[30]的结论基本一致, 说明Th17细胞和IL-17在肝细胞脂肪变性和炎症进程中起着关键的作用; 高脂饮食诱导的NASH小鼠由于Th17细胞的异常活化使其分泌的促炎因子IL-17增多, 后者可明显诱导趋化因子、IL-6、黏附分子等促炎症细胞因子的表达, 并介导中性粒细胞在肝脏的浸润, 导致肝脏发生炎症反应和免疫病理反应[31]. 而在体外, IL-17可以促进髓样树突状细胞和单核细胞活性, 并加强产生促炎性细胞因子TNF-α的能力[32]. Xu等[33]用高脂肪饮食成功在小鼠肝脏造出NASH模型后, 肝HE染色图片示肝细胞脂质沉积及空泡变性. 在使用抗IL-17抗体治疗后, 这些病理改变得以改善; 并发现抗IL-17抗体明显抑制了IL-17、IL-6、TNF-α等细胞因子的产生, 抗IL-17抗体同时还被发现能抑制由高脂饮食诱发的肝内巨噬细胞的激活和分泌[34].
此外, 还发现IL-17与非酒精性脂肪性肝病中的胰岛素抵抗有关. Xu等[33]发现, 肝细胞内脂肪酸的过量蓄积能够激发肝细胞产生细胞因子(如TNF-α和IL-6), 从而调节胰岛素敏感性. Ogura等[35]发现, 在体外, 模型组中IL-6较对照组明显增高, 加入IL-17干预后IL-6更进一步升高. 而IL-6与TGF-β能促进Th17细胞的增殖、分化. IL-6不仅作用于IL-17A的上游, 而且是其下游的一个重要靶点: IL-6能促进Th17细胞生成, 进而产生IL-17, 而IL-17能够诱导IL-6产生, 如此, IL-17和IL-6相互促进, 形成正反馈环路, 从而加重胰岛素抵抗, 进一步促进NASH的发生发展.
本研究发现: 与正常大鼠相比, NASH大鼠肝组织内肝细胞脂肪变性, 肝脏炎症浸润, 血清IL-17及TNF-α含量均升高, 二者呈正相关, 而经威灵仙多糖干预后, NASH大鼠血清IL-17、TNF-α含量则明显降低, 且二者亦呈正相关, 提示IL-17、TNF-α在NASH的发病过程中可能具有重要作用, 而威灵仙多糖可减轻NASH大鼠IL-17、TNF-α的释放, 从而达到缓解NASH进展的目的. 威灵仙多糖这一疗效与易善复相当. 本研究还发现, 经威灵仙多糖干预后, NASH大鼠肝脏脂肪样变、炎症浸润程度较干预前虽然有所减轻, 但减轻程度却不理想, 与易善复组情况相似, 提示NASH相关肝脏脂肪样变、炎症浸润可能较难完全改善.
总之, 基于本研究可以推测, NASH的治疗, 或许可以侧重于减少Th17细胞的异常活化从而减少IL-17的释放来达到治疗目的. 我们可以把减少NASH大鼠体内的炎症因子(如IL-17、TNF-α等)作为治疗NASH的研究方向, 或许能够为NASH的预防和治疗提供新的思路.
非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)的确切发病机制目前仍不清楚, 近年来研究发现, 肝脏的免疫应答可能参与NASH的发生发展, Th17细胞通过分泌白介素17(interleukin 17, IL-17)、血清肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)等多种效应分子介导肝脏的炎症反应.
陈茂伟, 教授, 广西医科大学第一附属医院质量管理办公室; 郭永红, 副主任医师, 西安交通大学医学院第二附属医院感染科
在NASH治疗方面, 关于生活方式修正的临床证据越来越多, 为大家认识和使用饮食、 运动处方提供了依据, 但肝组织学、 代谢方面的长期获益仍需要观察, 治疗依从性也需要提高; 益生菌和胰高血糖素样肽-1(glucagon-like peptide 1, GLP-1)活性上调剂的作用似乎值得期待, 但药物治疗总的进展不大, 提示发病机制的研究仍需要加强, 以便于针对性治疗手段的开发.
NASH在药物治疗包括合理选用烯磷脂酰胆碱、维生素E、水飞蓟宾及熊去氧胆酸等, 上述药物虽然有理论的支持, 但是在临床上尚无任何一种药物对NASH有明确治疗作用.
随着现代药理研究的深入, 威灵仙多糖显示出多种药理作用, 如较强的抗氧化作用、在体内能抑制肿瘤的生长, 增加小鼠机体的免疫力等, 本文就威灵仙多糖对高脂饮食诱导的 NASH大鼠治疗作用进行了探讨, 发现威灵仙多糖可能通过降低IL-17及TNF-α水平而发挥作用.
威灵仙多糖可有效治疗高脂饮食诱导的NASH大鼠, 其主要机制之一可能是降低NASH大鼠血清IL-17及TNF-α水平、改善NASH大鼠肝脏病理改变.
本文对研究NASH有一定的帮助.
编辑: 郭鹏 电编:闫晋利
| 1. | Björnsson E, Angulo P. Non-alcoholic fatty liver disease. Scand J Gastroenterol. 2007;42:1023-1030. [PubMed] [DOI] |
| 2. | Hübscher SG. Histological assessment of non-alcoholic fatty liver disease. Histopathology. 2006;49:450-465. [PubMed] [DOI] |
| 3. | Paschos P, Paletas K. Non alcoholic fatty liver disease and metabolic syndrome. Hippokratia. 2009;13:9-19. [PubMed] |
| 4. | Greenfield V, Cheung O, Sanyal AJ. Recent advances in nonalcholic fatty liver disease. Curr Opin Gastroenterol. 2008;24:320-327. [PubMed] [DOI] |
| 5. | Marrero JA, Fontana RJ, Su GL, Conjeevaram HS, Emick DM, Lok AS. NAFLD may be a common underlying liver disease in patients with hepatocellular carcinoma in the United States. Hepatology. 2002;36:1349-1354. [PubMed] [DOI] |
| 6. | Page JM, Harrison SA. NASH and HCC. Clin Liver Dis. 2009;13:631-647. [PubMed] [DOI] |
| 7. | Sanyal A, Poklepovic A, Moyneur E, Barghout V. Population-based risk factors and resource utilization for HCC: US perspective. Curr Med Res Opin. 2010;26:2183-2191. [PubMed] [DOI] |
| 8. | Fan JG, Farrell GC. Epidemiology of non-alcoholic fatty liver disease in China. J Hepatol. 2009;50:204-210. [PubMed] |
| 9. | Bellentani S, Scaglioni F, Marino M, Bedogni G. Epidemiology of non-alcoholic fatty liver disease. Dig Dis. 2010;28:155-161. [PubMed] [DOI] |
| 10. | Torres DM, Williams CD, Harrison SA. Features, diagnosis, and treatment of nonalcoholic fatty liver disease. Clin Gastroenterol Hepatol. 2012;10:837-858. [PubMed] [DOI] |
| 14. | 王 伟. 威灵仙总皂苷干预实验性NASH大鼠内毒素血症的疗效观察. 昆明: 昆明医科大学 2014; . |
| 23. | Shao B, Qin G, Xu R, Wu H, Ma K. Triterpenoid saponins from Clematis chinensis. Phytochemistry. 1995;38:1473-1479. [PubMed] |
| 26. | 孙 玉军. 威灵仙多糖的分离纯化及其活性研究. 合肥: 安徽大学 2007; . |
| 27. | Korn T, Bettelli E, Oukka M, Kuchroo VK. IL-17 and Th17 Cells. Annu Rev Immunol. 2009;27:485-517. [PubMed] |
| 29. | Tang Y, Bian Z, Zhao L, Liu Y, Liang S, Wang Q, Han X, Peng Y, Chen X, Shen L. Interleukin-17 exacerbates hepatic steatosis and inflammation in non-alcoholic fatty liver disease. Clin Exp Immunol. 2011;166:281-290. [PubMed] [DOI] |
| 30. | Harley IT, Stankiewicz TE, Giles DA, Softic S, Flick LM, Cappelletti M, Sheridan R, Xanthakos SA, Steinbrecher KA, Sartor RB. IL-17 signaling accelerates the progression of nonalcoholic fatty liver disease in mice. Hepatology. 2014;59:1830-1839. [PubMed] [DOI] |
| 32. | Zhang JY, Zhang Z, Lin F, Zou ZS, Xu RN, Jin L, Fu JL, Shi F, Shi M, Wang HF. Interleukin-17-producing CD4(+) T cells increase with severity of liver damage in patients with chronic hepatitis B. Hepatology. 2010;51:81-91. [PubMed] [DOI] |
| 33. | Xu R, Tao A, Zhang S, Zhang M. Neutralization of interleukin-17 attenuates high fat diet-induced non-alcoholic fatty liver disease in mice. Acta Biochim Biophys Sin (Shanghai). 2013;45:726-733. [PubMed] [DOI] |
| 34. | Dixon LJ, Berk M, Thapaliya S, Papouchado BG, Feldstein AE. Caspase-1-mediated regulation of fibrogenesis in diet-induced steatohepatitis. Lab Invest. 2012;92:713-723. [PubMed] [DOI] |