修回日期: 2015-09-16
接受日期: 2015-09-28
在线出版日期: 2015-10-28
目的: 观察表皮生长因子(epidermal growth factor, EGF)、生长抑素(somatostatin, SS)在急性酒精中毒大鼠颌下腺表达的变化.
方法: 正常♂SD大鼠36只, 按配对原则随机分为正常对照组(normal control group, NCG)(n = 12)及实验组(experiment group, EG)(n = 24). 实验组大鼠予53度白酒按10 g/kg的剂量灌胃, 并于灌胃后0.5、1.0、1.5、2.0 h取其颌下腺, 用免疫组织化学SABC法及图像分析方法观察EGF、SS的表达变化.
结果: 与正常对照组比较, 在急性酒精中毒期间, 颌下腺EGF、SS阳性细胞数量增加, 自灌胃后1.5 h始有统计学意义, 尤以灌胃后2.0 h最为明显(正常对照组 vs 实验2.0 h组: 50.56±4.21 vs 62.99±6.59, F = 8.297, P<0.05; 43.29±4.88 vs53.88±7.63, F = 9.161, P<0.05); 平均灰度值逐渐下降, 自灌胃后1.5 h始有统计学意义, 以2.0 h最为显著(正常对照组vs 实验2.0 h组: 169.38±7.88 vs 156.92±6.81, F = 28.137, P<0.05; 156.97±12.24 vs 148.31±7.41, F = 20.387, P<0.05).
结论: 急性酒精中毒对大鼠颌下腺EGF、SS的合成和分泌有明显影响.
© 2015年版权归百世登出版集团有限公司所有.
核心提示: 近年来, 临床常将表皮生长因子(epidermal growth factor, EGF)、生长抑素(somatostatin, SS)用于治疗胃肠出血、胃溃疡、浅表性胃炎等. 颌下腺是体内EGF的主要来源, 也能分泌SS参与胃肠功能调节. 本实验通过建立急性酒精中毒大鼠模型, 探讨颌下腺分泌的EGF及SS在胃肠保护方面的可能作用.
引文著录: 胡赟, 马洪, 夏白娟, 李一欣, 谢莉. 表皮生长因子与生长抑素在急性酒精中毒大鼠颌下腺表达的变化. 世界华人消化杂志 2015; 23(30): 4859-4863
Revised: September 16, 2015
Accepted: September 28, 2015
Published online: October 28, 2015
AIM: To detect the expression of epidermal growth factor (EGF) and somatostatin (SS) in submandibular glands of rats with acute alcohol intoxication.
METHODS: Male rats (n = 36) were divided into a normal control group (NCG, n = 12) and an experiment group (EG, n = 24). The EG was intragastrically given 53% alcohol. Submandibular gland tissue samples were taken from each group at 0.5, 1.0, 1.5, and 2.0 h to detect the expression of EGF and SS by immunohistochemistry.
RESULTS: As compared with the NCG, the numbers of EGF and SS positive cells increased during the period of acute alcohol intoxication, which were statistically significant since 1.5 h, especially prominent at 2.0 h (NCG vs EG 2 h: 50.56 ± 4.21 vs 62.99 ± 6.59, F = 8.297, P < 0.05; 43.29 ± 4.88 vs 53.88 ± 7.63, F = 9.161, P < 0.05); the mean grey values decreased gradually, which were statistically significant since 1.5 h, especially prominent at 2.0 h (NCG vs EG 2 h: 169.38 ± 7.88 vs 156.92 ± 6.81, F= 28.137, P < 0.05; 156.97 ± 12.24 vs 148.31 ± 7.41, F = 20.387, P < 0.05).
CONCLUSION: Acute alcohol intoxication alters EGF and SS which are synthetized and secreted by the submandibular glands.
- Citation: Hu Y, Ma H, Xia BJ, Li YX, Xie L. Expression of epidermal growth factor and somatostatin in submandibular glands of rats with acute alcohol intoxication. Shijie Huaren Xiaohua Zazhi 2015; 23(30): 4859-4863
- URL: https://www.wjgnet.com/1009-3079/full/v23/i30/4859.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i30.4859
酒精中毒和酒精滥用引起的健康、心理和社会问题已成为众多学者关注的公共卫生问题之一. 目前国内、外对酒精中毒引起的消化系统损伤相关病理改变及机制已经有了一定研究. 颌下腺除参与消化外, 还是机体神经内分泌轴的重要组成部分, 有学者将其作为基因治疗的靶器官并获较好疗效[1]. 其分泌的生物活性多肽与胃肠道生理功能的调节密切相关[2,3], 其中以表皮生长因子(epidermal growth factor, EGF)及生长抑素(somatostatin, SS)的研究最为常见. EGF能促进胃肠上皮细胞增殖和分化, 与胃肠功能调节密切相关[4-6], SS及其类似物在临床应用范围广泛, 对胃肠道出血及其他疾病的治疗效果较好[7,8], 二者对胃肠道均有较好的保护作用. 迄今为止, 尚未见有关急性酒精中毒大鼠颌下腺EGF及SS表达改变的相关报道. 本实验通过制备急性酒精中毒大鼠模型, 应用免疫组织化学及图像分析法, 检测颌下腺EGF、SS的表达变化情况, 探讨颌下腺对急性酒精中毒所致胃肠功能损伤所起的可能作用, 以期为进一步研究和探讨颌下腺对胃肠功能的调节机制提供形态学资料, 并试图为进一步通过利用颌下腺神经内分泌功能治疗酒精中毒引起的胃肠功能损伤提供相应的理论依据.
正常♂SD大鼠36只, 体质量180-220 g, 由贵州医科大学实验动物中心提供. 53度北京红星二锅头为北京红星股份有限公司生产. EGF抗血清、SS抗血清、羊抗兔 IgG, 由武汉博士得生物工程公司提供.
1.2.1 造模: 按配对原则将大鼠随机分为正常对照组(normal control group, NCG)(n = 12)及实验组(experiment group, EG)(n = 24), 实验前12 h禁食不禁水[9]. 实验组大鼠按10 mL/kg剂量给予53度北京红星二锅头灌胃, 并于灌胃后0.5、1.0、1.5、2.0 h处死(每时段6只), 取其颌下腺. 正常对照组不予任何处理, 同期处死, 每次3只. 多聚甲醛固定, 常规石蜡包埋, 制成4 µm厚的连续切片.
1.2.2 免疫组织化学染色: 按免疫组织化学SABC法进行, 分别显示EGF和SS阳性细胞. 主要步骤为: 切片常规脱蜡至水, 室温10%甲醇-过氧化氢 10 min, 正常羊血清(1:50)室温下封闭20 min, 分别滴加EGF抗血清(1:100)、SS抗血清(1:100), 4 ℃孵育过夜, 羊抗兔IgG(1:100)37 ℃孵育20 min, SABC复合物(1:100)37 ℃孵育20 min, DAB-H2O2液显色, 苏木精轻度复染, 中性树胶封片. 方法对照: 以PBS缓冲液代替特异性抗血清作为阴性对照, 用已知阳性片作阳性对照, 余步骤相同.
1.2.3 图像分析: 随机选取各时段实验组及同期正常对照组大鼠颌下腺切片各3例, 应用BioMias图像分析系统进行检测. 在40倍物镜下, 每例切片随机选取5个视野, 计数每个视野内有核EGF和SS阳性细胞数, 并检测其平均灰度值.
统计学处理 应用SPSS16.0软件包进行统计学分析, 数据采用mean±SD形式表示, 对所得数据进行单因素方差分析(One-way analysis of variance, ANOVA)进行统计分析, P<0.05为差异有统计学意义.
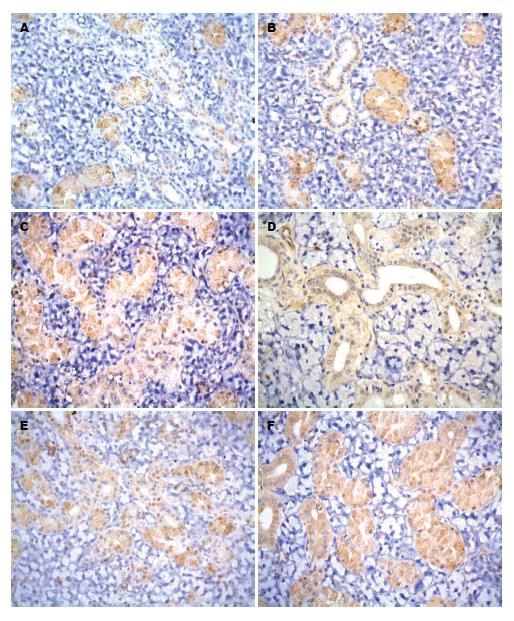
光镜下, 可见EGF阳性产物呈棕黄色细颗粒状, 分布于以颗粒曲管(granular convoluted tubule cell, GCT)为主的颌下腺各级导管上皮细胞胞质内, 各阳性细胞反应强弱不等, 腺泡细胞为阴性反应(图1A). 实验组大鼠颌下腺EGF阳性细胞的分布与正常对照组大鼠基本一致, 但细胞数量逐渐增多, 免疫染色变深(图1B), 以2 h最为明显(图1C). SS阳性产物主要分布于纹状管和GCT细胞细胞质中, 腺泡细胞呈阴性反应(图1D). 实验组大鼠各时段SS阳性细胞的分布未见明显改变, 但细胞数量增加, 阳性反应强度增加(图1E), 其中以灌胃后2 h阳性染色最深(图1F).
与正常对照组大鼠相比, 实验组各时段EGF、SS阳性细胞数量逐渐增加, 自灌胃后1.5 h始有统计学意义, 以2 h为明显(F = 8.297, P<0.05; F = 28.137, P<0.05); 图像分析测得平均灰度值逐渐下降, 自灌胃后1.5 h始有统计学意义, 尤以灌胃后2 h最为显著(F = 28.137, P<0.05; F = 20.387, P<0.05, 表1).
| 蛋白 | 测量指标 | NCG | 酒精灌胃各时段 | |||
| 0.5 h | 1.0 h | 1.5 h | 2.0 h | |||
| EGF | 细胞数量 | 50.56±4.21 | 52.48±4.33 | 54.82±5.70 | 59.43±6.69a | 62.99±6.59a |
| 平均灰度值 | 169.38±7.88 | 168.26±9.34 | 164.18±8.66 | 160.27±5.19a | 156.92±6.81a | |
| SS | 细胞数量 | 43.29±4.88 | 44.92±6.76 | 46.37±2.81 | 49.77±5.59a | 53.88±7.63a |
| 平均灰度值 | 156.97±12.24 | 155.78±10.15 | 153.52±8.62 | 150.33±7.34a | 148.31±7.41a | |
已有的研究[10]证实, 酒精对胃肠道有直接损害, 能引起胃肠上皮损伤、黏膜糜烂出血、浅表溃疡等. 颌下腺除分泌消化酶参与机体消化功能外, 还能分泌多种活性物质对胃肠功能进行调节. 本实验通过建立急性酒精中毒大鼠模型, 观察酒精对颌下腺活性物质分泌的影响. 实验中应用灌胃的方法, 保证酒精的摄入量, 使其容易控制, 从而保持大鼠血液中较高的酒精浓度, 符合人类的饮酒习惯. 这种方法优于采用腹腔注射法.
EGF是最早发现的生长因子, 对调节细胞生长、增殖和分化起着重要作用. 颌下腺是体内EGF的主要来源, 主要以腔分泌形式释放, 消化道中EGF的含量远远高于血液循环中的浓度. 唾液中的EGF能促进胃肠上皮细胞增殖, 维持胃肠黏膜的完整性, 同时也能抑制胃酸分泌, 对浅表性胃炎、胃肠道溃疡等均有积极作用[6,11,12]. 另有研究[13]报道, EGF能减轻酒精引起的炎症反应, 还能促进肠干细胞的增殖[14]. 本实验结果表明, 在急性酒精中毒期间, 颌下腺EGF阳性细胞数量增加, 平均灰度值下降, 表明颌下腺合成EGF增加, 提示颌下腺通过分泌EGF增多, 修复胃肠黏膜, 对抗酒精对胃肠道的损伤.
SS是从下丘脑分离和提纯的一种生长激素释放抑制因子, 不仅是一种内分泌激素, 而且还具有神经递质或神经调质的作用, 对多种生理功能均具有抑制作用, 影响广泛, 对几乎所有的内、外分泌活动及胃肠运动均有较强的抑制作用, 同时对胃肠道有明显的细胞保护作用[8,15]. 近年来SS及其类似物在临床应用范围非常广泛, 对胃肠出血、胰腺炎及胃肠道肿瘤等均有较好的治疗效果[7,16,17]. 研究[18]报道, SS衍生物善得定能促进胃溃疡的愈合. 在急性酒精中毒大鼠, 颌下腺SS阳性细胞数量增加, 平均灰度值下降, 表明此时SS合成增多. 已有的研究[19]证实, 急性酒精中毒时胃内分泌细胞合成和分泌SS减少. 故推测颌下腺分泌增多的SS是对胃SS分泌减少的一种代偿, 对酒精造成的胃肠功能损害有保护作用.
总之, 在急性酒精中毒大鼠, 颌下腺合成和分泌EGF、SS增多, 提示与酒精对胃肠道造成的损伤有关, 表明颌下腺对酒精中毒大鼠的胃肠功能有保护作用. 但其具体作用机制有待于进一步研究.
目前国内、外对酒精中毒引起的消化系统损伤相关病理改变及机制已经有了一定研究. 表皮生长因子(epidermal growth factor, EGF)及生长抑素(somatostatin, SS)的临床应用也日渐广泛. 颌下腺是机体神经内分泌轴的重要组成部分, 其分泌的生物活性多肽与胃肠生理功能的调节密切相关, 其中EGF能促进胃肠上皮细胞增殖, 减轻酒精引起的炎症反应, 对浅表性胃炎、胃肠道溃疡等有积极作用. SS对胃肠道有明显的细胞保护作用, 对胃肠出血等有较好的治疗效果. 已有学者利用颌下腺的神经内分泌功能将其作为基因治疗的靶器官并获较好疗效.
黄缘, 教授, 南昌大学第二附属医院消化内科, 江西省分子医学重点实验室
酒精中毒和酒精滥用引起的健康、心理和社会问题已成为众多学者关注的公共卫生问题之一. 而如何使酒精中毒患者胃肠功能恢复正常仍是目前需要进一步解决的问题之一. 本实验通过灌胃方法, 使大鼠血液中保持较高酒精浓度, 符合人类的饮酒习惯, 建立急性酒精中毒大鼠模型, 观察颌下腺分泌EGF、SS的变化情况.
本实验结果表明, 在急性酒精中毒期间, 颌下腺EGF、SS合成和分泌增加, 表明与胃肠黏膜损伤后的修复有关, 提示颌下腺对酒精中毒造成的胃肠损伤有保护作用. 而急性酒精中毒时胃SS合成和分泌减少, 可以推测颌下腺分泌增多的SS是对胃SS分泌减少的一种代偿, 对酒精造成的胃肠功能损害有保护作用.
为进一步研究和探讨颌下腺对胃肠功能的调节机制提供形态学资料, 并试图为进一步通过利用颌下腺神经内分泌功能治疗酒精中毒引起的胃肠功能损伤提供相应的理论依据.
本文选题很接近临床, 对研究急性酒精中毒有一定的帮助.
编辑: 郭鹏 电编:闫晋利
| 1. | Racz GZ, Zheng C, Goldsmith CM, Baum BJ, Cawley NX. Toward gene therapy for growth hormone deficiency via salivary gland expression of growth hormone. Oral Dis. 2015;21:149-155. [PubMed] [DOI] |
| 2. | Cetik S, Hupkens E, Malaisse WJ, Sener A, Popescu IR. Expression and localization of glucose transporters in rodent submandibular salivary glands. Cell Physiol Biochem. 2014;33:1149-1161. [PubMed] [DOI] |
| 3. | Wu JF, Zhang J, Xue G, Zhang HQ. Expression and localization of trefoil factor family genes in rat submandibular glands. Biotech Histochem. 2014;89:424-432. [PubMed] [DOI] |
| 4. | Cui XF, Zhou WM, Yang Y, Zhou J, Li XL, Lin L, Zhang HJ. Epidermal growth factor upregulates serotonin transporter and its association with visceral hypersensitivity in irritable bowel syndrome. World J Gastroenterol. 2014;20:13521-13529. [PubMed] [DOI] |
| 5. | Gill RK, Anbazhagan AN, Esmaili A, Kumar A, Nazir S, Malakooti J, Alrefai WA, Saksena S. Epidermal growth factor upregulates serotonin transporter in human intestinal epithelial cells via transcriptional mechanisms. Am J Physiol Gastrointest Liver Physiol. 2011;300:G627-G636. [PubMed] [DOI] |
| 8. | Liu L, Tan Q, Hu B, Wu H, Wang C, Tang C. Somatostatin inhibits the production of interferon-γ by intestinal epithelial cells during intestinal ischemia-reperfusion in macaques. Dig Dis Sci. 2014;59:2423-2432. [PubMed] [DOI] |
| 10. | Rocco A, Compare D, Angrisani D, Sanduzzi Zamparelli M, Nardone G. Alcoholic disease: liver and beyond. World J Gastroenterol. 2014;20:14652-14659. [PubMed] [DOI] |
| 11. | Arda-Pirincci P, Bolkent S. The role of epidermal growth factor in prevention of oxidative injury and apoptosis induced by intestinal ischemia/reperfusion in rats. Acta Histochem. 2014;116:167-175. [PubMed] [DOI] |
| 12. | Rijcken E, Sachs L, Fuchs T, Spiegel HU, Neumann PA. Growth factors and gastrointestinal anastomotic healing. J Surg Res. 2014;187:202-210. [PubMed] [DOI] |
| 13. | Chen YL, Peng HC, Hsieh YC, Yang SC. Epidermal growth factor improved alcohol-induced inflammation in rats. Alcohol. 2014;48:701-706. [PubMed] [DOI] |
| 14. | Biteau B, Jasper H. EGF signaling regulates the proliferation of intestinal stem cells in Drosophila. Development. 2011;138:1045-1055. [PubMed] [DOI] |
| 15. | Herszényi L, Mihály E, Tulassay Z. [Somatostatin and the digestive system. Clinical experiences]. Orv Hetil. 2013;154:1535-1540. [PubMed] [DOI] |
| 16. | Toumpanakis C, Caplin ME. Update on the role of somatostatin analogs for the treatment of patients with gastroenteropancreatic neuroendocrine tumors. Semin Oncol. 2013;40:56-68. [PubMed] [DOI] |
| 17. | Holzer P, Farzi A. Neuropeptides and the microbiota-gut-brain axis. Adv Exp Med Biol. 2014;817:195-219. [PubMed] [DOI] |
| 18. | Nassar NN, Schaalan MF, Zaki HF, Abdallah DM. Octreotide ameliorates gastric lesions in chronically mild stressed rats. World J Gastroenterol. 2011;17:1135-1142. [PubMed] [DOI] |