修回日期: 2015-09-17
接受日期: 2015-09-28
在线出版日期: 2015-10-28
目的: 研究柴胡疏肝散含药血清对体外大鼠胃Cajal间质细胞(interstitial cells of Cajal, ICC)增殖及其细胞周期的影响.
方法: 体外培养的大鼠胃ICC经荧光鉴定, 取生长对数期内的ICC与各含药血清共孵. 实验分为空白组、柴胡疏肝散含药血清组(5%、10%、20%)及10%多潘立酮含药血清组. 通过CCK-8法检测ICC的增殖作用; 使用流式细胞术检测ICC细胞周期; Western blot检测ICC细胞周期素依赖性激酶2(cyclin dependent kinase 2, CDK2)、cyclin E的表达.
结果: 与空白组比较, 柴胡疏肝散含药血清各浓度组及10%多潘立酮含药血清组可显著促进ICC增殖(均P<0.01), 可提高ICC细胞周期G0/G1期及S期比例(均P<0.01), 同时10%柴胡疏肝散及10%多潘立酮含药血清组可显著上调ICC周期蛋白CDK2、cyclin E的表达(均P<0.01). 柴胡疏肝散各浓度组内比较, 10%、20%浓度组对促进ICC增殖及提高G0/G1期和S期比例均优于5%浓度组(均P<0.05); 10%与20%浓度组在促进ICC增殖作用及提高S期比例上差异无统计学意义(均P>0.05). 与10%多潘立酮含药血清组比较, 10%柴胡疏肝散组对ICC增殖作用及上调CDK2、cyclin E的表达均优于10%多潘立酮组(均P<0.05); 10%、20%柴胡疏肝散含药血清组提高G0/G1期及S期比例亦优于10%多潘立酮组(均P<0.05).
结论: 柴胡疏肝散含药血清可提高ICC生长活性, 对ICC的增殖分化起促进作用.
核心提示: 5%、10%、20%柴胡疏肝散含药血清均可促进胃Cajal间质细胞(interstitial cells of Cajal, ICC)的增殖, 提高ICC细胞周期G0/G1及S期比例, 10%柴胡疏肝散含药血清可显著上调细胞周期素依赖性激酶2(cyclin dependent kinase 2)及cyclin E的表达, 这提示柴胡疏肝散含药血清促进ICC增殖分化是通过影响细胞周期起作用的.
引文著录: 张智, 凌江红, 宁海恩, 王煜姣, 梁纲, 张钰琴. 柴胡疏肝散含药血清对大鼠胃Cajal间质细胞增殖及细胞周期的影响. 世界华人消化杂志 2015; 23(30): 4792-4799
Revised: September 17, 2015
Accepted: September 28, 2015
Published online: October 28, 2015
AIM: To evaluate the effect of Chaihu Shugan Powder containing serum on proliferation and cell cycle of rat gastric interstitial cells of Cajal (ICCs) in vitro.
METHODS: ICCs were identified by immunofluorescence and then divided into different groups to co-culture in vitro with Chaihu Shugan Powder containing serum (5%, 10%, or 20%) or domperidone (10%). Untreated cells were used as a blank control. Cell proliferation was detected by CCK-8 assay, and the cell cycle was measured by flow cytometry (FCM). Western blot was used to detect the expression of CDK2 and cyclin E in ICCs.
RESULTS: Compared with the blank group, Chaihu Shugan Powder containing serum (5%, 10%, and 20%) and domperidone (10%) significantly promoted ICC proliferation (P < 0.01 for all) and increased the proportions of cells in G0/G1 and S phases (P < 0.01 for all). Chaihu Shugan Powder containing serum (10%) and 10% domperidone significantly upregulated the expression of CDK2 and cyclin E (P < 0.01 for all). Drug containing serum at concentrations of 10% and 20% was significantly better than 5% in promoting cell proliferation and increasing the proportions of cells in G0/G1 and S phases (P < 0.05 for all). The difference between 10% and 20% concentrations in increasing the proportion of cells in G0/G1 phase was significant (P < 0.05), but there was no significant difference in increasing the proportion of cells in S phase or cell proliferation (P > 0.05 for all). Compared with 10% domperidone, 10% drug containing serum was significantly better in promoting ICC proliferation and upregulating the expression of CDK2 and cyclin E (P < 0.05 for all). In terms of increasing the proportion of cells in G0/G1 and S phases, 10% and 20% drug containing serum was better than 10% domperidone (P < 0.05 for all).
CONCLUSION: Chaihu Shugan Powder containing serum can increase the activity and proliferation of rat gastric ICCs in vitro.
- Citation: Zhang Z, Ling JH, Ning HE, Wang YJ, Liang G, Zhang YQ. Effect of Chaihu Shugan Powder containing serum on proliferation and cell cycle of rat gastric interstitial cells of Cajal in vitro. Shijie Huaren Xiaohua Zazhi 2015; 23(30): 4792-4799
- URL: https://www.wjgnet.com/1009-3079/full/v23/i30/4792.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i30.4792
功能性消化不良、胃食管反流病、肠易激综合症等胃肠动力障碍性疾病是目前的多发病和常见病[1,2], 在祖国医学属于"胃脘痛"、"痞证"、"纳呆"、"便秘"、"胃反"等范畴, 精神心理障碍如焦虑抑郁、情志不舒等[3-5]是其明显促发因素. 柴胡疏肝散是疏肝理气法的经典代表方, 具有疏肝行气、活血止痛之功, 主治肝气郁滞证. 现代有关研究[6-10]表明, 柴胡疏肝散对功能性消化不良、肠易激综合征等胃肠动力障碍性疾病有明显疗效, 缓解率高, 但其具体作用机制尚不清楚, 可能与促胃动力作用有关. Cajal间质细胞(interstitial cells of Cajal, ICC)广泛分布于胃肠道, 是胃肠活动的起搏者和调节者, 同时也是胃肠道壁内神经信息的传递者, 对胃肠道活动有重要的影响[11]. ICC的数量和/或结构发生改变, 可引起胃肠功能活动的改变[12,13]. 那么, 柴胡疏肝散治疗胃肠动力障碍性疾病的机制是否可能通过影响ICC的增殖分化及活性从而促进胃肠动力? 本实验旨在通过体外ICC的培养, 利用血清药理学技术、CCK-8法、流式细胞术、蛋白免疫印迹法等, 观察柴胡疏肝散含药血清对ICC的影响, 探讨疏肝理气法治疗胃肠动力障碍性疾病可能的作用机制.
SPF级SD大鼠, 雌雄不限, 体质量200 g左右(广西医科大学实验动物中心提供, 许可证号: SCXK桂2014-0002). 中药饮片(陈皮、柴胡、川芎、枳壳、白芍、香附、炙甘草)及多潘立酮(西安杨森公司生产)均购自广西医科大学第一附属医院药房; M199培养基购自美国hyclone公司; 胎牛血清购自美国SCIENCELL公司; Ⅱ型胶原酶、胰蛋白酶、大鼠干细胞因子均购自美国Sigma公司; 青链霉素混悬液、D-Hanks缓冲液、抗荧光淬灭封片液购自杭州吉诺公司; 一抗兔抗大鼠C-kit蛋白多克隆IgG抗体(CD117/c-kit antibody)购自美国pierce公司; 二抗DylightTM488 Conjugate Goat anti-Rabbit IgG购自联科生物公司; 一抗CDK2兔抗鼠多克隆抗体、cyclin E小鼠抗大鼠多克隆抗体均购自美国CST公司; 抗兔及抗小鼠荧光二抗均购自美国LI-COR公司; 50 mL/L CO2培养箱、酶标仪购自美国Thermo公司; 正置荧光显微镜、倒置相差显微镜购自日本OLYMPUS公司, 流式细胞仪购自美国BD公司.
1.2.1 含药血清的制备: 参照相关文献[14,15], 取SD大鼠30只, 雌雄不限, 分为柴胡疏肝散组、多潘立酮组、空白血清组, 按随机数字表法每组分配10只大鼠. 柴胡疏肝散(来源《景岳全书》, 原方组成及用量: 陈皮6 g、柴胡6 g、川芎4.5 g、枳壳4.5 g、白芍4.5 g、香附4.5 g、炙甘草1.5 g)按照普通成人(60 kg/人)临床用量的10倍[16], 以1:5的容积比用蒸馏水泡30 min, 煎煮2次(30 min/次), 过滤, 去渣取汁, 合并滤液加热蒸发至浓度为105%(1.05 g/mL); 多潘立酮按成人(60 kg/人)临床用量的10倍, 用蒸馏水制成浓度为0.1%; 空白组给予生理盐水. 每组灌胃量均为1.5 mL/100g, 每天灌胃2次, 间隔12 h, 连续给药3 d. 采血及处理: 末次给药后1 h采血. 水合氯醛腹腔麻醉后, 剖腹并用真空采血管采集腹主动脉血, 室温静置至有血清析出, 3500 r/min离心15 min分离血清, 同组血清混合后, 于56 ℃水浴中灭活30 min, 用0.22 μm微孔滤膜过滤除菌, 置-80 ℃保存备用.
1.2.2 大鼠胃ICC的提取、培养: 参考相关文献中关于ICC的分离培养方法并进行适当调整[17-19], 取SD大鼠2只, 雌雄不限, 禁食不禁水8 h, 10%水合氯醛按0.3 mL/100 g腹腔注射麻醉后无菌开腹取胃, 沿胃小弯剪开, 用D-hanks缓冲液(含双抗)清洗3遍, 在解剖显微镜下用锐性镊子剥去胃黏膜层, 将胃肌条剪碎至0.1 cm×0.1 cm大小, Ⅱ型胶原酶消化液(用不含血清的M199培养基配制, 终浓度1.3 mg/mL)于37 ℃恒温水浴箱中消化胃组织碎块50 min左右, 1000 r/min、5 min离心弃上清, D-hanks缓冲液重悬并吹打5 min, 再离心弃上清, M199完全培养基(含M199培养基、10%胎牛血清、1%双抗、0.5 μg/mL两性霉素B和25 ng/mL干细胞因子)重悬细胞并过200目筛网, 加入等量的Ficoll 400密度梯度液1000 r/min、离心7 min, 最后调整细胞密度为1×106个/mL, 每个25 cm2的培养瓶接种4 mL, 50 mL/L 37 ℃、CO2培养箱内培养, 24 h后换液, 冲去未贴壁的细胞, 此后每隔3 d换液1次, 倒置显微镜下观察拍照.
1.2.3 大鼠胃ICC的鉴定: 取培养5-7 d的细胞, 经0.25%的胰蛋白酶消化成细胞悬液, 收集后离心并弃上清, 加入M199完全培养基重悬, 调整细胞密度, 接种至含无菌圆形盖玻片的24孔板中, 每孔接种1×104的细胞量, 贴壁24 h后经冰冻甲醇固定10 min, PBST清洗3次, 每次5 min; 5%脱脂奶粉封闭10 min, PBST清洗3次, 每次5 min; 加入一抗兔抗大鼠C-kit蛋白多克隆IgG抗体(1:100), 4 ℃冰箱孵育过夜, PBST液冲洗3遍, 加入二抗DylightTM488 Conjugate Goat anti-Rabbit IgG(1:200), 37 ℃培养箱避光孵育1 h, PBST清洗3遍, 最后加抗淬灭封片液封片, 置荧光显微镜下观察并拍照.
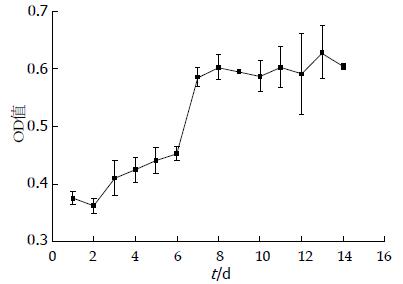
1.2.4 大鼠胃ICC生长对数期的确定: 经酶解法制备大鼠胃ICC单细胞悬液(方法同1.2.2), 接种至96孔板, 每孔接种1×104的细胞量, 50 mL/L CO2培养箱内培养24 h后, 按顺序取3孔加入20 μL浓度为5 mg/mL的MTT液培养4 h, 去掉培养液, 加入150 μL DMSO孵育10 min, 振荡30 s后, 酶标仪单波长492 nm处测光密度(optical density, OD)值, 培养板放回培养箱内继续培养, 之后分别在细胞培养的第2-14天重复上述操作, 测定OD值, 以培养细胞的天数为横坐标, 以OD值为纵坐标, 制作细胞生长曲线.
1.2.5 CCK-8法检测ICC的增殖作用: 取生长对数期ICC, 经胰酶消化并收集离心, 重悬计数后接种于96孔板, 每孔接种1×104细胞量, 24 h后换液并加入5%、10%、20%浓度的柴胡疏肝散含药血清及10%多潘立酮含药血清, 每组重复6孔, 于培养箱培养24 h后, 分别加入10 μL CCK-8, 孵育4 h后, 酶标仪以450 nm为主波长、630 nm为次波长, 采用单步测量法测其OD值.
1.2.6 流式细胞术检测ICC细胞周期: 取生长对数期ICC, 经胰酶消化离心后计数接种至6孔板, 每孔接种1×106的细胞量, 贴壁24 h后, 弃去孔内旧培养基, 将5%、10%、20%浓度的柴胡疏肝散含药血清及10%多潘立酮含药血清分别作用于ICC, 24 h后经胰酶消化并离心收集细胞, 700 mL/L冰冻乙醇4 ℃固定过夜, 余下步骤按照细胞周期试剂盒操作. 设空白血清孵育的细胞作空白对照组. 实验数据使用BD Accuri C6 Software处理.
1.2.7 Western blot检测ICC周期蛋白CDK2、cyclin E的表达: 取生长对数期ICC, 经胰酶消化离心后计数并接种至6孔板, 每孔接种1×106的细胞量, 贴壁24 h后, 弃去孔内旧培养基, 将10%浓度的柴胡疏肝散含药血清及多潘立酮含药血清分别作用于ICC, 24 h后经预冷PBS洗涤3次, 每次5 min, 用微量移液器吸净残余PBS, 加入100 μL含1%PMSF的RIPA细胞裂解液, 细胞刮子收集细胞, 冰浴30 min后4 ℃12000 r/min离心20 min, 吸取上清液, BCA法测量蛋白浓度, 取30 μg蛋白与相应的上样缓冲液混合, 沸水中变性5 min, 置于冰上备用. 蛋白经10%SDS-PAGE分离胶分离后转移至0.45 μm PVDF膜. 5%脱脂奶粉封闭PVDF膜1 h, 加入cyclin E、CDK2一抗(1:1000), 4 ℃过夜. 洗膜3次, 每次5 min, 加入荧光二抗(1:10000), 37 ℃孵育2 h, 洗膜3次, 每次5 min, 最后使用Odyssey双色红外成像系统进行扫膜成像, 通过Quantity One软件对Western条带进行定量分析, 以GAPDH作为内对照,确定目标蛋白的相对表达量.
统计学处理 所有实验数据均以mean±SD表示, 并采用SPSS16.0软件处理. 两组以上均数比较采用单因素方差分析(one-way ANOVA), 若方差齐, 组间及组内两两比较采用LSD方法, 若方差不齐, 组间及组内两两比较采用Dunnett's C法, P<0.05为差异有统计学意义.
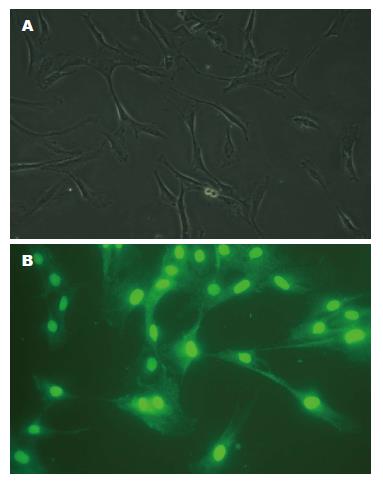
细胞培养5-7 d, 其形态显现清晰, 胞体呈三角形或梭形, 胞体上有2个以上的长突起, 并可形成二级突起, 以此与周围细胞紧密相连, 胞核大, 核周胞浆较少(图1A). ICC内kit基因编码酪氨酸激酶受体c-kit蛋白, 免疫荧光染色法可对培养的原代细胞进行特异性c-kit蛋白鉴定, 如图1B所示, 着色者即为阳性.
前3-5 d细胞生长处于滞留期, 生长缓慢, 6-8 d处于生长对数期, 增殖分裂速度快, 第9天以后进入平台期, 保持着相对稳定的生长状态(图2).
与空白组比较, 柴胡疏肝散含药血清各浓度组及10%多潘立酮含药血清组可显著促进ICC的增殖(均P<0.01). 柴胡疏肝散含药血清各浓度组内比较中, 10%、20%浓度组增殖效果优于5%浓度组(均P<0.05), 但10%与20%浓度组相比较差异无统计学意义(P>0.05). 与10%多潘立酮含药血清组相比较, 10%柴胡疏肝散含药血清组促进ICC增殖有差异(P<0.05)(表1).
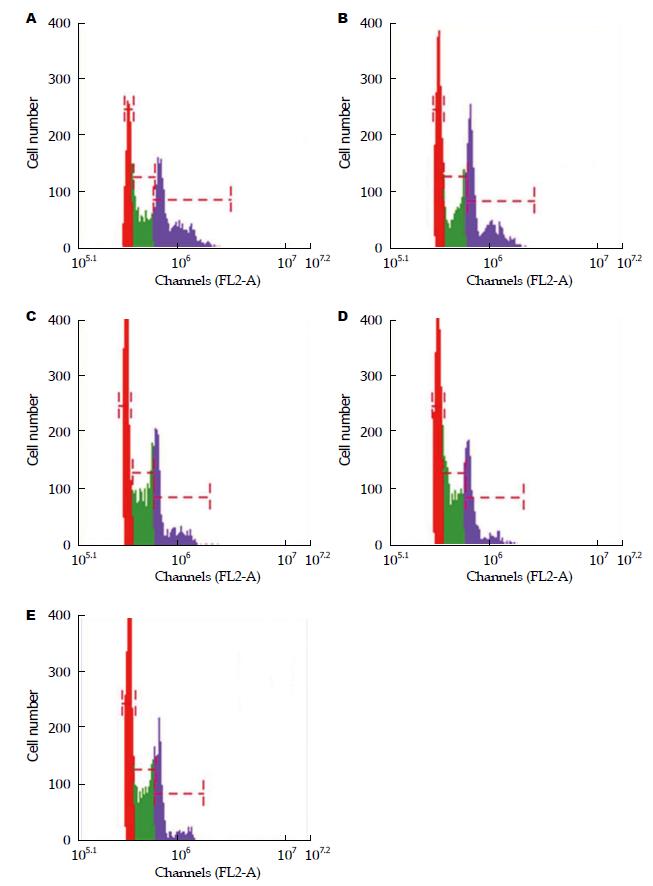
与空白组比较, 柴胡疏肝散含药血清各浓度组及10%多潘立酮含药血清组均可显著提高G0/G1期及S期比例(均P<0.01). 柴胡疏肝散含药血清组内比较中, 10%、20%浓度组提高G0/G1期比例显著优于5%浓度组(均P<0.05), 20%浓度组亦优于10%浓度组(P<0.05); 在提高S期比例上, 10%、20%浓度组亦优于5%浓度组(均P<0.05), 但10%与20%浓度组比较差异无统计学意义(P>0.05). 与10%多潘立酮含药血清组比较, 10%、20%柴胡疏肝散含药血清组均可显著提高G0/G1期及S期比例(均P<0.05)(表2, 图3).
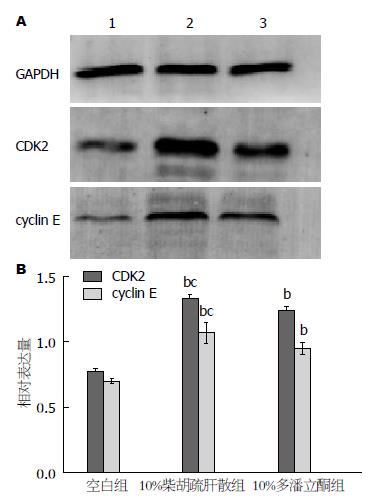
与空白组比较, 10%柴胡疏肝散及10%多潘立酮含药血清组ICC周期蛋白CDK2、cyclin E的表达显著增加(均P<0.01); 与10%多潘立酮含药血清组比较, 10%柴胡疏肝散含药血清组CDK2、cyclin E的表达有差异(P<0.05)(图4).
ICC广泛分布于胃肠道, 其在胃肠活动的起搏和调节作用已得到证实[20]. 临床上许多胃肠动力异常性疾病如胃食管反流病[21]、胃轻瘫[22,23]、慢传输型便秘[24]、假性肠梗阻[11]等, 均存在ICC数量和/或生理结构的异常. 胃肠道慢波节律和兴奋传导异常等, 是胃肠动力障碍性疾病的共同原因, ICC发育分化障碍、生理结构异常是多种胃肠疾病的关键机制[25]. 这无疑给临床治疗胃肠动力障碍性疾病提供了新的思路. 课题组前期研究[26-28]表明, 柴胡疏肝散可减轻长期夹尾应激大鼠抑郁、饮食量减低、体质量增长缓慢等情况, 改善胃组织学, 同时可上调其中枢和外周胃泌素的表达, 下调外周胃组织生长抑素表达. 基于柴胡疏肝散良好的临床疗效及前期实验研究, 本实验以ICC为切入点, 从细胞水平进一步探讨其治疗胃肠动力障碍性疾病可能的作用机制. 实验结果表明, 柴胡疏肝散含药血清各浓度组对ICC的增殖作用均优于空白组, 柴胡疏肝散含药血清可显著提高ICC的生长活性, 对ICC的增殖起促进作用, 但这种促进作用并不呈浓度依赖性, 而以10%浓度组效果较佳, 提高浓度并不能发挥更大的促进作用. 多潘立酮为外周多巴胺受体阻滞药, 是促胃动力经典药物, 实验中10%多潘立酮含药血清对ICC的增殖效果亦明显优于空白组, 而相同浓度的柴胡疏肝散含药血清对ICC的增殖效果则略优于多潘立酮组, 因此不排除柴胡疏肝散具有阻滞多巴胺受体的作用从而促进胃肠动力, 但这亦需要更多实验研究加以论证.
细胞周期(cell cycle)是指细胞从一次分裂完成开始到下一次分裂结束所经历的全过程, 细胞周期的变化通常以各周期时相所占百分比来表示. 细胞增殖分化过程中各细胞周期时相得以有序交替和变更, 又依赖于CDKs及cyclins的调节. cyclin E是细胞从G1期向S期转化的关键调节因子[29], 现有的研究[30,31]提示, G1/S转换顺利与否是细胞增殖快慢的关键. 在药物或其他方式作用产生的生长信号刺激下, cyclin E表达上调, 并与CDK2结合形成活化的cyclin E-CDK2复合体, 促使视网膜母细胞瘤基因蛋白(pRb)磷酸化并释放出重要的核转录因子E2F, S期有关靶分子的表达增加, 加速DNA复制从而促进细胞增殖. 本实验中, 在柴胡疏肝散及多潘立酮含药血清干预下, ICC的细胞周期相关蛋白表达发生了改变, cyclin E、CDK2表达上调, 流式细胞术示G0/G1、S期比例较空白组显著升高, 说明该含药血清可使DNA合成所需物质和能量合成加速, 并促进DNA复制, G1/S转换加速, 最终促进细胞的增殖.
总之, 柴胡疏肝散作为疏肝理气法的经典代表方, 其含药血清可提高体外培养的大鼠胃ICC生长活性, 促进增殖分化, 这种促进作用是通过影响DNA合成所需的物质能量和DNA复制的速度起作用的. 这些可能是柴胡疏肝散治疗胃肠动力障碍性疾病的作用机制之一, 也可能是疏肝理气法促胃动力的作用机制, 但其深层的分子生物学作用机制(比如通过何种信号通路促进ICC增殖分化等)以及其他可能的作用机制尚有待进一步研究.
胃肠动力障碍疾病是临床上常见的胃肠道疾病之一, 疏肝理气法经典方柴胡疏肝散在临床上治疗胃肠动力障碍性疾病疗效肯定, 但其具体作用机制还不十分明确, 可能与促胃动力有关. 以Cajal间质细胞(interstitial cells of Cajal, ICC)为作用靶点探讨柴胡疏肝散治疗胃肠动力障碍性疾病的作用机制还未见相关报道.
刘凤斌, 教授, 广州中医药大学第一附属医院消化内科; 齐清会, 教授, 大连医科大学附属第一医院
近年来有关促胃肠动力的相关中药药理药效的研究较多, 但对具体的促胃肠动力机制研究较欠缺, 许多涉及细胞分子水平的研究还有待解决.
课题组前期研究提示柴胡疏肝散可减轻长期夹尾应激大鼠抑郁、饮食量减低、体质量增长缓慢等情况, 改善胃组织学, 同时可上调其中枢和外周胃泌素的表达, 下调外周胃组织生长抑素表达. 周吕等研究发现柴胡疏肝散可增加慢性激怒应激大鼠胃窦平滑肌动力, 改善脑肠肽水平. 张铮铮等通过复制大鼠腹泻型肠易激综合征模型, 发现加味柴胡疏肝散可提高结肠黏膜中CCK水平, 从而缓解肠易激综合征模型大鼠的肠功能紊乱.
本实验通过制备柴胡疏肝散含药血清, 观察柴胡疏肝散含药血清对体外大鼠胃ICC的影响, 研究柴胡疏肝散治疗胃肠动力障碍性疾病可能的作用机制, 为深层次探讨疏肝理气法促胃肠动力机制奠定基础.
ICC广泛分布于胃肠道, 是胃肠活动的起搏者和调节者, 同时也是胃肠道壁内神经信息的传递者, 对胃肠道活动有重要的影响.本研究证实柴胡疏肝散含药血清可提高体外大鼠胃ICC生长活性, 促进增殖, 这可能是柴胡疏肝散治疗胃肠动力障碍性疾病可能的作用机制, 可为临床用药提供相应的理论依据.
论文设计合理, 研究过程规范, 立意新颖, 从ICC角度探讨柴胡疏肝散对胃肠道作用机制具有一定的理论指导意义.
编辑:郭鹏 电编:闫晋利
| 1. | Ohara S, Kawano T, Kusano M, Kouzu T. Survey on the prevalence of GERD and FD based on the Montreal definition and the Rome III criteria among patients presenting with epigastric symptoms in Japan. J Gastroenterol. 2011;46:603-611. [PubMed] [DOI] |
| 2. | Wang A, Liao X, Xiong L, Peng S, Xiao Y, Liu S, Hu P, Chen M. The clinical overlap between functional dyspepsia and irritable bowel syndrome based on Rome III criteria. BMC Gastroenterol. 2008;8:43. [PubMed] [DOI] |
| 5. | Van Oudenhove L, Aziz Q. The role of psychosocial factors and psychiatric disorders in functional dyspepsia. Nat Rev Gastroenterol Hepatol. 2013;10:158-167. [PubMed] [DOI] |
| 6. | Yang N, Jiang X, Qiu X, Hu Z, Wang L, Song M. Modified chaihu shugan powder for functional dyspepsia: meta-analysis for randomized controlled trial. Evid Based Complement Alternat Med. 2013;2013:791724. [PubMed] [DOI] |
| 11. | Jain D, Moussa K, Tandon M, Culpepper-Morgan J, Proctor DD. Role of interstitial cells of Cajal in motility disorders of the bowel. Am J Gastroenterol. 2003;98:618-624. [PubMed] |
| 12. | Kito Y, Suzuki H. Properties of pacemaker potentials recorded from myenteric interstitial cells of Cajal distributed in the mouse small intestine. J Physiol. 2003;553:803-818. [PubMed] |
| 13. | Streutker CJ, Huizinga JD, Driman DK, Riddell RH. Interstitial cells of Cajal in health and disease. Part I: normal ICC structure and function with associated motility disorders. Histopathology. 2007;50:176-189. [PubMed] |
| 17. | Xu WD, Jiang X, Lan L, Wang CH, Tong HX, Wang BX. Long-term culture and cryopreservation of interstitial cells of Cajal. Scand J Gastroenterol. 2012;47:89-98. [PubMed] [DOI] |
| 19. | Ordög T, Redelman D, Horowitz NN, Sanders KM. Immunomagnetic enrichment of interstitial cells of Cajal. Am J Physiol Gastrointest Liver Physiol. 2004;286:G351-G360. [PubMed] |
| 20. | Lee JC, Thuneberg L, Berezin I, Huizinga JD. Generation of slow waves in membrane potential is an intrinsic property of interstitial cells of Cajal. Am J Physiol. 1999;277:G409-G423. [PubMed] |
| 21. | Shafik A, Ahmed I, El Sibai O, Shafik AA. Interstitial cells of cajal in reflux esophagitis: role in the pathogenesis of the disease. Med Sci Monit. 2005;11:BR452-BR456. [PubMed] |
| 22. | Forster J, Damjanov I, Lin Z, Sarosiek I, Wetzel P, McCallum RW. Absence of the interstitial cells of Cajal in patients with gastroparesis and correlation with clinical findings. J Gastrointest Surg. 2005;9:102-108. [PubMed] |
| 23. | Zárate N, Mearin F, Wang XY, Hewlett B, Huizinga JD, Malagelada JR. Severe idiopathic gastroparesis due to neuronal and interstitial cells of Cajal degeneration: pathological findings and management. Gut. 2003;52:966-970. [PubMed] |
| 24. | Lee JI, Park H, Kamm MA, Talbot IC. Decreased density of interstitial cells of Cajal and neuronal cells in patients with slow-transit constipation and acquired megacolon. J Gastroenterol Hepatol. 2005;20:1292-1298. [PubMed] |
| 25. | Yin J, Chen JD. Roles of interstitial cells of Cajal in regulating gastrointestinal motility: in vitro versus in vivo studies. J Cell Mol Med. 2008;12:1118-1129. [PubMed] [DOI] |
| 26. | 凌 江红, 张 钰琴, 梁 纲, 韦 连明, 陈 业强, 刘 耀利, 李 勇杰. 疏肝理气法对夹尾应激大鼠行为学及胃组织学的影响. 世界华人消化杂志. 2009;17:299-302. [DOI] |
| 27. | 凌 江红, 韦 连明, 张 钰琴, 梁 纲, 王 道刚, 刘 耀利, 李 勇杰. 疏肝理气法对功能性消化不良大鼠下丘脑和胃窦胃泌素, 生长抑素表达的影响. 中国中药杂志. 2010;35:3069-3073. |
| 28. | 凌 江红, 韦 连明, 张 钰琴, 王 道刚, 梁 纲, 陈 业强, 刘 耀利, 李 勇杰. 疏肝理气法对功能性消化不良大鼠下丘脑胃血浆胃泌素的影响. 辽宁中医杂志. 2009;36:1812-1813. |
| 29. | Farley J, Smith LM, Darcy KM, Sobel E, O'Connor D, Henderson B, Morrison LE, Birrer MJ. Cyclin E expression is a significant predictor of survival in advanced, suboptimally debulked ovarian epithelial cancers: a Gynecologic Oncology Group study. Cancer Res. 2003;63:1235-1241. [PubMed] |
| 30. | Huang Q, Li J, Wang F, Oliver MT, Tipton T, Gao Y, Jiang SW. Syncytin-1 modulates placental trophoblast cell proliferation by promoting G1/S transition. Cell Signal. 2013;25:1027-1035. [PubMed] [DOI] |