修回日期: 2014-11-13
接受日期: 2014-11-25
在线出版日期: 2015-01-28
胃癌仍然占据肿瘤导致人类死亡排行榜的第2位. 中晚期胃癌对目前的治疗手段均不敏感, 患者的长期生存率令人沮丧. Notch信号通路是近来发现对胃肠道肿瘤细胞、肿瘤干细胞均具有重要调控作用的细胞信号通路, 研究发现Notch信号通路相关的配体和受体, 如Notch-1, 2, 3, Dll-1, 4, Jag-1, 2等均在胃癌组织中不同程度表达, 具有不同的临床意义. 与此同时, 这些配体和受体在以CD44阳性为代表的胃癌干细胞中也存在表达, 并且能调控这些细胞的某些生命活动. 鉴于Notch信号通路对胃癌及胃癌干细胞的关键调控作用, 可以预见其可能在未来成为临床治疗胃癌的潜在靶点.
核心提示: 以Notch信号通路为代表的细胞信号通路在胃癌及胃癌干细胞中的作用得到密切关注, 靶向该通路有可能对胃癌治疗具有一定价值.
引文著录: 张映城, 李勇进, 施俊, 秦志丰, 魏品康, 颜兵. Notch信号通路在胃癌中的研究进展. 世界华人消化杂志 2015; 23(3): 381-387
Revised: November 13, 2014
Accepted: November 25, 2014
Published online: January 28, 2015
Gastric cancer is still the second leading cause of cancer-related death. Currently, all the available therapeutic methods in practice appear to be blunt for the majority of advanced-stage patients and their long time-survival rate is also still rather frustrating. The Notch signaling pathway is increasingly demonstrated to play an important role in controlling the fate of gastric cancer cells and gastric cancer stem cells, and some previous studies have indicated that different Notch receptors and ligands, such as Notch-1, 2, 3, Dll-1, 4 and Jag-1, 2, were highly expressed in gastric cancer tissues and were associated with various clinical parameters. More notably, these receptors and ligands were also found to be expressed in gastric cancer stem cells, which were CD44 positive, and could have a key role in regulating the fate of these cells. Taking into consideration the pivotal role of Notch signaling pathway in gastric cancer and cancer stem cells, it would be promising to predict that it could become therapeutic targets in the future.
- Citation: Zhang YC, Li YJ, Shi J, Qin ZF, Wei PK, Yan B. Notch signaling pathway and gastric cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(3): 381-387
- URL: https://www.wjgnet.com/1009-3079/full/v23/i3/381.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i3.381
到目前为止在世界范围内, 胃癌仍然位居肿瘤导致人类死亡原因的第2位[1], 仅2011年, 全球范围内胃癌预测新发近100万例, 死亡约70万例[2]. 尽管是实体肿瘤中最为常见的一种, 但胃癌细胞的异质性使得目前大部分的治疗手段疗效不佳. 对于绝大多数中晚期患者而言, 长期生存似乎仍旧是一个遥远的目标. 近年来, 肿瘤干细胞成为临床研究的热点, 胃癌也不例外. 鉴于肿瘤干细胞在肿瘤发生、发展中的特殊作用, 靶向这些细胞成为未来临床抗胃癌可能的目标[3]. 以Notch信号通路为代表的细胞信号通路参与调控肿瘤干细胞各项生命活动, 近年来在胃癌中, 对于Notch信号通路的研究也取得了相当的进展, 现综述如下.
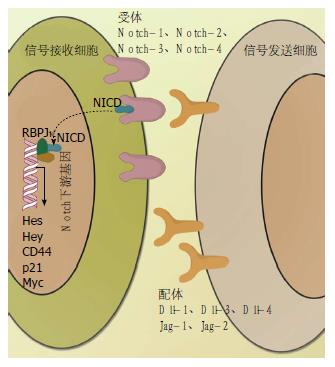
Notch信号通路是一类进化高度保守的细胞信号通路, 其对多种生命活动的关键调控作用贯穿于胚胎发育到成人各个时期. Notch信号通路的主要特点是通过细胞间的配体-受体相结合的方式发挥作用. 目前研究已经明确的Notch配体有5个, 分别是Dll-1、Dll-3、Dll-4和Jag-1、Jag-2, 其相应的受体有4个, 分别是Notch-1、Notch-2、Notch-3、Notch-4(图1)[4]. 相邻细胞的Notch受体和配体结合, 激活基质金属蛋白酶ADAM(一种解聚素和基质金属蛋白酶)裂解Notch通路胞外区域进而激活γ-分泌酶调节产生的Notch胞内区域(Notch intracellular domain, NICD), NICD进入细胞核后和Notch信号通路转录因子CSL(RBPJκ)相结合, 进而启动下游基因转录, 其中包括Hes和Hey[5]. 除经典的下游基因Hes和Hey外, Notch信号通路的靶基因还包括p21、CD44、Myc等[6]. 值得注意的是, 在经典的受体-配体相结合的方式激活外, Notch信号通路还能被其他的非经典方式激活, 例如Ma等[7]研究发现在膜型基质金属蛋白酶-1(membrane type 1 matrix metalloproteinase, MT1-MMP)可通过非经典途径激活Notch-1控制黑色素瘤细胞增殖; 此外非经典激活Notch通路还包括CSL-非依赖型, 其他信号通路交叉激活(如Wnt信号通路)等多种类型[8-13].
在胃肠道组织中, 不少研究已经证实Notch信号通路的相关配体和受体对于肠道正常干细胞生命活动的调节具有重要作用. Sato等[14]研究发现Lgr-5阳性的肠道细胞需要相邻的细胞提供Dll-4以激活下游的Hes1基因, 从而维持肠道干细胞的干性, van Es等[15]发现Notch抑制剂可使具有高增殖潜能的肠道祖细胞、腺瘤细胞分化成杯状细胞.
而在胃癌中, Notch信号通路不同的受体和配体表达具有不同的意义. Kang等[16]报道Notch参与胃上皮细胞分化到小凹腺体的过程, 在正常胃腺体峡部(潜在胃干细胞)发现Notch-1和Notch-3、Jag-1和Jag-2以及下游基因Hes1的表达, 同时上述指标(Notch-1、Notch-3、Jag-1、Jag-2及Hes1)在胃癌组织中的表达也远高于正常组织; 有意思的是, 进一步研究发现Notch-3和Jag-2高表达和肠型胃腺癌、更好的组织学分化相联系, 在多因素分析中提示患者良好的预后. 然而相比之下, 对Notch-1在胃癌组织中的表达报道更为多见, 如李大卫等[17]报道相比正常胃黏膜, Notch-1在胃癌组织中显著高表达并和肿瘤大小、分化程度、浸润深度、血管侵袭等明显相关, Notch-1阳性的患者3年生存率显著低于阴性的患者; 此外, Yeh等[18]报道Notch-1在胃癌组织中的激活能够显著促进肿瘤的进展; Yao等[19]以胃癌细胞株BCG-823为研究对象, 发现Notch-1高表达能抑制肿瘤坏死因子α(tumor necrosis factor α, TNF-α)诱导的胃癌细胞凋亡. 综合这些研究似乎可以看出, Notch-1在胃癌中促进胃癌细胞增殖、抑制胃癌细胞凋亡的特性能在一定程度上解释其和疾病快速进展存在某种内在联系. 除此之外, Notch-2也被发现在胃癌组织中表达, 但Notch-2对胃癌的发生、发展意义似乎远没有Notch-1重要[16]. 而对于Notch信号通路的配体, 研究发现奥沙利铂耐药的胃癌细胞株高表达Jag-1和Dll-4[20]. 此外, Li等[21]报道在SGC-7901人胃癌细胞株中, Dll-4高表达, 并可通过激活Notch信号通路促进胃癌的进展. Piazzi等[22]利用8株人胃癌细胞株(KATO-Ⅲ、SNU-601、SNU-719、AGS、SNU-16、MKN-1、MKN-45、TMK-1)分析了Notch信号通路相关配体和受体的表达, 发现在KATO-Ⅲ、SNU-601、SNU-719和AGS等4株胃癌细胞株中, Dll-1存在高表达, 这种高表达同样伴随着Notch-1及其下游基因Hes1的表达; 基于细胞研究结果, 研究人员进一步利用52例胃癌患者和21例健康对照验证, 发现仅在胃癌患者中Dll-1高表达. 此外对于Jag-1, 此外, Yeh等[18]报道Jag-1和胃癌侵袭紧密相关并预示患者不良预后.
近年来肿瘤干细胞成为临床抗肿瘤新靶点, 大量研究结果提示这些细胞相比非肿瘤干细胞具有更强的自我复制能力和增殖潜能, 能够产生肿瘤组织中不同分化程度的肿瘤细胞, 是恶性肿瘤的"发动机".
对胃癌干细胞的研究目前是临床肿瘤的研究热点之一, 其中利用特定的方法将胃癌干细胞从胃癌组织或大量的肿瘤细胞中分离出来又成为研究的重中之重. 目前, 利用Hoechst33342染色的方法, Fukuda等[23]从MKN-45、KATO-Ⅲ、MKN-74、MKN-28及MKN-1等胃癌细胞株和人胃癌标本中发现一小部分"SP细胞"具备胃癌干细胞特性; 其后Schmuck等[24]利用MKN-45, AGS胃癌细胞株也证明SP细胞具备肿瘤干细胞特性; She等[25]从KATO-Ⅲ细胞中分离出SP细胞, 也发现这类细胞具备肿瘤干细胞特性; 但有意思的是, SP细胞和非SP细胞在成瘤能力上未见差别; Zhang等[26]进一步发现从MKN-45细胞分离出的SP细胞具备肿瘤干细胞潜能, 然而从BGC-823胃癌细胞株中分离出的此部分细胞并未具备相似特性, 可见不是所有的SP细胞均具有胃癌干细胞特性.
除SP细胞外, 更多的报道是利用特定的表面标记采用流式细胞术分离胃癌干细胞. 其中CD133是早先被证明的广谱肿瘤干细胞标志物, 已经在结直肠癌、肝癌、胰腺癌中用于分离肿瘤干细胞[27]. 在胃癌中, CD133也被证实存在表达并和疾病快速进展、肿瘤耐药、早期复发和不良预后存在密切关系[28-30], 但CD133作为胃癌干细胞标记并未得到广泛使用, 在一些研究中发现CD133并未能标记胃癌干细胞[31]. 除CD133外, Jiang等[32]报道CD90可作为胃癌干细胞标志物, 但同样未得到广泛使用.
2009年, Takaishi等[33]发现CD44可作为胃癌干细胞的标记, 其在MKN-45、MKN-74、NCI-N87胃癌细胞株中高表达, 其他的分子标记如CD24、CD133、CD166等均未能在这些细胞株中作为胃癌干细胞标记. 在CD44的基础上, 一些研究者尝试使用两个或两个以上的标志物进一步分离胃癌干细胞, Zhang等[34]报道在AGS胃癌细胞株中, CD44和CD24双阳性的胃癌细胞具备胃癌干细胞特性; Chen等[35]利用胃癌患者外周血肿瘤细胞检测, CD44和CD54双阳性的胃癌细胞可能是胃癌干细胞. 除此之外, 一些正常的肠道干细胞标记如Lgr-5、Bmi-1、ALDH、Sox2、Oct4及Nanog等干细胞基因也被用于标记胃癌干细胞. Nishikawa等[36]报道Lgr-5可能是潜在的胃癌干细胞标志物, 并和Bmi-1、CD26、CD44、ALDH共表达; Nishikawa等[36]报道ALDH作为胃癌干细胞标志物和CD44存在共表达; 此外研究[37-39]认为干细胞基因在MKN-45胃癌细胞株中也同样被发现在CD44阳性胃癌细胞存在共表达现象. 综合目前的研究结果可以看出, CD44是众多的胃癌干细胞标记中较为适用的表面标记; 同样, 在众多的胃癌细胞株中, MKN-45是较为理想的分离胃癌干细胞的细胞株(表1)[33,40,41].
| 特征 | 项目 | 细胞株 | |||
| MKN-45 | MKN-74 | MKN-28 | KATO-Ⅲ | ||
| 基本信息 | 患者年龄(岁) | 62 | 37 | 70 | 55 |
| 患者性别 | 女 | 男 | 女 | 男 | |
| 原发肿瘤组织学分型 | 低分化腺癌 | 中分化腺癌 | 中分化腺癌 | 印戒细胞癌 | |
| 原代培养组织来源 | 肝转移 | 肝转移 | 淋巴结转移 | 腹水 | |
| 肿瘤干细胞标记表达 | CD44 | 无突变 | 无突变 | 沉默 | 无突变 |
| CD44表达量 | 高 | 高 | 无 | 中 | |
| CD133 | 无 | 无 | 无 | 高 | |
| VEGF表达 | VEGF mRNA | 高 | 高 | 低 | 高 |
| Notch通路靶基因表达 | p21 | 野生型 | 野生型 | 突变型 | 野生型 |
| mRNA | 高 | 高 | 高 | 可测的 | |
| 蛋白 | 可测量 | 可测量 | 不可测 | 不可测 | |
| c-myc突变 | 无 | 无 | 无 | ||
| 致瘤性 | 高 | 高 | 低 | 低 | |
近年来, 研究发现Notch信号通路对于调控和维持肿瘤干细胞的各项特殊功能具有重要作用. 例如Notch在多种肿瘤中均被证明和肿瘤干细胞最关键的特征自我更新能力明显相关, Notch对于维持肿瘤干细胞"干性"不可或缺[42]; 此外Notch还和肿瘤干细胞放疗耐受[43]、化疗耐药[44]、上皮间质转化[45]等生物学事件密切相关. 在结直肠癌中, Notch信号通路的激活甚至可以作为结肠癌干细胞的潜在标志物[46,47].
另外有意思的是对Notch-1的集中研究表明, Notch-1在多数情况下和肿瘤干细胞增殖具有紧密的关系. 例如在脑胶质瘤中发现抑制Notch-1可以导致细胞增殖能力下降[48]. 而在胃癌中, 近年来利用MKN-45胃癌细胞株, 采用CD44为胃癌干细胞标记发现Notch-1在CD44阳性胃癌细胞高表达[49,50], 文献回顾也能发现在MKN-45胃癌细胞株中Notch下游基因p21和Myc也存在高表达(表1), 有趣的是这种高表达伴随优势细胞增殖潜能和VEGF分泌能力, 提示Notch-1介导的胃癌干细胞增殖可能对肿瘤微血管生成具有一定的作用. 值得注意的是, Notch信号通路对胃癌干细胞的调节可能并非独立的, 例如在胃癌干细胞中存在Wnt表达的增高[51], 而Notch和Wnt并不互相独立, 在结肠癌中被发现通过Jag-1相连[52].
Notch信号通路在调节干细胞及肿瘤干细胞各项生命活动中具有重要作用, 其相关的配体或受体有可能成为未来抗肿瘤的靶点. 目前, 不少制药企业已经着手相关的小分子抑制剂靶向Notch信号通路(表2)[6]. 但是Notch信号通路对正常干细胞也同意具有重要的调节作用, 这种调节作用也是Notch小分子抑制剂不良反应的来源之一, 在未来的研究中, 进一步鉴定相关的关键调控靶点是临床运用Notch信号通路抑制肿瘤的必然途径.
| 小分子抑制剂 | 靶点 | 作用机制 |
| γ-分泌酶抑制剂 | Notch同源异构体 | 抑制γ-分泌酶调节的Notch裂解 |
| Notch配体 | ||
| γ-分泌酶基板 | ||
| γ-分泌酶调节剂 | γ-分泌酶基板 | 同上 |
| MAML1抑制剂 | Notch同源异构体 | 干扰Notch核共转录因子MAML1 |
| 其他以MAML1为靶点的核转录因子 | ||
| 负调节区单克隆抗体 | Notch受体或配体 | 干扰配体诱导的Notch其他组分的分离 |
| Dll-4单克隆抗体 | 靶向Dll-4 | 干扰配体-受体结合机制 |
| Notch可溶性受体诱导剂 | 相对特异作用于Notch同源异构体 | 同上 |
胃癌的发病是一个多因素、多步骤的过程, 在未来的几十年中, 胃癌仍将保持较高的发病率和死亡率, 是我国医疗卫生不可避免的负担. 肿瘤干细胞在恶性肿瘤发生、发展中具有重要作用, 彻底清除肿瘤肿瘤干细胞是达到恶性肿瘤长期稳定, 甚至是治愈的关键[53]. 随着研究的不断进展, 以Notch信号通路为代表的关键细胞信号通路对胃癌干细胞的各项调控作用必然得到进一步揭示, 这将为靶向Notch信号通路, 为临床提供新的抗胃癌选择作出重要贡献.
胃癌在我国具有很高的发病率和死亡率. 研究表明Notch信号通路参与胃癌的发生、发展和转移, 此外Notch信号通路的相关配体和受体参与对胃癌干细胞的调节, 本文通过综述Notch信号通路在胃癌中的研究进展, 为靶向Notch信号通路治疗胃癌提供一定的思路.
田字彬, 教授, 青岛大学医学院附属医院
研究表明, Notch信号通路参与对胃癌细胞的调控不仅体现在一般胃癌细胞上, 更体现在其对胃癌干细胞的调节上. 但目前对于Notch信号通路参与调控胃癌细胞/胃癌干细胞的具体形式及途径仍未完全清楚, 靶向Notch信号通路的相关配体和/或受体是否具有抗胃癌作用仍有待进一步研究.
本文较为全面的从Notch信号通路基本构成, Notch信号通路在胃癌中的研究, 胃癌干细胞的分离和鉴定, Notch信号通路与胃癌干细胞的关系及靶向Notch信号通路等4个方面综述 Notch信号通路在胃癌中的相关研究结果, 着重探讨胃癌干细胞的研究进展及Notch信号通路对其调控作用.
本文较全面综述Notch信号通路在胃癌及胃癌干细胞中的研究, 为未来靶向Notch信号通路治疗胃癌提供一定的思路.
胃癌干细胞: 指胃癌组织中一部分具有极强自我更新能力的细胞, 这些细胞具备类似正常组织干细胞的特性, 是胃癌发生、发展和转移的重要原因.
本文综述了Notch信号通路基本构成及在胃癌、胃癌干细胞中的研究现状、胃癌干细胞的分离和鉴定等内容, 介绍了Notch信号通路与胃癌的关系, 层次分明, 条理清晰, 为靶向Notch信号通路来指导临床抗胃癌治疗提供了理论依据.
编辑: 郭鹏 电编:都珍珍
| 1. | Hartgrink HH, Jansen EP, van Grieken NC, van de Velde CJ. Gastric cancer. Lancet. 2009;374:477-490. [PubMed] [DOI] |
| 2. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 3. | Stojnev S, Krstic M, Ristic-Petrovic A, Stefanovic V, Hattori T. Gastric cancer stem cells: therapeutic targets. Gastric Cancer. 2014;17:13-25. [PubMed] [DOI] |
| 4. | Thurston G, Kitajewski J. VEGF and Delta-Notch: interacting signalling pathways in tumour angiogenesis. Br J Cancer. 2008;99:1204-1209. [PubMed] [DOI] |
| 5. | Mumm JS, Kopan R. Notch signaling: from the outside in. Dev Biol. 2000;228:151-165. [PubMed] [DOI] |
| 6. | Takebe N, Harris PJ, Warren RQ, Ivy SP. Targeting cancer stem cells by inhibiting Wnt, Notch, and Hedgehog pathways. Nat Rev Clin Oncol. 2011;8:97-106. [PubMed] [DOI] |
| 7. | Ma J, Tang X, Wong P, Jacobs B, Borden EC, Bedogni B. Noncanonical activation of Notch1 protein by membrane type 1 matrix metalloproteinase (MT1-MMP) controls melanoma cell proliferation. J Biol Chem. 2014;289:8442-8449. [PubMed] [DOI] |
| 8. | Berechid BE, Kitzmann M, Foltz DR, Roach AH, Seiffert D, Thompson LA, Olson RE, Bernstein A, Donoviel DB, Nye JS. Identification and characterization of presenilin-independent Notch signaling. J Biol Chem. 2002;277:8154-8165. [PubMed] [DOI] |
| 9. | Martinez Arias A, Zecchini V, Brennan K. CSL-independent Notch signalling: a checkpoint in cell fate decisions during development? Curr Opin Genet Dev. 2002;12:524-533. [PubMed] [DOI] |
| 10. | Perumalsamy LR, Nagala M, Banerjee P, Sarin A. A hierarchical cascade activated by non-canonical Notch signaling and the mTOR-Rictor complex regulates neglect-induced death in mammalian cells. Cell Death Differ. 2009;16:879-889. [PubMed] [DOI] |
| 11. | Ramain P, Khechumian K, Seugnet L, Arbogast N, Ackermann C, Heitzler P. Novel Notch alleles reveal a Deltex-dependent pathway repressing neural fate. Curr Biol. 2001;11:1729-1738. [PubMed] [DOI] |
| 12. | Ann EJ, Kim HY, Seo MS, Mo JS, Kim MY, Yoon JH, Ahn JS, Park HS. Wnt5a controls Notch1 signaling through CaMKII-mediated degradation of the SMRT corepressor protein. J Biol Chem. 2012;287:36814-36829. [PubMed] [DOI] |
| 13. | Heitzler P. Biodiversity and noncanonical Notch signaling. Curr Top Dev Biol. 2010;92:457-481. [PubMed] [DOI] |
| 14. | Sato T, van Es JH, Snippert HJ, Stange DE, Vries RG, van den Born M, Barker N, Shroyer NF, van de Wetering M, Clevers H. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts. Nature. 2011;469:415-418. [PubMed] [DOI] |
| 15. | van Es JH, van Gijn ME, Riccio O, van den Born M, Vooijs M, Begthel H, Cozijnsen M, Robine S, Winton DJ, Radtke F. Notch/gamma-secretase inhibition turns proliferative cells in intestinal crypts and adenomas into goblet cells. Nature. 2005;435:959-963. [PubMed] [DOI] |
| 16. | Kang H, An HJ, Song JY, Kim TH, Heo JH, Ahn DH, Kim G. Notch3 and Jagged2 contribute to gastric cancer development and to glandular differentiation associated with MUC2 and MUC5AC expression. Histopathology. 2012;61:576-586. [PubMed] [DOI] |
| 18. | Yeh TS, Wu CW, Hsu KW, Liao WJ, Yang MC, Li AF, Wang AM, Kuo ML, Chi CW. The activated Notch1 signal pathway is associated with gastric cancer progression through cyclooxygenase-2. Cancer Res. 2009;69:5039-5048. [PubMed] [DOI] |
| 19. | Yao J, Qian C. Over-activated Notch-1 protects gastric carcinoma BGC-823 cells from TNFalpha-induced apoptosis. Dig Liver Dis. 2009;41:867-874. [PubMed] [DOI] |
| 20. | Bolós V, Blanco M, Medina V, Aparicio G, Díaz-Prado S, Grande E. Notch signalling in cancer stem cells. Clin Transl Oncol. 2009;11:11-19. [PubMed] [DOI] |
| 21. | Li GG, Li L, Li C, Ye LY, Li XW, Liu DR, Bao Q, Zheng YX, Xiang DP, Chen L. Influence of up-regulation of Notch ligand DLL4 on biological behaviors of human gastric cancer cells. World J Gastroenterol. 2013;19:4486-4494. [PubMed] [DOI] |
| 22. | Piazzi G, Fini L, Selgrad M, Garcia M, Daoud Y, Wex T, Malfertheiner P, Gasbarrini A, Romano M, Meyer RL. Epigenetic regulation of Delta-Like1 controls Notch1 activation in gastric cancer. Oncotarget. 2011;2:1291-1301. [PubMed] |
| 23. | Fukuda K, Saikawa Y, Ohashi M, Kumagai K, Kitajima M, Okano H, Matsuzaki Y, Kitagawa Y. Tumor initiating potential of side population cells in human gastric cancer. Int J Oncol. 2009;34:1201-1207. [PubMed] |
| 24. | Schmuck R, Warneke V, Behrens HM, Simon E, Weichert W, Röcken C. Genotypic and phenotypic characterization of side population of gastric cancer cell lines. Am J Pathol. 2011;178:1792-1804. [PubMed] [DOI] |
| 25. | She JJ, Zhang PG, Wang X, Che XM, Wang ZM. Side population cells isolated from KATO III human gastric cancer cell line have cancer stem cell-like characteristics. World J Gastroenterol. 2012;18:4610-4617. [PubMed] [DOI] |
| 26. | Zhang H, Xi H, Cai A, Xia Q, Wang XX, Lu C, Zhang Y, Song Z, Wang H, Li Q. Not all side population cells contain cancer stem-like cells in human gastric cancer cell lines. Dig Dis Sci. 2013;58:132-139. [PubMed] [DOI] |
| 27. | Visvader JE, Lindeman GJ. Cancer stem cells in solid tumours: accumulating evidence and unresolved questions. Nat Rev Cancer. 2008;8:755-768. [PubMed] [DOI] |
| 28. | Hashimoto K, Aoyagi K, Isobe T, Kouhuji K, Shirouzu K. Expression of CD133 in the cytoplasm is associated with cancer progression and poor prognosis in gastric cancer. Gastric Cancer. 2014;17:97-106. [PubMed] [DOI] |
| 29. | Lee HH, Seo KJ, An CH, Kim JS, Jeon HM. CD133 expression is correlated with chemoresistance and early recurrence of gastric cancer. J Surg Oncol. 2012;106:999-1004. [PubMed] [DOI] |
| 30. | Wakamatsu Y, Sakamoto N, Oo HZ, Naito Y, Uraoka N, Anami K, Sentani K, Oue N, Yasui W. Expression of cancer stem cell markers ALDH1, CD44 and CD133 in primary tumor and lymph node metastasis of gastric cancer. Pathol Int. 2012;62:112-119. [PubMed] [DOI] |
| 31. | Lee HJ, Choi YS, Kim SJ, Moon HJ. CD44 and CD133 as cancer stem cell markers for gastric cancer. J Gastric Cancer. 2010;10:99-105. [DOI] |
| 32. | Jiang J, Zhang Y, Chuai S, Wang Z, Zheng D, Xu F, Zhang Y, Li C, Liang Y, Chen Z. Trastuzumab (herceptin) targets gastric cancer stem cells characterized by CD90 phenotype. Oncogene. 2012;31:671-682. [PubMed] [DOI] |
| 33. | Takaishi S, Okumura T, Tu S, Wang SS, Shibata W, Vigneshwaran R, Gordon SA, Shimada Y, Wang TC. Identification of gastric cancer stem cells using the cell surface marker CD44. Stem Cells. 2009;27:1006-1020. [PubMed] [DOI] |
| 34. | Zhang C, Li C, He F, Cai Y, Yang H. Identification of CD44+CD24+ gastric cancer stem cells. J Cancer Res Clin Oncol. 2011;137:1679-1686. [PubMed] [DOI] |
| 35. | Chen T, Yang K, Yu J, Meng W, Yuan D, Bi F, Liu F, Liu J, Dai B, Chen X. Identification and expansion of cancer stem cells in tumor tissues and peripheral blood derived from gastric adenocarcinoma patients. Cell Res. 2012;22:248-258. [PubMed] [DOI] |
| 36. | Nishikawa S, Konno M, Hamabe A, Hasegawa S, Kano Y, Ohta K, Fukusumi T, Sakai D, Kudo T, Haraguchi N. Aldehyde dehydrogenase high gastric cancer stem cells are resistant to chemotherapy. Int J Oncol. 2013;42:1437-1442. [PubMed] |
| 37. | Liu J, Wang L, Ma L, Xu J, Liu C, Zhang J, Liu J, Chen R. Significantly increased expression of OCT4 and ABCG2 in spheroid body-forming cells of the human gastric cancer MKN-45 cell line. Oncol Lett. 2013;6:891-896. [PubMed] |
| 38. | Golestaneh AF, Atashi A, Langroudi L, Shafiee A, Ghaemi N, Soleimani M. miRNAs expressed differently in cancer stem cells and cancer cells of human gastric cancer cell line MKN-45. Cell Biochem Funct. 2012;30:411-418. [PubMed] [DOI] |
| 39. | Liu J, Ma L, Xu J, Liu C, Zhang J, Liu J, Chen R, Zhou Y. Spheroid body-forming cells in the human gastric cancer cell line MKN-45 possess cancer stem cell properties. Int J Oncol. 2013;42:453-459. [PubMed] |
| 40. | Yokozaki H. Molecular characteristics of eight gastric cancer cell lines established in Japan. Pathol Int. 2000;50:767-777. [PubMed] [DOI] |
| 41. | Ninomiya S, Inomata M, Tajima M, Ali AT, Ueda Y, Shiraishi N, Kitano S. Effect of bevacizumab, a humanized monoclonal antibody to vascular endothelial growth factor, on peritoneal metastasis of MNK-45P human gastric cancer in mice. J Surg Res. 2009;154:196-202. [PubMed] [DOI] |
| 42. | Hu YY, Zheng MH, Cheng G, Li L, Liang L, Gao F, Wei YN, Fu LA, Han H. Notch signaling contributes to the maintenance of both normal neural stem cells and patient-derived glioma stem cells. BMC Cancer. 2011;11:82. [PubMed] [DOI] |
| 43. | Bjornson CR, Cheung TH, Liu L, Tripathi PV, Steeper KM, Rando TA. Notch signaling is necessary to maintain quiescence in adult muscle stem cells. Stem Cells. 2012;30:232-242. [PubMed] [DOI] |
| 44. | Nefedova Y, Sullivan DM, Bolick SC, Dalton WS, Gabrilovich DI. Inhibition of Notch signaling induces apoptosis of myeloma cells and enhances sensitivity to chemotherapy. Blood. 2008;111:2220-2229. [PubMed] [DOI] |
| 45. | Bao B, Wang Z, Ali S, Kong D, Li Y, Ahmad A, Banerjee S, Azmi AS, Miele L, Sarkar FH. Notch-1 induces epithelial-mesenchymal transition consistent with cancer stem cell phenotype in pancreatic cancer cells. Cancer Lett. 2011;307:26-36. [PubMed] [DOI] |
| 46. | Bu P, Chen KY, Chen JH, Wang L, Walters J, Shin YJ, Goerger JP, Sun J, Witherspoon M, Rakhilin N. A microRNA miR-34a-regulated bimodal switch targets Notch in colon cancer stem cells. Cell Stem Cell. 2013;12:602-615. [PubMed] [DOI] |
| 47. | Hassan KA, Wang L, Korkaya H, Chen G, Maillard I, Beer DG, Kalemkerian GP, Wicha MS. Notch pathway activity identifies cells with cancer stem cell-like properties and correlates with worse survival in lung adenocarcinoma. Clin Cancer Res. 2013;19:1972-1980. [PubMed] [DOI] |
| 48. | Wang J, Wang C, Meng Q, Li S, Sun X, Bo Y, Yao W. siRNA targeting Notch-1 decreases glioma stem cell proliferation and tumor growth. Mol Biol Rep. 2012;39:2497-2503. [PubMed] [DOI] |
| 49. | Yan B, Zhou Y, Feng S, Lv C, Xiu L, Zhang Y, Shi J, Li Y, Wei P, Qin Z. β -Elemene-Attenuated Tumor Angiogenesis by Targeting Notch-1 in Gastric Cancer Stem-Like Cells. Evid Based Complement Alternat Med. 2013;2013:268468. [PubMed] |
| 50. | Yan B, Liu L, Zhao Y, Xiu LJ, Sun DZ, Liu X, Lu Y, Shi J, Zhang YC, Li YJ. Xiaotan Sanjie decoction attenuates tumor angiogenesis by manipulating Notch-1-regulated proliferation of gastric cancer stem-like cells. World J Gastroenterol. 2014;20:13105-13118. [PubMed] [DOI] |
| 51. | Mao J, Fan S, Ma W, Fan P, Wang B, Zhang J, Wang H, Tang B, Zhang Q, Yu X. Roles of Wnt/β-catenin signaling in the gastric cancer stem cells proliferation and salinomycin treatment. Cell Death Dis. 2014;5:e1039. [PubMed] [DOI] |
| 52. | Rodilla V, Villanueva A, Obrador-Hevia A, Robert-Moreno A, Fernández-Majada V, Grilli A, López-Bigas N, Bellora N, Albà MM, Torres F. Jagged1 is the pathological link between Wnt and Notch pathways in colorectal cancer. Proc Natl Acad Sci USA. 2009;106:6315-6320. [PubMed] [DOI] |
| 53. | Jordan CT, Guzman ML, Noble M. Cancer stem cells. N Engl J Med. 2006;355:1253-1261. [PubMed] [DOI] |