修回日期: 2015-09-17
接受日期: 2015-09-25
在线出版日期: 2015-10-18
目的: 本研究通过建立胆管癌大鼠模型, 以牛黄胆酸钠转运蛋白(sodium/taurocholate cotransporting polypeptide, Ntcp)为研究对象, 初步探讨Ntcp在胆管癌大鼠胆管肿瘤组织中的表达状况, 以期为治疗胆管癌找到新的手段和方法.
方法: Wistar大鼠(♂、体质量160 g±8 g)70只, 随机分为2组, 每组35只. 普通饮食对照组(简称对照组)予以普通饮食、3'-甲基-4-二甲基氨偶氮苯(3'-Me-DAB)饮食实验组(简称实验组)予以含3'-Me-DAB饮食. 经过20 wk, 建立胆管癌大鼠模型, 取对照组胆管组织和实验组胆管肿瘤组织: (1)实时定量PCR(real-time quantitative PCR, qRT-PCR)检测胆管组织和胆管肿瘤组织的Ntcp基因表达的强度; (2)石蜡切片后用免疫组织化学SP(streptavidin-perosidase)法检测胆管组织和胆管肿瘤组织的Ntcp蛋白表达的强度.
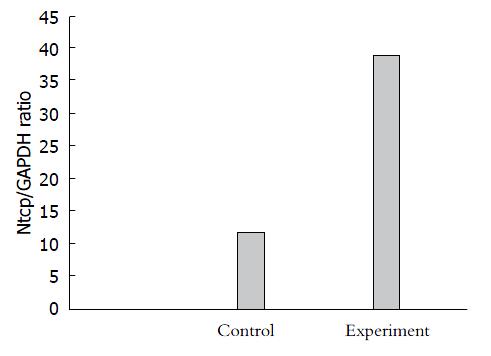
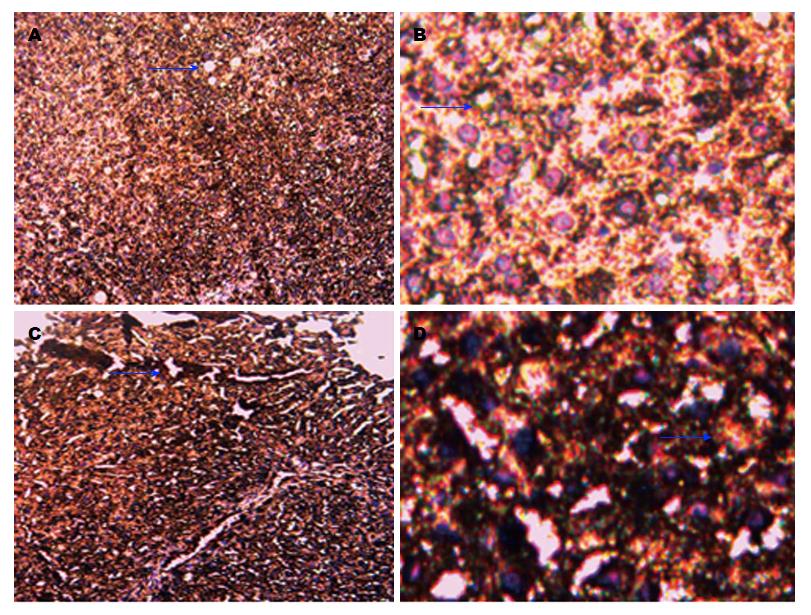
结果: qRT-PCR结果显示: Ntcp/GAPDH比率在对照组胆管组织中为12、在实验组胆管肿瘤组织中为39, 2组间的表达产生了统计学差异; 免疫组织化学SP法结果显示, 对照组胆管组织Ntcp基因表达阳性率为15.3%, 实验组胆管肿瘤组织Ntcp基因表达阳性率为69.2%(P<0.05).
结论: 实验组大鼠胆管肿瘤组织的Ntcp基因的表达较对照组胆管组织增多, 提示我们在胆管癌的治疗中, Ntcp有成为新的治疗靶点的可能.
核心提示: 建立胆管癌大鼠模型, 以牛黄胆酸钠转运蛋白(sodium/taurocholate cotransporting polypeptide, Ntcp)为研究对象, 初步探讨Ntcp基因在胆管癌大鼠中的表达状况, 以期为治疗胆管癌的找到新的手段和方法.
引文著录: 王洁萍, 张孟瑜, 李波, 夏先明. Ntcp在胆管癌大鼠胆管肿瘤组织中的表达状况. 世界华人消化杂志 2015; 23(29): 4694-4699
Revised: September 17, 2015
Accepted: September 25, 2015
Published online: October 18, 2015
AIM: To develop a rat model of bile duct cancer and detect sodium/taurocholate cotransporting polypeptide (Ntcp) expression in bile duct cancer tissues of this model, in order to provide a new method for the prevention and treatment of bile duct cancer.
METHODS: Seventy Wistar rats were randomly divided into either a control group or an experimental group, with 35 rats in each group. The control group was fed an ordinary diet, and the experimental group was fed a 3'-Me-DAB diet. After 20 wk, the bile duct cancer model was successfully established. Bile duct tissues were taken from rats of the control group and bile duct cancer tissues were taken from rats of the experimental group to detect the mRNA expression of Ntcp by real-time quantitative PCR (qRT-PCR), and protein expression by immunohistochemistry.
RESULTS: qRT-PCR analysis showed that in the bile duct tissues the Ntcp/GAPDH ratio was 12, but in the bile duct cancer tissues it was 39, which had an obvious difference. Immunohistochemistry showed that in the experimental group, the positive expression rate of Ntcp was 69.2%, significantly higher than 15.3% in the control group (χ2 = 10.28, P < 0.05).
CONCLUSION: The expression of the Ntcp gene increases significantly in rats with bile duct cancer, which suggests that drugs targeting Ntcp may be a new therapeutic strategy for bile duct cancer.
- Citation: Wang JP, Zhang MY, Li B, Xia XM. Ntcp expression in bile duct cancer tissues in rats. Shijie Huaren Xiaohua Zazhi 2015; 23(29): 4694-4699
- URL: https://www.wjgnet.com/1009-3079/full/v23/i29/4694.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i29.4694
胆管癌是肝胆系统疾病中常见的恶性肿瘤之一, 治疗困难, 研究资料显示, 其发病率在近年有逐年升高的表现, 但目前各种治疗方法和手段想要达到良好的效果仍然存在较大的难度. 胆管癌现阶段的治疗方法是首选手术切除, 但手术有适应症和禁忌症, 首先手术切除率处于一个较低的范围, 其次术后5年生存率也不高, 对合并身体多器官功能障碍, 肿瘤已发生浸润或转移者, 则失去了手术的条件, 但射频消融、介入栓塞等非手术治疗方法效果有限[1-3]. 那么, 是否能寻求更为有效的方法呢? 而基因治疗是目前尚未广泛应用又极具前景的治疗方式, 所以, 我们尝试从相关基因入手, 牛黄胆酸钠转运蛋白(sodium/taurocholate cotransporting polypeptide, Ntcp)基因与胆汁酸的重吸收有关, 而胆汁酸如果重吸收增多出现淤积, 则可能形成结石, 进而可能导致胆管组织的恶变, 那么其在胆管癌组织中有无表达、表达情况又如何目前尚无明确的研究. 因此, 本项目拟以Ntcp为研究对象, 研究在胆管癌大鼠胆管肿瘤细胞中Ntcp基因表达的状况, 尝试为胆管癌治疗提供新的思路.
健康成年♂Wistar大鼠70只, 体质量160 g±8 g, 由泸州医学院动物实验中心提供. 实时定量PCR检测(real-time quantitative PCR, qRT-PCR)定量试剂盒(购自上海索莱宝生物科技有限公司, SR1100); Ntcp单克隆抗体等(购自CHEMICON公司, 美国); 免疫组织化学试剂盒(购自CHEMICON公司, 美国, XL2001). ABI7500实时荧光定量PCR仪(ABI7500), 冰冻切片机(CM1950), HFsafe生物安全柜(1200A2), 显微摄像系统(PM-10A)等.
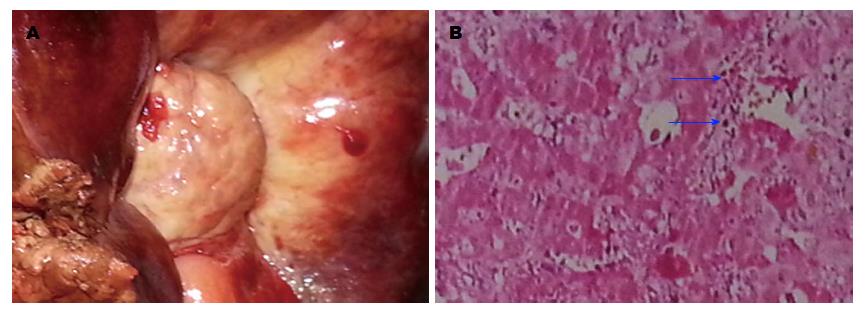
1.2.1 胆管癌大鼠模型制备: ♂Wistar大鼠随机分为2组, 每组35只: 普通饮食对照组(简称对照组)予以普通饮食、3'-甲基-4-二甲基氨偶氮苯(3'-Me-DAB)饮食实验组(简称实验组)予以含3'-Me-DAB饮食. 实验组饲以含3'-Me-DAB饮食, 连续20 wk后改为自由进食. 对照组, 自由饮水及进食. 每天观察动物的精神状态、饮食状况及皮毛的变化等一般情况. 于实验第8、16、20周, 分别取出模型组动物各2、2、2只, 剖腹观察胆管情况, 记录胆管的形态质地等的变化, 20 wk后经病理检查证实胆管癌大鼠模型建立成功.
1.2.2 实验步骤: 首先检测模型组及对照组胆管内胆汁酸各相关指标浓度. 取对照组胆管组织和实验组胆管肿瘤组织: (1)qRT-PCR检测胆管组织和胆管肿瘤组织的Ntcp基因表达的强度. 胆管组织和胆管肿瘤组织中RNA的提取参照TRIzol试剂说明书进行操作. 序列扩增机器为ABI7500, 以GAPDH为内参照. 设计Ntcp的上游引物: 5'-GATGGAGGTGCACAACGTAT-3', 下游引物: 3'-CTGTCTCAGTTCATGGCTCC-5'; GAPDH的上游引物: 5'-GATGGTGGGTATGGGTCAGAA-3', 下游引物: 3'-CTAGGAGCCAGGGCAGTAATC-5'; (2)石蜡切片后用免疫组织化学SP(streptavidin-perosidase)法检测胆管组织和胆管肿瘤组织的Ntcp蛋白表达的强度.
1.2.3 观察指标: Ntcp在正常胆管组织及胆管肿瘤组织中表达情况.
统计学处理 采用SPSS19.0统计软件进行分析, 统计学方法测得数据用mean±SD表示, 判断组间差异采用t检验及χ2检验, P<0.05为差异有统计学意义.
实验组大鼠自第6周开始, 进食量逐步开始下降, 部分体质量与对照组相比明显偏低, 喂食至20 wk后死亡3只. 对照组大鼠饮食及生长较好, 未出现死亡病例. 在第8、16、20周剖腹观察过程中发现大鼠肝门部胆管逐渐增厚、变硬、至20 wk时, 出现质硬包块. 20 wk后经病理检查证实已建立胆管癌大鼠模型, 除去死亡大鼠及建模过程中剖腹观察大鼠, 模型建立成功率为92.6%, 病理类型均为腺癌, 未建模成功大鼠经镜下观察其部分胆管细胞也已成异形性改变. 实验组大鼠胆管肿瘤组织主要集中在肝门部及右肝部分组织(图1).
20 wk后处死所有大鼠, 同时, 提取建模成功大鼠胆管内胆汁及对照组大鼠胆管内胆汁, 用自动生化仪检测与胆汁相关各项指标(表1).
使用2-△△Ct表达Ntcp扩增情况. 所得到结果如图2. 经过8个循环后, 使用t检验对组间差异进行分析, 所得结果显示差异具有统计学意义(t = 2.318, P<0.05).
光学高倍(100倍及200倍)物镜下: 胆管组织和胆管肿瘤组织中Ntcp蛋白出现黄色染色颗粒为阳性细胞(蓝色箭头所指). 每张切片随机选取6个视野, 每个视野内观察80个细胞, 阳性细胞≥10%为阳性, 否则为阴性. χ2检验显示: 实验组胆管肿瘤组织Ntcp蛋白表达阳性率为69.2%, 对照组胆管组织Ntcp蛋白表达阳性率为15.3%(χ2 = 10.28, P<0.05)(图3).
胆管癌是胆道系统常见的恶性肿瘤之一, 目前其发病机制尚不完全清楚, 现认为其发病是各种因素综合作用的结果, 影响状况和条件较多. 由于导致胆管癌产生的综合因素较多, 所以目前的治疗有各种困难存在[4-6]. 就现阶段的治疗方法来讲, 早期的胆管癌可以行根治性的手术切除, 而一旦肿瘤发生浸润或转移, 手术则不能再作为首选的治疗手段, 而各种非手术治疗方法效果有限, 即便是经过了上述的治疗, 胆管癌的复发率也较高, 其治疗方法有待发展和提高. 所以, 我们反复思考, 能不能找到一种行之有效的办法. 就目前而言, 基因治疗是一种尚未广泛应用于临床但又极具前景的治疗方案, 可能使胆管癌的治疗产生重大的变化, Ntcp基因与胆汁酸重吸收关系密切, 而胆汁酸如果重吸收增多出现淤积, 则可能形成结石, 进而导致胆管组织的恶变. 因此, Ntcp基因进入了我们的思考范围并引导我们设计了上述对比试验, 以期能发现一些与胆管癌相关的变化[7-9].
Ntcp是一种具有胆酸转运功能的多肽类物质,在胆汁酸重吸收过程中, 其具备重要作用[10-12]. 胆汁酸经过分泌进入肠道后, 结合胆汁酸在回肠通过小肠刷状缘钠盐依赖的胆汁酸转运体(apical sodium-dependent bile acid transport, ASBT), 胆汁酸结合蛋白和基侧膜的终末腔面钠盐依赖的胆汁酸转运体(terminal apical sodium-dependent bile acid transporter, tASBT)依次作为介质, 其中约80%的胆汁酸在Ntcp协助下被摄入肝细胞内并再次被分泌到胆汁中形成胆汁酸的肠肝循环[13-15]. 而如果Ntcp功能紊乱导致胆汁酸重吸收出现紊乱, 则可能出现肝内胆汁淤积, 而由于胆汁淤积, 则可能出现胆固醇、胆色素等在胆管的沉积, 从而形成结石, 而胆管结石的长期存在, 反复刺激胆管及胆管周围组织产生炎症, 继而可引起胆管细胞的恶变; 而胆管结石正是我们目前了解的可能产生胆管癌的原因之一. 因此, Ntcp基因的表达和变化情况是我们所关注的重点[16,17].
我们在设计的试验中观察发现, 通过20 wk时间含3'-Me-DAB饮食的喂养, 模型组大鼠的饮食量及体质量均较对照组逐步降低, 除去死亡大鼠及建模过程中剖腹观察大鼠, 胆管癌大鼠模型建立成功率为92.6%, 病理类型均为腺癌, 大部分呈浸润性生长表现, 而其中1只大鼠出现了外生性生长的情况, 未建模成功大鼠经镜下观察其部分胆管细胞也已出现了异形性改变. 肿瘤组织主要集中在肝门部, 约8%大鼠右肝部分组织也出现了肿瘤. 除去死亡大鼠及建模过程中剖腹观察大鼠, 96.2%大鼠在胆管内发现了泥沙样结石. 当建立模型成功后, 在试验中首先检测建模成功大鼠胆管内胆汁及对照组大鼠胆管内胆汁各相关指标, 发现总胆固醇(total cholesterol, TC)、血清总胆汁酸(total bile acids, TBA)、直接胆红素(direct bilirubin, DBIL)等指标在模型组中较对照组升高, 通过使用qRT-PCR对Ntcp基因表达进行检测、发现在模型组胆管肿瘤组织中Ntcp基因相对表达率约为对照组胆管组织中Ntcp基因相对表达率的3.25倍; 免疫组织化学对Ntcp蛋白表达进行检测, 发现在模型组胆管肿瘤组织中Ntcp蛋白阳性表达率约为对照组胆管组织中Ntcp蛋白阳性表达率的4.52倍. 从而证实胆管癌大鼠的胆管肿瘤组织中Ntcp基因出现了明显变化的情况, 表达升高显著, 较对照组有明显的增多; 说明在胆管癌的胆管肿瘤组织中胆汁酸的重吸收开始紊乱, 随着Ntcp基因表达的增加, 胆汁酸重吸收出现了显而易见的增强[18,19]; 由此我们初步考虑正常生理状态时如果胆汁酸增加, 则会伴随Ntcp基因表达减弱, 从而加快胆汁酸的排泄, 降低胆管内胆汁酸的浓度, 避免过高浓度胆汁酸对胆管细胞及肝细胞的损害; 而胆管癌时则出现了胆汁酸的代谢障碍, 随着Ntcp基因表达的增强, 大量胆汁酸重吸收进入肝内, 胆固醇和胆色素的沉积刺激胆管上皮细胞, 出现胆管炎及胆管周围炎, 胆管细胞反复出现破坏及增生, 进一步可能导致胆管细胞发生恶变. 那么, 既然已经发现在胆管癌胆管肿瘤组织中Ntcp基因表达增强, 其是否会体现出新的治疗意义? 我们会在此实验模型基础上继续进行Ntcp基因敲除, 药物干预等实验, 了解进一步的变化情况. 在目前所用治疗胆管癌的药物首先非常稀少, 其次普遍存在不同种类的问题, 可能无法完全达到治疗目的、需长期服用、胃肠道反应大, 患者可持续接受性差等缺点, 上述情况阻碍了其作为临床治疗药物的广泛应用, 但目前尚无可直接作用于胆管癌相关基因又可产生较好疗效在临床广泛应用的药物. 在此, Ntcp基因表达变化的发现, 可能为基础研究和临床治疗胆管癌提供新的药物治疗靶点[20], 找到一种新的治疗方向.
胆管癌的发生发展过程非常繁杂, 目前临床上现有的手术及非手术治疗手段有限, 且效果欠佳.
刘金钢, 教授, 博士生导师, 中国医科大学附属盛京医院外科
目前研究的热点和重点为新型的治疗胆管癌的方法和药物, 而基因治疗目前尚未广泛应用于临床, 但又极具治疗前景, 所以尝试从相关基因入手, 为胆管癌治疗提供新的思路.
本文从胆管癌相关基因牛黄胆酸钠转运蛋白(sodium/taurocholate cotransporting polypeptide, Ntcp)入手, 初步发现了Ntcp在胆管癌组织中的表达状况, 为胆管癌治疗找寻新的方法.
通过初步发现Ntcp在胆管癌大鼠胆管组织中的表达状况, 为进一步寻找作用于Ntcp基因的药物打下基础, 从而改善胆管癌治疗的方法和措施.
Ntcp: 对胆汁酸盐浓度稳定的维持和胆汁酸盐的肠肝循环中胆汁酸重吸收等生理功能具有重要作用.
文章整体对临床研究有一定借鉴作用.
编辑: 于明茜 电编:都珍珍
| 1. | Park JI. Primary hepatic tuberculosis mimicking intrahepatic cholangiocarcinoma: report of two cases. Ann Surg Treat Res. 2015;89:98-101. [PubMed] [DOI] |
| 2. | Cheng CT, Chu YY, Yeh CN, Huang SC, Chen MH, Wang SY, Tsai CY, Chiang KC, Chen YY, Ma MC. Peritumoral SPARC expression and patient outcome with resectable intrahepatic cholangiocarcinoma. Onco Targets Ther. 2015;8:1899-1907. [PubMed] [DOI] |
| 3. | Schmeding M, Neumann UP. Liver Transplant for Cholangiocarcinoma: A Comeback? Exp Clin Transplant. 2015;13:301-308. [PubMed] |
| 4. | Ruzzenente A, Conci S, Valdegamberi A, Pedrazzani C, Guglielmi A. Role of surgery in the treatment of intrahepatic cholangiocarcinoma. Eur Rev Med Pharmacol Sci. 2015;19:2892-2900. [PubMed] |
| 5. | Ignjatović II, Matić SV, Dugalić VD, Knežević DM, Micev MT, Marko D Bogdanović SM. A Case of Autoimmune Cholangitis Misdiagnosed for Cholangiocarcinoma: How to Avoid Unnecessary Surgical Intervention? Srp Arh Celok Lek. 2015;143:337-340. [PubMed] |
| 6. | Ciresa M, De Gaetano AM, Pompili M, Saviano A, Infante A, Montagna M, Guerra A, Giuga M, Vellone M, Ardito F. Enhancement patterns of intrahepatic mass-forming cholangiocarcinoma at multiphasic computed tomography and magnetic resonance imaging and correlation with clinicopathologic features. Eur Rev Med Pharmacol Sci. 2015;19:2786-2797. [PubMed] |
| 7. | Veloso Alves Pereira I, Buchmann B, Sandmann L, Sprinzl K, Schlaphoff V, Döhner K, Vondran F, Sarrazin C, Manns MP, Pinto Marques Souza de Oliveira C. Primary biliary acids inhibit hepatitis D virus (HDV) entry into human hepatoma cells expressing the sodium-taurocholate cotransporting polypeptide (NTCP). PLoS One. 2015;10:e0117152. [PubMed] [DOI] |
| 8. | Troeller A, Yan D, Marina O, Schulze D, Alber M, Parodi K, Belka C, Söhn M. Comparison and limitations of DVH-based NTCP models derived from 3D-CRT and IMRT data for prediction of gastrointestinal toxicities in prostate cancer patients by using propensity score matched pair analysis. Int J Radiat Oncol Biol Phys. 2015;91:435-443. [PubMed] [DOI] |
| 9. | Song P, Rockwell CE, Cui JY, Klaassen CD. Individual bile acids have differential effects on bile acid signaling in mice. Toxicol Appl Pharmacol. 2015;283:57-64. [PubMed] [DOI] |
| 10. | Elinger S. HBV: Stowaway of NTCP. Clin Res Hepatol Gastroenterol. 2014;38:661-663. [PubMed] [DOI] |
| 11. | Fattah S, Augustijns P, Annaert P. Age-dependent activity of the uptake transporters Ntcp and Oatp1b2 in male rat hepatocytes: from birth till adulthood. Drug Metab Dispos. 2015;43:1-8. [PubMed] [DOI] |
| 12. | Erlinger S. NTCP deficiency: a new inherited disease of bile acid transport. Clin Res Hepatol Gastroenterol. 2015;39:7-8. [PubMed] [DOI] |
| 13. | Dong Z, Ekins S, Polli JE. Quantitative NTCP pharmacophore and lack of association between DILI and NTCP Inhibition. Eur J Pharm Sci. 2014;66C:1-9. [PubMed] [DOI] |
| 14. | Fu LL, Liu J, Chen Y, Wang FT, Wen X, Liu HQ, Wang MY, Ouyang L, Huang J, Bao JK. In silico analysis and experimental validation of azelastine hydrochloride (N4) targeting sodium taurocholate co-transporting polypeptide (NTCP) in HBV therapy. Cell Prolif. 2014;47:326-335. [PubMed] [DOI] |
| 15. | Zhang G, Zhou Y, Rao Z, Qin H, Wei Y, Ren J, Zhou L, Wu X. Effect of Yin-Zhi-Huang on up-regulation of Oatp2, Ntcp, and Mrp2 proteins in estrogen-induced rat cholestasis. Pharm Biol. 2015;53:319-325. [PubMed] [DOI] |
| 16. | Romero MR, Monte MJ, Marin JJ. Pathophysiological and pharmacological implications of elucidating the molecular bases of the interaction between HBV and the bile acid transporter NTCP. Ann Hepatol. 2015;14:143-144. [PubMed] |
| 17. | Benadjaoud MA, Blanchard P, Schwartz B, Champoudry J, Bouaita R, Lefkopoulos D, Deutsch E, Diallo I, Cardot H, de Vathaire F. Functional data analysis in NTCP modeling: a new method to explore the radiation dose-volume effects. Int J Radiat Oncol Biol Phys. 2014;90:654-663. [PubMed] [DOI] |
| 18. | Vojtíšek R, Mužík J, Slampa P, Budíková M, Hejsek J, Smolák P, Ferda J, Fínek J. The impact of PET/CT scanning on the size of target volumes, radiation exposure of organs at risk, TCP and NTCP, in the radiotherapy planning of non-small cell lung cancer. Rep Pract Oncol Radiother. 2014;19:182-190. [PubMed] [DOI] |
| 19. | Tong S, Li J. Identification of NTCP as an HBV receptor: the beginning of the end or the end of the beginning? Gastroenterology. 2014;146:902-905. [PubMed] [DOI] |
| 20. | Wopken K, Bijl HP, van der Schaaf A, van der Laan HP, Chouvalova O, Steenbakkers RJ, Doornaert P, Slotman BJ, Oosting SF, Christianen ME. Development of a multivariable normal tissue complication probability (NTCP) model for tube feeding dependence after curative radiotherapy/chemo-radiotherapy in head and neck cancer. Radiother Oncol. 2014;113:95-101. [PubMed] [DOI] |