修回日期: 2015-08-04
接受日期: 2015-08-12
在线出版日期: 2015-09-28
目的: 探讨地衣芽孢杆菌对实验性结肠炎相关肝脏病变的治疗作用与机制.
方法: 将45只BALB/c小鼠随机分为正常组、葡聚糖硫酸钠(dextran sulfate sodium, DSS)组和治疗组, 实验过程中对各组小鼠进行疾病活动指数评分(disease activity index, DAI), 在造模及给药后第11天处死小鼠, 检测血清丙氨酸氨基转移酶(aspartate transaminase, ALT)、天门冬氨酸氨基转移酶(alanine aminotransferase, AST)、D-乳酸、二胺氧化酶(diamine oxidase, DAO)、内毒素(endotoxin), 取结肠及肝脏进行HE染色, 运用酶联免疫吸附测定(ELISA)肝组织匀浆中肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-6(interleukin-6, IL-6)含量水平.
结果: 通过地衣芽孢杆菌对DSS模型小鼠进行治疗发现, 与正常组比较, DSS组DAI评分明显增高(P<0.05), 治疗组与DSS组相比DAI评分降低(P<0.05); DSS组结肠长度与治疗组相比缩短程度更为显著(P<0.05); 与正常组比较, DSS组及治疗组血清ALT、AST、D-乳酸、DAO、内毒素均升高(P<0.05), 肝组织匀浆中TNF-α、IL-6含量显著升高(P<0.05); 而治疗组血清ALT、AST、D-乳酸、DAO、内毒素较DSS组均降低(P<0.05), 肝组织匀浆中TNF-α、IL-6含量较DSS组显著降低(P<0.05).
结论: 地衣芽孢杆菌对实验性结肠炎及相关肝胆病变有明显治疗作用, 可能与改善肠黏膜通透性和恢复免疫功能有关.
核心提示: 本文结合关于炎症性肠病(inflammatory bowel disease, IBD)相关肝脏病变的最新研究, 通过应用地衣芽孢杆菌调节肠道菌群平衡, 改善肠道炎症引起的微生态紊乱, 观察地衣芽孢杆菌对葡聚糖硫酸钠诱导的实验性结肠炎模型小鼠的治疗作用, 以期为IBD相关肝脏病变的临床治疗寻求新的治疗途径.
引文著录: 郑楠, 王雪明, 苏丽, 赵亚娇, 李楠. 地衣芽胞杆菌对实验性结肠炎相关肝脏病变的疗效及机制影响. 世界华人消化杂志 2015; 23(27): 4399-4405
Revised: August 4, 2015
Accepted: August 12, 2015
Published online: September 28, 2015
AIM: To investigate the therapeutic effects of Bacillus licheniformis on experimental colitis associated hepatobiliary disease.
METHODS: Forty-five male BALB/c mice were randomly divided into three groups: a normal group, a model group and a treatment group. Experimental colitis was induced in mice with dextran sulfate sodium. Disease activity index (DAI) was evaluated daily during the study period. Serum levels of aspartate transaminase (ALT), alanine aminotransferase (AST), D-lactate, diamine oxidase (DAO), and endotoxin were measured. The levels of tumor necrosis factor-α (TNF-α) and interleukin-6 (IL-6) in liver tissue were measured by ELISA.
RESULTS: Compared with the normal group, DAI score was significantly higher in the DSS group (P < 0.05); however, DAI score was significantly lower in the treatment group compared with the DSS group (P < 0.05). Colon shortening was more significant in the DSS group than in the treatment group (P < 0.05). Compared with the normal group, serum levels of ALT, AST, D-lactate, DAO, and endotoxin as well as the levels of TNF-α and IL-6 in liver homogenates were significantly increased (P < 0.05) in the DSS group; these parameters were significantly lower in the treatment group than in the DSS group (P < 0.05).
CONCLUSION: Bacillus licheniformis can reduce the severity of colitis associated liver disease possibly by promoting the recovery of intestinal mucosal permeability and immune function.
- Citation: Zheng N, Wang XM, Su L, Zhao YJ, Li N. Efficacy of Bacillus licheniformis in mice with colitis related liver disease. Shijie Huaren Xiaohua Zazhi 2015; 23(27): 4399-4405
- URL: https://www.wjgnet.com/1009-3079/full/v23/i27/4399.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i27.4399
炎症性肠病(inflammatory bowel disease, IBD)专指病因及发病机制未明的炎症性肠道疾病(idiopathic inflammatory bowel disease), 包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD). 目前认为其发病可能是遗传、免疫、肠黏膜屏障功能失调、饮食、精神等多因素综合作用所致[1]. IBD的主要病变虽然位于肠道, 但与之相关的各种肠外表现也并非少见, 肝胆疾病被认为是最常见的肠外表现之一. 有研究[2]推测IBD时, 肠黏膜屏障受损以及肠道菌群失调导致黏膜通透性增高, 细菌发生移位且内毒素产生增多, 入血后转运至肝脏, 激活肝内的枯否细胞(Kupffer)致炎性因子[如肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-6(interleukin-6, IL-6)等]增多, 对肝细胞产生直接损害, 导致肝胆疾病的发生. Aron等[3]
在实验动物模型的门静脉中发现肠源杆菌可支持肠道菌群移位的观点, 但至今IBD与肝胆疾病的病因及发病机制尚未有合理的解释. 研究[4,5]证明葡聚糖硫酸钠(dextran sulfate sodium, DSS)在致UC模型同时可伴发肝脏炎症、脂肪变等表现, 与人类UC伴发肝胆疾病有诸多相似之处, 因此本实验应用DSS构建实验性结肠炎模型[6], 以模拟人类UC, 通过对D-乳酸、二胺氧化酶(diamine oxidase, DAO)的测定研究地衣芽孢杆菌治疗前后UC小鼠肠黏膜通透性变化, 并检测肝功能及肝组织中TNF-α、IL-6的含量水平, 分析其在疾病过程中的变化, 为临床UC及相关肝胆病变的病因及治疗提供新思路.
健康♂7周龄BALB/c小鼠45只, 体质量18-23 g, 由北京维通利华实验动物技术有限公司提供, 动物合格证号No. 11400700046690. DSS(MW = 36000-50000)购自美国MP Biochemicals; 便隐血(OB)试剂(匹拉米洞半定量检测法)购自珠海贝索生物技术有限公司; TNF-α(Lot Number: 3017938)、IL-6(Lot Number: 2317740)ELISA试剂盒均购自美国BD Biosciences; D-乳酸检测试剂盒购自美国AAT Bioquest Inc.; DAO试剂盒购自上海纪宁实业有限公司; 内毒素ELISA试剂盒购自上海邦奕生物科技有限公司; 动物组织蛋白裂解液、蛋白酶抑制剂均购自北京德路祺科技有限公司; 地衣芽孢杆菌活菌胶囊(国药准字: S10950019)购自东北制药集团沈阳第一制药有限公司; GentleMACS™全自动温和组织处理器购自德国美天旎生物技术有限公司(Miltenyi Biotec GmbH); BECKMAN CX9全自动生化分析仪购自美国Beckman-coulter公司.
1.2.1 动物分组与模型的建立: 45只♂BALB/c小鼠采用随机数字表法分为正常组、DSS组及治疗组, 每组15只. 各组小鼠体质量对比, 差别无统计学意义(P>0.05). 普通恒温环境, 代谢笼独立饲养. 以无菌蒸馏水配置3%DSS溶液为唯一饮用水供DSS组及治疗组小鼠自由饮用10 d[4], 正常组饮用蒸馏水. 地衣芽孢杆菌108 CFU/mL于造模第1天起对治疗组进行灌胃给药(0.2 mL/10 g), 1次/d, 其余两组予生理盐水灌胃.
1.2.2 结肠炎症程度评估: 实验过程中每日给小鼠称质量, 测大便隐血, 观察大便性状、饮食、皮毛光泽度、精神及活动状态等, 用于评估疾病活动指数(disease activity index, DAI)(表1). 小鼠出现稀便、便隐血阳性、肉眼血便中任一项作为造模成功标准. 造模至第11天时将小鼠去眼球取血后颈椎脱臼处死.
| 体质量下降(%) | 大便性状 | 大便隐血/肉眼血便 | 记分 |
| 0 | 正常 | 正常 | 0 |
| 1-5 | 松散 | 隐血阳性 | 1 |
| 6-10 | 2 | ||
| 11-15 | 稀便 | 肉眼血便 | 3 |
| >15 | 4 |
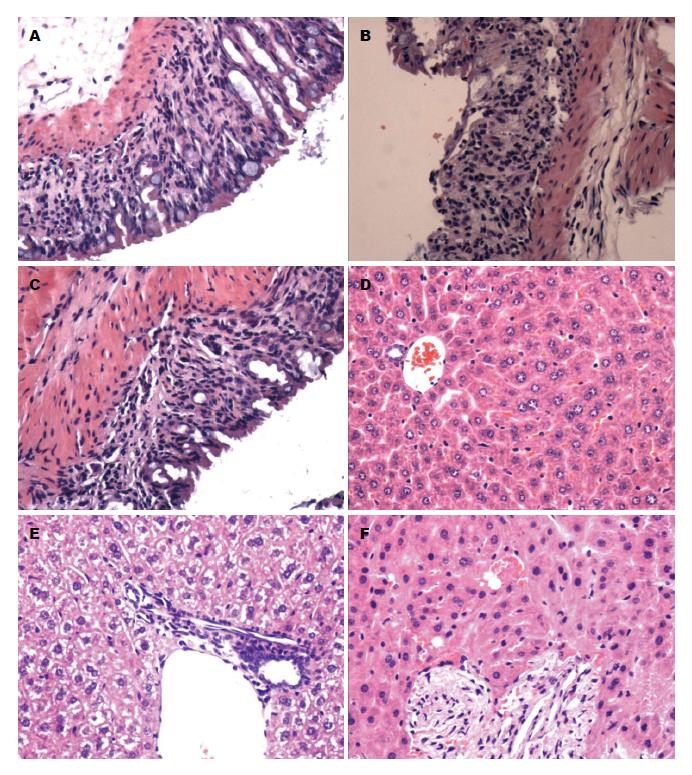
1.2.3 病理切片HE染色检查: 统一取同一部位1 cm左右远端结肠组织甲醛固定、石蜡包埋切片, 行苏木精-伊红(HE)染色. 统一取0.5 cm3左右肝脏左叶甲醛固定24 h后, 常规石蜡切片制作, HE染色, 图像处理系统拍照分析.
1.2.4 肠黏膜通透性、内毒素及肝功能测定: 收集小鼠血液于无菌Eppendorf管中, 4 ℃ 3000 g离心10 min, 吸取上清, -80 ℃冻存. 参照试剂盒说明书检测血清中D-乳酸、DAO、内毒素水平; 采用全自动生化仪以IFCC推荐法检测血清丙氨酸氨基转移酶(aspartate transaminase, ALT)、天门冬氨酸氨基转移酶(alanine aminotransferase, AST).
1.2.5 TNF-α、IL-6含量测定: 取肝脏右叶组织冰生理盐水冲洗, 吸水纸吸干水分后称质量, 弯盘置于冰上以眼科剪剪碎组织, 每100 mg组织加入1 mL冰动物组织蛋白裂解液及1%蛋白酶抑制剂, 用GentleMACS™全自动温和组织处理器制备组织匀浆, 4 ℃ 10000 g离心15 min, 吸取上清液, 重复离心1次再次收集上清, -80 ℃冻存. 参照ELISA试剂盒说明书测定TNF-α、IL-6含量.
统计学处理 所有统计应用SPSS19.0统计软件, 实验数据以mean±SD表示, 各组间比较采用单因素方差分析, 组间两两比较采用Student't检验, P<0.05为差异有统计学意义.
DSS组小鼠逐渐出现不同程度的腹泻、便血、精神萎靡、体质量减轻等. 治疗组腹泻、便血、体质量减轻等症状较轻, 可见成形便, 治疗后期多为便隐血阳性, 肉眼血便少见. 第11天处死小鼠后, 正常组结肠外观平滑, 长度偏长, 肠黏膜光整, 无溃疡、出血; DSS组小鼠结肠红肿, 长度缩短, 肠黏膜凹凸不平, 伴糜烂、充血, 个别伴有脓液; 治疗组结肠轻度水肿伴渗出, 炎症程度较轻, 个别可见点状出血点. 正常组小鼠肝脏表面红润、光滑、无出血点, 质软, 韧性较好; DSS组肝脏普遍颜色暗淡、表面可见鲜红色出血点、质脆、夹持易破裂; 治疗组小鼠肝脏颜色较红润, 依稀可见少量出血点, 质软.
结肠HE染色光镜下观察, 正常组小鼠结肠黏膜上皮完整, 腺体排列整齐, 无充血水肿, 无炎症细胞浸润; DSS组结肠黏膜明显充血水肿, 黏膜上皮损伤脱落可见溃疡形成, 腺体结构不完整伴炎细胞浸润; 治疗组结肠黏膜伴或不伴水肿, 个别腺体结构不完整, 少炎细胞浸润. 肝脏HE染色光镜下观察, 正常对照组肝脏结构清晰, 无炎性细胞浸润, 无细胞肿胀及脂肪滴; DSS组肝小叶周围细胞颗粒变性, 伴炎细胞浸润, 肝细胞内可见脂肪滴; 治疗组肝脏可见炎症细胞浸润, 肝小叶周围肝细胞颗粒变性及细胞肿胀较少见或表现轻微(图1).
通过对各组小鼠每日体质量变化、大便性状和隐血情况计算小鼠DAI评分结果显示, DSS组、治疗组与正常组比较, DAI评分明显增高(P<0.05), 治疗组DAI较DSS组明显降低(P<0.05). 全结肠长度测量结果显示DSS组、治疗组与正常组比较, 结肠长度明显缩短(P<0.05), 治疗组与DSS组相比结肠长度增加(P<0.05). 血清内毒素水平测定结果提示, DSS组、治疗组小鼠内毒素水平较正常组明显升高, 治疗组内毒素水平较DSS组降低(P<0.05)(表2).
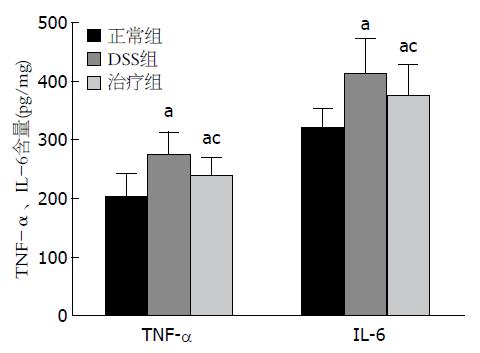
对各组小鼠D-乳酸、DAO、ALT、AST的测定提示, DSS组、治疗组较正常组肠黏膜通透性增加、肝功能减退(P<0.05), 其中治疗组与DSS组相比, 肠黏膜通透性降低、肝功能好转(P<0.05)(表3). ELISA检测肝组织匀浆中TNF-α、IL-6结果显示, DSS组、治疗组较正常组TNF-α、IL-6表达水平增高(P<0.05), 治疗组与DSS组相比, TNF-α、IL-6表达水平降低(P<0.05)(图2).
UC的病因及发病机制至今尚不十分明确, 以腹痛、腹泻、黏液脓血便、里急后重等为主要临床表现. 此外, 在累及全身各个系统的肠外表现中肝胆疾病屡见不鲜, 并且是影响IBD病死率的重要因素之一. 有报道显示, IBD患者并发肝胆疾病的几率明显高于一般人群[7,8]. 1998年, Riegler等[9]提出了"肝-肠轴"的概念, 指出肠道和肝脏在机体免疫防御机制上互相影响、互相调节、紧密相关. 因此通过对IBD相关肝胆疾病的研究, 有利于充分认识、综合分析IBD的病情及肠外表现, 为IBD的综合治疗提供帮助.
研究[5,10]表明, DSS模型诱发肝胆病变并非DSS直接作用, 而是由于结肠黏膜通透性增高, 黏膜屏障受损导致细菌易位、内毒素水平升高等因素引发肝脏病变, 并且肝胆疾病的出现与结肠炎症相伴随, 这与人类UC并发肝胆疾病有诸多相似之处. Karlsson等[11]的研究指出, DSS诱导UC模型引发肝脏病变与人类IBD相似, 可用于验证IBD相关肝脏疾病代谢改变及靶向研究. 因此本实验应用DSS诱导UC模型, 通过物理、化学方式破坏生物生理稳态使肠黏膜上皮屏障破坏, 通过各种途径激活巨噬细胞、T细胞、中性粒细胞等, 进一步引起免疫细胞因子改变[10]. 肠黏膜屏障功能可防止肠道内有害物质通过肠壁进入肠外组织或器官中, 而当这一屏障功能被破坏, 肠黏膜通透性增加, 肠道失去原有的抵抗能力, 产生肠源性细菌移位和内毒素血症等[12]. 肠源性内毒素血症可激活肝Kuffper细胞释放炎性介质, 同时激活补体并趋化中性粒细胞聚集, 引发过度炎症反应, 进一步损伤肝细胞. D-乳酸、DAO是反应肠黏膜通透性的敏感指标, DSS组D-乳酸、DAO显著升高, 黏膜通透性增加屏障功能受损, 治疗组D-乳酸、DAO有所降低, 肠黏膜屏障功能较好.
已证实DSS模型主要由1型/2型辅助性T细胞(T helper cells 1/T helper cells 2, Th1/Th2)反应介导, 与人类UC的免疫学反应十分相似. TNF-α又称恶液素(cachectin), 主要由巨噬细胞、单核细胞产生的一种非糖蛋白的单核因子. TNF-α具有多种生物学作用, 与受体结合后可诱导细胞溶解、死亡; 损伤内皮细胞, 激活凝血系统; 作为内源性致热源引起发热, 刺激机体产生IL-1、IL-6等; 促进细胞增殖分化, 调节免疫功能以及抗肿瘤作用等[13]. IL-6是一种多肽物质, 主要由T细胞、B细胞、单核巨噬细胞等分泌, 在各种炎症反应中起着核心调节作用. 有研究报道IL-6除了对B细胞具有刺激作用外, 还是肝细胞的强效刺激因子, 通过基因转录诱导肝细胞合成急性期反应蛋白, 其中以C反应蛋白和淀粉状蛋白A的增加尤为显著[14]. 在UC患者和UC结肠炎小鼠的肠黏膜中含有大量巨噬细胞及其产生的促炎因子(TNF-α、IL-6等), 他们参与了结肠的病理损伤, 同时肠道内革兰氏阴性菌过度繁殖产生大量内毒素, 他是TNF-α强有力的激活剂. 促炎因子增多、内毒素释放入血可直接损伤肝细胞并会激活肝内细胞因子网络系统引起炎性变. 结果中DSS组肝脏组织匀浆中TNF-α、IL-6明显升高, 经过地衣芽孢杆菌治疗后二者表达水平降低.
血清学检查是临床上评估肝功能最常用的检验指标, 其中转氨酶水平是检测肝细胞受损的敏感指标. ALT主要存在于肝细胞胞中, AST则主要位于肝细胞线粒体中. 肝细胞受损变性时, 细胞膜通透性改变, ALT游离出来进入血液; 当肝细胞受损严重累及线粒体等细胞器时, AST释放入血. DSS组小鼠ALT、AST升高, 肝功能减退且受损较严重, 地衣芽孢杆菌治疗组较DSS组有所改善.
地衣芽孢杆菌活菌胶囊属于需氧的益生菌制剂, 进入肠道后通过消耗氧气制造厌氧环境, 促进正常厌氧菌如双歧杆菌、乳酸杆菌等繁殖, 同时抑制腐败菌生长繁殖, 减少细菌内毒素的产生; 可降低肠道pH, 酸性环境促进氨及内毒素排泄, 利于患者肝功能好转[15]. 有研究[16,17]报道, 口服地衣芽孢杆菌活菌胶囊可改善肠道微环境, 减少氨及内毒素的吸收, 抑制炎症因子释放, 对于辅助治疗肝脏炎症性疾病具有较好的临床价值. 本研究应用地衣芽孢杆菌治疗UC小鼠模型, 提示其可能是通过调节肠道菌群, 促进肠黏膜屏障功能恢复, 减少细菌移位、内毒素的生成和入血以及炎性因子的产生, 从而减轻内毒素和炎性因子对肝脏的损伤作用.
UC肠外表现的发病机制仍不十分明确, 肝脏病变与结肠炎症并存, 二者并非独立存在, 可能拥有某些共同的发病机制, 如自身免疫因素、UC合并细菌感染引起菌血症、有毒物质的吸收等. 本研究表明地衣芽胞杆菌有利于促进肠黏膜屏障功能的恢复, 使其在抗结肠炎作用的同时改善了肝功能, 下调了炎症因子的表达, 促进免疫功能恢复, 更有利于UC的综合治疗, 为识别UC的肠外表现, 进行早期、有效的治疗, 进一步控制UC的疾病进展及改善预后提供新的思路.
"肝-肠轴"的概念指出肠道和肝脏在机体免疫防御机制上互相影响、互相调节、紧密相关. 因此通过对炎症性肠病(inflammatory bowel disease, IBD)相关肝胆疾病的研究, 有利于充分认识、综合分析IBD的病情及肠外表现.
潘秀珍, 教授, 主任医师, 福建省立医院消化科
近年来, 微生态制剂在临床上的应用越发广泛, 在恢复肠道菌群平衡、防止感染、合理利用抗生素、提高机体免疫力等方面有重要作用, 且肝病的微生态疗法亦是目前研究热点.
国外最新研究结果表明, 补充益生菌制剂调节肠道菌群平衡有利于缓解葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导的实验性结肠炎小鼠的结肠炎症表现, 且通过肠道微生态环境的改善有利于缓解肠道炎症导致的相关肝脏病变, 因此微生态疗法应得到更多的重视.
近年来对IBD相关肝胆疾病的关注越来越多, 然而二者的病因及发病机制仍未明确, 肝脏病变与结肠炎症并存, 二者并非独立存在, 可能拥有某些共同的发病机制, 因此对这一方面的研究有利于综合、全面认识IBD.
本文应用地衣芽孢杆菌治疗实验性结肠炎小鼠相关的肝脏病变, 通过调节肠道微生态平衡达到改善肝脏功能的目的, 期望可以通过调节肠道菌群平衡减轻致炎反应, 从而缓解IBD及其相关的肝脏病变.
DSS: 是葡聚糖的聚阴离子衍生物, 由葡聚糖和氯磺酸的酯化反应形成, 有提高核酸杂交率、显示免疫相关活动、纯化材料等重要作用, 是制备小鼠实验性结肠炎经典模型的物理制剂; 疾病活动指数评分(disease activity index, DAI): 结合患者(患病动物)的体质量下降百分率、大便黏稠度和大便出血三个方面进行综合评分将3项结果的总分除以3即为DAI值.
虽然地衣芽孢杆菌对肝硬化等肝病的疗效已有大量文章, 对IBS的疗效也已肯定, 但对IBD肝损害的文章还不多. 本研究对IBD肝损害的临床研究和诊治有参考意义.
编辑: 郭鹏 电编: 都珍珍
| 1. | Bouguen G, Chevaux JB, Peyrin-Biroulet L. Recent advances in cytokines: therapeutic implications for inflammatory bowel diseases. World J Gastroenterol. 2011;17:547-556. [PubMed] [DOI] |
| 2. | 叶 世华, 缪 应雷. 炎症性肠病与免疫性肝病的研究进展. 胃肠病学与肝病学杂志. 2014;23:588-592. |
| 3. | Aron JH, Bowlus CL. The immunobiology of primary sclerosing cholangitis. Semin Immunopathol. 2009;31:383-397. [PubMed] [DOI] |
| 4. | Egger B, Procaccino F, Sarosi I, Tolmos J, Büchler MW, Eysselein VE. Keratinocyte growth factor ameliorates dextran sodium sulfate colitis in mice. Dig Dis Sci. 1999;44:836-844. [PubMed] |
| 5. | Gäbele E, Dostert K, Hofmann C, Wiest R, Schölmerich J, Hellerbrand C, Obermeier F. DSS induced colitis increases portal LPS levels and enhances hepatic inflammation and fibrogenesis in experimental NASH. J Hepatol. 2011;55:1391-1399. [PubMed] [DOI] |
| 6. | Whittem CG, Williams AD, Williams CS. Murine Colitis modeling using Dextran Sulfate Sodium (DSS). J Vis Exp. 2010;1652. [PubMed] [DOI] |
| 8. | Parente F, Pastore L, Bargiggia S, Cucino C, Greco S, Molteni M, Ardizzone S, Porro GB, Sampietro GM, Giorgi R. Incidence and risk factors for gallstones in patients with inflammatory bowel disease: a large case-control study. Hepatology. 2007;45:1267-1274. [PubMed] |
| 9. | Riegler G, D'Incà R, Sturniolo GC, Corrao G, Del Vecchio Blanco C, Di Leo V, Carratù R, Ingrosso M, Pelli MA, Morini S. Hepatobiliary alterations in patients with inflammatory bowel disease: a multicenter study. Caprilli & amp; Gruppo Italiano Studio Colon-Retto. Scand J Gastroenterol. 1998;33:93-98. [PubMed] |
| 10. | Håkansson A, Bränning C, Molin G, Adawi D, Hagslätt ML, Jeppsson B, Nyman M, Ahrné S. Blueberry husks and probiotics attenuate colorectal inflammation and oncogenesis, and liver injuries in rats exposed to cycling DSS-treatment. PLoS One. 2012;7:e33510. [PubMed] [DOI] |
| 11. | Karlsson A, Jägervall A, Pettersson M, Andersson AK, Gillberg PG, Melgar S. Dextran sulphate sodium induces acute colitis and alters hepatic function in hamsters. Int Immunopharmacol. 2008;8:20-27. [PubMed] |
| 12. | 彭 小青, 李 夏雨, 王 玮, 李 楠, 马 健, 沈 守荣. Th1/Th2细胞炎性因子在大鼠溃疡性结肠炎治疗模型中的表达. 中南大学学报(医学版). 2013;38:1020-1028. |
| 13. | Kalambokis G, Tsianos EV. Endotoxaemia in the pathogenesis of cytopenias in liver cirrhosis. Could oral antibiotics raise blood counts? Med Hypotheses. 2011;76:105-109. [PubMed] [DOI] |
| 14. | 刘 晓柳, 李 光千. 白介素-6及其受体与心血管系统的研究进展. 细胞与分子免疫学杂志. 2009;25:189-191. |