修回日期: 2015-08-05
接受日期: 2015-08-31
在线出版日期: 2015-09-28
目的: 探讨中国江西汉族人群ITGA2 C807T基因多态性与大肠腺瘤及大肠癌患病风险的关系.
方法: 本研究为基于医院人群的病例-对照研究, 包括95例正常对照、48例大肠腺瘤和89例大肠癌个体. 采用聚合酶链反应-限制性片段长度多态性(polymerase chain reaction restriction fragment length polymorphism assay, PCR-RFLP)方法检测研究人群ITGA2 C807T基因型分布, 并对该基因多态性与大肠癌临床病理特征的关系进行分析.
结果: ITGA2 C807T基因型频率和等位基因频率在大肠腺瘤组和对照组的总体分布无显著差异, 而其在大肠癌组和对照组的分布具有显著差异. 相比于野生基因型CC, 携带变异基因型(CT+TT)的个体患大肠腺瘤和大肠癌的风险均增高. 在分层分析中, 变异基因型并未增加患大肠腺瘤的风险, 变异基因型增加患大肠癌的风险在女性、吸烟、饮酒、高学历、脑力劳动、城市受试者中具有统计学意义. 大肠癌病例分别按病变部位、病理类型、肿瘤大小、分化程度、浸润深度、淋巴结转移和Dukes分期临床病理特征分层后, 均未见ITGA2 C807T基因型分布存在显著性差异.
结论: ITGA2 C807T基因多态性可能增加大肠腺瘤和大肠癌患病风险.
核心提示: 在中国江西汉族人群中ITGA2 C807T多态性与增加大肠腺瘤和大肠癌风险相关. 特别是在女性组、吸烟者、饮酒者、高学历者、脑力劳动者和城市受试者中, 此多态性增加患大肠癌风险.
引文著录: 李佳玲, 陈杰, 韩明, 刘立玺, 龚敏, 李兴, 文萍, 刘爱莲, 秦章禄, 韩容芬, 文剑波. ITGA2 C807T多态性与大肠腺瘤及大肠癌发病风险的相关性. 世界华人消化杂志 2015; 23(27): 4358-4367
Revised: August 5, 2015
Accepted: August 31, 2015
Published online: September 28, 2015
AIM: To evaluate the impact of the ITGA2 C807T gene polymorphism on the risk of colorectal adenoma (CRA) and colorectal cancer (CRC) in a Chinese Han population.
METHODS: A hospital-based case-control study was conducted, including 95 healthy controls, 48 patients with CRA and 89 patients with CRC. Genotyping was performed by polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP) assay. Association of the genotypes with the clinical and pathological features of CRC was evaluated.
RESULTS: The frequencies of the genotypes and alleles in CRC were significantly different from those of controls, but there were no significant differences between CRA and controls. Compared with individuals with the wild type genotype CC, subjects with the variant genotypes (CT + TT) had a significantly higher risk of CRA and CRC. In stratified analyses, the elevated CRC risk was especially evident in older individuals, females, smokers, drinkers, well-educated subjects, mental workers and urban subjects. However, no correlation was observed between CRA patients and controls in stratified analyses. When stratified by clinicopathological features such as lesion distribution, pathology subtype, tumor size, differentiation degree, depth of invasion, lymph node metastasis and Duke's stage in patients with CRC, no associations were observed in the polymorphism distributions.
CONCLUSION: The ITGA2 C807T polymorphism may be associated with an increased risk of CRA and CRC.
- Citation: Li JL, Chen J, Han M, Liu LX, Gong M, Li X, Wen P, Liu AL, Qin ZL, Han RF, Wen JB. Association of ITGA2 C807T polymorphism with risk of colorectal adenoma and colorectal cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(27): 4358-4367
- URL: https://www.wjgnet.com/1009-3079/full/v23/i27/4358.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i27.4358
自1975年Morson提出大肠癌遵循腺瘤-腺癌的组织发生顺序以来[1], 众多研究[2-8]表明, 大肠从正常黏膜到腺瘤, 再发展为进展期大肠癌, 为遗传因素与环境因素交互作用导致的多步骤、多阶段的复杂进展过程. 有研究[9,10]报道整联蛋白在肿瘤形成和转移中起着重要的作用, 尤其是α2β1、αⅡbβ3和αⅤβ3被认为是整联蛋白家族中参与肿瘤发生和进展的关键因子. 整联蛋白α2β1表达于上皮细胞, 在肿瘤细胞中的表达水平和肿瘤迁移、侵袭和细胞分化相关[11-13], 且大量研究[14-19]发现整联蛋白α2β1参与大肠癌发生、发展、转移. 人类整联蛋白α2亚单位基因(ITGA2)位于染色体5q11.2, 在该基因编码区的第7个外显子上807位核苷酸发现一个C到T的同义突变(NCBI SNP ID: rs1126643). 有研究[20,21]证明该单核苷酸多态性ITGA2 C807T影响着整联蛋白α2β1的表达量(α2亚单位只和β1亚单位结合), TT基因型者整联蛋白α2β1表达最高, CT基因型者整联蛋白α2β1表达次之, CC基因型者整联蛋白α2β1表达最低. 有研究[22-24]发现ITGA2 C807T多态性可能与乳腺癌、胃癌和结肠癌风险相关, 其中一项国外研究[24]证实ITGA2 C807T多态性与降低大肠癌风险[OR = 0.77, 95%可信区间(95% confidence interval, 95%CI): 0.64-0.94, P = 0.011]相关. 而大部分大肠癌的遗传风险是通过腺瘤的易感性介导的[25]. 所以本研究通过检测ITGA2 C807T多态位点以探索其与中国江西汉族人群大肠腺瘤和大肠癌遗传易感性的关系.
研究对象的筛选: 病例组: 89例散发型大肠癌病例及48例大肠腺瘤病例来自江西省萍乡市人民医院2014-02/2015-03经组织病理学确诊的住院患者(图1). 对照组: 95例对照人群为同时期入院进行健康体检的人群. 实验纳入标准: (1)研究对象均签署知情同意书; (2)年龄≥18岁, 性别不限; (3)大肠癌病例采血时未行放射和化学治疗, 分期标准采用Dukes改良分期和TNM分期; (4)对照组人群均否认肿瘤和遗传病史; (5)病例组和对照组均为无血缘关系的萍乡及周边地区的汉族人群; (6)能通过问卷调查收集研究对象的年龄、性别、身高、体质量、住址、教育程度、吸烟、饮酒、饮茶状态、高血压史、糖尿病史、家族史等相关信息. 实验排除标准: (1)无法获取知情同意者; (2)经过多次放射与化学治疗大肠癌患者; (3)合并有其他遗传性疾病的所有研究对象, 合并有肿瘤的对照组和合并有除大肠癌外的肿瘤的大肠癌患者. 现吸烟或曾吸烟平均每天吸烟一支以上并持续2年以上者被定义为吸烟个体, 现饮酒或曾饮酒平均每天1次以上并持续3 mo以上者被定义为饮酒个体, 现饮茶或曾饮茶平均每天2次以上并持续3 mo以上者被定义为饮茶个体. 家族中1名以上亲属和/或2名以上二级亲属患大肠癌者被定义为大肠癌家族史阳性. 根据国际抗癌联盟和美国癌症联合会联合制定的第7版肿瘤TNM分期法评定肿瘤侵犯深度和局部淋巴结转移状态[26,27]. 分化等级依据世界卫生组织(World Health Organization, WHO)[28,29]. 该研究已经医院伦理委员会批准. 实验试剂的来源: 全血基因组DNA快速提取试剂盒购自北京博迈德生物技术有限公司; 10×PCR Buffer及Taq DNA聚合酶购自MBI Fermentas; 上下游引物由金斯瑞生物科技公司合成.
1.2.1 血液白细胞DNA的提取: 采集外周静脉血2 mL, 保存于-20 ℃低温冰箱. 用全血基因组DNA快速提取试剂盒提取血液白细胞DNA, 按标准流程进行操作, 提取的DNA经核酸蛋白测定仪检测浓度和纯度.
1.2.2 基因分型: 采用聚合酶链反应-限制性片段长度多态性方法(polymerase chain reaction restriction fragment length polymorphism assay, PCR-RFLP)检测ITGA2 C807T基因型. PCR反应体系为20 μL, 其中包括2 μL 10×PCR Buffer, 1.75 mmol/L MgCl2, 0.15 mmol/L dNTPs, 0.25 μmol/L上下游引物, F: 5'-GTGTTTAACTTGAACACATAT-3', R: 5'-ACCTTGCATATTGAATTGCTT-3', 1 U Taq DNA聚合酶和150 ng模板DNA. PCR扩增程序为: 95 ℃预变性5 min, 然后经35个循环: 包括94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸60 s, 最后72 ℃延伸5 min. 115 bp的扩增产物用限制性内切酶TaqⅠ65 ℃水浴酶切12 h后, 经3%琼脂糖凝胶电泳, 在紫外分光仪分析基因型.
统计学处理 用SPSS16.0软件进行数据统计分析, 所有统计检验均基于双尾, P<0.05被认为具有统计学意义. Shapiro-Wilk检验用于检测定量资料的正态性. 如果是正态分布则用Student's t-检验检测两组间的差异; 如果是偏态分布, 则用Mann-Whitney秩和检验检测两组间的差异. 采用拟合优度χ2检验检测Hardy-Weinberg平衡, 用以确认研究样本的群体代表性和计算各组的基因型频率及等位基因频率. 采用Pearson χ2检验比较病例组和对照组中的基因型和分类变量分布的差异. 以优势比(odds ratio, OR)及其95%CI表示相对风险度. 以野生型CC基因型携带者为参照, OR值为1. 用非条件Logistic回归法计算经年龄、性别、身高、体质量、住址、教育程度、吸烟饮酒饮茶状态、高血压史、糖尿病史和家族史校正的OR值.
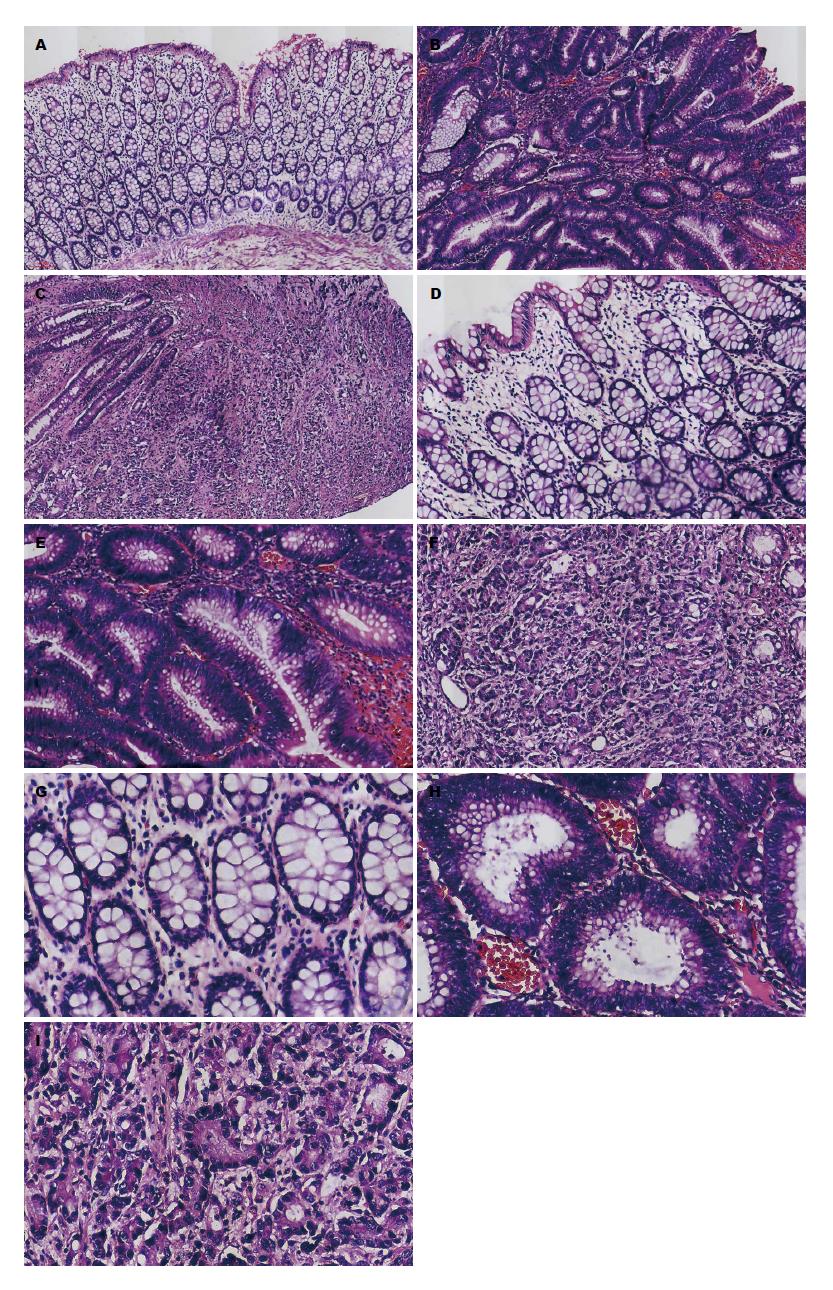
病例组和对照组的病理图片如图1. 图1A、D、G为对照组不同显微镜视野下的病理图片: 可见腺体排列整齐, 间质少量淋巴细胞浸润; 图1B、E、H为大肠腺瘤组: 可见腺体异型增生, 上皮细胞增生成复层或假复层, 核深染; 图1C、F、I为大肠腺癌组: 无明显腺管样结构, 取而代之的是异型深染的细胞浸润于间质中. 病例组和对照组在性别上无统计学差异, 大肠腺瘤组和对照组在年龄(5岁以内)上无统计学差异, 大肠癌组年龄稍大, 提示配对基本成功. 病例组和对照组的糖尿病史、饮酒、饮茶和婚姻状况无差异. 大肠癌组体质量、身高和BMI较对照组低. 病例组和对照组在高血压史、大肠癌家族史、教育程度、职业、居住地上差异具有统计学意义. 大肠腺瘤组和对照组吸烟状况差异具有统计学意义(表1).
| 基本特征 | 正常对照组(n = 95) | 大肠腺瘤组(n = 48) | 大肠癌组(n = 89) | P值1 | P值2 |
| 性别(男性) | 49(51.58) | 32(66.67) | 42(47.19) | 0.086 | 0.552 |
| 年龄3(岁) | 49(38-56) | 53(46-62) | 62(51-68) | 0.102 | <0.001 |
| 体质量3(kg) | 62(53-68) | 62(55-68) | 53(48-57) | 0.915 | <0.001 |
| 身高4(cm) | 163(159-170) | 163(159-170) | 161(155-168) | 0.926 | 0.040 |
| BMI4(kg/m2) | 2.30(2.13-2.45) | 2.30(2.10-2.48) | 2.08(1.91-2.20) | 0.998 | <0.001 |
| 高血压 | 8(8.42) | 11(22.92) | 24(26.97) | 0.016 | 0.001 |
| 糖尿病 | 7(7.37) | 5(10.42) | 5(5.62) | 0.535 | 0.631 |
| 吸烟 | 26(27.37) | 23(47.92) | 25(28.09) | 0.014 | 0.913 |
| 饮酒 | 27(28.42) | 20(41.67) | 22(24.72) | 0.111 | 0.570 |
| 饮茶 | 52(54.74) | 24(50.00) | 41(46.07) | 0.592 | 0.240 |
| 婚姻(已婚) | 92(96.84) | 48(100.00) | 87(97.75) | 0.213 | 0.704 |
| 大肠癌家族史(有) | 0(0.00) | 3(6.25) | 4(4.49) | 0.012 | 0.037 |
| 教育程度 | <0.001 | <0.001 | |||
| 文盲 | 2(2.11) | 3(6.25) | 11(12.36) | ||
| 小学 | 5(5.26) | 13(27.08) | 47(52.81) | ||
| 初中以上 | 88(92.63) | 32(66.67) | 31(34.83) | ||
| 职业 | <0.001 | <0.001 | |||
| 体力 | 3(3.16) | 28(58.33) | 67(75.28) | ||
| 脑力 | 92(96.84) | 20(41.67) | 22(24.72) | ||
| 居住地 | <0.001 | <0.001 | |||
| 农村 | 4(4.21) | 27(56.25) | 58(65.17) | ||
| 城市 | 91(95.79) | 21(43.75) | 31(34.83) |
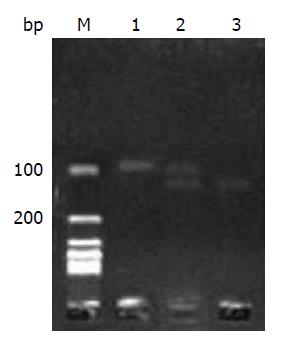
野生型CC纯合子基因型有92 bp和23 bp两个片段; 突变型TT纯合子仅有115 bp一个片段; CT杂合子基因型有115、92和23 bp三个片段(图2). 所有的样本均以随机号编码, 所有分析均为盲法, 随机抽取约10%的样本重复实验, 结果100%一致.
病例和对照人群基因型分布都符合Hardy-Weinberg平衡定律(对照组P = 0.555, 大肠腺瘤组P = 0.559, 大肠癌组P = 0.615), 表明没有遗传漂移或对特定ITGA2基因型没有选择性优势. 表2显示大肠癌组和对照组基因型分布具有统计学差异(P<0.01), 大肠腺瘤组和对照组基因型分布未见统计学差异. 大肠癌组T等位基因频率显著高于对照组(P<0.05), 大肠腺瘤组与对照组等位基因频率差异无统计学意义. 与野生基因型CC相比, 变异基因型(CT+TT)的OR值, 在校正了年龄、性别、身高、体质量、住址、教育程度、吸烟饮酒饮茶状态、高血压史、糖尿病史和家族史后, 大肠腺瘤组为1.51(95%CI: 1.17-2.51, P = 0.037), 其中CT和TT分别增加了39%(95%CI: 1.04-2.12)和43%(95%CI: 0.75-2.47)的大肠腺瘤风险和. 大肠癌组为1.62(95%CI: 1.23-2.30, P = 0.024), 其中CT和TT分别增加了57%(95%CI: 1.20-2.18)和60%(95%CI: 0.93-2.87)的大肠癌风险.
| ITGA2基因型 | 正常对照组1[n(%)] | 大肠腺瘤组1[n(%)] | 大肠癌组1[n(%)] | 校正OR24(95%CI) | P值2 | 校正OR34(95%CI) | P值3 |
| 总体 | 95 | 48 | 89 | ||||
| CC | 66(69.47) | 28(58.33) | 44(49.44)b | 1.00 | 1.00 | ||
| CT | 11(11.58) | 9(18.75) | 24(26.96) | 1.39(1.04-2.12) | 0.041 | 1.57(1.20-2.18) | 0.036 |
| TT | 18(18.95) | 11(22.92) | 21(23.60) | 1.43(0.75-2.47) | 0.183 | 1.60(0.93-2.87) | 0.084 |
| CT+TT | 29(30.53) | 20(41.67) | 45(50.56) | 1.51(1.17-2.51) | 0.037 | 1.62(1.23-2.30) | 0.024 |
| 等位基因 | |||||||
| C等位基因 | 143(75.26) | 65(67.71) | 112(62.92)a | ||||
| T等位基因 | 47(24.74) | 31(32.29) | 66(37.08)a |
表3显示了用对照组中位年龄(49岁)、性别、吸烟、饮酒、教育、职业和居住地对受试者进行分层分析, 进一步研究ITGA2变异基因型对大肠腺瘤和大肠癌风险的影响. 结果显示在所有分层因素下变异基因型并未增加患大肠腺瘤的风险. 变异基因型增加的大肠癌风险在女性人群有统计学意义(校正OR = 1.83, 95%CI: 1.18-2.82, P = 0.007), 而在男性人群没有统计学意义. 对吸烟和饮酒情况分层分析显示, 在吸烟和饮酒受试者中, 携有变异基因型各增加87%和105%的大肠癌风险(P = 0.004、P = 0.023), 而在非吸烟和非饮酒受试者中无统计学意义. 此外, 此多态性与增加大肠癌风险的相关性在高学历、脑力劳动和城市受试者中有统计学意义(P = 0.005、P = 0.040、P = 0.013), 而在低学历、体力劳动和农村受试者中无统计学意义. 我们没有发现此多态性与大肠癌风险相关性的年龄差异.
| 分组 | (CT+TT)(%)/CC(%) | 校正 | P值1 | 校正 | P值2 | ||
| 对照组(n = 95) | 大肠腺瘤组(n = 48) | 大肠癌组(n = 89) | OR13(95%CI) | OR23(95%CI) | |||
| 年龄(岁) | |||||||
| ≤49 | 13(13.7)/35(36.9) | 8(16.7)/11(22.9) | 9(10.1)/9(10.1) | 1.96(0.65-5.95) | 0.236 | 1.64(0.94-2.88) | 0.084 |
| >49 | 16(16.8)/31(32.6) | 12(25.0)/17(35.4) | 36(40.5)/35(39.3) | 1.37(0.53-3.55) | 0.520 | 1.41(0.96-2.07) | 0.076 |
| 性别 | |||||||
| 男 | 15(15.8)/31(32.6) | 6(12.5)/10(20.8) | 21(23.6)/26(29.2) | 1.38(0.41-4.59) | 0.602 | 1.29(0.85-1.97) | 0.234 |
| 女 | 14(14.7)/35(36.9) | 14(29.2)/18(37.5) | 24(27.0)/18(20.2) | 1.84(0.73-4.66) | 0.197 | 1.83(1.18-2.82) | 0.007 |
| 吸烟 | |||||||
| 吸烟者 | 5(5.3)/21(22.1) | 9(18.7)/14(29.2) | 15(16.9)/10(11.2) | 2.70(0.75-9.76) | 0.130 | 1.87(1.34-4.72) | 0.004 |
| 非吸烟者 | 24(25.2)/45(47.4) | 11(22.9)/14(29.2) | 30(33.7)/34(38.2) | 1.47(0.58-3.74) | 0.415 | 1.29(0.91-1.82) | 0.157 |
| 饮酒 | |||||||
| 饮酒者 | 6(6.3)/21(22.1) | 9(18.7)/11(22.9) | 12(13.5)/10(11.2) | 2.86(0.81-10.1) | 0.103 | 2.05(1.11-3.80) | 0.023 |
| 非饮酒者 | 23(24.2)/45(47.4) | 11(22.9)/17(35.4) | 33(37.1)/34(38.2) | 1.27(0.51-3.14) | 0.611 | 1.38(0.97-1.95) | 0.070 |
| 教育程度 | |||||||
| 文盲 | 1(1.05)/1(1.05) | 0(0.00)/3(6.25) | 4(4.50)/7(7.90) | 0.33(0.01-11.94) | 0.547 | 0.76(0.17-3.44) | 0.718 |
| 小学 | 2(2.10)/3(3.16) | 7(14.60)/6(12.50) | 23(25.80)/24(27.00) | 1.17(0.12-10.99) | 0.893 | 0.98(0.35-2.72) | 0.967 |
| 初中以上 | 26(27.40)/62(65.30) | 13(27.10)/19(39.60) | 18(20.20)/13(14.60) | 1.75(0.75-4.08) | 0.195 | 1.83(1.20-2.80) | 0.005 |
| 职业 | |||||||
| 体力 | 0(0.00)/3(3.16) | 13(27.10)/15(31.20) | 33(37.10)/34(38.20) | 2.60(0.24-28.15) | 0.432 | 1.71(0.54-5.43) | 0.365 |
| 脑力 | 29(30.50)/63(66.30) | 7(14.60)/13(27.10) | 12(13.50)/10(11.20) | 1.21(0.44-3.36) | 0.713 | 1.64(1.02-2.64) | 0.040 |
| 居住地 | |||||||
| 农村 | 2(2.1)/2(2.1) | 12(25.0)/15(31.2) | 28(31.5)/30(33.7) | 0.80(0.01-6.55) | 0.835 | 0.97(0.35-2.66) | 0.947 |
| 城市 | 27(28.4)/64(67.4) | 8(16.7)/13(27.1) | 17(19.1)/14(15.7) | 1.46(0.54-3.92) | 0.454 | 1.70(1.12-2.58) | 0.013 |
大肠癌病例分别按病变部位、病例类型、肿瘤大小、分化程度、浸润深度、淋巴结转移和Dukes分期临床病理特征分层后, 均未见ITGA2 C807T位点基因型分布存在显著性差异(P>0.05)(表4).
| 病理特征 | CT+ TT | CC | χ2值 | P值 |
| 病变部位 | 0.013 | 0.908 | ||
| 结肠 | 24(27.0) | 24(27.0) | ||
| 直肠 | 21(23.6) | 20(22.4) | ||
| 病理分型 | 0.320 | 0.570 | ||
| 腺癌 | 43(48.3) | 43(48.3) | ||
| 其他类型 | 2(2.2) | 1(1.1) | ||
| 肿瘤大小1(cm3) | 1.100 | 0.295 | ||
| ≤10 | 15(16.9) | 10(11.2) | ||
| >10 | 30(33.7) | 33(37.1) | ||
| 分化程度 | 0.180 | 0.671 | ||
| 高分化 | 3(3.4) | 4(4.5) | ||
| 中低分化 | 42(47.2) | 40(44.9) | ||
| 浸润深度 | 1.440 | 0.230 | ||
| Tis+T1+T2 | 8(9.0) | 4(4.5) | ||
| T3+T4 | 37(41.6) | 40(44.9) | ||
| 淋巴结转移1 | 0.001 | 0.976 | ||
| 无 | 30(33.7) | 19(21.3) | ||
| 有 | 24(27.0) | 15(16.9) | ||
| Dukes分期1 | 0.030 | 0.868 | ||
| A+B | 29(32.6) | 13(14.6) | ||
| C+D | 31(34.8) | 15(16.9) |
大肠癌发生发展的分子遗传学模式为腺瘤-癌序列, 在这一过程中存在一系列癌基因和抑癌基因的改变, 包括遗传学和表观遗传学改变. 整联蛋白是细胞表面的异二聚体蛋白家族里的一个成员, 他调节着细胞与细胞外基质、细胞与细胞之间的相互作用[30]. 整联蛋白α2β1也被称为血小板糖蛋白Ⅰa-Ⅱa(GPⅠa-Ⅱa), 他几乎表达于所有上皮细胞, 并且其在肿瘤细胞中的表达水平和肿瘤细胞的运动能力, 侵袭力和细胞分化相关.
ITGA2 C807T多态性被证实与整联蛋白α2β1的表达密切相关, 但其确切的机制仍然不清楚[31,32]. 该多态性位点位于第253位密码子, 是一个同义SNP位点, 其编码着苯丙氨酸, 位点突变并未引起编码的氨基酸改变, 也未引起整联蛋白的分子结构发生变化, 但其可能和某个未知的功能多态性连锁不平衡从而共同影响ITGA2的表达, 也可能是该位点多态性能影响ITGA2 mRNA的稳定性, 从而导致蛋白的表达量发生改变.
到目前为止, ITGA2 C807T基因多态性和癌症风险的相关性只有少量的报道, 尽管这些结果还不一致. Gerger等[24]发现ITGA2基因C807T多态性和结肠癌的低风险性相关(OR = 0.77, 95% CI; 0.64-0.94, P = 0.011). 他们的另外一项病例对照研究发现, 携带最常见的ITGA2基因单倍型(807C_1648G)的人群患乳腺癌的风险显著降低(OR = 0.72, 95%CI; 0.53-0.98)[22]. 然而, Ayala等[33]的研究却没有发现ITGA2基因C807T多态性和乳腺癌风险存在相关性. 一项基于中国人群的研究[23]发现, ITGA2 C807T多态性不仅增加胃癌风险, 而且与胃癌分化程度和侵袭有关.
基于以上这些研究, 我们进行了这项以医院为基础的病例对照研究, 我们发现本研究对照组突变T等位基因的频率为24.74%, 这和另外一项研究中中国台湾人群的频率(27.1%)相似[34], 也和HapMap数据库(http://snp.cshl.org/)提供的汉族人的频率(26.7%)相似, 表明我们研究的人群没有出现选择偏倚. 通过对基因型分布和疾病风险估计, 我们发现大肠癌组和对照组的基因型分布和等位基因频率具有统计学差异, 而大肠腺瘤组和对照组差异没有统计学意义. 风险评估发现突变纯合子TT并不能增加疾病风险, 而突变杂合子CT能显著增加疾病风险, 总体分析发现突变基因型(CT+TT)分别增加了51%和62%的患大肠腺瘤和大肠癌的风险. Gerger等[24]的研究却证实变异基因型能降低大肠癌的风险, 这与我们的研究结果相反, 其可能的原因是: 该研究是基于欧洲高加索人种的基础上, 而我们的研究是基于中国汉族人群的病例对照研究, 人种的差异可能存在基因差异, 从而导致研究结果不一致. 另一方面, 大部分大肠癌的遗传风险是通过腺瘤的易感性介导的, 所以该多态性变异基因型增加患大肠腺瘤的风险与此论点是一致的.
在亚组分析中, 我们发现此多态性增加大肠癌风险在女性受试者中有意义, 而在男性受试者中无意义. 这可能与女性受试者的雌激素水平相关, 也可能是由于样本量太少导致的. 同样的, 对吸烟和饮酒状态进行分层统计分析, 有统计学意义的相关性存在于吸烟和饮酒受试者, 而不是非吸烟和非饮酒受试者. 众所周知, 吸烟和饮酒能导致基因发生变异而导致某些疾病的发生[35], 所以我们假设受试者在持续的吸烟和饮酒状态下可能发生了某些基因的突变, 与ITGA2 C807T多态位点协同作用导致大肠癌风险增加. 我们也注意到在高学历、脑力劳动和城市受试者中, 该多态性能显著增加大肠癌的风险, 而在低学历、体力劳动和农村受试者中并没有发现. 高学历、脑力劳动和城市受试者的接触环境普遍较好, 而大肠癌是环境与遗传因素共同作用的结果, 当环境因素较好时遗传因素更容易凸显其作用[36], 我们的结论符合这个说法. 在所有亚组分析中, 我们并未发现变异基因型对大肠腺瘤的风险有影响.
除此之外, 我们还对大肠癌按病变部位、病例类型、肿瘤大小、分化程度、浸润深度、淋巴结转移和Dukes分期临床病理特征进行分层分析, 研究表明均未见ITGA2 C807T位点基因型分布存在显著性差异.
我们的研究表明在中国江西汉族人群中ITGA2 C807T多态性与增加大肠腺瘤和大肠癌风险相关. 特别是在女性组、吸烟者、饮酒者、高学历者、脑力劳动者和城市受试者中, 此多态性增加患大肠癌风险. 结果提示我们, 该多态性或许可以作为大肠腺瘤和大肠癌遗传易感性的分子诊断标志物. 但我们研究的样本量相对较小, 因此, 在分层分析中, 基因和环境的交互作用或许会被低估. 为了深入研究该多态性在大肠腺瘤和大肠癌的发生发展中的作用, 需要进一步的大样本研究和功能研究来阐明.
感谢邱萍、温志辉、付云辉、赖丽霞、徐林芳、唐琳、周珊、荣军、郭朝阳及周兴舰在本实验中给予的大力帮助.
大肠从正常黏膜到腺瘤, 再发展为进展期大肠癌, 为多步骤、多阶段的复杂进展过程. ITGA2 C807T影响着整联蛋白α2β1的表达量, 而α2β1的表达量和功能改变参与了大肠癌的发生发展和转移, 因此本文进行了一项基于中国人群的病例对照研究, 以明确ITGA2 C807T基因多态性与大肠腺瘤及大肠癌患病风险的相关性.
陈光, 教授, 吉林大学第一医院消化器官外科
本研究拟在考虑年龄、性别、身高、体质量、住址、教育程度、吸烟饮酒饮茶状态、高血压史、糖尿病史和家族史等条件下, 探讨ITGA2基因多态性与大肠腺瘤及大肠癌患病风险的相关性.
ITGA2基因C807T多态性和各种疾病都密切相关, 包括缺血性脑卒中、视网膜静脉闭塞、急性冠脉综合症、乳腺癌、胃癌.
利用聚合酶链反应-限制性片段长度多态性分析法, 首次探讨中国人群ITGA2基因多态性与大肠腺瘤以及大肠腺瘤恶变为大肠癌的关系.
此研究有助于在分子水平加深对大肠肿瘤发病机制的认识, 同时为探讨我国人群大肠腺瘤及大肠癌患病风险、大肠腺瘤转化为大肠癌的风险提供了新的遗传学证据和靶点, 并可将该基因作为筛选诊断大肠肿瘤高危人群或易感个体的分子标志物.
ITGA2 C807T: 人类整联蛋白α2亚单位基因(ITGA2)位于染色体5q11.2, 在该基因编码区的第7个外显子上807位核苷酸发现一个C到T的同义突变(NCBI SNP ID: rs1126643).
本文内容充实, 设计合理, 对临床研究有参考价值.
编辑: 郭鹏 电编: 都珍珍
| 1. | Muto T, Bussey HJ, Morson BC. The evolution of cancer of the colon and rectum. Cancer. 1975;36:2251-2270. [PubMed] |
| 2. | Meijer GA, Hermsen MA, Baak JP, van Diest PJ, Meuwissen SG, Beliën JA, Hoovers JM, Joenje H, Snijders PJ, Walboomers JM. Progression from colorectal adenoma to carcinoma is associated with non-random chromosomal gains as detected by comparative genomic hybridisation. J Clin Pathol. 1998;51:901-909. [PubMed] |
| 3. | Hermsen M, Postma C, Baak J, Weiss M, Rapallo A, Sciutto A, Roemen G, Arends JW, Williams R, Giaretti W. Colorectal adenoma to carcinoma progression follows multiple pathways of chromosomal instability. Gastroenterology. 2002;123:1109-1119. [PubMed] |
| 4. | Talieri M, Papadopoulou S, Scorilas A, Xynopoulos D, Arnogianaki N, Plataniotis G, Yotis J, Agnanti N. Cathepsin B and cathepsin D expression in the progression of colorectal adenoma to carcinoma. Cancer Lett. 2004;205:97-106. [PubMed] [DOI] |
| 5. | Sillars-Hardebol AH, Carvalho B, de Wit M, Postma C, Delis-van Diemen PM, Mongera S, Ylstra B, van de Wiel MA, Meijer GA, Fijneman RJ. Identification of key genes for carcinogenic pathways associated with colorectal adenoma-to-carcinoma progression. Tumour Biol. 2010;31:89-96. [PubMed] [DOI] |
| 6. | 吴 在德, 吴 肇汉. 外科学. 第7版. 北京: 人民卫生出版社 2010; 487-488. |
| 7. | Carvalho B, Sillars-Hardebol AH, Postma C, Mongera S, Terhaar Sive Droste J, Obulkasim A, van de Wiel M, van Criekinge W, Ylstra B, Fijneman RJ. Colorectal adenoma to carcinoma progression is accompanied by changes in gene expression associated with ageing, chromosomal instability, and fatty acid metabolism. Cell Oncol (Dordr). 2012;35:53-63. [PubMed] [DOI] |
| 8. | Choi JW, Liu H, Shin DH, Yu GI, Hwang JS, Kim ES, Yun JW. Proteomic and cytokine plasma biomarkers for predicting progression from colorectal adenoma to carcinoma in human patients. Proteomics. 2013;13:2361-2374. [PubMed] [DOI] |
| 9. | Parise LV, Lee J, Juliano RL. New aspects of integrin signaling in cancer. Semin Cancer Biol. 2000;10:407-414. [PubMed] [DOI] |
| 10. | Hood JD, Cheresh DA. Role of integrins in cell invasion and migration. Nat Rev Cancer. 2002;2:91-100. [PubMed] [DOI] |
| 11. | Zutter MM, Santoro SA. Widespread histologic distribution of the alpha 2 beta 1 integrin cell-surface collagen receptor. Am J Pathol. 1990;137:113-120. [PubMed] |
| 12. | Gui GP, Puddefoot JR, Vinson GP, Wells CA, Carpenter R. Altered cell-matrix contact: a prerequisite for breast cancer metastasis? Br J Cancer. 1997;75:623-633. [PubMed] |
| 13. | Felding-Habermann B, O'Toole TE, Smith JW, Fransvea E, Ruggeri ZM, Ginsberg MH, Hughes PE, Pampori N, Shattil SJ, Saven A. Integrin activation controls metastasis in human breast cancer. Proc Natl Acad Sci USA. 2001;98:1853-1858. [PubMed] [DOI] |
| 14. | Kirkland SC, Ying H. Alpha2beta1 integrin regulates lineage commitment in multipotent human colorectal cancer cells. J Biol Chem. 2008;283:27612-27619. [PubMed] [DOI] |
| 15. | Song J, Zhang J, Wang J, Cao Z, Wang J, Guo X, Dong W. β1 integrin modulates tumor growth and apoptosis of human colorectal cancer. Oncol Rep. 2014;32:302-308. [PubMed] [DOI] |
| 16. | Bartolomé RA, Barderas R, Torres S, Fernandez-Aceñero MJ, Mendes M, García-Foncillas J, Lopez-Lucendo M, Casal JI. Cadherin-17 interacts with α2β1 integrin to regulate cell proliferation and adhesion in colorectal cancer cells causing liver metastasis. Oncogene. 2014;33:1658-1669. [PubMed] [DOI] |
| 17. | Ferraro A, Boni T, Pintzas A. EZH2 regulates cofilin activity and colon cancer cell migration by targeting ITGA2 gene. PLoS One. 2014;9:e115276. [PubMed] [DOI] |
| 18. | Oh BY, Kim KH, Chung SS, Hong KS, Lee RA. Role of β1-Integrin in Colorectal Cancer: Case-Control Study. Ann Coloproctol. 2014;30:61-70. [PubMed] [DOI] |
| 19. | Song J, Zhang J, Wang J, Wang J, Guo X, Dong W. β1 integrin mediates colorectal cancer cell proliferation and migration through regulation of the Hedgehog pathway. Tumour Biol. 2015;36:2013-2021. [PubMed] [DOI] |
| 20. | Kritzik M, Savage B, Nugent DJ, Santoso S, Ruggeri ZM, Kunicki TJ. Nucleotide polymorphisms in the alpha2 gene define multiple alleles that are associated with differences in platelet alpha2 beta1 density. Blood. 1998;92:2382-2388. [PubMed] |
| 21. | Corral J, González-Conejero R, Rivera J, Ortuño F, Aparicio P, Vicente V. Role of the 807 C/T polymorphism of the alpha2 gene in platelet GP Ia collagen receptor expression and function--effect in thromboembolic diseases. Thromb Haemost. 1999;81:951-956. [PubMed] |
| 22. | Langsenlehner U, Renner W, Yazdani-Biuki B, Eder T, Wascher TC, Paulweber B, Clar H, Hofmann G, Samonigg H, Krippl P. Integrin alpha-2 and beta-3 gene polymorphisms and breast cancer risk. Breast Cancer Res Treat. 2006;97:67-72. [PubMed] [DOI] |
| 23. | Chen J, Liu NN, Li JQ, Yang L, Zeng Y, Zhao XM, Xu LL, Luo X, Wang B, Wang XR. Association between ITGA2 C807T polymorphism and gastric cancer risk. World J Gastroenterol. 2011;17:2860-2866. [PubMed] [DOI] |
| 24. | Gerger A, Hofmann G, Langsenlehner U, Renner W, Weitzer W, Wehrschütz M, Wascher T, Samonigg H, Krippl P. Integrin alpha-2 and beta-3 gene polymorphisms and colorectal cancer risk. Int J Colorectal Dis. 2009;24:159-163. [PubMed] [DOI] |
| 25. | Carvajal-Carmona LG, Zauber AG, Jones AM, Howarth K, Wang J, Cheng T, Riddell R, Lanas A, Morton D, Bertagnolli MM. Much of the genetic risk of colorectal cancer is likely to be mediated through susceptibility to adenomas. Gastroenterology. 2013;144:53-55. [PubMed] [DOI] |
| 27. | Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol. 2010;17:1471-1474. [PubMed] [DOI] |
| 29. | Li ZS, Li Q. [The latest 2010 WHO classification of tumors of digestive system]. Zhonghua Binglixue Zazhi. 2011;40:351-354. [PubMed] |
| 30. | Thomas GJ, Nyström ML, Marshall JF. Alphavbeta6 integrin in wound healing and cancer of the oral cavity. J Oral Pathol Med. 2006;35:1-10. [PubMed] [DOI] |
| 31. | Matsuoka T, Hirakawa K, Chung YS, Yashiro M, Nishimura S, Sawada T, Saiki I, Sowa M. Adhesion polypeptides are useful for the prevention of peritoneal dissemination of gastric cancer. Clin Exp Metastasis. 1998;16:381-388. [PubMed] |
| 32. | Avraamides CJ, Garmy-Susini B, Varner JA. Integrins in angiogenesis and lymphangiogenesis. Nat Rev Cancer. 2008;8:604-617. [PubMed] [DOI] |
| 33. | Ayala F, Corral J, González-Conejero R, Sánchez I, Moraleda JM, Vicente V. Genetic polymorphisms of platelet adhesive molecules: association with breast cancer risk and clinical presentation. Breast Cancer Res Treat. 2003;80:145-154. [PubMed] |
| 34. | Chen CH, Lo YK, Ke D, Liu CK, Liou CW, Wu HL, Lai ML. Platelet glycoprotein Ia C807T, Ib C3550T, and IIIa Pl(A1/A2) polymorphisms and ischemic stroke in young Taiwanese. J Neurol Sci. 2004;227:1-5. [PubMed] [DOI] |
| 35. | Slattery ML, Potter JD, Friedman GD, Ma KN, Edwards S. Tobacco use and colon cancer. Int J Cancer. 1997;70:259-264. [PubMed] [DOI] |
| 36. | Hung RJ, Boffetta P, Brennan P, Malaveille C, Gelatti U, Placidi D, Carta A, Hautefeuille A, Porru S. Genetic polymorphisms of MPO, COMT, MnSOD, NQO1, interactions with environmental exposures and bladder cancer risk. Carcinogenesis. 2004;25:973-978. [PubMed] [DOI] |