修回日期: 2015-09-01
接受日期: 2015-09-07
在线出版日期: 2015-09-28
目的: 观察术前同步放化疗治疗及单纯手术治疗在Ⅱ/Ⅲ期中低位直肠癌患者中的临床疗效和安全性.
方法: 回顾性收集新疆医科大学附属肿瘤医院2008-01/2014-12收治的708例Ⅱ/Ⅲ期经病理证实的中低位直肠癌患者的临床资料, 其中术前同步放化疗组211例, 单纯手术组497例. 术前同步放化疗组给予术前放疗(50 Gy/25次, 共5 wk), 并根据化疗方案的不同分为A(放疗+奥沙利铂+卡培他滨)、B(放疗+奥沙利铂+亚叶酸钙+5-氟尿嘧啶)、C(放疗+单药卡培他滨)3组, 手术组直接行手术治疗, 两组均遵循全直肠系膜切除术(total mesorectal excision, TME)原则. 分析不同治疗模式与预后之间的关系.
结果: 183例患者术前同步放化疗治疗后排便困难、便血、排便次数增多等症状得以改善, 占86.73%; 其中30例因个人原因未行手术; 其余181例患者均行根治性切除术(R0), 实际保肛率60.77%(110/181), 与单纯手术组相比差异有明显统计学意义(χ2 = 40.1, P = 0.000); 19例术后病理未查见肿瘤细胞, 为病理消退(pCR), 总消退率为10.5%(19/181). 原发肿瘤T分期、N分期及TNM分期的降期率分别为49.76%(105/211)、82.93%(175/211)和50.03%(114/211). 两组术后中位生存期分别为49 mo和37 mo. 同步放化疗组5年总生存率为63.98%, 显著高于单纯手术组的51.51%(χ2 = 70.65, P = 0.000); 远处转移率(包括局部复发加远处转移)同步放化疗组为46.6%, 明显低于单纯手术组的56.9%, 两组相比差异明显有统计学意义(χ2 = 91.46, P = 0.000). A、B、C 3组的5年生存率分别为A: 80.95%; B: 71.43%; C: 73.24%, 3组之间的差异有统计学意义(P<0.05). 急性不良反应多为1、2级, 伤口愈合延迟、术后肠梗阻及吻合口瘘发生率低. 2例患者术前同步放化疗治疗后, 术前检查时发现疾病进展, 病期由Ⅲ期进展为Ⅳ期, 但无1例患者发生围手术期死亡.
结论: 术前同步放化疗能明显降低肿瘤分期、提高手术保肛率, 降低局部复发及远处转移率, 提高患者生存率, 不良反应及术后并发症较小, 大多数患者可耐受. 术前同步放化疗组中, A组的5年总体生存率要优于B组和C组.
核心提示: Ⅱ/Ⅲ期中、低位直肠癌先行术前同步放化疗后再行手术治疗, 患者的总生存率及预后较单纯手术患者要好.
引文著录: 张梦, 吾尔满, 阿合力, 刘莹, 孟涛, 成芳. Ⅱ/Ⅲ期中低位直肠癌术前同步放化疗的临床疗效评价. 世界华人消化杂志 2015; 23(27): 4350-4357
Revised: September 1, 2015
Accepted: September 7, 2015
Published online: September 28, 2015
AIM: To evaluate the efficiency and safety of preoperative concurrent chemoradiotherapy in patients with stage Ⅱ-Ⅲ mid-low rectal cancer.
METHODS: The clinical data of 708 patients with stage Ⅱ-Ⅲ mid-low rectal cancer treated at the Affiliated Tumor Hospital of Xinjiang Medical University from January 2008 to December 2014, including 211 patients who received preoperative concurrent chemoradiotherapy plus surgery and 497 patients who received surgery alone, were analyzed retrospectively. Intensity-modulated radiation therapy (IMRT) or conformal radiation therapy (50 Gy/25 fractions, a total of 5 wk) was given. Three different chemotherapy regimens were used: oxaliplatin plus capecitabine (group A), oxaliplatin plus calcium folinate plus 5-fluorouridine (group B), and capecitabine alone (group C). Both groups received total mesorectal excision (TME). The efficacy, safety and prognosis were compared in different groups.
RESULTS: After preoperative concurrent chemoradiotherapy, symptoms such as bowel problems, bloody stool, and stool frequency were improved in 183 (86.73%) patients. Thirty patients did not receive surgery because of personal reasons, and 181 cases recevied radical surgery. The rate of sphincter preservation was 60.77% (110/181), which was significantly higher than that in patients receiving surgery alone (χ2 = 40.1, P = 0.000). Nineteen cases had no tumor cells as revealed by postoperative pathology, which suggested a pathological complete response (pCR) rate of 10.5% (19/181).The rates of pathological down-staging for the primary tumor, lymph nodes and clinical stage were 49.76% (105/211), 82.93% (175/211) and 50.03% (114/211), respectively. The median survival for the two groups was 49 mo and 37 mo, respectively. The 5-year survival rate was significantly higher in the preoperative chemoradiotherapy plus surgery group than in the surgery alone group (63.98% vs 51.51%, χ2 = 70.65, P = 0.000). The distant metastasis rate (including local recurrence plus distant metastases) were 46.6% and 56.9%, respectively, which were significantly different between the two groups (χ2 = 91.46, P = 0.000). The 5-year survival rates of groups A, B and C were 80.95%, 71.43% and 73.24%, respectively, and there were significant differences in the three groups (P < 0.05). Acute adverse reactions were mostly grade 1 or 2. The incidence rates of delayed wound healing, postoperative ileus and anastigmatic leakage were low. After preoperative concurrent chemoradiotherapy, the stage of two patients progressed from Ⅲ to Ⅳ, but no one died during the preoperative period.
CONCLUSION: Preoperative concurrent chemotherapy can significantly reduce the stage of tumor, increase the rate of sphincter preservation, reduce local recurrence and distant metastasis, and improve survival in patients with stage Ⅱ-Ⅲ mid-low rectal cancer. The incidence of adverse reactions and complications is relatively low, and most patients could tolerate. Different preoperative chemotherapy regimens are associated with different 5-year survival rates.
- Citation: Zhang M, Wu EM, A HL, Liu Y, Meng T, Cheng F. Efficacy of preoperative chemoradiotherapy in patients with stage Ⅱ-Ⅲ mid-low rectal cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(27): 4350-4357
- URL: https://www.wjgnet.com/1009-3079/full/v23/i27/4350.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i27.4350
直肠癌是消化系最常见的恶性肿瘤之一, 其发病率呈逐年递增的趋势. 有资料显示我国以中低位直肠癌最为多见, 占全部直肠癌的80%以上[1]. Ⅱ/Ⅲ期中低位直肠癌的临床治疗, 首选的仍是外科手术. 但是, 单纯性的手术治疗效果往往不佳, 根治性切除率低, 术后局部复发率高, 部分患者不能保肛而行造瘘术, 致使患者生活质量大为下降. 近年来, 术前同步放化疗在Ⅱ/Ⅲ期中、低位直肠癌中的疗效已成为研究热点, 并且术前同步放化疗能提高Ⅱ/Ⅲ期中、低位直肠癌的保肛率, 降低局部区域复发率, 并能显著提高远期生存率, 已成为Ⅱ/Ⅲ期直肠癌的标准治疗手段[2]. 目前, 临床上针对中、低位直肠癌术前同步放化疗方案尚未有统一规定, 其中以5-氟尿嘧啶(5-fluorouridine, 5-Fu)为基础的联合化疗方案较为常见. 随着新药如卡培他滨、雷替曲塞、奥沙利铂和伊立替康等的问世, 术前同步放化疗方案也有不同的组合. 本研究旨在通过对Ⅱ/Ⅲ期中、低位直肠癌患者术前行同步放化疗后, 观察其对肿瘤的分期、保肛率和生存率的影响, 并比较放疗同步联合不同化疗药物用于治疗Ⅱ/Ⅲ期中、低位直肠癌患者的临床疗效和安全性.
收集整理2008-01/2014-12新疆医科大学附属肿瘤医院收治的经病理诊断明确并顺利完成术前同步放化疗和/或全直肠系膜切除术(total mesorectal excision, TME)的708例Ⅱ/Ⅲ期中、低位直肠癌患者的临床资料. 其中, 术前同步放化疗组211例, 男性127例, 女性84例; 汉族167例, 少数民族44例; 年龄19-81岁, 中位年龄59.4岁; 根据国际抗癌联盟(Union for International Cancer Control, UICC)分期:Ⅱ期35例、Ⅲ期176例; 腺癌193例、管状腺癌1例、印戒细胞癌1例、黏液腺癌16例. 单纯手术组497例, 其中男性293例, 女性204例; 汉族421例, 少数民族76例; 年龄15-79岁, 中位年龄59.4岁; UICC分期: Ⅱ期114例、Ⅲ期383例; 腺癌447例、管状腺癌3例、印戒细胞癌3例、黏液腺癌44例. 两入组患者基线具有可比性(P>0.05)(表1). 全部患者术前放化疗及手术均经患者同意并签署知情同意书. 卡培他滨片, 500 mg×12片, 批号: 15052956; 奥沙利铂, 50 mg/支, 批号: 15041415; 亚叶酸钙100 mg/支, 批号: 15030417, 江苏恒瑞医药股份有限公司. 氟尿嘧啶, 10 mL: 0.25 g, 批号: FA150606, 上海旭东海普药业有限公司.
| 项目 | 术前同步放化疗组 | 单纯手术组 | χ2值 | P值 |
| n | 211 | 497 | - | - |
| 性别 | 0.20 | >0.05 | ||
| 男 | 127 | 293 | ||
| 女 | 84 | 204 | ||
| 中位年龄(岁) | 59.373 | 59.421 | 65.83 | >0.05 |
| 民族 | 3.21 | >0.05 | ||
| 汉族 | 167 | 421 | ||
| 少数民族 | 44 | 76 | ||
| 术前临床分期 | 3.59 | >0.05 | ||
| Ⅱ期 | 35 | 114 | ||
| Ⅲ期 | 176 | 383 | ||
| 距齿状线距离(cm) | 1.32 | >0.05 | ||
| ≤5 | 93 | 196 | ||
| 5-10 | 118 | 301 | ||
| 分化程度 | 5.66 | >0.05 | ||
| 高分化 | 4 | 22 | ||
| 中分化 | 201 | 447 | ||
| 低分化 | 6 | 28 | ||
| 病理分型 | 2.46 | >0.05 | ||
| 腺癌 | 193 | 447 | ||
| 管状腺癌 | 1 | 3 | ||
| 印戒细胞癌 | 1 | 3 | ||
| 黏液腺癌 | 16 | 44 |
1.2.1 放疗: 采用Philips Brilliance大孔径螺旋计算机断层扫描(computed tomography, CT)进行模拟定位. 将CT图像传输至治疗计划系统, 靶区和保护器官由2名以上医师(至少1名主任医师)共同勾画. 采用23EX或600CD直线加速器进行5-7野的术前放疗, 总剂量50 Gy, 2 Gy/次, 5次/wk, 共25次完成. 照射野肉眼肿瘤靶区(gross tumor volume, GTV)包括直肠肿瘤和周围筋膜内组织及转移的淋巴结, 临床靶区(clinical target volume, CTV)包括肿瘤原发灶和淋巴引流区. 计划靶区(planning target volume, PTV)为CTV外扩0.5-1.0 cm. 靶区上界在LS-S1椎体间, 下界至闭孔下缘或肛门边缘. 95%等剂量曲线包括PTV, 危及器管(organs at risk, OARs)剂量限定为双侧股骨头V50<5%、膀胱V30<50%、小肠V50<5%.
1.2.2 同步化疗: A组(Xelox方案): 同期化疗卡培他滨片1000 mg/m2 bid d1-14、d22-35+奥沙利铂130 mg/m2 d1、d22; B组(Folfox方案): 奥沙利铂85 mg/m2, d1、d22; 亚叶酸钙400 mg/m2, d1-5, d22-26; 氟尿嘧啶400 mg/m2, d1-5, d22-26; C组(capecitabine): 同期口服卡培他滨片化疗825 mg/m2 bid, 与放疗同步; 在治疗过程中, 一旦出现3-4级血液学毒性或手足综合征, 处理正常后卡培他滨改为原剂量的75%后继续治疗.
1.2.3 手术治疗: 所有手术患者均完成同步放化疗后行手术治疗或直接行手术治疗. 手术均在全麻下行TME, 手术方式包括低位或超低位经腹前切除术(low anterior resection, LAR)和腹会阴联合切除术(abdominal perineal resection, APR). 术前同步放化疗组所有病例在治疗结束4-6 wk后由胃肠外科医师评估后再行手术治疗.
1.2.4 疗效和不良反应评价标准: 临床和病理分期标准以2002年国际抗癌联盟TNM分期为准. 直肠肿块和淋巴结转移情况术前根据B超、CT、核磁、直肠镜、肛门指检等来进行判定. 术后根据美国癌症委员会病理肿瘤分期指南对切除的肿瘤标本进行评估[3], 根据美国国立癌症研究所常见不良反应标准(3.0版)和美国放疗肿瘤组织或欧洲癌症研究与治疗组织急性放射反应评估标准将不良反应分为4级.
1.2.5 随访: 术后第1-2年内每3 mo复查1次, 第3-5年内每6 mo复查1次, 5年以后每1年复查1次. 复查内容包括胸部X线片, 腹部B超、血癌胚抗原(carcino embryonic antigen, CEA), 肠镜, 增强CT, 全身骨扫描等, 复查项目中如有异常, 完善检查以明确是否有复发转移. 所有病例均通过入院复查, 定期门诊及电话随访的方式来完成随访, 研究截止至2015-01或患者死亡. 总随访时间为1-84 mo, 中位随访时间为42 mo, 失访病例21例, 随访率为97.03%, 失访病例按截尾数据处理.
统计学处理 应用SPSS17.0统计软件进行统计分析, 计数资料的比较采用χ2检验, 生存率的计算采用Kaplan-Meier, 生存率比较采用Log-rank检验, 并用Cox模型对预后的影响因素进行多因素分析, P<0.05为差异具有统计学意义.
术前同步放化疗的不良反应主要为骨髓抑制、恶心、呕吐、腹泻、放射性皮肤反应、放射性膀胱炎、手足综合征等, 占44.1%(93/211). 其中, 治疗过程中, 发生Ⅲ-Ⅳ级不良反应的患者有12例, 占5.7%(12/211). 无1例患者因术前同步放化疗不良反应而停止行手术或死亡. 211例患者经同步放化疗后, 其中183例患者主观的排便困难、便血、排便次数增多等症状较前好转, 占86.73%(183/211). 经直肠指检、盆腔CT或磁共振成像(magnetic resonance imaging, MRI)等一系列检查, 对肿瘤分期进行评估, 治疗前后TNM分期、T分期和N分期进行比较, 肿瘤明显降期, 差异有统计学意义(χ2 = 4.4, P<0.05; χ2 = 4.9, P<0.05; χ2 = 6.1, P<0.05)(表2).
| 项目 | 治疗前 | 治疗后 | χ2值 | P值 |
| n | 211 | 211 | - | - |
| T0N0M0 | 0 | 29 | 4.4 | <0.05 |
| Ⅰ期 | 0 | 27 | ||
| Ⅱ期 | 11 | 58 | ||
| Ⅲ期 | 200 | 95 | ||
| Ⅳ期 | 0 | 2 | ||
| T0 | 0 | 29 | 4.9 | <0.05 |
| T1 | 0 | 6 | ||
| T2 | 0 | 27 | ||
| T3 | 38 | 56 | ||
| T4 | 173 | 93 | ||
| N0 | 11 | 139 | 6.1 | <0.05 |
| N1 | 86 | 36 | ||
| N2 | 114 | 36 |
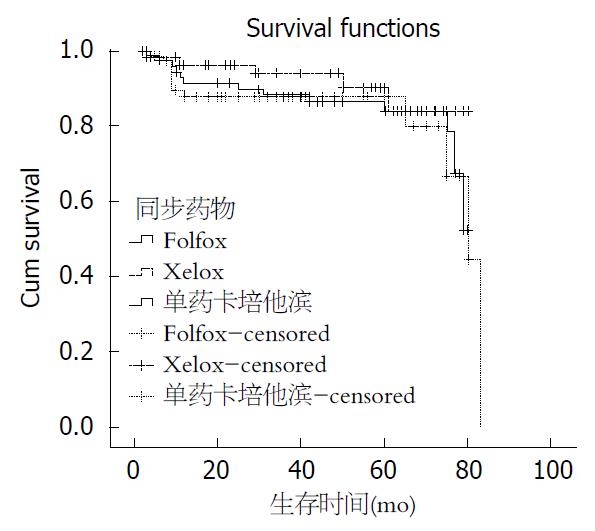
本研究中, 术前同步放化疗组根据同步药物的不同分为A(放疗+Xelox)、B(放疗+Folfox)、C(capecitabine)3个组. 3组之间T降期与N降期均有明显的统计学差异(P值均<0.05), 且对A、B、C 3组患者的资料应用Kaplan-Meier法进行生存曲线的比较, 提示A组总的生存率要高于B、C两组, 结果如表3和图1.
| 项目 | A组 | B组 | C组 | χ2值 | P值 |
| n | 84 | 56 | 71 | - | - |
| T降期 | 50 | 9 | 22 | 6.98 | <0.05 |
| N降期 | 70 | 45 | 38 | 9.72 | <0.05 |
| 1年总生存率n(%) | 73(86.90) | 42(75.00) | 57(80.28) | 10.26 | <0.05 |
| 3年总生存率n(%) | 69(82.14) | 41(73.21) | 55(77.46) | 13.48 | <0.05 |
| 5年总生存率n(%) | 68(80.95) | 40(71.43) | 52(73.24) | 13.39 | <0.05 |
同步放化疗组181例患者行手术治疗, 其中LAR术110例(60.8%)、APR术71例(39.2%); 手术组患者LAR术269例(54.1%)、APR术228例(45.9%). 放化疗组共25例(11.8%)(感染5例、消化道反应1例、吻合口瘘16例、术后肠梗阻2例、切口延迟愈合1例)患者发生术后并发症, 手术组共47例(9.5%)(感染15例、消化道反应2例、吻合口瘘18例、术后肠梗阻9例、切口延迟愈合3例)患者发生术后并发症, 两组患者之间出现术后并发症差异无明显的统计学意义(χ2 = 0.93, P>0.05).
术前同步放化疗组211例中181例(85.8%)行手术治疗, 对照组497例患者全部(100%)进行手术切除, 同步放化疗组110例(60.8%)行保肛手术, 手术组269例(54.1%)行保肛手术, 同步放化疗组的保肛率明显高于手术组(χ2 = 40.1, P<0.05), 两组在总生存率、无瘤生存率及复发转移率之间也有明显的统计学差异(均P<0.05, 表4).
| 项目 | 术前同步放化疗组 | 单纯手术组 | χ2值 | P值 |
| n | 181 | 497 | - | - |
| 保肛率 | 110/181 | 269/497 | 40.10 | 0.000 |
| 5年总生存率n(%) | 135(63.9) | 256(51.5) | 70.65 | 0.000 |
| 5年无瘤生存率n(%) | 122(57.7) | 209(42.1) | 1.07 | 0.000 |
| 5年复发转移n(%) | 98(46.6) | 283(56.9) | 91.46 | 0.000 |
我们将影响两组总生存率的多种影响因素如性别、民族、年龄、体质量指数(body mass index, BMI)、肿瘤距齿状线距离、病理类型、分化程度、肿瘤占肠周值、肿瘤侵犯深度、脉管是否受侵、是否同步放化治疗、同步药物、是否手术、手术方式、淋巴结个数、临床分期、术后是否化疗以及化疗方式等18个因素进行多因素分析, 得出性别、年龄、民族、BMI、肿瘤距齿状线距离、同步药物以及手术方式等因素均对生存的影响不明显(P>0.05), 而分化程度、肿瘤占肠周值、肿瘤侵犯深度、脉管受侵、同步放化疗、是否手术、淋巴结、术后是否化疗以及临床分期等因素则被证实是影响直肠癌患者预后的危险因素(P<0.05)(表5).
| 因素 | B | SE | χ2值 | P值 | RR | 95%CI |
| 性别 | 0.168 | 0.143 | 1.386 | 0.239 | 1.183 | 0.894-1.565 |
| 民族 | -0.060 | 0.184 | 0.105 | 0.746 | 0.942 | 0.657-1.350 |
| 年龄 | -0.045 | 0.138 | 0.138 | 0.746 | 0.956 | 0.729-1.254 |
| 体质量指数 | -0.030 | 0.084 | 0.123 | 0.726 | 0.971 | 0.823-1.145 |
| 距齿状线距离 | -0.111 | 0.144 | 0.591 | 0.442 | 0.895 | 0.675-1.187 |
| 病理类型 | 0.474 | 0.166 | 1.963 | 0.161 | 1.261 | 0.912-1.745 |
| 分化程度 | 0.232 | 0.210 | 5.071 | 0.024 | 1.606 | 1.063-2.427 |
| 肿瘤占肠周值 | 0.802 | 0.226 | 12.638 | 0.002 | 2.230 | 1.433-3.470 |
| 肿瘤侵犯深度 | 0.594 | 0.773 | 11.754 | 0.001 | 1.811 | 1.290-2.543 |
| 脉管受侵 | 0.549 | 0.279 | 3.863 | 0.044 | 1.732 | 1.002-2.995 |
| 同步放化疗 | -0.760 | 0.299 | 6.442 | 0.011 | 0.468 | 0.260-0.841 |
| 同步药物 | 0.073 | 0.085 | 0.728 | 0.393 | 1.075 | 0.910-1.271 |
| 是否手术 | 2.689 | 1.187 | 5.132 | 0.023 | 4.712 | 1.437-3.629 |
| 手术方式 | 0.031 | 0.037 | 0.663 | 0.416 | 1.031 | 0.958-1.110 |
| 淋巴结 | 18.060 | 0.000 | ||||
| 淋巴结(1-3枚) | 1.211 | 0.289 | 17.526 | 0.000 | 3.356 | 1.904-5.915 |
| 淋巴结(≥4枚) | 0.567 | 272.000 | 4.360 | 0.037 | 1.763 | 1.035-3.002 |
| 临床分期 | 14.092 | 0.007 | ||||
| 临床分期(Ⅰ期) | 2.263 | 1.081 | 4.386 | 0.036 | 9.611 | 1.156-79.895 |
| 临床分期(Ⅱ期) | 2.120 | 1.071 | 3.916 | 0.048 | 8.331 | 1.020-68.017 |
| 临床分期(Ⅲ期) | 2.808 | 1.086 | 6.682 | 0.010 | 16.584 | 1.972-139.478 |
| 临床分期(Ⅳ期) | 3.247 | 1.475 | 4.848 | 0.028 | 25.706 | 1.428-462.633 |
| 术后化疗 | -0.806 | 0.100 | 8.237 | 0.004 | 1.332 | 1.095-1.619 |
| 化疗方式 | 0.073 | 0.085 | 0.728 | 0.393 | 1.075 | 0.910-1.271 |
直肠癌是常见的消化系肿瘤, 其发病率也在逐年上升. 在我国直肠癌的发病率仅次于胃癌、食管癌. 根据肿瘤下缘距齿状线的距离可将直肠癌分为低位直肠癌、中位直肠癌和高位直肠癌, 距离齿状线的距离分别<5、5-10和>10 cm. 我国绝大多数的直肠癌为中、低位直肠癌, 占全部直肠癌的75%. 从解剖学上来看, 直肠在盆腔腹膜返折水平以下的部位无腹膜覆盖, 且位置固定, 由此决定了中下段直肠肿瘤更易于向周围组织局部浸润扩散, 因此中、低位直肠癌具有较高的局部复发及远处转移风险. 目前Ⅱ/Ⅲ期中、低位直肠癌的临床治疗, 仍以外科手术为首选, 但要遵循在尽量完全切除原发肿瘤和区域淋巴结的基础上争取行"保肛手术"的原则, 以提高患者的生存质量[4]. 但是, 单纯性的手术治疗效果往往不佳, 根治性切除率低, 术后局部复发率高, 部分患者不能保肛而行造瘘术, 以致患者生存质量大为下降. 直肠癌新辅助治疗是20世纪80年代提出的一种新型辅助治疗手段, 是通过术前放、化疗而实现肿瘤降期、减少复发、提高保肛率的有效手段[5]. 而术前同步放化疗是新辅助治疗的方式之一. 美国国家综合癌症网(National Comprehensive Cancer Network, NCCN)指南推荐, 术前同期放化疗+手术+术后辅助化疗是局部晚期直肠癌患者的标准治疗模式[6]. 新辅助放化疗可以降低肿瘤分期, 缩小体积, 提高肿瘤根治性切除率和保肛率[7], 因此, 在对Ⅱ/Ⅲ期中、低位直肠癌进行治疗时, 在确保疗效的前提下, 尽可能地保留肛门括约肌的功能, 有效提高患者的生存质量. 与单纯手术治疗相比, 术前同步放化疗更具有优势: (1)术前肿瘤周围血运未破坏, 照射野组织氧含量较好, 对放射线更敏感; (2)术前同步放化疗可明显缩小肿瘤体积, 降低手术难度, 提高手术切除率, 降低肿瘤分期, 同时还能提高保肛率; (3)放疗属于局部治疗, 对远处微小转移灶无杀伤作用, 但若同步联合化疗, 可对微小转移灶有一定的杀伤作用, 从而降低术后远处转移率. (4)术前同步放化疗可以避免因术后瘢痕及血管供应的改变而使化疗药物在杀伤原发肿瘤细胞时药物浓度有所降低[8]. 刘秀兰等[9]报道, Ⅱ/Ⅲ期中、低位直肠癌行术前同步放化疗, 术后保肛率为63.7%, 同等条件的患者直接手术治疗, 保肛率为24.7%, 前者明显优于后者. 本研究的术前放化疗组和手术组保肛率分别为54.1%和60.8%, 与文献报道不尽相同, 考虑可能与本研究所纳入病例中的中、位直肠癌患者所占比例较高有关, 为60.6%(301/497).
直肠癌患者经过术前同步放化疗后, 瘤体组织发生变性、坏死、纤维化等继发改变, 肿瘤细胞活性大大下降, 术后病理甚至未查见癌细胞, 仅见纤维组织, 即pCR, 本研究的pCR率为10.5%(19/181). 211例Ⅱ/Ⅲ期中、低位直肠癌患者术前同步放化疗后, 总的降期率为55%, T分期、N分期与术前比较降期也较明显, 与国外研究报道的术前同步放化疗结果基本一致[10,11]. 本组211例术前同步放化疗患者仅181例完成手术治疗, 术后并发症累计发生率为11.8%, 且未增加手术的难度及并发症, 同国内学者徐徕等[12]的报道的结论相近.
目前术前放疗同步联合以5-Fu为基础的化疗在治疗Ⅱ/Ⅲ期中、低位直肠癌患者中较常见, 而直肠癌放疗已从常规放疗发展到精确放疗阶段, 而三维调强适形放疗作为近几年发展的一种新技术, 通过采用共面或非共面进行照射, 在肿瘤靶区受到根治剂量照射的同时, 周围敏感器官仅会受到可耐受的低剂量照射, 可以最大程度的保护正常组织免受放射损伤[13]. 在新药卡培他滨应用临床之前, 新疆医科大学附属肿瘤医院术前放疗多同步联合Folfox方案, 但持续静脉滴注5-Fu给患者带来穿刺所有的并发症如感染、血栓以及静脉炎等, 而卡培他滨是一种口服氟嘧啶氨基甲酸酯类药物, 其本身无抗肿瘤作用, 可在具有高胸腺磷酸化酶活性的肿瘤细胞内转化为具有抗肿瘤活性的5-Fu, 发挥抗肿瘤作用, 从而最大程度地降低了5-Fu对人体细胞的损害, 患者顺应性好[14]. 本研究结果显示, 在Ⅱ/Ⅲ期中、低位直肠癌的治疗中, 3种术前同步放化疗模式的1、3、5总体生存率有统计学差异, 术前放疗联合Xelox方案组的5年总体生存率要优于联合单药卡培他滨组和Folfox组. 口服卡培他滨化疗虽然方便, 且患者顺应性高, 并可以避免持续滴注5-Fu的不便和穿刺风险, 但远期疗效欠佳; 放疗同步联合卡培他滨组于联合Folfox组相比, 虽然两组疗效比较有显著性差异, 但本研究所得5年生存率前者仅稍高于后者(73.2% vs 71.4%), 故在临床应用时, 若患者体质弱, 不能耐受静脉穿刺的并发症, 可考虑放疗同步联合口服卡培他滨.
目前术前同步放化疗已成为Ⅱ/Ⅲ期直肠癌患者的标准治疗方案, van Gijn等[15]回顾性的研究了行术前同步放化疗和单纯性TME手术治疗的患者的临床资料及随访结果, 显示与单纯手术相比, 术前同步放化疗可明显减低Ⅱ/Ⅲ期直肠癌患者的局部复发率和远处转移率. 黄蓉等[7]的报道术前同步放化疗后手术治疗的除了有较低的局部复发和远处转移率(23.3%)外, 5年总生存率和无瘤生存率也均有优势(分别为76.6%、72.1%), 均高于与本研究结果: 5年总生存率为63.9%, 5年无瘤生存率为57.7%, 考虑与本研究所纳入Ⅲ期病例较多有关, 占术前同步放化疗组的94.8%(200/211), 但本研究数据分析显示, 与单纯手术组相比, 术前同步放化疗组的远期疗效要优于单纯手术组. 本组多因素分析发现分化程度、肿瘤占肠周值、肿瘤侵犯深度、脉管受侵、同步放化疗、是否手术、淋巴结、术后是否化疗以及临床分期等因素均是预后的影响因素. 因此, 加强术前同步放化疗强度可提高降期率, 并根据术后病理分期选择性辅助化疗, 可降低局部复发及远处转移风险, 从而改善患者预后.
本研究的缺陷在于: (1)术前同步放化疗组的病例数较少, 需进一步扩大样本量以验证结果; (2)随访时间相对较短, 需随访更长时间以了解远期疗效; (3)本研究同步放化疗组中, 有2例患者在治疗结束行术前检查时发现远处转移, 提示每个患者对放、化疗的敏感性不尽相同.在直肠癌的综合治疗中, 要实行个体化治疗,寻求更优的治疗方案. 若能结合有效的放、化疗敏感性的分子预测加以评估, 则可能尽量避免延误那些对放、化疗敏感性差的患者的治疗时机.
中低位直肠癌在我国占结直肠癌患者中的80%以上, 尤其是Ⅱ/Ⅲ期中低位直肠癌患者, 单纯手术往往效果欠佳, 复发转移率较高, 患者保肛率低, 严重影响患者生活质量.
肖秀英, 副主任医师, 上海交通大学医学院附属仁济医院
术前同步放化疗治疗已成为Ⅱ/Ⅲ期中低位直肠癌治疗的标准治疗方式, 但个体化的治疗更为重要, 因此, 寻求实用且对患者治疗有效的治疗方案就显得尤为重要.
黄蓉等收集了291例局部进展期(Ⅱ/Ⅲ期)直肠癌术前新辅助放化疗的病例, 通过对不同的治疗模式与预后的研究, 得出术前新辅助放化疗提高了局部进展期直肠癌的R0切除率及保肛率, 并使肿瘤显著降期, 不良反应较轻且未增加手术并发症, 局部复发率低且远期生存率得到改善. 该研究样本量大, 设计严谨, 结论较肯定.
国内目前尚未有大样本的文献报道新疆地区术前同步放化的疗效评价的研究. 本文通过研究目前新疆地区Ⅱ/Ⅲ期中低位直肠癌术前常用的几种同步放化疗的治疗方案, 来评价针对新疆地区的人群, 何种治疗方案最优.
在术前同步放化疗治疗的过程中方案较多, 但如何选择一个对不同患者治疗敏感的方案较困难. 本研究通过分析发现, 近几年, 新疆地区常用的术前同步放化疗方案以放疗联合"Xelox"效果较好, 并且未来亟待开展大样本, 多种性的研究来进一步探讨不同治疗方式的疗效.
Ⅱ/Ⅲ期中低位直肠癌术前同步放化疗的临床疗效评价一文, 总体上, 思路清晰, 有一定的创新性, 研究内容新颖, 代表新疆地区直肠目前治疗水平及疗效, 得出结论的证据充分.
编辑: 郭鹏 电编: 都珍珍
| 3. | Greene FL, Page DL, Flemnig ID, Fritz A, Balch CM, Haller DG, Morrow M. American Jonit Committee on Caneer: AJCC Caneer Staging Manual. 6th ed, NewYork: Springer 2002; 157-164. |
| 6. | Engstrom PF, Arnoletti JP, Benson AB, Chen YJ, Choti MA, Cooper HS, Covey A, Dilawari RA, Early DS, Enzinger PC. NCCN Clinical Practice Guidelines in Oncology: rectal cancer. J Natl Compr Canc Netw. 2009;7:838-881. [PubMed] |
| 7. | 黄 蓉, 张 路柠, 肖 巍魏, 陈 利, 曾 智帆, 丁 培荣, 高 远红, 陈 功, 潘 志忠, 刘 孟忠. 291例局部进展期直肠癌术前新辅助放化疗的临床意义分析. 中华放射肿瘤学杂志. 2015;24:143-148. |
| 10. | Beddy D, Hyland JM, Winter DC, Lim C, White A, Moriarty M, Armstrong J, Fennelly D, Gibbons D, Sheahan K. A simplified tumor regression grade correlates with survival in locally advanced rectal carcinoma treated with neoadjuvant chemoradiotherapy. Ann Surg Oncol. 2008;15:3471-3477. [PubMed] [DOI] |
| 11. | Sauer R, Liersch T, Merkel S, Fietkau R, Hohenberger W, Hess C, Becker H, Raab HR, Villanueva MT, Witzigmann H. Preoperative versus postoperative chemoradiotherapy for locally advanced rectal cancer: results of the German CAO/ARO/AIO-94 randomized phase III trial after a median follow-up of 11 years. J Clin Oncol. 2012;30:1926-1933. [PubMed] [DOI] |
| 14. | Gérard JP, Azria D, Gourgou-Bourgade S, Martel-Lafay I, Hennequin C, Etienne PL, Vendrely V, François E, de La Roche G, Bouché O. Clinical outcome of the ACCORD 12/0405 PRODIGE 2 randomized trial in rectal cancer. J Clin Oncol. 2012;30:4558-4565. [PubMed] [DOI] |
| 15. | van Gijn W, Marijnen CA, Nagtegaal ID, Kranenbarg EM, Putter H, Wiggers T, Rutten HJ, Påhlman L, Glimelius B, van de Velde CJ. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer: 12-year follow-up of the multicentre, randomised controlled TME trial. Lancet Oncol. 2011;12:575-582. [PubMed] |