修回日期: 2015-07-02
接受日期: 2015-07-14
在线出版日期: 2015-09-18
目的: 建立大鼠回肠不完全性肠梗阻(incomplete intestinal obstruction, IIO), 探究白萝卜提取物(Raphanus sativus extract, Rex)对梗阻所致肠黏膜过氧化损伤的保护作用.
方法: SD大鼠随机分为正常组(A组, n = 14)、假手术组(B组, n = 14)、模型组(C组, n = 20)和治疗组(D组, n = 20). 采用末端回肠套环法建立IIO大鼠模型, 造模成功后, 每天D组灌胃Rex药汁(100 mg/kg), 其余各组灌胃等量生理盐水, 并分别于第5天、7天开腹分离腹主动脉, 取血3 mL用于超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)血清学测定, 取梗阻部位以上回肠组织4 cm行苏木精-伊红(HE)染色, 同时制备组织匀浆用于检测二胺氧化酶(diamine oxidase, DAO).
结果: 与B组比较, 5、7 d时, C组SOD活性和DAO含量均降低(P<0.05或P<0.01), 而MDA含量均显著升高(P<0.01), 肠黏膜损伤评分显著增加(P<0.01), 出现肠黏膜上皮细胞肿胀, 偶有坏死, 脱落, 黏膜下层、肌层及浆膜层明显瘀血, 并伴有炎细胞浸润; 与C组比较, D组给药Rex后, SOD活性升高(P<0.05或P<0.01), DAO含量显著增加(P<0.01), MDA含量显著降低(P<0.01), 黏膜损伤评分明显降低(P<0.01), 回肠黏膜破损, 炎细胞浸润及血管反应均明显减轻.
结论: Rex可以提高SOD活性, 降低MDA含量, 同时增加肠组织内DAO含量来减轻IIO对大鼠肠黏膜的过氧化损伤, 对肠黏膜具有保护作用.
核心提示: 食源性药物白萝卜提取物(Raphanus sativus extract)可以提高超氧化物歧化酶(superoxide dismutase)活性, 降低丙二醛(malondialdehyde)含量, 同时增加肠组织内二胺氧化酶(diamine oxidase)含量减轻肠黏膜过氧化损伤改善肠黏膜上皮细胞的结构和功能, 保护肠黏膜, 对大鼠不完全性肠梗阻(incomplete intestinal obstruction)有较好的治疗效果.
引文著录: 曹德琦, 罗兰, 汪瑞鸥, 杨拯, 张璐璐, 游淋玉, 王强, 宋强, 李欣芮, 梁羽. 白萝卜提取物对不完全性肠梗阻大鼠小肠黏膜过氧化损伤的保护作用. 世界华人消化杂志 2015; 23(26): 4236-4241
Revised: July 2, 2015
Accepted: July 14, 2015
Published online: September 18, 2015
AIM: To investigate the protective effects of Raphanus sativus extract (Rex) on intestinal mucosal peroxide damage in a rat model of incomplete intestinal obstruction (IIO).
METHODS: Sprague-Dawley rats were randomly divided into a normal group (group A, n = 14), a sham-operation group (group B, n = 14), an intestinal obstruction group (group C, n = 20) and an intestinal obstruction + Rex group (group D, n = 20). IIO was induced by surrounding the terminal ileum with a sterile pipe. After that, the animals in group D was given Rex (100 mg/kg body weight), while the rest groups were given equal volumes of saline. On days 5 and 7, the abdominal cavity was opened to collect 3 mL blood from the abdominal aorta for determining superoxide dismutase (SOD) and malondialdehyde (MDA) levels. Meanwhile, two segments of the small intestine were taken 4 cm above the obstructive for hematoxylin-eosin (HE) staining and for measuring diamine oxidase (DAO), respectively.
RESULTS: At each corresponding time point, compared with group B, SOD and DAO levels were significantly lower (P < 0.05 or P < 0.01) and MDA content and mucosal injury score were significantly higher (P < 0.01) in group C. Swelling, necrosis and shedding were visible in epithelial cells. Meanwhile, the submucosa, muscular and serosa had apparent congestion with infiltration of inflammatory cells. Compared with group C, treatment with Rex in group D significantly increased SOD activity (P < 0.05 or P < 0.01) and DAO content (P < 0.01), while MDA content and mucosal injury score were significantly decreased (P < 0.01). The damage of the ileum mucosa, infiltration of inflammatory cells and vascular responses in the ileum were significantly alleviated after treatment with Rex.
CONCLUSION: Rex can elevate serum SOD activity, reduce MDA content and increase tissue DAO levels in rats with IIO to protect the intestinal mucosal from being damaged by oxidative stress reaction effectively.
- Citation: Cao DQ, Luo L, Wang RO, Yang Z, Zhang LL, You LY, Wang Q, Song Q, Li XR, Liang Y. Protective effects of Raphanus sativus extract on intestinal mucosal peroxide damage in rats with incomplete intestinal obstruction. Shijie Huaren Xiaohua Zazhi 2015; 23(26): 4236-4241
- URL: https://www.wjgnet.com/1009-3079/full/v23/i26/4236.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i26.4236
肠梗阻是常见的外科急腹症之一, 在起病之初多为不完全性肠梗阻(incomplete intestinal obstruction, IIO). 肠管发生阻塞后, 若不及时解除梗阻, 随时间的延长, 会逐渐加重对肠道的血运、酶学、离子平衡及代谢的不良影响, 并使超微结构发生变化, 激活或释放多种水解酶, 加重细胞内其他结构的损伤, 使肠道的防御屏障功能减弱, 最终导致肠黏膜上皮细胞发生缺血缺氧、能量代谢和其他物质代谢障碍, 同时机体生成大量的氧自由基(oxygen free radical, OFR), 引发很强的脂质过氧化(lipid peroxide, LPO)反应, 严重时将会导致严重的全身反应, 甚至危及生命安全[1,2]. 由于肠梗阻手术风险大, 且术后会不可避免的发生多种并发症, 故临床上对肠梗阻患者多以非手术治疗为主, 因此如何减轻这种损伤是当前研究的热点问题之一.
白萝卜有很好的理气顺气作用, 在饮食中备受青睐, 且得到学者研究[3,4]验证, 其提取物确实有促胃动力作用. 近年来, 白萝卜提取物(Raphanus sativus extract, Rex)因其在抗菌、抗氧化、修复肠壁损伤等方面具有重要的调节作用而受到重视[5,6]. 但关于Rex抗氧化损伤的研究主要集中在肝脏等器官组织[7], 而在胃肠方面还未见报道.
基于上述理论, 本研究采用套环法成功复制大鼠IIO模型后, 给予Rex进行治疗, 对不同时间点大鼠行血清超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA), 肠组织匀浆二胺氧化酶(diamine oxidase, DAO)以及苏木精-伊红(HE)染色测定, 以探讨其抗氧化应激效应, 为Rex在胃肠动力疾病的作用机制以及祖国传统中药的药用价值开发方面提供理论支撑, 也为临床非手术治疗IIO提供新的借鉴和思路.
清洁级SD大鼠, 雌雄不分, 体质量200 g±20 g, 由成都达硕生物科技有限公司提供, 许可证号: SCXK(川)2008-24; SOD试剂盒(南京建成生物工程研究, 批号: 20130108); MDA试剂盒(南京建成生物工程研究, 批号: 20130106); DAO酶联免疫分析(ELISA)试剂盒(武汉基因美生物技术有限公司, 批号: 201212); 一次性使用乳胶胆管引流管[(26型T管, 南通安琪医疗用品有限公司, 批号:20101204)作为套环]; RE-52AA型旋转蒸发器(上海亚荣生化仪器厂); ModulyoD-230型冷冻干燥机(Thermo Electron Corporation); BioMate-3S分光光度计(Thermo Fisher Scientific); 680酶标仪(BIO-RAD, USA); 1575洗板机(BIO-RAD, USA).
1.2.1 自制Rex: 方法参照文献[3], 采用卫青萝卜(Raphanus sativus-root), 榨汁后将残渣转至容器中, 加入适量蒸馏水, 密闭, 常温下静置3 d, 倾取上层清液, 压榨药汁, 并与之前收集的滤液混合, 静置24 h, 过滤, 取滤液置于旋转蒸发器中, 40 ℃-45 ℃旋转蒸干, 得稠膏, 将稠膏置冷冻干燥机中冻干, 得绿色药粉, 即Rex, 称质量, 计算提取率[提取率 = 制得提取物质量(g)/原料质量(g)×100%]为3.67%. 将制备得到的提取物外用锡纸包装密封, 避光于-4 ℃冰箱保存.
1.2.2 动物分组及模型的建立: SD大鼠68只, 随机均分成正常组(A组, n = 14)、假手术组(B组, n = 14)、模型组(C组, n = 20)和治疗组(D组, n = 20). 所有动物实验前禁食12 h, 治疗组于术前2 h灌胃Rex(100 mg/kg), 其他各组灌胃等量的生理盐水, 自由饮水. 参照文献[8,9]方法, 大鼠麻醉后逐层打开腹腔, 将自制宽3 mm无菌橡胶套环套于距回盲部约2 cm的回肠段, 关闭腹腔, 3 d后开腹取出套环并逐层关闭腹腔, 常规消毒, 继续给予护理和治疗.
1.2.3 动物日常护理及治疗: 大鼠造模成功后用鼠笼单独清洁饲养, 禁食1 d, 给予适量饮水, 每日早晚各补充1次葡萄糖生理盐水(糖盐体积比为1:1, 2 mL/次). 于第2天开始, 每日早晚各喂食5 g, 未吃完的饲料取出称质量并记录, 正常饮水. D组灌胃给药Rex(按每次100 mg/kg体质量溶于生理盐水中)2 mL, 其余各组灌服等体积生理盐水, 1次/d, 分别连续给药5 d、7 d. 如有动物死亡, 则解剖观察各器官的形态、结构改变, 分析动物死因并记录.
1.2.4 标本处理: 分别于造模后第5、7天的同一时间点麻醉后打开腹腔, 腹主动脉内取血3 mL于Ep管中, 室温静置自然凝固30 min后, 3500 r/min离心5 min, 收集血清用于SOD活性和MDA含量测定; 剪取距梗阻部位以上4 cm的小肠组织, 以台氏液轻柔冲洗肠腔内容物后, 无菌滤纸吸干水分, 上端2 cm肠组织加9倍肠质量的生理盐水, 于冰盒中手工做成10%的组织匀浆, 4 ℃, 4500 r/min离心10 min, 收集上清液用于DAO含量测定, 下段2 cm肠组织用于HE染色.
1.2.5 HE染色: 将回肠组织用10%甲醛固定24 h后流水冲洗30 min常规脱水、石蜡包埋、切片, HE染色, 在光镜下观察其形态学改变, 并根据Chiu等[10]6级评价方法评价肠黏膜损伤程度.
1.2.6 血清SOD活性和MDA含量检测: 使用SOD和MDA试剂盒进行测定, 步骤严格按照说明书进行.
1.2.7 肠壁组织匀浆DAO含量的测定: 使用大鼠DAO酶联免疫分析(ELISA)试剂盒, 采用双抗体夹心法测定大鼠肠组织匀浆中DAO含量, 测定步骤严格按照说明书进行.
统计学处理 实验数据以mean±SD表示, 由SPSS19.0统计软件包分析处理数据, 各组间数据统计学差异进行单因素方差分析(One-way ANOVA), 选择Levene方法进行方差齐性检验, 符合方差齐性要求采Student-Newman-Keuls法(S-N-K)对数据进行组间比较, P<0.05为差异有统计学意义.
所有动物实验前正常. 造模期间, 大鼠多数反应迟缓, 食量减少, 排便困难, 少部分一般情况极差, 活动显著减少, 精神萎靡. 梗阻3 d后解除时, 打开腹腔, 发现大部分老鼠梗阻部位以上内容物堆积, 胀气严重, 以下几乎无内容物, 且梗阻处出现轻微黏连, 肠管颜色异常, 大网膜包绕套环呈团状. 造模成功后, 大鼠体质量有所下降, 排便异常, 出现动物死亡, 且死亡量大幅增加. 动物尸体解剖后发现, 肠管严重黏连坏死, 肠腔内容物大量堆积, 胀气明显. 经Rex治疗动物能正常饮食, 精神状态较好, 在各时间点打开腹腔, 梗阻部位均有不同程度的改善, 且随着给药Rex时间的延长, 改善显著.
与B组比较, 5、7 d时, C组SOD活性和DAO含量均降低(P<0.05或P<0.01), 而MDA含量均显著升高(P<0.01)(表1).
| 分组 | 5 d | 7 d | ||||
| SOD(U/mL) | MDA(nmol/mL) | DAO(pg/dL) | SOD(U/mL) | MDA(nmol/mL) | DAO(pg/dL) | |
| A组 | 106.78±18.88c | 4.20±0.40d | 286.68±9.02 | 79.40±8.72 | 3.23±0.38c | 258.78±1.56d |
| B组 | 111.29±34.86 | 4.54±0.43 | 291.31±23.00 | 110.35±26.61 | 2.94±0.34 | 254.68±14.92 |
| C组 | 66.53±3.16a | 6.32±0.50b | 266.08±9.07a | 42.41±10.40b | 4.22±0.58b | 220.89±7.86a |
| D组 | 124.50±3.75d | 4.91±0.70d | 302.08±8.30d | 91.46±34.12c | 2.80±0.48d | 266.75±17.89d |
与B组比较, 5、7 d时, DAO含量均降低(P<0.05或P<0.01); 与C组比较, D组给药Rex后, DAO含量显著高于C组提高(P<0.01)(表1).
2.4.1 肠黏膜损伤镜下评分: C组各时间点回肠黏膜损伤评分增加, D组评分则显著低于C组(P<0.01)(表2).
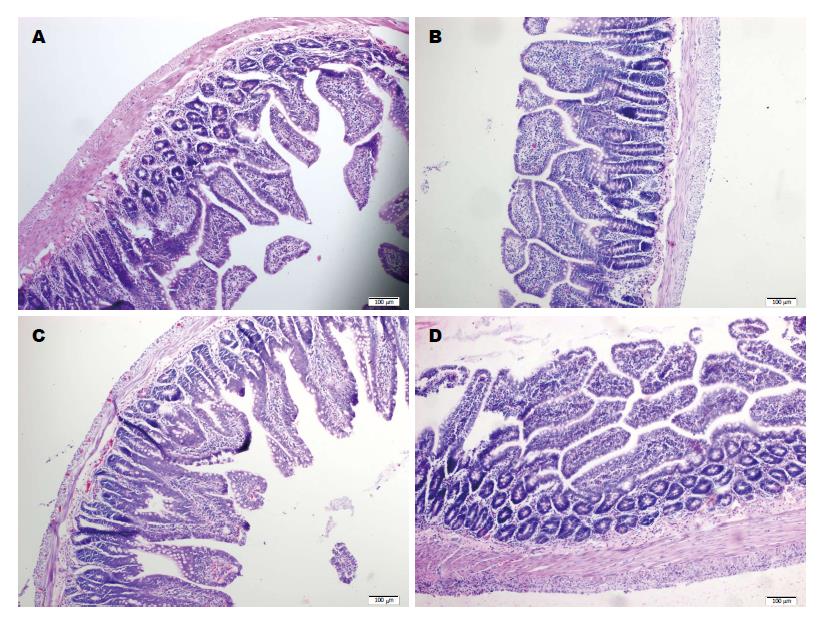
2.4.2 组织病理改变: HE染色发现各时间点A组与B组回肠组织横断面各层结构完整, 绒毛排列整齐, 界线清楚, 偶见B组大鼠回肠组织间质轻微水肿, 绒毛界限轻微模糊. C组回肠黏膜上皮细胞肿胀, 界限不清, 偶有坏死, 脱落, 黏膜下层、肌层及浆膜层明显瘀血, 毛细管明显扩张, 并有大量炎细胞浸润. 与C组比较, D组回肠上皮细胞肿胀减轻, 炎细胞浸润明显减少, 回肠绒毛破损程度减轻, 充血、水肿、渗出、溃疡及血管反应明显减轻(图1).
白萝卜作为食源性植物, 有很好的药用价值及可能的临床应用前景. 国内研究[3]也发现其提取物可以通过调节回肠肌电慢波活动, 在一定程度上对肠梗阻大鼠的胃肠动力有较好的调节作用, 国外也有学者对Rex对动物胃肠动力的生理机制及药理学机制进行了部分研究[4,11]. 已被证明的其提取物成分中含有一种有突出的抗癌、抗氧化、抗菌以及抗突变能力的生物活性很强的芥子油[4-(methylthio)-3-butenyl isothiocyanate][12,13], 对机体的抗氧化系统有很强的保护作用. 目前关于Rex抗氧化损伤的研究主要集中在肝脏等器官组织[7], 在胃肠动力障碍性疾病则少有研究, 尤其是在肠梗阻疾病治疗上研究的甚少.
肠梗阻后, 受细菌移位、肠道机会性感染、肠动力性能改变等因素的影响[14], 肠道的运动、吸收、分泌功能和肌电均发生改变, 损坏肠道正常功能. 随梗阻时间的延长, 会逐渐加重对肠道的血运、酶学、离子平衡及代谢的不良影响, 并使超微结构发生变化, 当损伤严重时, 激活或释放多种水解酶, 加重细胞内其他结构的损伤, 使肠道的防御屏障功能减弱. 最终导致肠黏膜上皮细胞发生缺血缺氧、能量代谢和其他物质代谢障碍. DAO是黏膜保护作用的细胞内酶, 肠梗阻后, 由于细胞受损, DAO会释放入血, 导致血浆和肠腔DAO活性增高而肠黏膜内DAO含量降低[15], 同时机体生成大量的OFR, 引发很强的LPO反应, 导致膜的基本特性(受体、离子通道、酶活性等)发生变化.
SOD是内源性OFR的清除剂, 而MDA是LPO反应的终产物, 两者是目前公认的能反映OFR的产生及引发LPO反应程度的指标. DAO作为保护肠黏膜的完整性的一种细胞内酶以空肠和回肠活性最高[2], 主要是通过调节细胞离子平衡, 影响细胞内传导通路, 维持细胞内Ca2+稳态, 抑制膜LPO促进细胞修复等环节发挥作用[16], 测定肠黏膜DAO含量是表示小肠黏膜结构和功能的理想指标, 而且在小肠屏障功能的众多检测方法中, 是以DAO检测敏感可靠[17].
本实验显示, 大鼠IIO后, 肠黏膜细胞完整性受损且发生了明显的氧化应激反应, Rex可以通过抵抗这一反应, 提高血清内SOD活性, 降低MDA含量, 同时提高黏膜组织内DAO含量, 抑制膜LPO, 促进细胞修复等环节保护小肠上皮细胞, 从而保护小肠黏膜结构与功能的完整, 使其免受过氧化损伤, 从而对IIO大鼠进行治疗. Gilani等[11]的研究提示Rex不良反应轻微, 药用安全, 可靠, 但是肠梗阻病理变化复杂, Rex成分多样且可能还有其他的生物学作用, 如对胃肠激素, 炎症因子的影响等, 不能在本实验中得到充分的验证, 有待今后更加深入的研究来逐步阐明, 确定该药物所含的组分以及各组分的药理作用及其用于肠梗阻的治疗机制. 因此, 相信随着对Rex研究的不断深入和拓展, 将有可能为肠梗阻的保守治疗开辟新途径.
肠梗阻后, 肠组织缺血、缺氧, 酶学改变等因素引发强烈的氧化应激反应并加重损伤, 大量实验证实白萝卜提取物(Raphanus sativus extract, Rex)有很好的抗氧化作用, 但其研究主要集中在肝脏等器官组织, 在胃肠动力障碍性疾病则少有研究, 尤其是在治疗肠梗阻上研究的甚少.
陈海龙, 教授, 大连医科大学附属第一医院院办
近年来, Rex因其药性温和, 刺激性小, 在抗氧化、修复肠壁损伤, 促进胃肠动力等多方面具有重要的调节作用而受到消化系研究领域的重视, 探讨食源性药物Rex对胃肠疾病的作用及机制已成为一新的研究热点.
研究已证明的Rex成分中含有一种有突出的抗癌、抗氧化、抗菌以及抗突变能力的生物活性很强的芥子油[4-(methylthio)-3-butenyl isothiocyanate], 对机体的抗氧化系统有很强的保护作用; Ben Salah-Abbès研究报道Rex对机体的抗氧化系统有很强的保护作用.
本研究利用外科手术方法成功建立了大鼠不完全性肠梗阻(incomplete intestinal obstruction, IIO)动物模型, 同时给予食源性药物Rex治疗, 研究其肠组织病理改变, 氧化损伤程度, 酶学改变, 结果表明Rex能够抵抗IIO大鼠的氧化应激反应, 提高二胺氧化酶(diamine oxidase, DAO)水平, 具有保护肠黏膜屏障的功能.
药用食物白萝卜来源广泛, 且其提取物能够保护IIO大鼠肠黏膜的过氧化损伤. 本实验为Rex在胃肠疾病的作用机制及祖国传统中药的药用价值开发方面提供理论支持, 也为保守治疗IIO的研究提供新的思路和方法, 积累了基础研究资料.
过氧化损伤: 是指机体在遭受各种有害刺激时, 体内高活性分子如活性氧自由基(reactive oxygen species)和活性氮自由基(reactive nitrogen species)产生过多, 氧化程度超出氧化物的清除, 氧化系统和抗氧化系统失衡, 从而导致组织损伤.
本文利用外科手术方法成功建立了大鼠IIO动物模型, 同时给予食源性药物Rex治疗, 研究其肠组织病理改变, 氧化损伤程度, 酶学改变, 有一定的创新性, 有一定学术意义和临床应用价值.
编辑: 韦元涛 电编: 闫晋利
| 2. | 邹 大军. 急性小肠梗阻时血清DAO、MDA及肠壁组织学变化的研究. 石家庄: 河北医科大学 2007; . |
| 3. | 李 禹呈, 罗 兰, 杨 拯, 曹 德琦, 孙 金菊, 胡 雯思, 卓 睿, 李 亚光, 郑 麟凤, 孙 元丽. 白萝卜提取物改善肠梗阻大鼠平滑肌收缩力的研究. 时珍国医国药. 2014;25:2128-2131. |
| 4. | Zashikhin AL, Sehlin J, Barmina AO. [Reactive changes in the smooth muscle tissue of the rat small intestine during experimental intestinal obstruction]. Morfologiia. 2010;137:48-53. [PubMed] |
| 5. | Beevi SS, Mangamoori LN, Subathra M, Edula JR. Hexane extract of Raphanus sativus L. roots inhibits cell proliferation and induces apoptosis in human cancer cells by modulating genes related to apoptotic pathway. Plant Foods Hum Nutr. 2010;65:200-209. [PubMed] [DOI] |
| 6. | Beevi SS, Narasu ML, Gowda BB. Polyphenolics profile, antioxidant and radical scavenging activity of leaves and stem of Raphanus sativus L. Plant Foods Hum Nutr. 2010;65:8-17. [PubMed] [DOI] |
| 7. | Wang LS, Sun XD, Cao Y, Wang L, Li FJ, Wang YF. Antioxidant and pro-oxidant properties of acylated pelargonidin derivatives extracted from red radish (Raphanus sativus var. niger, Brassicaceae). Food Chem Toxicol. 2010;48:2712-2718. [PubMed] [DOI] |
| 8. | Yuan ML, Yang Z, Li YC, Shi LL, Guo JL, Huang YQ, Kang X, Cheng JJ, Chen Y, Yu T. Comparison of different methods of intestinal obstruction in a rat model. World J Gastroenterol. 2013;19:692-705. [PubMed] [DOI] |
| 9. | 杨 拯, 李 昆, 袁 梦郎, 王 超, 柏 玲, 邱 有波, 彭 梅芳, 朱 晓艳, 张 林. 电针足三里穴对不完全性肠梗阻大鼠小肠肌电活动的影响. 世界华人消化杂志. 2011;19:1237-1243. [DOI] |
| 10. | Chiu CJ, McArdle AH, Brown R, Scott HJ, Gurd FN. Intestinal mucosal lesion in low-flow states. I. A morphological, hemodynamic, and metabolic reappraisal. Arch Surg. 1970;101:478-483. [PubMed] [DOI] |
| 11. | Gilani AH, Ghayur MN. Pharmacological basis for the gut stimulatory activity of Raphanus sativus leaves. J Ethnopharmacol. 2004;95:169-172. [PubMed] [DOI] |
| 12. | Ben Salah-Abbès J, Abbès S, Abdel-Wahhab MA, Oueslati R. Raphanus sativus extract protects against Zearalenone induced reproductive toxicity, oxidative stress and mutagenic alterations in male Balb/c mice. Toxicon. 2009;53:525-533. [PubMed] [DOI] |
| 13. | Shi S, Kaur IP. Inhibition of cooked food-induced mutagenesis by dietary constituents: Comparison of two natural isothiocyanates. Food Chemistry. 2009;112:977-981. [DOI] |
| 14. | Liao D, Zhao J, Gregersen H. 3d Mechanical properties of the partially obstructed guinea pig small intestine. J Biomech. 2010;43:2079-2086. [PubMed] [DOI] |
| 16. | Bounous G, Echavé V, Vobecky SJ, Navert H, Wollin A. Acute necrosis of the intestinal mucosa with high serum levels of diamine oxidase. Dig Dis Sci. 1984;29:872-874. [PubMed] [DOI] |