修回日期: 2015-07-22
接受日期: 2015-07-24
在线出版日期: 2015-09-18
目的: 探讨间充质干细胞(mesenchymal stem cells, MSCs)联合大承气汤(dachengqi decoction, DcqD)对重症急性胰腺炎(severe acute pancreatitis, SAP)大鼠的治疗效果及机制.
方法: 将60只SD♂大鼠随机分为假手术组(sham-operated, SO), 模型组(model control, MC), MSCs治疗组(MSC), DcqD治疗组(DD)和MSCs联合DcqD治疗组(MSCDD)(n = 12), 用1.5%脱氧胆酸钠胆胰管内逆行注射诱导SAP模型. 通过Percoll密度梯度离心法与全骨髓贴壁分离法分离、培养MSCs. MSCs经大鼠尾静脉注入前用DAPI标记. 24 h后, 荧光显微镜观察MSCs体内分布, 流式细胞仪检测中性粒细胞凋亡率, 测量各组血清淀粉酶、脂肪酶、肿瘤坏死因子α(tumour necrosis factor-α, TNF-α)、白介素6(interleukin-6, IL-6)、IL-10及CD4+CD25+调节性T细胞(CD4+CD25+ regulatory T cells, CD4+CD25+Tregs)含量. 记录各组大鼠死亡率, 观察并记录各组大鼠胰腺组织病理变化及组织学评分.
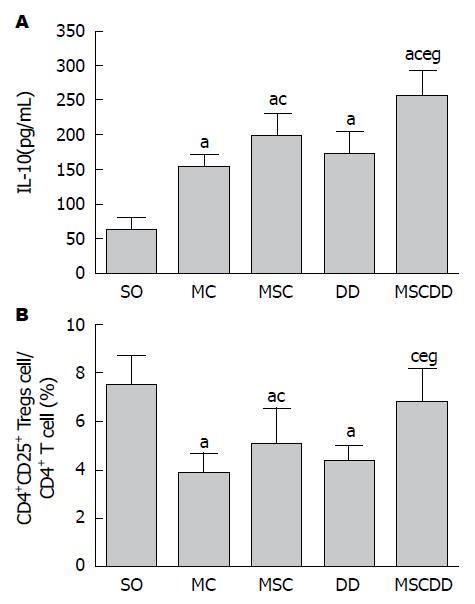
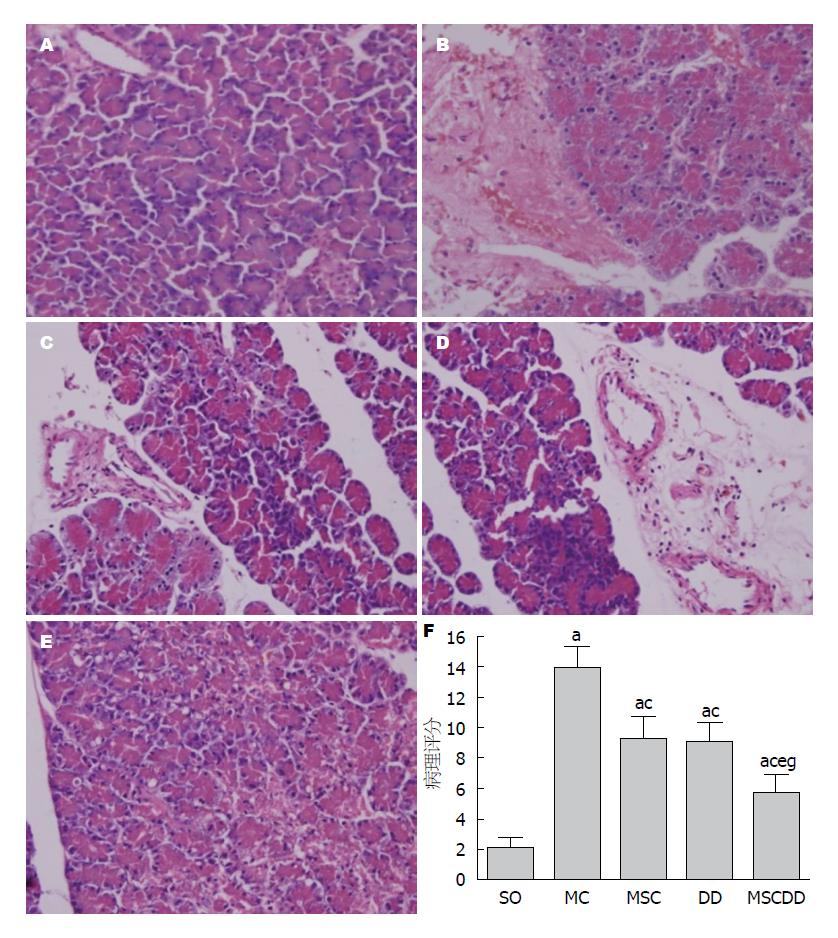
结果: 各治疗组大鼠死亡率低于MC. 荧光显微镜下, MSC胰腺管腔可见大量蓝色荧光, MC未发现. 中性粒细胞凋亡指数, DD较MC显著升高(P<0.05). 血清TNF-α、IL-6、淀粉酶与脂肪酶水平, MSCDD较SAP、MSC及DD显著降低(P<0.05). IL-10与CD4+CD25+Tregs含量, MSCDD较SAP、MSC及DD组显著升高(P<0.05), MSCDD与SO之间无统计学差异(P>0.05). 各治疗组均能改善组织病理变化及降低组织学评分, 尤其是MSCDD.
结论: MSCs联合DcqD应用于SAP早期时优于单独治疗, 并可能引起协同效果. 其潜在机制可能是通过参与胰腺损伤修复, 促进中性粒细胞及腺泡细胞由坏死转向凋亡, 以及抑制炎症反应.
核心提示: 骨髓间充质干细胞(mesenchymal stem cells)联合大承气汤(dachengqi decoction, DcqD)应用于重症急性胰腺炎(severe acute pancreatitis)早期时优于单独治疗, 并可能引起协同效果. DcqD潜在机制可能通过诱导腺泡细胞及中性粒细胞凋亡来限制胰腺组织损伤, 减轻炎症反应.
引文著录: 孙发律, 李会朋, 滕勇生, 尚东. 大鼠骨髓间充质干细胞联合大承气汤对重症急性胰腺炎模型大鼠的保护作用及机制. 世界华人消化杂志 2015; 23(26): 4167-4176
Revised: July 22, 2015
Accepted: July 24, 2015
Published online: September 18, 2015
AIM: To investigate the therapeutic effects of mesenchymal stem cells (MSCs) combined with Dachengqi decoction (DcqD) in rats with severe acute pancreatitis (SAP) and to explore the underlying mechanism.
METHODS: Sixty male Sprague-Dawley rats were randomly divided into sham-operated (SO), model-control (MC), MSCs-treatment (1.0 × 106 MSCs; MSC group), DcqD-treatment (1 mL/100 g; DD group), and MSCs-plus-DcqD-treatment (MSCDD group) groups (n = 12). SAP was induced in rats by retrograde infusion of 1.5% sodium deoxycholate into the biliopancreatic duct. Isolation and culture of MSCs were performed by Percoll density gradient centrifugation and plastic adherence separating. Ahead of infusion, MSCs were labelled with DAPI via the tail vein. After 24 h of administration, distribution of MSCS in vivo was observed by fluorescence microscopy. Neutrophil apoptosis was identified by flow cytometry. Serum levels of amylase, lipase, tumour necrosis factor-α (TNF-α), interleukin (IL)-6, IL-10 and blood CD4+CD25+ regulatory T cells (CD4+CD25+Tregs) percentages were determined. Mortality, pathological changes in the pancreas, and histological scores were assessed.
RESULTS: The mortality rate of SAP rats was significantly lower in the treatment groups. Under a fluorescence microscope, the lumen tissue in the pancreatic sections of the MSC group exhibited bright blue fluorescence, whereas that in the MC group did not. Compared with the MC group, the MSC, DD and MSCDD groups had a significant decrease in TNF-α, IL-6, amylase, and lipase (P < 0.05). IL-10 and CD4+CD25+Tregs percentage were significantly higher in the MSCDD group than in the SAP, MSC and DD groups. However, there was no significant difference between the MSCDD and SO groups in IL-10 or CD4+CD25+Tregs percentage (P > 0.05). The pancreatic pathological changes and histopathologic scores were attenuated in the treatment groups, especially in the MSCDD group.
CONCLUSION: The combined therapy proved to be more effective than either MSC or DD alone and may cause synergistic effects in the early stage of SAP. The potential mechanisms that might account for the favourable effects include participating in injured pancreas repair, switching from neutrophils or acinar cell necrosis to apoptosis and inhibiting over-inflammatory reaction.
- Citation: Sun FL, Li HP, Teng YS, Shang D. Therapeutic effects of rat bone marrow-derived mesenchymal stem cells combined with Dachengqi decoction in rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2015; 23(26): 4167-4176
- URL: https://www.wjgnet.com/1009-3079/full/v23/i26/4167.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i26.4167
急性胰腺炎(acute pancreatitis, AP)是临床上常见的急腹症之一, 约20%发展为重症急性胰腺炎(severe acute pancreatitis, SAP)[1]. 一般认为SAP的发病机制是由于胰腺腺泡细胞内酶原提前激活引起胰腺局部组织水肿、出血、坏死以及炎症细胞浸润, 以上病理改变刺激循环血多形核中性粒细胞或巨噬细胞活化并释放大量炎症因子[如白介素(interleukin, IL)-1β、IL-6、干扰素γ(interferon gamma, IFN-γ), TNF-α, IL-4和IL-10], 经炎症联级反应, 形成全身炎症反应综合征(systemic inflammatory response syndrome, SIRS), 并最终导致多器官功能障碍(multiple organ dysfunction syndrome, MODS)或死亡[2-4]. 过去几十年来, 随着重症监护医学的飞跃发展, 急性胰腺炎的整体死亡率呈下降趋势, 但合并有严重并发症SAP患者的死亡率仍维持在40%左右[5]. 目前治疗上很难完全逆转SAP的发病进程[6].
本实验提出一种较新的中西医结合治疗SAP方法, 即间充质干细胞(mesenchymal stem cells, MSCs)联合使用大承气汤(dachengqi decoction, DcqD). MSCs具有多向分化能力, 可参与受损组织的再生与修复; 此外, MSCs还具有免疫抑制活性及抗炎作用. DcqD记录于《伤寒论》, 作为通里攻下的代表方剂, 已在我国广泛用于治疗阳明¸实证上千年, 具有良好的疗效. 大承气汤组方由大黄、厚朴、枳实、芒硝组成. 之前有实验证明大承气汤可通过诱导胰腺腺泡细胞凋亡、防止腺泡细胞坏死及减少炎症反应治疗大鼠AP[7]. 国内、外已有文献记载单用MSCs或DcqD对急性胰腺炎有治疗作用[8-10], 但是还未报道其联合治疗效果, 另外MSCs或DcqD治疗SAP的具体作用机制仍不清楚. 因此, 我们研究MSCs联合DcqD对SAP模型大鼠的治疗作用及探讨其潜在的机制.
60只健康清洁级♂SD大鼠, 体质量180-220 g, 由大连医科大学动物实验中心供给. 水合氯醛由天津市科密欧化学试剂开发中心供给. 脱氧胆酸钠、Percoll分离液购自美国Sigma公司. 胎牛血清、0.25%胰蛋白酶、1%青霉素-链霉素(双抗)、低糖DMEM培养基购自美国Gibco公司; TNF-α、IL-6与IL-10 ELISA试剂盒购自南京KeyGen Biotech公司. Anti-ratCD4-FITC、Anti-ratCD25-PE、Anti-CD45-FITC与Anti-CD90-PE购自美国Biolegend公司, 大鼠淋巴细胞分离液购自天津TBD公司. 大承气汤: 生大黄15 g、芒硝6 g、厚朴15 g、枳实12 g、其中大黄后下, 芒硝冲服. 由大连医科大学附属第一医院中药制剂室制成浓度为1:1(质量体积比)的药液, 过滤灭菌后瓶装, 冰箱4 ℃贮存. 超净工作台购自上海博讯实业有限公司医疗设备厂; 台式高速低温离心机(D-37520)购自德国Osterode kerdro公司; 流式细胞仪购自美国BECTON公司; HWS-20恒温水浴箱购自江苏太仓市实验设备厂; PH240A型培养箱购自上海一恒科技有限公司; 酶标仪(BENCHMARK10735)购自日本BIORAD公司; BX-51型光学显微镜购自OLYMPUS BX51荧光显微镜购自日本OLYMPUS公司; Vitro250型全自动生化分析仪购自美国Johnson公司.
1.2.1 模型建立: 依据本课题组以前诱导SAP大鼠模型的方法[11], 大鼠实验前12 h禁食, 自由饮水. 10%水合氯醛(3 mL/kg体质量)麻醉后经上腹正中切口入腹, 暴露十二指肠, 用1 mL注射器针头经胆胰管十二指肠乳头开口处入胆胰管, 同时用无损伤小动脉夹临时夹闭胆总管近端, 逆行注入1.5%脱氧胆酸钠(1 mL/kg体质量), 停针2 min(指捏十二指肠乳头部位), 观察胰腺有水肿充血改变后, 退出针头, 去掉小动脉夹, 十二指肠复位, 缝合关腹. 假手术组(sham-operated, SO)仅在开腹后轻轻翻动胰腺, 不进行胆胰管内给药, 其他操作同SAP. 将造模成功后大鼠随机分为模型组(model control, MC)、MSCs治疗组(MSC)、DcqD治疗组(DD)及MSCs联合DcqD治疗组(MSCDD), 每组12只; MSC经尾静脉注入1 mL MSCs(约1.0×106细胞)/只, DD经灌胃予以2 mL DcqD(约1 mL/100 g体质量)/只, MSCDD同时予以1 mL MSCs和2 mL DcqD. SO与MC按相同方法注射等剂量生理盐水. 药物干预后予以自由饮水、禁食. 24 h后开腹行腹主动脉采血.
1.2.2 MSCs的分离、培养及鉴定: 严格无菌条件下分离健康大鼠股骨, 剔除肌肉等组织, 剪开骨端, 暴露骨髓腔, 用含10%胎牛血清的低糖DMEM培养液反复冲洗骨髓腔于培养皿内. 充分吹打混匀后加入等体积Percoll工作液, 2500 r/min离心20 min, 吸取界面层. 用PBS洗涤细胞2次, 然后用含10%胎牛血清, 100 U/mL青霉素-链霉素的低糖DMEM培养液重悬细胞. 计数, 以1.0×106/mL密度接种于25 cm2底面积的培养瓶中, 置37 ℃、50 mL/L CO2饱和湿度的培养箱中培养, 48 h首次更换培养液, 弃未贴壁的细胞, 以后每48 h换液1次. 并每天观察细胞贴壁、分裂和增殖情况, 当细胞接近80%融合时, 用0.25%胰蛋白酶将贴壁细胞消化分离, 制成单细胞悬浮液, 按1:2传代, 做好标记. 观察至贴壁细胞融合铺满瓶底, 重复以上操作, 进行传代扩增. 取第3代达到80%融合以上的细胞, 用0.25%胰蛋白酶消化后, PBS洗1-2次, 细胞计数, 用PBS调整细胞浓度为1×106/mL. 样品管和对照管(EP管)均加入100 μL细胞悬浮液, 样品管分别加荧光直标单抗CD45、CD90, 对照管不加抗体, 室温下避光孵育30 min. PBS离心洗涤2遍, 重悬细胞. 流式细胞仪直接荧光法检测CD45、CD90的表达.
1.2.3 DAPI标记MSCs: 取生长状态良好的第3代大鼠MSCs, 培养基按4 mL/瓶换液, 加入0.2 mL DAPI, 配制成浓度为50 μg/mL, 常规培养2 h, 经胰酶消化制成细胞悬浮液, 并取少量滴于载玻片上, 荧光显微镜下观察标记情况. 植入前用PBS洗6遍, 再用DMEM混悬, 使其细胞浓度为1×106/mL.
1.2.4 相关指标检测: 全自动生化分析仪测定血淀粉酶、血脂肪酶检含量, ELISA法测定标本中TNF-α、IL-6与IL-10含量: 具体操作方法详见试剂盒说明书.
1.2.5 CD4+CD25+调节性T细胞占CD4+T细胞的百分率测定: 操作包括两部分: (1)外周血单个核细胞的提取: 取全血2 mL, 注入肝素化的无菌试管中摇匀, 加入等量的PBS缓冲液; 将4 mL大鼠淋巴细胞分离液置于10 mL离心管中, 将稀释的血液加于分离液上方2500 r/min离心30 min. 用移液器吸取单个核细胞层置于另一离心管中; 加入6 mL的PBS缓冲液, 混匀后1500 r/min离心10 min, 弃上清, 再用PBS液洗2次; 用PBS配制成浓度为1.0×106/mL细胞悬浮液, 备用; (2)流式细胞术检测: 取上述细胞悬液1 mL, 1500 r/min离心10 min, 弃上清, 用100 μL PBS混匀后加入Anti-ratCD4-FITC、Anti- ratCD25-PE两种抗体各5 μL, 对照管只加等量的细胞. 各管置室温中避光孵育30 min后, PBS离心洗涤2遍, 重悬细胞. 流式细胞仪直接荧光法检测CD4、CD25的表达.
1.2.6 中性粒细胞凋亡检测: 操作包括两部分: (1)外周血中性粒细胞的分离: 取肝素化全血2.5 mL, 加入等量的T-500, 37 ℃水浴箱静置30 min, 取上清, 1000 r/min离心10 min, 弃上清, 加入2 mL RPMI 1640培养液, 吹打混匀, 分别依次加入42% Percoll应用液、51%Percoll应用液及2 mL细胞悬液, 1000 r/min离心10 min. 离心后分为3层, 用移液器吸取中间细胞层, 加入2 mL RPMI 1640培养液洗涤, 1000 r/min离心5 min, 弃上清; (2)细胞凋亡的检测: 用300 μL结合缓冲液重新悬浮细胞, 细胞浓度调整至1.0×106/mL, 取100 μL的细胞悬液于1.5 mL流式管中, 加入5 μL Annexin V-FITC和5 μL propidium iodide(PI), 室温避光孵育30 min, 流式细胞仪检测中性粒细胞凋亡与坏死指数.
1.2.7 胰腺组织病理学评分: 胰腺经40 g/L甲醛固定24 h后石蜡包埋, 切片, HE染色后于光镜下观察, 在两位病理医师的协助下, 依据胰腺组织水肿、出血、坏死与炎症4项程度, 每项划分为0-4分, 盲法评估胰腺组织损伤程度. 本实验采用改良Kusske[12]评分系统, 最终积分为该4项组织积分的总和.
统计学处理 采用SPSS17.0版本统计软件对数据进行处理, 检测数据用mean±SD表示. 组内连续变量间比较采用one-way ANOVA, 组间连续变量间比较采用Student's t-test. 病理组织评分采用Kruskal-Wallis方法分析. P<0.05为差异具有统计学意义.
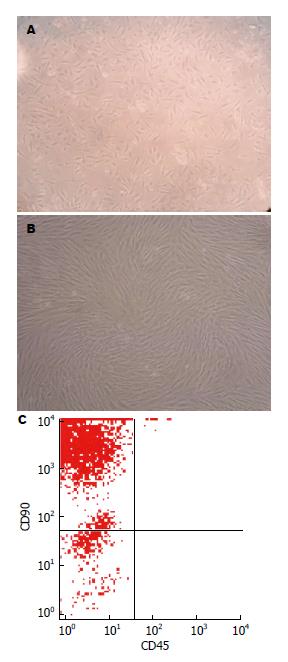
2.1.1 显微镜下MSCs形态学及生长情况观察: (1)MSCs原代培养第10天后, 细胞形态呈梭形、多角形, 伸出长短不一、粗细不匀的胞质突起(图1A); (2)传代培养时, 细胞在接种后24 h即可贴壁, 细胞形态呈现梭形或纺锤形、三角形、多角形. 逐次传代后, 其形态均一, 增殖活跃的细胞呈集落样生长, 细胞边界清楚, 核饱满(图1B).
2.1.2 MSCs细胞表型鉴定: MSCs细胞表面CD90阳性率约91.39%, MSCs细胞表面CD45阴性率约99.72%(图1C).
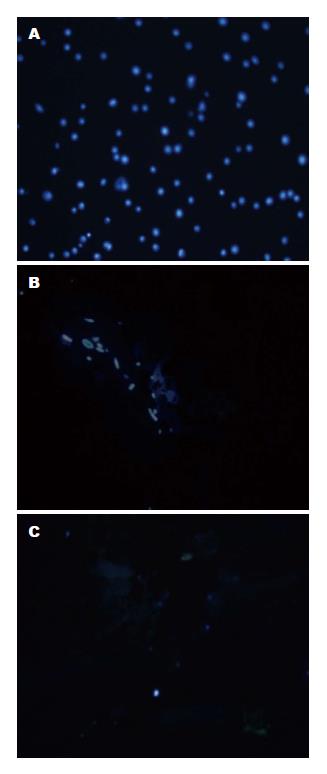
荧光显微镜下可见细胞核呈明亮蓝色荧光, 标记率达100%. MC与MSC组胰腺组织切片, 荧光显微镜下可见MSC管腔组织中有明亮蓝色荧光细胞, MC未见明显荧光细胞. 提示MSCs在SAP大鼠中定位于受损胰腺组织(图2).
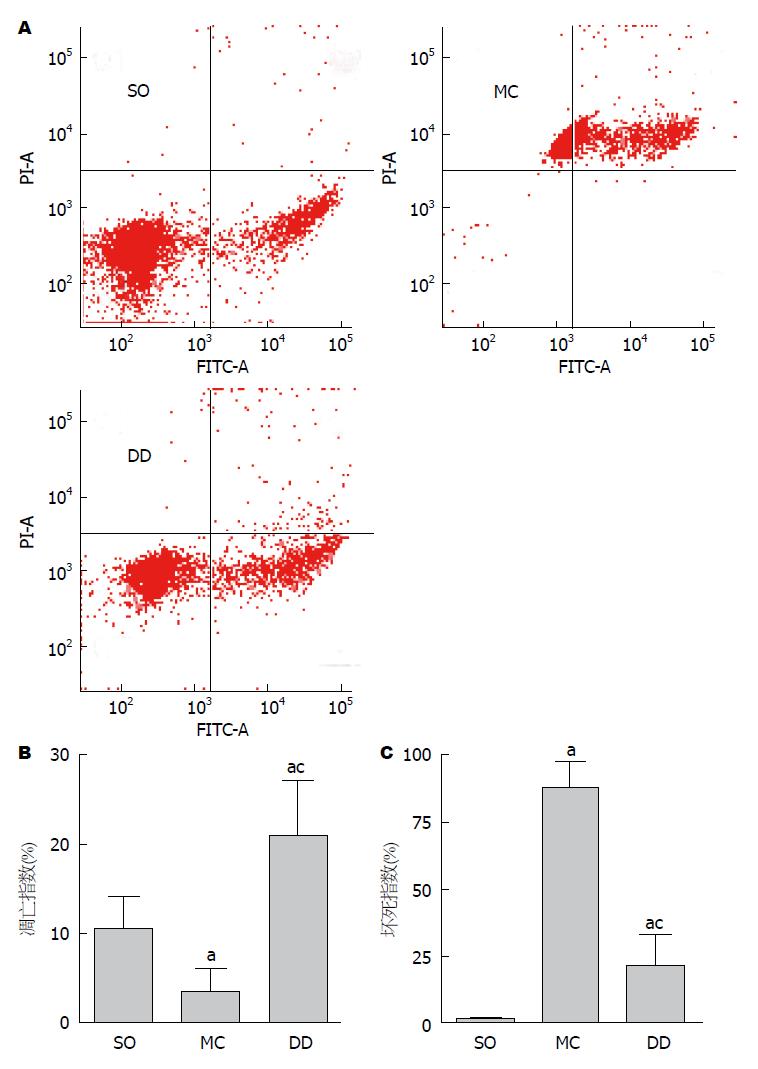
MC组大鼠外周血中性粒细胞凋亡率低、坏死率高. DcqD治疗后24 h, 大鼠外周血中性粒细胞凋亡率显著升高, 坏死率显著降低(P<0.05). 实验数据提示DcqD可诱导SAP大鼠外周血中性粒细胞由坏死转向凋亡(图3).
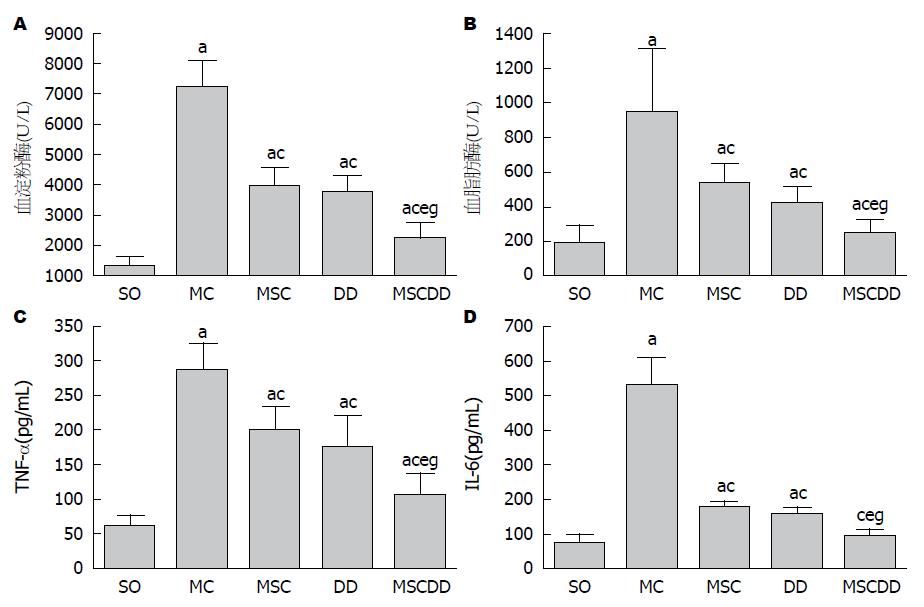
2.4.1 血清中淀粉酶、脂肪酶、IL-6和TNF-α水平的测定: 血清淀粉酶、脂肪酶、IL-6和TNF-α水平, SO、MSC、DD与MSCDD较MC显著性降低(P<0.05). 与MSC及DD比较, MSCDD能显著性降低血清淀粉酶(分别降低46.9%与40.3%)及脂肪酶(分别降低51.6%与39.5%)水平, 而MSC与DD之间无明显变化(图4A, B). 与MSC及DD比较, MSCDD能显著性降低血清TNF-α(分别降低45.7%与38.2%)和IL-6(分别降低46.4%与39.3%)水平, 但MSC与DD之间无显著统计学意义. 值得注意的是, MSCDD IL-6水平较SO无明显差异(图4C, D).
2.4.2 血清中IL-10和CD4+CD25+Tregs水平的测定: SO血清IL-10水平明显高于MC及各治疗组. 与MC比较, MSC与MSCDD IL-10水平升高具有显著统计学意义(P<0.05). 另外, IL-10水平在DD与MC之间无统计学差异(P<0.05). 与MSC和DD比较, MSCDD IL-10水平显著性升高(分别升高28.7%与47.8%)(图5A). 大鼠血清CD4+CD25+Tregs百分率, MC、DD与MSC较SO显著下降(P<0.05), MSCDD较SO无统计学差异, MSC与MSCDD较MC显著升高(P<0.05), DD与MC之间无统计学差异, MSCDD较MSC与DD显著升高(分别升高33.6%与56.1%)(图5B).
造模24 h后, SO、MC、MSC、DD与MSCDD大鼠的死亡率分别为0(0/12), 33.3%(4/12), 16.7%(2/12), 16.7%(2/12), 8.3%(1/12). SO大鼠胰腺组织小叶结构清晰, 无明显水肿、出血、坏死及中性粒细胞浸润. MC胰腺实质可见大片出血, 坏死, 细胞结构模糊不清, 红细胞淤积, 血管不同程度扩张, 胰腺组织间隙及实质内有大量中性粒细胞及单核细胞浸润. 各治疗组与MC比较, 胰腺组织病理变化可见不同程度的改善, 其中联合用药组病变程度最轻, 治疗效果最为明显(图6A-E). 胰腺组织病理评分, MSC、DD与MSCDD较MC组显著性降低(P<0.05), MSCDD组较MSC与DD组同等程度显著性降低(约37.5%), MSC与DD组之间无明显差异(图6F).
过度炎症反应导致机体免疫功能低下、器官功能受损、感染等, 进而并发症明显升高, 进一步加重SAP病情的发展. 胰腺损伤时外周血中大量多形核中性粒细胞(polymorphonuclear neutrophils, PMN)活化, 介导促炎因子(如TNF-α与IL-6)合成与分泌, 这些因子在SAP中介导局部或全身过度炎症反应中起重要作用, 导致SIRS形成, 甚至MODS或死亡. 因此, 新的治疗策略旨在找到某种药物可以有效地阻止或逆转中性粒细胞大量活化, 包括抑制促炎因子的释放, 促进抑炎因子的释放, 及促使活化的PMN凋亡. Bhatia等[13]与Rau等[14]提出一种当时较新的治疗策略, 即通过靶向作用于引起炎症细胞活化的炎症因子. Cuzzocrea等[15]与Masamune等[16]证实使用TNF-α、IL-1β或IL-6抗体对AP实验动物模型具有较好的效果. 这一观点与本实验结果基本一致, 数据显示MSCs与DcqD均可降低TNF-α与IL-6水平, 早期外周血促炎因子的减少有利于SAP病情治疗. SAP时随着大量促炎因子的释放, 机体抗炎症因子代偿性升高以维持机体免疫功能, 形成代偿性抗炎反应综合征[17]. 有文献报道[18]IL-10作为机体内一种主要的抗炎因子, 其在外周血中大量释放见于AP. 与本实验结果相同, MC及各治疗组IL-10水平明显高于SO. 另外, 很早有报道[19]证实IL-10对AP模型小鼠具有治疗作用. 本实验显示MSC及MSCDD外周血IL-10含量较MC显著性升高. 因此, IL-10水平的升高在一定程度上能改善SAP大鼠胰腺组织损伤. 虽然MC与MSC大鼠均可见IL-10水平升高, 但是两者胰腺组织病理改变及预后完全相反. 对上述现象有以下两种可能解释: (1)SAP初期由CARS代偿性升高的外周血IL-10含量不足以阻止病情向SIRS方向进展; (2)病情未改善情况下, 长时间CARS过程也会持续性破坏机体免疫功能, 进一步加重胰腺组织损伤, 引发全身严重并发症.
近年来已证实MSCs对AP的治疗机制可能与其通过外周血循环募集于受损胰腺有关. Jung等[20]报道人骨髓MSCs能够迁移至受损胰腺, 修复腺泡细胞结构, 减轻胰腺损伤. 本实验显示MSC大鼠胰腺可见大量明亮蓝色荧光, MC几乎没有, 且病理变化及胰酶指标得到明显改善, 进一步验证以上可能性机制. MSCs治疗SAP的另一潜在机制与调控外周血调节性T细胞有关. CD4+CD25+Tregs是目前研究的较为清楚、与炎症反应较为密切、持续高表达IL-2受体α链(CD25)的调节性T细胞亚型之一. CD4+CD25+Tregs具有免疫抑制性和免疫无能性两大功能, 其免疫抑制性表现在经TCR介导的信号刺激被激活后能够抑制CD4+C25-T淋巴细胞的活化和增殖, 与其分泌的抑制性免疫调节因子(IL-10、TGF-β)及通过细胞表面表达的一些免疫抑制信号分子是分不开的[21,22]. 最近研究[23]显示外周血CD4+CD25+Tregs含量在SAP大鼠中降低, 这种变化与血清TNF-α水平呈负相关, 可引起免疫活化失控, 导致促炎症因子与抗炎症因子失衡, 进一步加重炎症反应. 这与本实验所观察数据一致. 此外, 大量实验证据显示MSCs对CD4+CD25+Tregs具有上调作用, 而后者可参与MSCs的免疫调节作用. Prevosto等[24]将MSCs与同种异体单个核细胞在IL-2存在下共培养72 h, 检测结果证实MSCs能明显增加共培养后CD4+CD25+Tregs所占单个核细胞的百分率. 余劲明等[25]通过体外淋巴细胞增殖实验与体内注射MSCs实验,证实高浓度的大鼠MSCs不仅可以在体外实验中增加CD4+CD25+Tregs的比率, 静脉输入体内后仍具有相同的作用. 以上结果与本实验基本一致, 数据显示外周血CD4+CD25+Tregs含量在MSC与MSCDD显著高于MC, 且MSCDD与SO基本在同一水平. CD4+CD25+Tregs作为具有免疫抑制作用的T淋巴细胞, 可调节促炎-抗炎平衡, 介导CD4+CD25-T细胞的活化和增殖, 诱导CD4+CD25-T细胞凋亡, 从而影响炎症反应的结局[26]. Sun等[27]临床报道AP患者早期给予肠内营养可提高外周血CD4+CD25+Tregs百分比, 且预后较好. 总结以上数据, 我们推断MSCs在体内可能通过诱导外周血CD4+CD25+Tregs的形成, 使后者抑制促炎因子及促进抗炎因子的释放, 进而限制SAP炎症反应.
胰腺腺泡细胞的损伤及坏死是AP的重要特征. Bhatia等[28]曾提出凋亡对AP治疗有益, 因为细胞凋亡可维持质膜的完整性, 防止细胞内促炎因子及胰酶等成分外泄, 因此避免组织自我损伤及SIRS形成. Wang等[29]提出DcqD可能通过诱导腺泡细胞凋亡来减少胰腺局部炎症及病理变化. 此外, 研究表明外周血PMN凋亡延迟在SAP的发生发展中起重要作用, 是胰腺炎患者发生SIRS并进展为MODS的重要环节[30]. O'Neill等[31]报道, 在SAP时, PMN凋亡延迟, 由于SAP炎性反应消退依赖于PMN凋亡, PMN凋亡过程延缓, 存活时间延长, 在多种组织内滞留增加, 此时细胞仅能释放氧自由基等炎症介质和蛋白水解酶, 丧失了吞噬、杀伤等正常的免疫功能, 加重了炎症反应和周围组织损伤, 进而使SAP迁延和恶化. 因此, 可通过诱导PMN凋亡, 适时、适度清除PMN治疗SAP. 本实验及先前课题组实验证实DcqD及其主要活性成分大黄素可诱导PMN凋亡, 减轻炎症反应, 其机制可能与三条经典凋亡通路激活有关, 目前我们已经证实SAP外周血PMN凋亡与Fas配体外源通路及线粒体内源通路激活有关[32,33]. 因此, 我们推测DcqD可能通过分别诱导SAP大鼠腺泡细胞及PMN凋亡, 从而控制SAP时炎症的发生、发展和转归, 限制组织损伤, 降低死亡率.
为进一步研究MSCs与DcqD对SAP大鼠治疗机制差异性, 我们着重观察各治疗组间血清IL-10与CD4+CD25+Tregs水平变化. 数据显示MSCs可显著升高IL-10与CD4+CD25+Tregs水平, 而DacD没有, 并且MSCs联合DcqD对CD4+CD25+Tregs的调节具有协同效果(图5). 本实验最有意义发现是MSCs与DcqD对SAP大鼠治疗的潜在协同作用. 汇总以前与本实验结果, 列举MSCs与DcqD可能潜在协同机制如下: (1)MSCs植入体内后通过血液循环募集于受损胰腺参与胰腺组织的再生与修复; (2)MSCs限制炎症反应机制可能是通过上调外周血CD4+CD25+Tregs百分比, 促使后者促进抗炎因子(如IL-10)及抑制促炎因子(如TNF-α、IL-6)释放; (3)DcqD可能通过诱导腺泡细胞及PMN凋亡来限制胰腺组织损伤, 促进炎症吸收, 控制病情进展; (4)DcqD可通过促进胃肠蠕动, 维持肠黏膜通透性稳定, 阻止肠道菌群或内毒素移位, 从而防止全身严重并发症形成[34]. 所有实验数据显示MSCs与DcqD联合用药比单独使用治疗效果更为明显.
总之, MSCs与DcqD对SAP大鼠均具有一定的治疗效果, 并且在起病早期, 联合用药可能收到协同治疗效果. 本实验提供了一种基于DcqD为代表的中药方剂与MSCs为代表的干细胞联合治疗SAP临床思维方法. 但是该实验也存在一定局限性. 试验样本量不足, MSCs与DcqD的临床药理毒性作用还未完全清楚, 联合用药的剂量、时间以及疗程等均有待以后进一步研究.
重症急性胰腺炎(severe acute pancreatitis, SAP)病情凶险, 死亡率高. 骨髓间充质干细胞(mesenchymal stem cells, MSCs)可参与受损组织的再生与修复; 此外, 其还具有免疫抑制活性及抗炎作用. 大承气汤(Dachengqi decoction, DcqD)可通过诱导胰腺腺泡细胞凋亡、防止腺泡细胞坏死及减轻炎症反应治疗大鼠急性胰腺炎.
陈海龙, 教授, 大连医科大学附属第一医院院办
目前发现单用MSCs或DcqD对急性胰腺炎动物模型均有一定治疗作用, 但还未报道其联合治疗效果, 另外其对SAP的具体作用机制仍不清楚.
在类似研究中, 已经有人报道MSCs治疗SAP可通过参与受损胰腺组织修复及免疫抑制性来发挥作用. 另外有人指出DcqD可能通过诱导腺泡细胞凋亡来治疗急性胰腺炎.
首次提出MSCs联合DcqD治疗SAP可能引起协同效果, 并首次较系统阐明DcqD潜在治疗作用可能是通过促进中性粒细胞及腺泡细胞由坏死转向凋亡而实现的.
本实验提供了一种基于DcqD为代表的中药方剂与MSCs为代表的干细胞联合治疗SAP临床思维方法.
本文探讨MSCs联合DcqD治疗SAP大鼠的治疗效果及机制, 应用于SAP早期时优于单独治疗, 并可能引起协同效果. 提出潜在机制可能是通过参与胰腺损伤修复, 促进中性粒细胞及腺泡细胞由坏死转向凋亡, 以及抑制炎症反应. 该论文具有较好的理论意义, 而且有一定的创新性.
编辑: 郭鹏 电编: 闫晋利
| 2. | Dawra R, Sah RP, Dudeja V, Rishi L, Talukdar R, Garg P, Saluja AK. Intra-acinar trypsinogen activation mediates early stages of pancreatic injury but not inflammation in mice with acute pancreatitis. Gastroenterology. 2011;141:2210-2217.e2. [PubMed] [DOI] |
| 3. | Sah RP, Garg P, Saluja AK. Pathogenic mechanisms of acute pancreatitis. Curr Opin Gastroenterol. 2012;28:507-515. [PubMed] [DOI] |
| 4. | Kylänpää L, Rakonczay Z, O'Reilly DA. The clinical course of acute pancreatitis and the inflammatory mediators that drive it. Int J Inflam. 2012;2012:360685. [PubMed] [DOI] |
| 5. | Stevenson K, Carter CR. Acute pancreatitis. Surgery (Oxford). 2013;31:295-303. [DOI] |
| 6. | Lankisch PG, Lerch MM. Pharmacological prevention and treatment of acute pancreatitis: where are we now? Dig Dis. 2006;24:148-159. [PubMed] [DOI] |
| 7. | Ren YY, Gong HL, Tang WF, Wan MH, Zhao JL, Huang X. [Dachengqi Decoction induces pancreatic acinar cell apoptosis in experimental acute pancreatitis in rats]. Zhongxiyi Jiehe Xuebao. 2009;7:651-656. [PubMed] [DOI] |
| 8. | Wan MH, Li J, Gong HL, Xue P, Zhu L, Chen GY, Xia Q, Wen-Fu T. Clinical observation on the effect of dexamethasone and Chinese herbal decoction for purgation in severe acute pancreatitis patients. Chin J Integr Med. 2011;17:141-145. [PubMed] [DOI] |
| 9. | Jung KH, Yi T, Son MK, Song SU, Hong SS. Therapeutic effect of human clonal bone marrow-derived mesenchymal stem cells in severe acute pancreatitis. Arch Pharm Res. 2015;38:742-751. [PubMed] [DOI] |
| 10. | Tu XH, Song JX, Xue XJ, Guo XW, Ma YX, Chen ZY, Zou ZD, Wang L. Role of bone marrow-derived mesenchymal stem cells in a rat model of severe acute pancreatitis. World J Gastroenterol. 2012;18:2270-2279. [PubMed] [DOI] |
| 12. | Kusske AM, Rongione AJ, Ashley SW, McFadden DW, Reber HA. Interleukin-10 prevents death in lethal necrotizing pancreatitis in mice. Surgery. 1996;120:284-288; discussion 289. [PubMed] |
| 13. | Bhatia M, Neoptolemos JP, Slavin J. Inflammatory mediators as therapeutic targets in acute pancreatitis. Curr Opin Investig Drugs. 2001;2:496-501. [PubMed] |
| 14. | Rau BM, Krüger CM, Schilling MK. Anti-cytokine strategies in acute pancreatitis: pathophysiological insights and clinical implications. Rocz Akad Med Bialymst. 2005;50:106-115. [PubMed] |
| 15. | Cuzzocrea S, Mazzon E, Dugo L, Centorrino T, Ciccolo A, McDonald MC, de Sarro A, Caputi AP, Thiemermann C. Absence of endogenous interleukin-6 enhances the inflammatory response during acute pancreatitis induced by cerulein in mice. Cytokine. 2002;18:274-285. [PubMed] |
| 16. | Masamune A, Shimosegawa T. [Anti-cytokine therapy for severe acute pancreatitis]. Nihon Rinsho. 2004;62:2116-2121. [PubMed] |
| 17. | Mentula P, Kylänpää ML, Kemppainen E, Jansson SE, Sarna S, Puolakkainen P, Haapiainen R, Repo H. Plasma anti-inflammatory cytokines and monocyte human leucocyte antigen-DR expression in patients with acute pancreatitis. Scand J Gastroenterol. 2004;39:178-187. [PubMed] |
| 18. | Chen CC, Wang SS, Lu RH, Chang FY, Lee SD. Serum interleukin 10 and interleukin 11 in patients with acute pancreatitis. Gut. 1999;45:895-899. [PubMed] |
| 19. | Van Laethem JL, Marchant A, Delvaux A, Goldman M, Robberecht P, Velu T, Devière J. Interleukin 10 prevents necrosis in murine experimental acute pancreatitis. Gastroenterology. 1995;108:1917-1922. [PubMed] |
| 20. | Jung KH, Song SU, Yi T, Jeon MS, Hong SW, Zheng HM, Lee HS, Choi MJ, Lee DH, Hong SS. Human bone marrow-derived clonal mesenchymal stem cells inhibit inflammation and reduce acute pancreatitis in rats. Gastroenterology. 2011;140:998-1008. [PubMed] [DOI] |
| 22. | Belkaid Y, Piccirillo CA, Mendez S, Shevach EM, Sacks DL. CD4+CD25+ regulatory T cells control Leishmania major persistence and immunity. Nature. 2002;420:502-507. [PubMed] [DOI] |
| 24. | Prevosto C, Zancolli M, Canevali P, Zocchi MR, Poggi A. Generation of CD4+ or CD8+ regulatory T cells upon mesenchymal stem cell-lymphocyte interaction. Haematologica. 2007;92:881-888. [PubMed] |
| 25. | 余 劲明, 蔡 德鸿, 张 桦, 袁 小澎, 陈 宏. 同种异基因大鼠间充质干细胞移植对体内CD4 CD25 T细胞的影响. 中国组织工程研究与临床康复. 2009;13:137-140. |
| 26. | Tolar J, Hippen KL, Blazar BR. Immune regulatory cells in umbilical cord blood: T regulatory cells and mesenchymal stromal cells. Br J Haematol. 2009;147:200-206. [PubMed] [DOI] |
| 27. | Sun JK, Mu XW, Li WQ, Tong ZH, Li J, Zheng SY. Effects of early enteral nutrition on immune function of severe acute pancreatitis patients. World J Gastroenterol. 2013;19:917-922. [PubMed] [DOI] |
| 28. | Bhatia M. Apoptosis of pancreatic acinar cells in acute pancreatitis: is it good or bad? J Cell Mol Med. 2004;8:402-409. [PubMed] |
| 29. | Wang J, Chen G, Gong H, Huang W, Long D, Tang W. Amelioration of experimental acute pancreatitis with Dachengqi Decoction via regulation of necrosis-apoptosis switch in the pancreatic acinar cell. PLoS One. 2012;7:e40160. [PubMed] [DOI] |
| 30. | Chen HM, Hsu JT, Chen JC, Ng CJ, Chiu DF, Chen MF. Delayed neutrophil apoptosis attenuated by melatonin in human acute pancreatitis. Pancreas. 2005;31:360-364. [PubMed] |
| 31. | O'Neill S, O'Neill AJ, Conroy E, Brady HR, Fitzpatrick JM, Watson RW. Altered caspase expression results in delayed neutrophil apoptosis in acute pancreatitis. J Leukoc Biol. 2000;68:15-20. [PubMed] |
| 33. | 马 江波, 尚 东. 全身炎性反应综合征中性粒细胞线粒体细胞色素的研究进展. 国际病理科学与临床杂志. 2010;30:527-530. |
| 34. | Chen H, Li F, Jia JG, Diao YP, Li ZX, Sun JB. Effects of traditional Chinese medicine on intestinal mucosal permeability in early phase of severe acute pancreatitis. Chin Med J (Engl). 2010;123:1537-1542. [PubMed] |