修回日期: 2015-08-04
接受日期: 2015-08-17
在线出版日期: 2015-09-08
目的: 探讨DR-nm23基因对人结直肠癌细胞SW620生物学特性的影响.
方法: 以无内源性DR-nm23表达组SW620、空白对照组SW620/mock和pGC-FU-DR-nm23-GFP慢病毒转染组SW620/DR-nm23为实验对象, 应用细胞体外实验及体内转移瘤模型检测分析DR-nm23转染前后对结直肠癌细胞增殖、运动、侵袭及转移能力的影响.
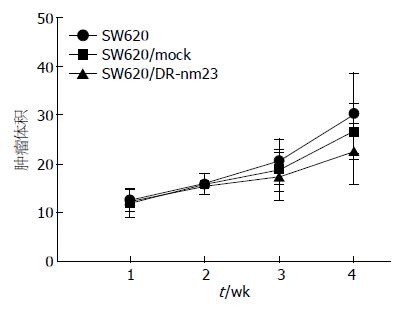
结果: DR-nm23转染后能抑制SW620细胞的体外增殖能力, 通过6 d连续比较, SW620/DR-nm23、SW620/mock和SW620 3组细胞体外生长曲线(F = 15.657, P = 0.002)及平板克隆实验(F = 45.476, P = 0.003)差异有统计学意义. Transwell体外运动小室24 h穿过细胞数分别为SW620/DR-nm23组14.00±1.85, SW620/mock组18.00±2.01, SW620组17.00±1.98, 3组差异有统计学意义(F = 10.746, P = 0.006). Boyden侵袭小室3组差异不显著. SW620/DR-nm23组皮下成瘤能力(F = 5.579, P = 0.008)及肝转移能力较SW620/mock组及SW620组显著减弱.
结论: 外源性DR-nm23基因高表达具有抑制结直肠癌细胞SW620增殖、侵袭及转移的能力, 因此可作为判断结直肠癌患者预后的潜在指标.
核心提示:DR-nm23是肿瘤转移抑制基因家族nm23成员之一. DR-nm23基因高表达具有抑制结直肠癌SW620细胞体内体外增殖、运动及转移的能力, 可作为判断结直肠癌患者预后的潜在指标, 并为进一步深入研究其作用机制奠定理论基础.
引文著录: 曲利娟, 梁莉, 苏娟娟. 上调DR-nm23表达对人结直肠癌细胞SW620生物学特性的影响. 世界华人消化杂志 2015; 23(25): 4024-4031
Revised: August 4, 2015
Accepted: August 17, 2015
Published online: September 8, 2015
AIM: To investigate the effect of DR-nm23 overexpression on biological characteristics of human colorectal carcinoma SW620 cells.
METHODS: SW620 cells were divided into three groups: non-endogenous expression (SW620) group, mock control (SW620/mock) group, and recombinant lentiviral expression vector pGC-FU-DR-nm23-GFP transfected (SW620/DR-nm23) group. Both in vitro cell experiments and in vivo xenograft tumor model assay were carried out to investigate the role of DR-nm23 in regulation of colorectal cancer cell proliferation, movement, invasion and metastasis.
RESULTS: Induced overexpression of DR-nm23 in SW620 cells via lentiviral infection resulted in significant inhibition of cell proliferation as revealed by cell growth curve (F = 15.657, P = 0.002) and clonogenic assay (F = 45.476, P = 0.003) in vitro. Meanwhile, Transwell assay showed that the numbers of cells that passed the membrane in the SW620/DR-nm23 group, SW620/mock group and SW620 group were 14.00 ± 1.85, 18.00 ± 2.01, and 17.00 ± 1.98, respectively, indicating that the migration ability was also significantly impaired in the SW620/DR-nm23 group (F = 10.746, P = 0.006). There was no significant difference in the three groups in Boyden chamber assay. Besides, the growth rate (F = 5.579, P = 0.008) and liver metastasis rate of the SW620/DR-nm23 group were significantly reduced as compared with those of the SW620 or SW620/mock group in vivo.
CONCLUSION: Overexpression of DR-nm23 may inhibit the invasive and metastatic capabilities of colorectal carcinoma SW620 cells. Thus, expression status of DR-nm23 may act as a potential prognostic factor in patients with colorectal cancer.
- Citation: Qu LJ, Liang L, Su JJ. Effect of DR-nm23 overexpression on biological characteristics of human colorectal carcinoma SW620 cells. Shijie Huaren Xiaohua Zazhi 2015; 23(25): 4024-4031
- URL: https://www.wjgnet.com/1009-3079/full/v23/i25/4024.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i25.4024
DR-nm23是肿瘤转移抑制基因家族nm23成员之一[1]. 有关DR-nm23与结直肠癌的关系, 文献中除了本课题组前期研究证实DR-nm23基因和蛋白在结直肠癌组织中的表达低于正常黏膜组织、且与淋巴结转移负相关外[2,3], 未检索到其他相关报道. 随后我们又成功构建稳定表达pGC-FU-DR-nm23-GFP慢病毒载体的SW620/DR-nm23细胞系[4]. 本文拟通过观察比较DR-nm23转染前后, 对结直肠癌细胞体外增殖、运动、侵袭及体内成瘤、转移等生物学特性的影响, 进一步探讨其参与结直肠癌侵袭转移的分子机制.
SW620/DR-nm23和SW620/mock分别系课题组前期实验[4]获得的转染pGC-FU-DR-nm23-GFP重组慢病毒、pGC-FU-GFP空载体的结直肠癌细胞系. SPF级4-6 wk裸鼠购自上海斯莱克实验动物有限责任公司; Transwell运动小室购自Corning公司; Boyden侵袭小室购自Chemicon公司. DMEM培养基购自GIBCO; 胎牛血清、DMSO、胰酶、琼脂糖等试剂分别购自上海捷倍思、上海微科、上海化学试剂公司.
1.2.1 细胞培养: 采用含10%胎牛血清DMEM培养液, 37 ℃、50 mL/L CO2条件下培养, 取生长状态良好的细胞用于实验.
1.2.2 细胞生长曲线实验: 以SW620/DR-nm23、SW620/mock和SW620细胞为实验对象. 以2×103/孔细胞接种于96孔板, 分别培养1-6 d, 每孔加10 μL CCK-8溶液, 继续培养0.5 h, 用Biol-Rad酶联免疫检测仪在570 nm测光度A值. 每组设3个重复孔, 取平均值, 绘制增殖曲线.
1.2.3 细胞平板克隆实验: 以1×102/孔细胞接种于6孔板, 每种细胞接种3孔, 轻晃均匀分散细胞, 37 ℃、50 mL/L CO2培养箱孵育2 wk, 肉眼可见细胞克隆, 弃培养液, PBS洗2次, 空气干燥; 甲醇固定15 min, 弃甲醇, 空气干燥; Giemsa染色15 min, 流水缓慢洗去染液, 空气干燥; 显微镜下计数>50个细胞的克隆数. 平板克隆形成率 = 形成克隆数/接种细胞数×100%.
1.2.4 细胞运动实验: 培养细胞密度达80%时, 0.25%胰酶消化, 制成单细胞悬液, 用无血清RPMI 1640调节细胞密度为0.5×105/mL. 采用Transwell小室, 上下室之间铺8 μm孔径聚碳酸酯微孔膜. 向上室加入无血清培养基孵育90 min后, 接种0.5×105个/mL的单细胞悬液200 μL, 下室加500 μL含10%胎牛血清的完全培养基作为趋化因子, 37 ℃、50 mL/L CO2湿化培养箱孵育24 h. 取出小室, 吸掉培养液, 用棉签轻轻拭去未穿膜细胞, 中性甲醛固定, Giemsa染色15 min. 在200倍显微镜下取上、下、左、右、中心5个视野, 计数穿膜细胞数, 取其均值代表浸润力量值.
1.2.5 细胞侵袭实验: 采用Boyden小室, 聚碳酸酯膜孔径8 μm, 上室加300 μL无血清DMEM培养液, 37 ℃、50 mL/L CO2培养箱孵育1-2 h, 构建人工基底膜ECMatrix; 吸净上室培养液, 接种0.5×106-1.0×106个/mL的单细胞悬液300 μL, 下室加500 μL含10%胎牛血清的完全培养基; 37 ℃、50 mL/L CO2孵育48 h. 取出滤膜, 用棉签轻轻拭去未穿膜细胞, 中性甲醛固定, Giemsa染色15 min. 200倍显微镜下随机取5个视野, 计数穿膜细胞数, 取其均值.
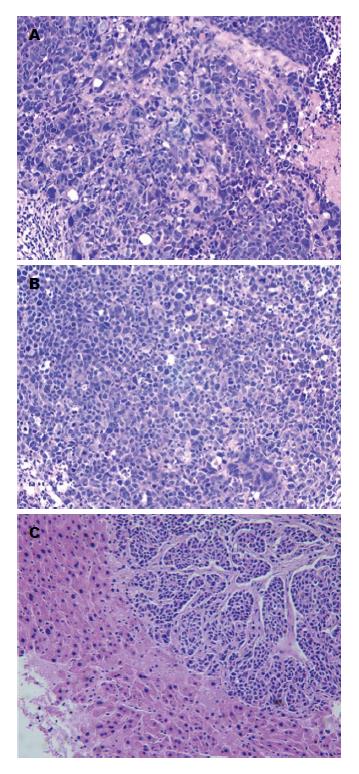
1.2.6 原位移植法皮下成瘤及体内转移实验: 取对数生长期细胞, 0.25%胰酶消化, 无血清培养基洗3次, 细胞计数; 裸鼠9只, 分3组, 每组3只, 分别取5×106个SW620/DR-nm23、SW620/mock、SW620细胞注射于裸鼠右下臀部皮下, LT-9MACIMSYSPULS整体荧光体视镜实时观察、采集、测量肿瘤体积, 绘制生长曲线; 28 d后处死裸鼠, 无菌条件下将皮下瘤块切成1 mm3/块, 置于冰上备用. 裸鼠24只, 分3组, 每组8只, 1%戊巴比妥钠0.1 mL/kg腹腔注射麻醉4-6 wk裸鼠, 固定裸鼠, 取右下腹部切口消毒皮肤、逐层切开进腹, 暴露结肠, 将瘤块缝于肠壁原位, 缝合皮肤; 术后继续在SPF条件下饲养; 整体荧光体视镜实时活体观察, 8 wk后处死裸鼠, 取材结肠肿瘤、肝、脾、肾、肺组织, 40 g/L甲醛固定、石蜡包埋、切片、HE染色, 显微镜下观察.
统计学处理 应用SPSS13.0软件进行统计学分析, 组间差异以单因素方差分析进行检验, P<0.05为差异有统计学意义.
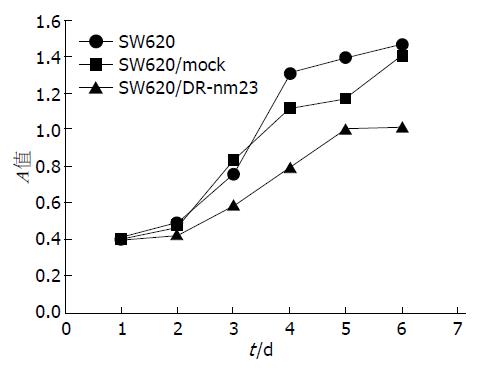
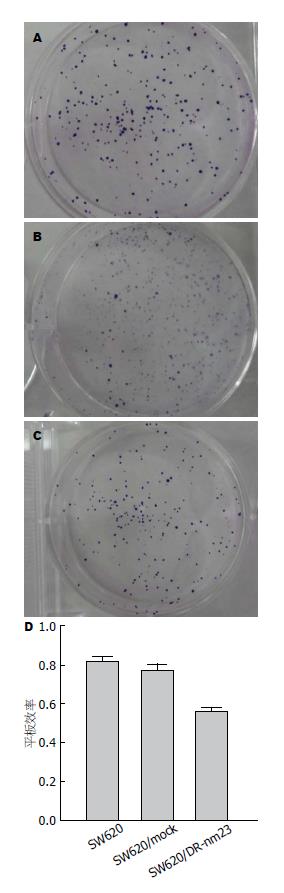
CCK-8法观察体外细胞生长状态, 通过6 d连续比较, 3组细胞增殖能力差异有统计学意义(F = 15.657, P = 0.002)(图1). 平板克隆形成观察细胞增殖状态, SW620/DR-nm23组细胞平板克隆率较SW620/mock组和SW620组慢, SW620/DR-nm23组20%, SW620/mock组50%, SW620组70%, 3组差异显著(F = 45.476, P = 0.003)(图2). DR-nm23基因具有抑制结直肠癌细胞增殖的能力.
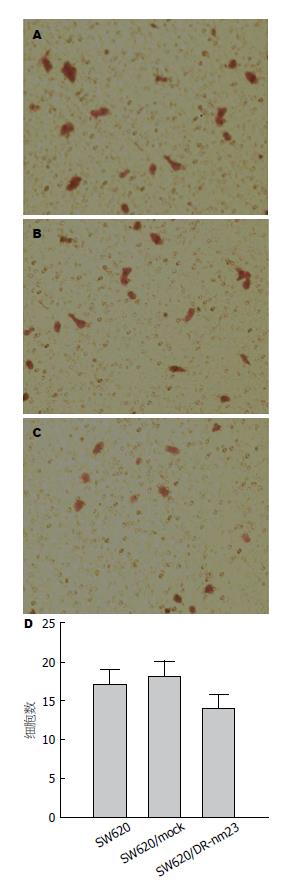
Transwell小室法检测3组细胞运动能力, 24 h后观察3组细胞均可通过变形运动穿过聚碳酸酯微孔膜进入下室, 并对下室细胞进行计数, SW620/DR-nm23组14.00±1.85, SW620/mock组18.00±2.01, SW620组17.00±1.98. 3组差异显著(F = 10.746, P = 0.006)(图3). DR-nm23基因具有抑制结直肠癌细胞体外运动的能力.
Boyden侵袭小室重复多次实验, 24 h、48 h观察3组中每组仅个别细胞穿透基底膜, 结果无统计学意义.
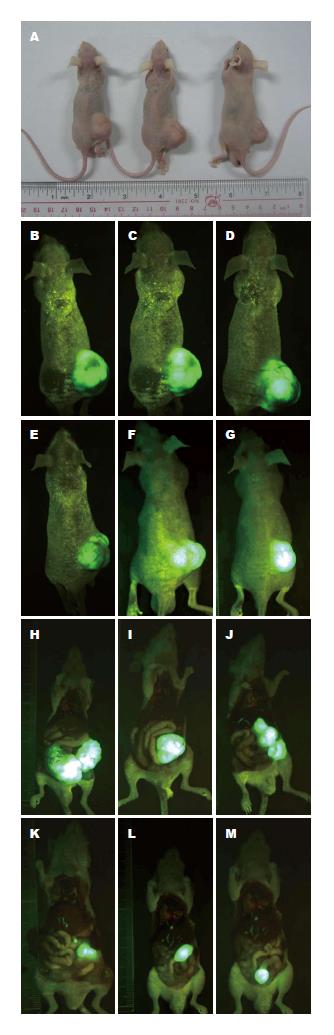
实时观察测量皮下肿瘤的体积, 绘制肿瘤皮下生长曲线, SW620/DR-nm23组皮下成瘤能力分别弱于SW620/mock组及SW620组, 3组差异显著(F = 5.579, P = 0.008). 结肠原位接种8 wk后, SW620/DR-nm23组肝转移率12.5%(1/8), SW620/mock组及SW620组肝转移率均为37.5%(3/8), 其余脏器均未见转移病灶. 提示DR-nm23具有抑制结直肠癌细胞体内成瘤及转移的能力(图4-6).
结直肠癌是常见的消化系恶性肿瘤, 在我国城市地区, 结直肠癌在恶性肿瘤发病率和死亡率的排名中均位列第三[5]. 侵袭和转移是导致结直肠癌患者死亡的主要原因, 临床上超过半数的患者在行根治手术之前已经出现了微转移, 这也是导致结直肠癌患者术后复发和转移的直接原因[6]. 因此, 鉴定特异性转移相关基因, 对结直肠癌的早期诊断、预后判断、提高治疗效果及降低死亡率均具有重要意义.
nm23家族作为经典的肿瘤转移抑制基因早已引起人们的广泛关注[7-10]. 已知哺乳动物体内存在超过10种nm23, 研究最多的是nm23-H1和nm23-H2, DR-nm23即nm23-H3. nm23也是高度保守的多功能蛋白家族, 具有二磷酸核苷激酶(nucleoside diphosphate kinase, NDPK)活性、组氨酸蛋白激酶活性、丝氨酸自身磷酸化等特性, 参与了众多与细胞分化和增殖等相关的活动[11-13]. Salerno等[13]研究发现, KSR1是Ras1激酶抑制剂, nm23通过调控组氨酸蛋白激酶活性使KSR1的392位丝氨酸发生磷酸化作用, 继而下调Ras1活性, 抑制Ras-Raf-MEK细胞存活信号通路, 抑制乳腺癌细胞生长. nm23还可通过活化糖原合成激酶-3β(glycogen synthase kinase-3β, GSK-3β)抑制Wnt信号通路, Wnt通路对肿瘤发生发展具有重要调节作用, β-catenin是Wnt通路的关键分子[14,15]. 抑制GSK-3β活性使β-catenin不被磷酸化而发生聚集, 激活TCF促进细胞的增殖分化; 反之, GSK-3β活化使β-catenin发生降解, 抑制细胞的分化和增殖[16,17]. 本实验研究与上述结果相似, SW620细胞转染DR-nm23后, 其体外生长、平板克隆及裸鼠体内成瘤显著受到抑制, 提示DR-nm23亦具有抑制结直肠癌细胞体内外分化和增殖的能力.
结直肠癌的侵袭和转移是一个复杂的病理过程, 受多种基因/蛋白-肿瘤抑制级链反应的调控, 其中肿瘤细胞运动行为的改变和运动能力的增强是促进细胞迁徙运动所必不可少的, 该过程需要肌动蛋白和微管蛋白的不断重建[18,19]. 本课题体外运动实验结果显示, DR-nm23转染后, SW620细胞的运动能力明显减弱(P<0.01); 而且利用整体可视化动物模型实时观察DR-nm23转染前后SW620细胞裸鼠皮下成瘤和转移情况, 也发现转染后成瘤灶大小和转移率小于转染前. 以上结果提示DR-nm23与结直肠癌的发生和转移密切相关, 可能通过影响细胞运动而抑制结直肠癌侵袭转移的能力.
Venturelli等[1]研究DR-nm23基因结构发现, 与nm23家族其他成员一样, 该基因也存在精氨酸-甘氨酸-天冬氨酸(arginine-glycine-asparagine, RGD)序列. RGD存在于多种黏附蛋白分子中, 是细胞表面与整合素受体特异性结合的配体, 参与细胞骨架蛋白微丝聚合、维持细胞头部稳定性及细胞定向迁移等过程, 在肿瘤侵袭转移和信号转导方面发挥重要生物学效应[20-22]. 一些研究[23,24]表明nm23通过RGD与整合素相互作用, 使下游效应分子Talin、Vinculin、Paxillin及F-actin等细胞骨架蛋白表达发生改变, 影响结直肠癌细胞黏附、迁移及转移等生物学行为; 另一方面, 作为上游效应分子, nm23激活黏着斑激酶(FAK), 活化RhoA/ROCK信号通路及其下游效应分子如p-MLC、p-LIM1和p-cofilin等, 参与调控肌动蛋白微丝聚合、肌动蛋白重塑、细胞收缩性及定向细胞运动[25-29].
此外, DR-nm23基因遗传结构的改变可能也与肿瘤细胞迁徙运动有关, 134位组氨酸残基H134和136位丝氨酸残基S136与NDPK活性密切有关, 突变(H134Q及S136P)失活的NDPK不能将微管蛋白tubulin上的GDP转化为GTP, 使tubulin与GDP结合, 微管解聚, 细胞无法维持正常形态而引起运动, 进而促进肿瘤浸润和转移[30].
课题组Boyden侵袭小室多次实验发现, DR-nm23基因转染前后, 3组SW620细胞穿透基底膜的数量均极少. 可能的原因是SW620细胞本身运动能力较弱, 通过变形运动进入下室的细胞数目较少; 转染后SW620/DR-nm23细胞运动能力更加减弱, 进入下室的细胞数目更少. 而Boyden侵袭小室又是在Transwell小室基础上重新构建人工基底膜ECMatrix, 可想而知细胞更加难以穿透. 由于细胞计数太少, 故不具有统计学意义.
总之, DR-nm23基因具有抑制结直肠癌细胞SW620增殖、运动及转移的能力, 可作为判断结直肠癌患者预后的潜在指标, 并为进一步深入研究其作用机制奠定了理论基础.
结直肠癌是常见的消化系恶性肿瘤, 在我国城市地区, 结直肠癌在恶性肿瘤发病率和死亡率的排名中均位列第三. 侵袭和转移是导致结直肠癌患者死亡的主要原因, 临床上超过半数的患者在行根治手术之前已经出现了微转移, 这也是导致结直肠癌患者术后复发和转移的直接原因. 因此, 鉴定特异性转移相关基因, 对结直肠癌的早期诊断、预后判断、提高治疗效果及降低死亡率均具有重要意义.
文彬, 研究员, 广州中医药大学脾胃研究所
近年来DR-nm23基因与多种肿瘤形成和进展等方面的研究越来越受到关注, 但DR-nm23与结直肠癌侵袭转移的相关性研究未见报道.
Venturelli等研究发现DR-nm23基因存在精氨酸-甘氨酸-天冬氨酸(arginine-glycine-asparagine, RGD)序列. RGD存在于多种黏附蛋白分子中, 是细胞表面与整合素受体特异性结合的配体.一方面通过调控下游效应分子Talin、Vinculin、Paxillin及F-actin等细胞骨架蛋白表达发生改变,参与细胞骨架蛋白微丝聚合、维持细胞头部稳定性及细胞定向迁移等过程; 另一方面, 作为上游效应分子激活黏着斑激酶, 活化RhoA/ROCK信号通路及其下游效应分子如p-MLC、p-LIM1和p-cofilin等, 参与调控肌动蛋白微丝聚合、肌动蛋白重塑、细胞收缩性及定向细胞运动, 在肿瘤侵袭转移和信号转导方面发挥重要生物学效应.
关于DR-nm23与结直肠侵袭转移的关系, 文献中除了本课题组前期研究证实DR-nm23基因和蛋白在结直肠癌组织中的表达低于正常黏膜组织、且与淋巴结转移负相关外, 未检索到其他相关报道. 随后我们成功构建稳定表达pGC-FU-DR-nm23-GFP慢病毒载体的SW620/DR-nm23细胞系, 本文通过观察比较DR-nm23转染前后, 对结直肠癌细胞体外增殖、运动、侵袭及体内成瘤、转移等生物学特性的影响, 进一步探讨其参与结直肠癌侵袭转移的分子机制.
DR-nm23基因高表达具有抑制结直肠癌SW620细胞增殖、侵袭及转移的能力, 可作为反映结直肠癌生物学行为和判断结直肠癌患者预后的潜在指标.
DR-nm23: 又称nm23-H3或NME3, 是1995年Venturelli等利用cDNA文库差异显示筛选技术, 从慢性粒细胞性白血病急性发作期的原代细胞中克隆出, 与nm23-H1和nm23-H2具有65%-70%同源性; nm23家族具有二磷酸核苷激酶活性、组氨酸蛋白激酶活性、丝氨酸自身磷酸化等特性, 参与众多与细胞分化和增殖等相关的活动.
本研究内容是一个系列研究, 前期已成功构建稳定表达慢病毒转染细胞系, 在本研究中进一步进行裸鼠移植瘤实验及体外细胞增殖、侵袭及运动能力的研究, 课题设计合理、研究结果可信.
编辑: 郭鹏 电编: 都珍珍
| 1. | Venturelli D, Martinez R, Melotti P, Casella I, Peschle C, Cucco C, Spampinato G, Darzynkiewicz Z, Calabretta B. Overexpression of DR-nm23, a protein encoded by a member of the nm23 gene family, inhibits granulocyte differentiation and induces apoptosis in 32Dc13 myeloid cells. Proc Natl Acad Sci USA. 1995;92:7435-7439. [PubMed] [DOI] |
| 7. | Kim HD, Youn B, Kim TS, Kim SH, Shin HS, Kim J. Regulators affecting the metastasis suppressor activity of Nm23-H1. Mol Cell Biochem. 2009;329:167-173. [PubMed] [DOI] |
| 8. | Marino N, Marshall JC, Collins JW, Zhou M, Qian Y, Veenstra T, Steeg PS. Nm23-h1 binds to gelsolin and inactivates its actin-severing capacity to promote tumor cell motility and metastasis. Cancer Res. 2013;73:5949-5962. [PubMed] [DOI] |
| 9. | Fancsalszky L, Monostori E, Farkas Z, Pourkarimi E, Masoudi N, Hargitai B, Bosnar MH, Deželjin M, Zsákai A, Vellai T. NDK-1, the homolog of NM23-H1/H2 regulates cell migration and apoptotic engulfment in C. elegans. PLoS One. 2014;9:e92687. [PubMed] [DOI] |
| 10. | Carotenuto M, Pedone E, Diana D, de Antonellis P, Džeroski S, Marino N, Navas L, Di Dato V, Scoppettuolo MN, Cimmino F. Neuroblastoma tumorigenesis is regulated through the Nm23-H1/h-Prune C-terminal interaction. Sci Rep. 2013;3:1351. [PubMed] [DOI] |
| 11. | Boissan M, Dabernat S, Peuchant E, Schlattner U, Lascu I, Lacombe ML. The mammalian Nm23/NDPK family: from metastasis control to cilia movement. Mol Cell Biochem. 2009;329:51-62. [PubMed] [DOI] |
| 12. | Postel EH, Zou X, Notterman DA, La Perle KM. Double knockout Nme1/Nme2 mouse model suggests a critical role for NDP kinases in erythroid development. Mol Cell Biochem. 2009;329:45-50. [PubMed] [DOI] |
| 13. | Salerno M, Palmieri D, Bouadis A, Halverson D, Steeg PS. Nm23-H1 metastasis suppressor expression level influences the binding properties, stability, and function of the kinase suppressor of Ras1 (KSR1) Erk scaffold in breast carcinoma cells. Mol Cell Biol. 2005;25:1379-1388. [PubMed] [DOI] |
| 14. | Huang C, Ma R, Xu Y, Li N, Li Z, Yue J, Li H, Guo Y, Qi D. Wnt2 promotes non-small cell lung cancer progression by activating WNT/β-catenin pathway. Am J Cancer Res. 2015;5:1032-1046. [PubMed] |
| 15. | Huang J, Xiao D, Li G, Ma J, Chen P, Yuan W, Hou F, Ge J, Zhong M, Tang Y. EphA2 promotes epithelial-mesenchymal transition through the Wnt/β-catenin pathway in gastric cancer cells. Oncogene. 2014;33:2737-2747. [PubMed] [DOI] |
| 16. | Ji XK, Xie YK, Zhong JQ, Xu QG, Zeng QQ, Wang Y, Zhang QY, Shan YF. GSK-3β suppresses the proliferation of rat hepatic oval cells through modulating Wnt/β-catenin signaling pathway. Acta Pharmacol Sin. 2015;36:334-342. [PubMed] [DOI] |
| 18. | Sokolowski JD, Gamage KK, Heffron DS, Leblanc AC, Deppmann CD, Mandell JW. Caspase-mediated cleavage of actin and tubulin is a common feature and sensitive marker of axonal degeneration in neural development and injury. Acta Neuropathol Commun. 2014;2:16. [PubMed] [DOI] |
| 19. | Schappi JM, Krbanjevic A, Rasenick MM. Tubulin, actin and heterotrimeric G proteins: coordination of signaling and structure. Biochim Biophys Acta. 2014;1838:674-681. [PubMed] |
| 20. | Amendola R, Martinez R, Negroni A, Venturelli D, Tanno B, Calabretta B, Raschellà G. DR-nm23 gene expression in neuroblastoma cells: relationship to integrin expression, adhesion characteristics, and differentiation. J Natl Cancer Inst. 1997;89:1300-1310. [PubMed] [DOI] |
| 21. | Amendola R, Martinez R, Negroni A, Venturelli D, Tanno B, Calabretta B, Raschellà G. DR-nm23 expression affects neuroblastoma cell differentiation, integrin expression, and adhesion characteristics. Med Pediatr Oncol. 2001;36:93-96. [PubMed] |
| 22. | She S, Xu B, He M, Lan X, Wang Q. Nm23-H1 suppresses hepatocarcinoma cell adhesion and migration on fibronectin by modulating glycosylation of integrin beta1. J Exp Clin Cancer Res. 2010;29:93. [PubMed] [DOI] |
| 23. | Toquet C, Colson A, Jarry A, Bezieau S, Volteau C, Boisseau P, Merlin D, Laboisse CL, Mosnier JF. ADAM15 to α5β1 integrin switch in colon carcinoma cells: a late event in cancer progression associated with tumor dedifferentiation and poor prognosis. Int J Cancer. 2012;130:278-287. [PubMed] [DOI] |
| 24. | Lee M, Lee HJ, Seo WD, Park KH, Lee YS. Sialylation of integrin beta1 is involved in radiation-induced adhesion and migration in human colon cancer cells. Int J Radiat Oncol Biol Phys. 2010;76:1528-1536. [PubMed] [DOI] |
| 25. | Wong CC, Wong CM, Au SL, Ng IO. RhoGTPases and Rho-effectors in hepatocellular carcinoma metastasis: ROCK N'Rho move it. Liver Int. 2010;30:642-656. [PubMed] [DOI] |
| 26. | Kamai T, Tsujii T, Arai K, Takagi K, Asami H, Ito Y, Oshima H. Significant association of Rho/ROCK pathway with invasion and metastasis of bladder cancer. Clin Cancer Res. 2003;9:2632-2641. [PubMed] |
| 27. | Ridley AJ. Rho GTPases and cell migration. J Cell Sci. 2001;114:2713-2722. [PubMed] |
| 28. | Luo L. Rho GTPases in neuronal morphogenesis. Nat Rev Neurosci. 2000;1:173-180. [PubMed] [DOI] |
| 29. | Sahai E, Marshall CJ. Differing modes of tumour cell invasion have distinct requirements for Rho/ROCK signalling and extracellular proteolysis. Nat Cell Biol. 2003;5:711-719. [PubMed] [DOI] |
| 30. | Venturelli D, Cesi V, Ransac S, Engelhard A, Perrotti D, Calabretta B. The nucleoside diphosphate kinase activity of DRnm23 is not required for inhibition of differentiation and induction of apoptosis in 32Dcl3 myeloid precursor cells. Exp Cell Res. 2000;257:265-271. [PubMed] [DOI] |