修回日期: 2015-08-11
接受日期: 2015-08-17
在线出版日期: 2015-09-08
目的: 探讨白芍总苷对大鼠体外循环后肝损伤的保护作用及其机制.
方法: 将200只白鼠按照随机分组方式分为对照组、假手术组、低剂量组、中剂量组和高剂量组. 利用显微外科器械和微型化体外循环环路设备, 对除假手术组外大鼠进行体外循环. 低、中、高剂量组大鼠在进行体外循环时分别在体外循环预充液中按照0.6、1.2和1.8 mg/kg加入白芍总苷. 在体外循环2 h后, 对各组大鼠血清转氨酶、总胆红素、前白蛋白、转铁蛋白、C反应蛋白、血清淀粉样蛋白A、肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)、白介素-1β(interleukin-1β, IL-1β)、IL-6、血清生长激素(growth hormone, GH)、生长激素结合蛋白(growth hormone binding protein, GHBP)、胰岛素样生长因子-1(insulin-like growth factor-1, IGF-1)和胰岛素样生长因子结合蛋白-3(insulin-like growth factor binding protein-3, IGFBP-3)进行检测, 肝细胞胆盐转运蛋白: 钠/牛黄胆酸盐共转运子(Na+/taurocholate cotransporting polypeptide, NTCP)、胆盐输出泵(bile salt export pump, BSEP)、类法尼醇X受体(farnesoid X receptor, FXR)进行检测.
结果: 实验发现, 对照组大鼠经过处理后血清转氨酶和总胆红素、前白蛋白、转铁蛋白、C反应蛋白、血清淀粉样蛋白A、TNF-α、IL-1β、IL-6显著高于假手术组(P<0.05), 低、中、高剂量组上述指标显著低于对照组. GH、GHBP、IGF-1和IGFBP-3含量显著低于假手术组(P<0.05). 而肝细胞胆盐转运蛋白NTCP、BSEP、FXR含量也显著低于假手术组(P<0.05). 低、中、高剂量组显著高于对照组. 且各剂量组在各项检查指标中也存在显著差异(P<0.05).
结论: 白芍总苷可以保护大鼠体外循环导致的肝损伤.
核心提示: 白芍总苷保护大鼠体外循环后出现的肝损伤的机制可能是降低其炎症反应, 抑制其生长激素抵抗, 从而保护肝细胞, 增强其胆盐转运蛋白表达相关.
引文著录: 顾敏威, 张勇, 孙振宇. 白芍总苷对大鼠体外循环后肝损伤的保护作用. 世界华人消化杂志 2015; 23(25): 3997-4004
Revised: August 11, 2015
Accepted: August 17, 2015
Published online: September 8, 2015
AIM: To investigate the effect of total glucosides of paeony (TGP) on rat hepatic injury after cardiopulmonary bypass (CPB) and the underlying mechanism.
METHODS: Two hundred rats were randomly divided into a control group, a sham operation group, low-, medium- and high-dose TGP groups. Except the sham operation group, all other groups received CPB. In the low-, medium- and high-dose TGP treatment groups, 0.6, 1.2 and 1.8 mg/kg TGP was added into the priming solution, respectively. After 2 h of CPB, serum levels of transaminases, total bilirubin, prealbumin, transferrin, C-reactive protein, serum amyloid A, tumor necrosis factor alpha (TNF-α), interleukin-1β (IL-1β), IL-6, growth hormone (GH), growth hormone binding protein (GHBP), insulin-like growth factor-1 (IGF-1) and insulin-like growth factor binding protein-3 (IGFBP-3) were detected. Also, the expression of Na+/taurocholate cotransporting polypeptide (NTCP), bile salt export pump (BSEP) and farnesoid X receptor (FXR) in the liver was tested.
RESULTS: Serum levels of glutamic pyruvic transaminase, aspartate transaminase, total bilirubin, prealbumin, transferrin, C-reactive protein, serum amyloid A protein, TNF-α, IL-1β, and IL-6 were significantly higher in the control group after treatment than in the sham operation group (P < 0.05); however, these parameters were significantly lower in the three treatment groups than in the control group (P < 0.05). Serum levels of GH, GHBP, IGF-1 and IGFBP-3 as well as hepatic expression of NTCP, BSEP and FXR were significantly lower in the control group than in the sham operation group (P < 0.05); however, these parameters were significantly higher in the three treatment groups than in the control group (P < 0.05). There were significant differences in all parameters among the three treatment groups (P < 0.05).
CONCLUSION: TGP can protect against liver injury caused by CPB in rats.
- Citation: Gu MW, Zhang Y, Sun ZY. Effect of total glucosides of paeony on rat hepatic injury after cardiopulmonary bypass. Shijie Huaren Xiaohua Zazhi 2015; 23(25): 3997-4004
- URL: https://www.wjgnet.com/1009-3079/full/v23/i25/3997.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i25.3997
体外循环是目前多种心胸外科手术必须的条件, 但是由于其本身对于全身是一种极强的刺激, 容易导致机体产生过强的应激反应[1,2]. 因此, 相应而来的炎症反应和组织损伤成为了心胸外科手术患者死亡的原因之一. 此前, 人们主要将这种应激反应导致的不良后果的关注点放在了心、肺、脑等器官上, 但是其对于肝脏的损伤, 人们却重视不足. 我们发现体外循环后, 很多患者存在着血清转氨酶和胆红素升高, 血清前白蛋白及转铁蛋白降低, 提示肝功能受损. 因此找到一种可以有效保护体外循环患者在手术过程中及手术后肝功能的方法十分重要[3,4]. 本研究正是为了探寻白芍总苷对于体外循环导致的肝损伤的作用和机制, 现在汇报如下.
健康成年♂清洁级大鼠, 购自中国人民解放军第三军医大学实验动物中心, 体质量为480 g±35 g, 在恒温、清洁环境下饲养. 白芍总苷粉剂由安徽医科大学临床药理研究所赠送. 阿托品、乌拉特、肝素钠、乳酸林格氏液等由中国人民解放军第三军医大学实验药品管理中心提供.
1.2.1 分组和手术: 将健康成年清洁级大鼠按照随机分组的方式分为对照组、假手术组、低、中、高剂量组, 每组10只. 除假手术组外, 每组大鼠均接受手术干预. 将大鼠禁食12 h, 禁水6 h后, 在手术前皮下注射阿托品, 剂量为0.3 mg/kg. 用乌拉坦1 mg/kg腹腔注射麻醉, 然后将颈部及双侧股部脱毛, 碘伏消毒, 仰卧位固定, 气管切开, 用呼吸机辅助呼吸, 分离左侧股动脉, 插入静脉留置针, 接动脉血压及血气检测, 控制PaCO2在35-40 mmHg. 分离左侧颈动脉, 右侧颈静脉, 结扎, 右侧颈静脉注射肝素钠300 IU/kg. 左侧颈动脉插动脉灌注管, 经右侧颈静脉插入静脉留置针, 穿刺到右心房水平. 体外循环环路为左颈动脉灌注, 右侧颈静脉引流. 体外循环环路由滚压式血泵, 变温水箱, 贮血器, 静脉引流管, 动脉引流管和中空纤维膜氧合器组成. 预充液16 mL, 氧合器和热交换器10 mL, 其他管道6 mL. 对照组预充液由同种大鼠血液, 血定安, 5%碳酸氢钠和甘露醇, 肝素钠组成. 低、中、高剂量组大鼠预充液中分别加入白芍总苷, 加入剂量分别为0.6、1.2和1.8 mg/kg. 每只大鼠在体外循环状态处理150 min. 然后停机, 根据大鼠血压心率等情况给予多巴胺, 多巴酚丁胺, 补血补液等处理. 然后待大鼠清醒, 呼吸循环稳定后拔除气管导管和动静脉穿刺管, 观察大鼠情况. 假手术组所有大鼠仅进行手术干预, 干预方法同上但不进行体外循环[5,6].
1.2.2 检测指标: 各组大鼠在进行麻醉后手术开始前和手术干预清醒后3 h经下腔静脉取血3 mL进行检测, 检测大鼠血清谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate transaminase, AST)、总胆红素、前白蛋白、转铁蛋白、C反应蛋白、血清淀粉样蛋白A、肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)、白介素-1β(interleukin-1β, IL-1β)、IL-6、血清生长激素(growth hormone, GH)、生长激素结合蛋白(growth hormone binding protein, GHBP)、胰岛素样生长因子-1(insulin-like growth factor-1, IGF-1)和胰岛素样生长因子结合蛋白-3(insulin-like growth factor binding protein-3, IGFBP-3)检测. 然后将所有大鼠处死, 取整个肝脏组织, 磨成匀浆, 通过Western blot检测其钠/牛黄胆酸盐共转运子(Na+/taurocholate cotransporting polypeptide, NTCP)、胆盐输出泵(bile salt export pump, BSEP)、类法尼醇X受体(farnesoid X receptor, FXR)含量. Western blot检测方法如下: 首先提取肝组织膜蛋白, 方法为使用蛋白裂解液A 10 mL加入肝组织匀浆中, 然后800 r/min, 离心匀浆10 min, 再将取得上清在100000 r/min, 离心1 h, 弃上清, 用蛋白裂解液B重悬, 在冰上孵育2 h, 离心1000 r/min, 30 min, 最后取得膜蛋白. 然后检测蛋白浓度, 最后进行Western blot检测. 方法为安装电泳仪玻璃板, 然后配置分离胶溶液, 灌注于两个玻璃板间, 流出灌注积层胶的空间用dH2O覆盖, 放置30 min后倒出覆盖液体, 三蒸水冲洗顶部数次后, 灌注积层胶溶液, 插入梳子, 放置30 min后取出数字, 加入三蒸水, 将凝胶固定于电泳仪上, 加入电泳缓冲液, 将样品加热后立即插入冰水中点样, 每个孔加样25 μL, 电泳2-3 h, 然后用1×转移缓冲液浸泡硝酸纤维素滤膜, 然后取下凝胶, 打开夹板, 黑色朝下, 依次放上海绵、滤纸、凝胶和硝酸纤维素滤膜, 在依次放置滤纸、海绵, 然后安装于电泳槽中按电压100 V于冰盒中, 时间100 min, 最后用丽春红染色, 漂洗, 封闭, 漂洗滤膜, 在室温下加入一抗, 孵育过夜, 然后漂洗加入二抗, 孵育1 h, 最后洗去抗体, 加入发光剂, 排干, 显影[7,8].
统计学处理 本研究所有研究数据均采用SPSS13.0统计软件包进行ANOVA方差分析、配对t检验处理, P<0.05为差异具有统计学意义.
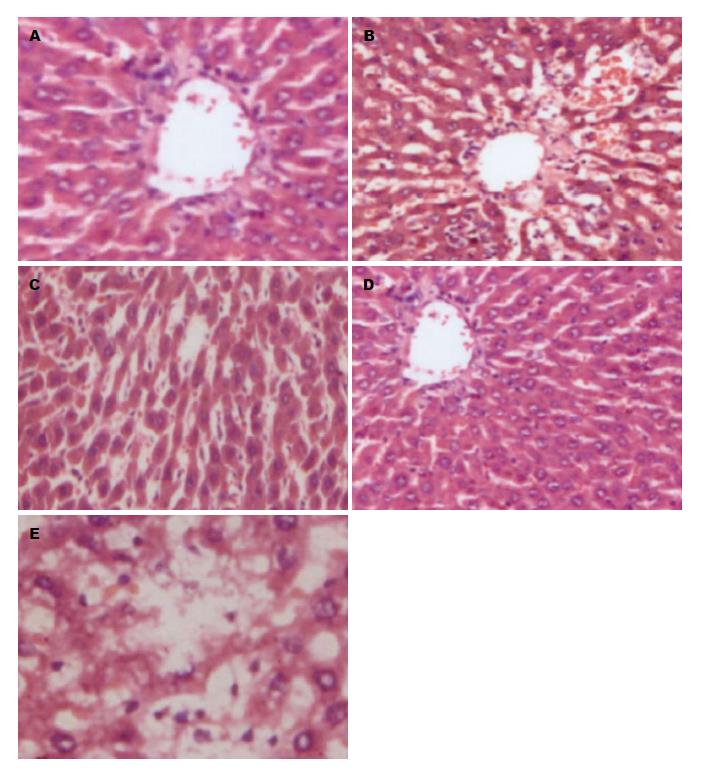
假手术组肝索排列整齐, 未见肿胀; 低剂量组肝细胞明显肿胀; 中剂量组肝索排列整齐, 未轻微肿胀; 高剂量组肝索排列整齐, 未见肿胀; 对照组肝细胞肿胀, 且核固缩(图1).
从表1中可以发现对照组大鼠血清AST、ALT、总胆红素、C反应蛋白及血清淀粉样蛋白A显著高于假手术组(P<0.05), 转铁蛋白、前白蛋白显著低于对照组(P<0.05). 低、中、高剂量组大鼠外周血AST、ALT、总胆红素、C反应蛋白及血清淀粉样蛋白A显著低于对照手术组(P<0.05), 转铁蛋白、前白蛋白显著高与对照组(P<0.05). 低、中、高剂量组之间个检验指标也存在着显著差异(P<0.05).
| 分组 | ALT(U/L) | AST(U/L) | 前白蛋白(mg/L) | 转铁蛋白(mg/L) | 血清总胆红素(μmol/L) | C反应蛋白(mg/L) | 血清淀粉样蛋白A(pg/dL) |
| 对照组 | 206.23±19.36 | 269.36±20.36 | 170.36±30.23 | 41.23±8.20 | 23.69±6.26 | 19.23±2.65 | 623.69±15.69 |
| 假手术组 | 36.23±2.02a | 37.69±5.32a | 289.36±45.98a | 72.69±9.65a | 3.85±1.23a | 4.12±0.89a | 321.25±7.69a |
| 低剂量组 | 176.36±15.45c | 200.23±10.26c | 189.63±41.23c | 65.39±7.23c | 15.98±4.56c | 16.98±5.36c | 559.69±12.36c |
| 中剂量组 | 139.59±6.36e | 153.26±9.63e | 236.23±45.23e | 58.69±8.21e | 11.02±3.63e | 11.69±3.68e | 501.36±14.36e |
| 高剂量组 | 76.39±8.59g | 102.69±5.96g | 269.36±41.23g | 50.23±7.58g | 6.36±2.56g | 7.26±1.23g | 389.36±12.23g |
从表2中发现对照组大鼠外周血各项致炎因子指标显著升高, 其TNF-α、IL-1β、IL-6显著高于假手术组(P<0.05). 而低、中、高剂量组大鼠血清TNF-α、IL-1β、IL-6显著低于对照组(P<0.05), 且低、中、高剂量组之间也存在着显著差异(P<0.05).
从表3可以发现对照组外周血GH、GHBP、IGF-1、IGFBP-3显著低于假手术组(P<0.05), 低、中、高剂量组显著高于对照组(P<0.05). 低、中、高剂量组之间还存在着显著差异.
体外循环对于人和实验动物而言都是一种较为重大的创伤[9,10]. 所以, 这种创伤极容易导致较为严重的炎症及应激反应. 这种炎症反应主要是由于手术创伤和缺血再灌注导致, 同时, 由于各种人工材料与机体尤其是血液接触后对于这种炎症反应的产生也起到了极大的作用[11-13]. 而因为体外循环而导致的肝脏损伤主要与炎症介质损伤肝细胞, 肝脏灌注不足相关.
在研究中发现体外循环导致的肝脏损伤的表现主要集中在肝细胞受损, 导致血清转氨酶升高, 肝脏合成功能受到抑制, 肝脏合成的各种蛋白降低, 肝脏处理胆红素能力下降导致血清胆红素升高. 同时在研究中发现, 由于体外循环这种较强的刺激的存在, 血清急性期C反应蛋白也显著增加.
肝脏转氨酶升高主要集中在AST和ALT, 这表明肝细胞受损较为严重的部分应该是细胞膜和线粒体, 这可能与体外循环时间较长导致肝脏存在较为严重的淤血, 所以导致细胞膜和线粒体膜通透性出现改变导致[14-17].
血清胆红素升高也有不少文献有过报道[18-20], 他们认为胆红素升高原因主要分为肝前性、肝细胞性和肝后性. 肝前性主要是由于体外循环干预导致过多的红细胞破裂, 同时在预充液中加入不少库存血, 存在红细胞破坏情况, 这导致血清游离胆红素升高. 而肝细胞性主要是由于肝脏低血流灌注, 炎性介质损伤等诸多原因共同作用, 导致肝细胞功能下降, 导致肝细胞代谢胆红素能力下降. 而肝后性主要是由于肝脏淤血较重, 导致肝血窦扩张, 肝内胆管受到压迫, 导致胆汁引流不畅, 导致直接胆红素升高. 同时由于胆盐潴留, 肝细胞受损更加严重.
在研究中还发现, 大鼠在经过体外循环干预后其合成功能也显著下降, 发现大鼠在干预后其血清前白蛋白和转铁蛋白均显著下降. 但是上述的血清转氨酶, 胆红素和前白蛋白, 转铁蛋白的改变在大鼠经过白芍总苷的干预后改变出现了变化, 随着白芍总苷剂量的增加, 大鼠血清上述变化呈现下降趋势, 这说明体外循环干预会对大鼠肝功能导致较大损伤, 使得血清转氨酶及胆红素升高, 肝脏合成功能降低, 同时外周血急性反应蛋白显著升高. 但是白芍总苷可以有效保护肝脏功能, 同时这种保护功能会随着剂量的升高而得到增强.
为了验证探寻炎症介质机制导致肝损伤的证据我们检测了大鼠体内TNF-α、IL-1β、IL-6的含量, 发现经过体外循环干预后的大鼠体内相关炎性因子明显高于假手术组, 因此可以相信炎性介质的确在造成肝损伤方面起到一定的作用. 但是大鼠在接受白芍总苷干预后这些炎性因子的含量显著下降, 并且这种下降水平还随着白芍总苷剂量上升而增加, 这说明体外循环会导致大鼠体内产生较为严重的炎症反应, 导致外周血各种致炎因子升高, 而白芍总苷可以降低这种炎症反应. 同时, 这种作用还存在着剂量依赖关系.
同时还检测了大鼠外周血GH、GHBP、IGF-1、IGFBP-3, 发现经过体外循环干预的大鼠体内存在较为严重的生长激素抵抗. 肝脏是生长激素-生长激素受体轴的中心器官. 生长激素-生长激素受体轴在调节应激代谢中发挥了非常重要的作用. 体外循环导致机体GH和GHR下降, 导致肝脏出现GH抵抗, 导致严重的代谢紊乱, 降低了细胞增殖能力及调节免疫防御能力, 这种能力的下降不止会导致肝脏损伤, 更可能导致肠道屏障功能破坏导致严重的毒血症、败血症等不良后果[21-23]. 生长激素还可以通过其受体使得细胞内STAT5磷酸化, 调节细胞内多种基因表达情况, 如核因子-κB(nuclear factor-κB, NF-κB). 而IGF-1可以作用于肝外组织, 使得细胞蛋白分解受到抑制, 但是研究发现其外周血含量严重下降, 同时IGFBP-3也显著下降, 这也导致大鼠整个机体处于高分解代谢状态, 进一步加重了大鼠机体代谢紊乱[24-28]. 但是大鼠在接受了白芍总苷的干预后上述的这些改变呈现出下降的趋势, 并且这种趋势还随着白芍总苷的用量增加而增强, 这说明体外循环可以导致大鼠在早期出现较为严重的生长激素抵抗, 表现为GH、GHBP、IGF-1、IGFBP-3水平的显著下降, 而白芍总苷可以有效地改善这种生长激素抵抗作用, 这种保护作用还存在着显著的剂量依赖关系.
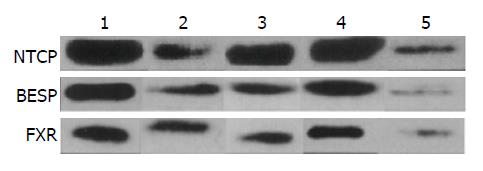
最后检测了大鼠肝脏胆盐转运蛋白的含量, 也发现由于肝脏功能的严重损伤, 肝脏细胞胆盐转运蛋白表达下降, 导致较为严重的胆汁淤积, 尤其是BESP和NTCP. 而近来的研究[28-30]提示这两种转运蛋白的功能受到FXR的调控, 因此可以认为FXR是调节胆盐代谢的关键蛋白, 其对于机体胆红素和胆盐代谢起着重要的调节作用. 研究提示这3种蛋白都显著下降, 因此可以认为体外循环对于大鼠肝脏胆盐转运蛋白表达起到了显著的抑制作用. 但是上述3种蛋白在大鼠接受了白芍总苷的干预后下降趋势显著降低, 这表明, 体外循环会导致大鼠肝脏胆盐转运蛋白含量显著降低, 使其出现转运障碍, 而白芍总苷可以有效地降低这种抑制作用, 同时这种作用也存在着剂量依赖关系.
本研究除了探讨了体外循环对于大鼠肝损伤产生的机制也探寻了白芍总苷对于这种损伤的保护作用. 还发现白芍总苷可以显著降低体外循环大鼠外周血的转氨酶及胆红素提高前白蛋白和转铁蛋白含量, 这说明了其对于大鼠肝脏的保护作用. 为了进一步探寻其保护的大鼠肝脏功能的作用, 检测了用了白芍总苷大鼠体内急性期反应蛋白和各种炎症因子, 发现这些检测指标都显著低于对照组, 这说明白芍总苷保护肝脏的机制与降低其体内炎症反应水平相关. 同时也检测了大鼠体内GH、GHBP、IGF-1、IGFBP-3. 然后发现经过白芍总苷干预, 大鼠体内GH、GHBP、IGF-1、IGFBP-3得到了不同程度的提升, 同时这种升高与白芍总苷浓度存在相关性. 这说明, 白芍总苷保护大鼠肝脏的作用也和降低大鼠生长激素抵抗相关. 最后也检测了大鼠肝脏胆盐转运蛋白的含量, 发现大鼠肝脏胆盐转运蛋白在经过白芍总苷处理后也得到了一定的提升, 这可能正是经过白芍总苷处理后大鼠外周血胆红素下降的原因. 白芍总苷的以上作用与白芍总苷的浓度均存在相关性. 因此可以认为白芍总苷保护大鼠体外循环后出现的肝损伤的机制可能是降低其炎症反应, 抑制其生长激素抵抗, 从而保护肝细胞, 增强其胆盐转运蛋白表达相关.
体外循环是目前多种心胸外科手术必须的条件, 但是由于其本身对于全身是一种极强的刺激, 容易导致机体产生过强的应激反应. 体外循环后, 很多患者存在着血清转氨酶和胆红素升高, 肝功能障碍的情况.
张明辉, 教授, 主任医师, 河北省唐山市人民医院感染性疾病科; 戴朝六, 教授, 中国医科大学第二临床学院(盛京医院)肝胆外科
体外循环而导致的肝脏损伤主要与炎症介质损伤肝细胞、肝脏灌注不足相关.
白芍总苷保护大鼠体外循环后出现的肝损伤的机制可能是与降低其炎症反应, 抑制其生长激素抵抗, 从而保护肝细胞, 增强其胆盐转运蛋白表达相关.
体外循环: 体外循环是利用一系列特殊人工装置将回信静脉血引流到体外, 经人工方法进行气体交换, 调节温度和过滤后, 输回体内动脉系统的生命支持技术. 在体外循环过程中, 由于人工装置取代了人体功能, 因此也称心肺转流, 体外循环机也称为人工心肺机. 进行体外循环的目的是在实施心脏直视手术时, 维持全身组织器官的血液供应.
本研究发现白芍总苷对肝脏损伤的防护与其剂量存在正相关, 其机制可能是降低炎症反应, 抑制生长激素抵抗, 对临床有一定参考价值.
编辑: 郭鹏 电编: 都珍珍
| 3. | Rau S, Kohn B, Richter C, Fenske N, Küchenhoff H, Hartmann K, Härtle S, Kaspers B, Hirschberger J. Plasma interleukin-6 response is predictive for severity and mortality in canine systemic inflammatory response syndrome and sepsis. Vet Clin Pathol. 2007;36:253-260. [PubMed] |
| 4. | Sánchez-Conde P, Rodríguez-López JM, Nicolás JL, Lozano FS, García-Criado FJ, Cascajo C, González-Sarmiento R, Muriel C. The comparative abilities of propofol and sevoflurane to modulate inflammation and oxidative stress in the kidney after aortic cross-clamping. Anesth Analg. 2008;106:371-38, table of contents. [PubMed] [DOI] |
| 5. | Copple IM, Goldring CE, Kitteringham NR, Park BK. The Nrf2-Keap1 defence pathway: role in protection against drug-induced toxicity. Toxicology. 2008;246:24-33. [PubMed] |
| 6. | Gutteridge JM, Halliwell B. Comments on review of Free Radicals in Biology and Medicine, second edition, by Barry Halliwell and John M. C. Gutteridge. Free Radic Biol Med. 1992;12:93-95. [PubMed] |
| 8. | 邱 永升, 贾 英萍. 体外循环术中应用右旋美托咪啶对简单先天性心脏病患儿的脑保护作用. 中华胸心血管外科杂志. 2013;29:617-619. |
| 13. | Kwak MK, Cho JM, Huang B, Shin S, Kensler TW. Role of increased expression of the proteasome in the protective effects of sulforaphane against hydrogen peroxide-mediated cytotoxicity in murine neuroblastoma cells. Free Radic Biol Med. 2007;43:809-817. [PubMed] |
| 14. | Maher JM, Dieter MZ, Aleksunes LM, Slitt AL, Guo G, Tanaka Y, Scheffer GL, Chan JY, Manautou JE, Chen Y. Oxidative and electrophilic stress induces multidrug resistance-associated protein transporters via the nuclear factor-E2-related factor-2 transcriptional pathway. Hepatology. 2007;46:1597-1610. [PubMed] |
| 15. | Maher JM, Aleksunes LM, Dieter MZ, Tanaka Y, Peters JM, Manautou JE, Klaassen CD. Nrf2- and PPAR alpha-mediated regulation of hepatic Mrp transporters after exposure to perfluorooctanoic acid and perfluorodecanoic acid. Toxicol Sci. 2008;106:319-328. [PubMed] [DOI] |
| 16. | Jain AK, Mahajan S, Jaiswal AK. Phosphorylation and dephosphorylation of tyrosine 141 regulate stability and degradation of INrf2: a novel mechanism in Nrf2 activation. J Biol Chem. 2008;283:17712-17720. [PubMed] [DOI] |
| 17. | Niture SK, Jaiswal AK. Prothymosin-alpha mediates nuclear import of the INrf2/Cul3 Rbx1 complex to degrade nuclear Nrf2. J Biol Chem. 2009;284:13856-13868. [PubMed] [DOI] |
| 18. | Kannoji A, Phukan S, Sudher Babu V, Balaji VN. GSK3beta: a master switch and a promising target. Expert Opin Ther Targets. 2008;12:1443-1455. [PubMed] [DOI] |
| 19. | Rojo AI, Rada P, Egea J, Rosa AO, López MG, Cuadrado A. Functional interference between glycogen synthase kinase-3 beta and the transcription factor Nrf2 in protection against kainate-induced hippocampal cell death. Mol Cell Neurosci. 2008;39:125-132. [PubMed] |
| 20. | Johnson JA, Johnson DA, Kraft AD, Calkins MJ, Jakel RJ, Vargas MR, Chen PC. The Nrf2-ARE pathway: an indicator and modulator of oxidative stress in neurodegeneration. Ann N Y Acad Sci. 2008;1147:61-69. [PubMed] [DOI] |
| 21. | Chen PC, Vargas MR, Pani AK, Smeyne RJ, Johnson DA, Kan YW, Johnson JA. Nrf2-mediated neuroprotection in the MPTP mouse model of Parkinson's disease: Critical role for the astrocyte. Proc Natl Acad Sci USA. 2009;106:2933-2938. [PubMed] [DOI] |
| 22. | Reddy NM, Kleeberger SR, Kensler TW, Yamamoto M, Hassoun PM, Reddy SP. Disruption of Nrf2 impairs the resolution of hyperoxia-induced acute lung injury and inflammation in mice. J Immunol. 2009;182:7264-7271. [PubMed] [DOI] |
| 23. | Wang XJ, Sun Z, Villeneuve NF, Zhang S, Zhao F, Li Y, Chen W, Yi X, Zheng W, Wondrak GT. Nrf2 enhances resistance of cancer cells to chemotherapeutic drugs, the dark side of Nrf2. Carcinogenesis. 2008;29:1235-1243. [PubMed] [DOI] |
| 24. | Ohta T, Iijima K, Miyamoto M, Nakahara I, Tanaka H, Ohtsuji M, Suzuki T, Kobayashi A, Yokota J, Sakiyama T. Loss of Keap1 function activates Nrf2 and provides advantages for lung cancer cell growth. Cancer Res. 2008;68:1303-1309. [PubMed] [DOI] |
| 25. | Shibata T, Ohta T, Tong KI, Kokubu A, Odogawa R, Tsuta K, Asamura H, Yamamoto M, Hirohashi S. Cancer related mutations in NRF2 impair its recognition by Keap1-Cul3 E3 ligase and promote malignancy. Proc Natl Acad Sci USA. 2008;105:13568-13573. [PubMed] [DOI] |
| 26. | Shibata T, Kokubu A, Gotoh M, Ojima H, Ohta T, Yamamoto M, Hirohashi S. Genetic alteration of Keap1 confers constitutive Nrf2 activation and resistance to chemotherapy in gallbladder cancer. Gastroenterology. 2008;135:1358-1368, 1368.e1-4. [PubMed] [DOI] |
| 27. | Reid G, Kirschner MB, van Zandwijk N. Circulating microRNAs: Association with disease and potential use as biomarkers. Crit Rev Oncol Hematol. 2011;80:193-208. [PubMed] [DOI] |
| 28. | Ranasinghe AM, Bonser RS. Biomarkers in acute aortic dissection and other aortic syndromes. J Am Coll Cardiol. 2010;56:1535-1541. [PubMed] [DOI] |
| 29. | Wen D, Zhou XL, Li JJ, Hui RT. Biomarkers in aortic dissection. Clin Chim Acta. 2011;412:688-695. [PubMed] [DOI] |
| 30. | Girdauskas E, Kuntze T, Borger MA, Röhrich K, Schmitt D, Fassl J, Falk V, Mohr FW. Acute respiratory dysfunction after surgery for acute type A aortic dissection. Eur J Cardiothorac Surg. 2010;37:691-696. [PubMed] [DOI] |