修回日期: 2015-07-28
接受日期: 2015-08-04
在线出版日期: 2015-08-28
目的: 探讨急性胰腺炎(acute pancreatitis, AP)患者血清中microRNA155(miR-155)的表达水平及其临床意义.
方法: 以28例中/重度急性胰腺炎患者为A组、32例轻度急性胰腺炎患者为B组、20例健康者为对照组, 取血标本进行血清RNA抽提, 采用实时荧光定量PCR(RT-qPCR)技术检测血清中miR-155表达量, 分析miR-155的表达及与各组AP患者临床特征的关系, 并绘制ROC曲线分析其诊断AP的价值.
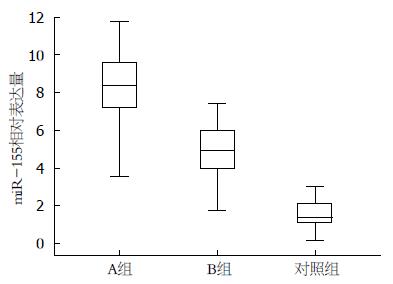
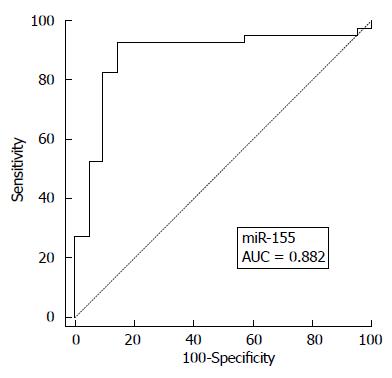
结果: miR-155相对表达量: A组为8.09±2.28, B组为4.94±1.41, 对照组为1.58±0.81, 差异均有统计学意义(P<0.05); miR-155与MCTSI评分、BISAP评分、Ranson评分, APACHEII评分有相关性(P<0.05), 与性别、年龄无相关性(P>0.05); miR-155的ROC曲线下面积0.882, 预测AP的最佳miR-155浓度截断值为3.55, 灵敏度92.5%, 特异度85.7%.
结论: miR-155可能是AP患者的血清标志物, 且对AP严重程度有一定的预测作用.
核心提示: 多种miRNA在胰腺组织中特异性表达, 本研究中发现miR-155在急性胰腺炎(acute pancreatitis, AP)外周血中特异性表达, 并可能成为胰腺炎新的分子诊断标志物, 对AP的严重程度及预后有一定的预测作用, 为AP提供新的诊断思路和治疗靶点.
引文著录: 林姝, 陈香宇, 王喜莹, 韩莉莉, 李文静, 李文元. miR-155在急性胰腺炎患者外周血中的表达及其临床意义. 世界华人消化杂志 2015; 23(24): 3935-3939
Revised: July 28, 2015
Accepted: August 4, 2015
Published online: August 28, 2015
AIM: To determine the serum expression level of miR-155 in acute pancreatitis (AP) patients and to analyze its clinical significance.
METHODS: Twenty-eight patients with moderately severe AP (MSAP) or severe AP (SAP) were included in group A, 32 patients with mild AP (MAP) were included in group B, and 20 healthy people were included as normal controls (NCs). Serum miR-155 expression levels were detected by real-time quantitative PCR. The differences in miR-155 expression level in different groups, and the correlation between miR-155 expression level and clinical characteristics of AP patients were analyzed. A receiver operating characteristic curve (ROC curve) was plotted to explore the diagnostic value of serum miR-155.
RESULTS: The mean relative expression level of serum miR-155 was 8.09 ± 2.28 in group A, 4.94 ± 1.41 in group B, and 1.58 ± 0.81 in the NC group, and there were significant differences between groups A and B, group A and the NC group, and group B and the NC group (P < 0.05). The relative expression levels of miR-155 were correlated with patients' BISAP score, Ranson score, APACHE II score and MCTSI score (P < 0.05), but not with patients' gender and age. The area under the ROC curve of miR-155 for prediction of AP severity was 0.882, with a sensitivity of 92.5% and specificity of 85.7%, and the best cutoff value was 3.55.
CONCLUSION: Serum miR-155 may be a potential biomarker for the diagnosis of AP, and it is clinically useful for the prediction of the severity of AP.
- Citation: Lin S, Chen XY, Wang XY, Han LL, Li WJ, Li WY. Clinical significance of serum miR-155 expression level in acute pancreatitis patients. Shijie Huaren Xiaohua Zazhi 2015; 23(24): 3935-3939
- URL: https://www.wjgnet.com/1009-3079/full/v23/i24/3935.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i24.3935
急性胰腺炎(acute pancreatitis, AP)是胰腺的急性炎症损伤, 其发病率逐年升高, 病死率居高不下, 根据《中国急性胰腺炎诊治指南》(2013年)[1]及2012年美国亚特兰大AP的分型和分级系统[2], 建议将AP分为轻度急性胰腺炎(mild acute pancreatitis, MAP)、中度急性胰腺炎(moderately acute pancreatitis, MSAP)和重度急性胰腺炎(severe acute pancreatitis, SAP). 虽然大部分MAP为自限性, 预后良好, 但仍有20%左右转变为MSAP或SAP, 病死率高达36%-50%, 且目前缺少特异有效的治疗方法[3]. 因此, AP的机制研究受到大家的广泛重视, 随着研究的深入, 发现了一些血清、基因和细胞学标志物等, 其中microRNA(miRNA)的发现给AP的研究带来了重大启示, 当胰腺损伤时, 胰腺腺泡细胞释放miRNA, 并在外周血中稳定表达, 在AP的早期的判断及评估上发挥重要作用. 现已有实验[4-10]证实miR-216、miR-10b、miR-146a等在AP患者外周血中特异性表达, 并可能成为判断AP严重程度的预测指标. Tian等[11]对AP的肠黏膜屏障功能障碍进行研究, 发现其机制可能与miR-155的过表达有关, miR-155在胰腺炎大鼠血清中也特异性高表达. 但在胰腺炎患者血清中miR-155的表达情况还少有报道, 因此本研究检测了AP患者血清中miR-155的表达, 进一步探究miRNA在胰腺炎中的作用, 并为其诊治提供一定的实验基础.
选取2013-09/2015-01郑州大学第一附属医院收治的AP患者60例, 其中28例MASP和SAP患者(男13例, 女15例), 中位年龄为46岁(26-76岁)为A组; 32例MAP患者(男18例, 女14例), 中位年龄为43岁(23-73岁)为B组, 所有患者均符合2013年《中国急性胰腺炎诊治指南》[1]中的诊断及分级标准. 同期, 选择健康者20名作为对照组(男女性各10名), 中位年龄43岁(20-73岁), 各项生化指标及腹部彩超结果均未见异常且无AP临床表现. 排除标准: 排除糖尿病、心血管疾病、恶性肿瘤等慢性病病史患者. 3组性别、年龄差异无统计学意义(P>0.05). 并于入院后对患者进行改良的CT严重指数(modified CT severity index, MCTSI)评分、急性胰腺炎严重程度床边指数(beside index of severity in acute pancreatitis, BISAP)评分、Ranson评分, 急性生理与慢性健康评分Ⅱ(acute physiology and chronic health evaluation, APACHEⅡ). 该研究己经过参与者的知情同意, 并签署知情同意书, 且已通过郑州大学第一附属医院伦理委员会的批准. 7500Fast型qRT-PCR仪(美国ABI公司); 低温高速离心机(德国EPPENDORF INC公司), RNA提取试剂TRI Reagent BD(美国GeneCopoeia公司); RT反转录试剂(美国GeneCopoeia公司), qRT-PCR试剂盒(美国GeneCopoeia公司); 紫外分光光度计NanoDrop2000c(美国赛默飞世尔公司); U6及miR-155特异引物(上海GenePharma公司).
入院后24-48 h内搜集患者的外周血样本, 静置25 min, 2 h内于4 ℃下、1000 r/min离心10 min; 吸取上清液至无菌无酶1.5 mL离心管中, 4 ℃、12000 r/min离心10 min, 吸取上清液至新的离心管中, 并置于下-80 ℃冰箱内保存备用. 用TRI Reagent BD试剂在无菌无RNA酶条件下严格按照说明书的方法提取总RNA, 紫外分光光度计检测RNA浓度, 吸光度(A260/280)值在1.8-2.0的样品置于冰箱保存, 用于后续实验. 严格按照RT反转录试剂盒说明书进行RNA逆转录, 将RNA反转录为cDNA. 进行miR-155的荧光定量检测, 以U6为内参基因, U6及miR-155特异引序列为, miR-155: Forward primer: 5'-GCGAAAGCATTTGCCAAGAA-3', Reverse primer: 5'-CATCACAGACCTGTTATTGC-3'; 内参U6: Forward primer: 5'-AGCGGGAAATCGTGCGTGACA-3', Reverse primer: 5'-GTGGACTTGGGAGAGGACTGG-3'. PCR反应体系总体积为20 μL, 其中含有2×miRcute miRNA Premix(含SYBR, ROX)10 μL, Forward primer 1 μL, Reverse primer 0.4 μL, miR第一链cDNA 1 μL, ddH2O 7.6 μL. 实时定量PCR反应条件: 94 ℃预变性2 min, 然后以95 ℃ 30 s、95 ℃ 3 s和60 ℃ 30 s进行40个循环, 血浆miR-155的相对表达量用2-△△Ct法计算, △Ct = CtmiR-155-CtU6, △△Ct = AP患者标本的△Ct值-正常组△Ct值.
统计学处理 采用SPSS18.0统计软件进行统计学分析, 计量资料mean±SD表示, 组间比较采用t检验. 运用MedCalc14绘制受试者工作曲线(ROC曲线)及曲线下面积(area under curve, AUC)评价miR-155作为一种诊断方法是否具有临床应用价值, 筛选预测的最佳界值(AUC ≤ 0.5为无诊断价值, 0.5<AUC ≤ 0.7为诊断准确性较低, 0.7<AUC ≤ 0.9为诊断准确性较好, AUC>0.9表示诊断准确性最高), P<0.05为差异有统计学意义.
A组为8.09±2.28, B组为4.94±1.41, 对照组为1.58±0.81, A组、B组miR-155相对表达量均高于对照组, 且A组miR-155相对表达量高于B组(P<0.05, 图1).
miR-155与性别、年龄无相关性(P>0.05), 与MCTSI评分、BISAP评分、Ranson评分, APACHEⅡ评分有相关性(P<0.05, 表1).
| 临床特征 | n | miR-151(△△CT) | P值 |
| 性别 | 0.154 | ||
| 男 | 32 | 6.35±1.63 | |
| 女 | 28 | 6.48±1.24 | |
| 年龄(岁) | 0.399 | ||
| >50 | 26 | 5.82±1.63 | |
| <50 | 34 | 6.86±1.12 | |
| MCTSI评分(分) | 0.000 | ||
| <4 | 37 | 4.81±1.37 | |
| ≥4 | 23 | 9.02±1.24 | |
| BISAP评分(分) | 0.013 | ||
| <3 | 47 | 5.35±1.24 | |
| ≥3 | 13 | 7.42±0.98 | |
| Ranson评分(分) | 0.002 | ||
| <3 | 26 | 5.05±1.16 | |
| ≥3 | 34 | 8.62±1.26 | |
| APACHEⅡ评分(分) | 0.000 | ||
| <8 | 44 | 4.12±1.31 | |
| ≥8 | 16 | 7.89±1.11 |
ROC曲线下面积0.882(0.7<AUC ≤ 0.9), 预测AP的最佳miR-155浓度截断值为3.55(灵敏度92.5%, 特异度85.7%)(图2).
miRNA是一类内源性的非蛋白编码的小分子RNA, 在细胞的增殖、分化、激素水平的调节等过程中起重要作用, 通过调节基因的表达进而影响多种疾病的发生发展, 在肿瘤组织、外周血、胸腹水、尿液、唾液等体液中均可特异性表达[11-14]. 近年来, miRNA在炎症性疾病中的作用逐渐凸显, 参与了多种病理生理过程[15-17], 其中miR-155是一种多功能的miRNA, 已被证明其具有参与细胞因子的产生、炎症介导、抗原提呈、细胞的增殖分化及凋亡等作用[18-21], 在介导和炎症反应相关的基因调节过程发挥着重要作用.
AP由于病情发展凶险、病死率高、发病机制复杂, 关于其机制的研究一直是国内外学者的研究热点, 至今仍存在较大争议, 其中包括"胰酶自身消化学说"、"白细胞过度激活学说"、"肠道屏障破坏学说"、"细胞凋亡学说"等. Tian等[11]对AP的肠黏膜屏障功能障碍进行研究时发现, 小肠上皮细胞连接复合体(apical junctional complex, AJC)是维持肠黏膜屏障功能稳定的重要因素, miR-155过表达时, 其所翻译的紧密连接蛋白ZO-1和E-钙黏附蛋白水平明显下降, 导致肠道屏障功能破坏, 因此, miR-155在AP发病机制及病情的发展中的可能发挥重要的作用.
本研究采用RT-qPCR技术检测AP患者及健康者血清中miR-155表达水平, 发现miR-155在AP患者血清中相对表达量高于正常对照组, 且MASP和SAP血清中相对表达量高于MAP组. 这与上诉结论一致, 进一步证实miR-155可能参与AP的发生发展、调控炎症反应, 在AP患者中特异性表达. 本实验结果中miR-155与MCTSI评分、BISAP评分、Ranson评分、APACHEII评分有相关性, 而与年龄、性别无相关性, miR-155的ROC曲线下面积0.882, 预测AP的最佳miR-155浓度截断值为3.55(灵敏度92.5%, 特异度85.7%). 进一步证明, miR-155可能作为AP新的诊断标志物, 且在AP严重程度的判断上起一定作用. 但由于miR-155在染色体上的定位尚不明确, 因此有可能导致表达的性别差异, 另外鉴于患者入院时间、样本采集时间、发病原因及诊疗经过的不同可能对miR-155的相对表达量及各项评分的测定有一定的影响, 均可能导致结果偏差, 不一定能代表总体水平, 因此需要进一步扩大样本量进一步深入研究.
由于临床获取胰腺组织较困难, 本研究并未对胰腺组织miR-155的表达情况进行检测和分析, 而且其在预测AP中的作用还需与患者临床生化指标、并发症、死亡率、微创引流率、住院时间等直接临床证据比较, 进一步证实其临床价值及意义. 因此, 证明miR-155在AP发病机制中的具体作用及其临床价值, 还需要进一步的实验及探讨.
提高AP早期诊断水平仍然是一个紧迫而困难的问题, miRNA在体液中的稳定表达尤其是在外周血中的稳定表达, 为检测提供了更多的方便, 也为临床实际应用提供了更大的可能性, 在AP的早期诊断、治疗及机制研究中具有重要前景[22,23]. 深入研究miR-155在AP中的机制及临床价值, 可能为AP的诊断和治疗提供新的思路, 有助于从转录后层面提高AP的诊断水平, 改善AP的治疗效果及预后.
急性胰腺炎(acute pancreatitis, AP)病情发展迅速、预后凶险, 总体病死率较高, 至今尚无特异性治疗方法, 近几年随着的深入研究, 发现多种miRNA参与胰腺疾病的发生发展, 在AP的发病机制中发挥重要作用.
谭晓冬, 教授, 中国医科大学附属盛京医院
当胰腺损伤时miRNA从胰腺腺泡细胞释放入血, 并能在外周血中稳定表达, 有望成为早期诊断AP及严重程度的生物标志物.
研究表明, miR-155的过表达可能导致肠黏膜屏障功能障碍, 参与多种病理生理过程, 并在AP大鼠外周血中特异性高表达.
本文通过对AP患者及正常人群血清miR-155相对表达量的检测, 分析其与AP临床特征的相关性, 评估了血清miR-155作为胰腺炎分子标志物的诊断效能.
本研究采用RT-qPCR技术检测AP患者及健康者血清中miR-155表达水平, 研究结果表明miR-155可能是AP患者的血清标志物, 且对AP严重程度有一定的预测作用.
BISAP评分: 2008年Wu等提出了一个新的预后评估系统-BISAP评分, 共包括血尿素氮、精神神经状态异常、全身炎症反应综合征、年龄、胸腔积液等5项指标, 能较好的预测急性胰腺炎预后.
本文具有一定的科学性和创新性, 对临床有较好的应用与指导价值.
编辑: 郭鹏 电编:闫晋利
| 2. | Banks PA, Bollen TL, Dervenis C, Gooszen HG, Johnson CD, Sarr MG, Tsiotos GG, Vege SS. Classification of acute pancreatitis--2012: revision of the Atlanta classification and definitions by international consensus. Gut. 2013;62:102-111. [PubMed] [DOI] |
| 3. | Vege SS, Gardner TB, Chari ST, Munukuti P, Pearson RK, Clain JE, Petersen BT, Baron TH, Farnell MB, Sarr MG. Low mortality and high morbidity in severe acute pancreatitis without organ failure: a case for revising the Atlanta classification to include "moderately severe acute pancreatitis". Am J Gastroenterol. 2009;104:710-715. [PubMed] [DOI] |
| 5. | Gu SX, Li X, Hamilton JL, Chee A, Kc R, Chen D, An HS, Kim JS, Oh CD, Ma YZ. MicroRNA-146a reduces IL-1 dependent inflammatory responses in the intervertebral disc. Gene. 2015;555:80-87. [PubMed] [DOI] |
| 6. | Zhang J, Ning X, Cui W, Bi M, Zhang D, Zhang J. Transforming growth factor (TGF)-β-induced microRNA-216a promotes acute pancreatitis via Akt and TGF-β pathway in mice. Dig Dis Sci. 2015;60:127-135. [PubMed] [DOI] |
| 7. | Hermansen SK, Kristensen BW. MicroRNA biomarkers in glioblastoma. J Neurooncol. 2013;114:13-23. [PubMed] [DOI] |
| 8. | Qin T, Fu Q, Pan YF, Liu CJ, Wang YZ, Hu MX, Tang Q, Zhang HW. Expressions of miR-22 and miR-135a in acute pancreatitis. J Huazhong Univ Sci Technolog Med Sci. 2014;34:225-233. [PubMed] [DOI] |
| 9. | Blenkiron C, Askelund KJ, Shanbhag ST, Chakraborty M, Petrov MS, Delahunt B, Windsor JA, Phillips AR. MicroRNAs in mesenteric lymph and plasma during acute pancreatitis. Ann Surg. 2014;260:341-347. [PubMed] [DOI] |
| 10. | Usborne AL, Smith AT, Engle SK, Watson DE, Sullivan JM, Walgren JL. Biomarkers of exocrine pancreatic injury in 2 rat acute pancreatitis models. Toxicol Pathol. 2014;42:195-203. [PubMed] [DOI] |
| 11. | Tian R, Wang RL, Xie H, Jin W, Yu KL. Overexpressed miRNA-155 dysregulates intestinal epithelial apical junctional complex in severe acute pancreatitis. World J Gastroenterol. 2013;19:8282-8291. [PubMed] [DOI] |
| 12. | Brennecke J, Cohen SM. Towards a complete description of the microRNA complement of animal genomes. Genome Biol. 2003;4:228. [PubMed] |
| 13. | Dehwah MA, Xu A, Huang Q. MicroRNAs and type 2 diabetes/obesity. J Genet Genomics. 2012;39:11-18. [PubMed] [DOI] |
| 14. | An F, Zhan Q, Xia M, Jiang L, Lu G, Huang M, Guo J, Liu S. From moderately severe to severe hypertriglyceridemia induced acute pancreatitis: circulating miRNAs play role as potential biomarkers. PLoS One. 2014;9:e111058. [PubMed] [DOI] |
| 15. | Georgantas RW, Streicher K, Greenberg SA, Greenlees LM, Zhu W, Brohawn PZ, Higgs BW, Czapiga M, Morehouse CA, Amato A. Inhibition of myogenic microRNAs 1, 133, and 206 by inflammatory cytokines links inflammation and muscle degeneration in adult inflammatory myopathies. Arthritis Rheumatol. 2014;66:1022-1033. [PubMed] [DOI] |
| 16. | Abdellatif M. Differential expression of microRNAs in different disease states. Circ Res. 2012;110:638-650. [PubMed] [DOI] |
| 17. | Min M, Peng L, Yang Y, Guo M, Wang W, Sun G. MicroRNA-155 is involved in the pathogenesis of ulcerative colitis by targeting FOXO3a. Inflamm Bowel Dis. 2014;20:652-659. [PubMed] [DOI] |
| 18. | Szafranska AE, Davison TS, John J, Cannon T, Sipos B, Maghnouj A, Labourier E, Hahn SA. MicroRNA expression alterations are linked to tumorigenesis and non-neoplastic processes in pancreatic ductal adenocarcinoma. Oncogene. 2007;26:4442-4452. [PubMed] |
| 19. | Ma X, Conklin DJ, Li F, Dai Z, Hua X, Li Y, Xu-Monette ZY, Young KH, Xiong W, Wysoczynski M. The oncogenic microRNA miR-21 promotes regulated necrosis in mice. Nat Commun. 2015;6:7151. [PubMed] [DOI] |
| 20. | Devier DJ, Lovera JF, Lukiw WJ. Increase in NF-κB-sensitive miRNA-146a and miRNA-155 in multiple sclerosis (MS) and pro-inflammatory neurodegeneration. Front Mol Neurosci. 2015;8:5. [PubMed] [DOI] |
| 21. | Song J, Lee JE. miR-155 is involved in Alzheimer's disease by regulating T lymphocyte function. Front Aging Neurosci. 2015;7:61. [PubMed] [DOI] |
| 22. | Zhang J, Ren J, Chen H, Geng Q. Inflammation induced-endothelial cells release angiogenesis associated-microRNAs into circulation by microparticles. Chin Med J (Engl). 2014;127:2212-2217. [PubMed] |
| 23. | Rebane A, Akdis CA. MicroRNAs: Essential players in the regulation of inflammation. J Allergy Clin Immunol. 2013;132:15-26. [PubMed] [DOI] |