修回日期: 2015-07-13
接受日期: 2015-07-24
在线出版日期: 2015-08-28
目的: 探讨瑞巴派特对大鼠非甾体类抗炎药(non-steroid anti-inflammatory drugs, NSAIDs)相关性小肠损伤的保护作用及可能的机制.
方法: 将30只健康♂SD大鼠随机分为阴性对照组、双氯芬酸损伤组、瑞巴派特保护组, 每组10只. 通过应用双氯芬酸7.5 mg/(kg•d)灌胃, 1次/d、连续4 d的方法制作大鼠NSAIDs相关性小肠损伤模型. 瑞巴派特保护组在每次造模前1 h用100 mg/(kg•d)瑞巴派特对大鼠进行灌胃预处理, 连续4 d. 阴性对照组应用等量的生理盐水灌胃, 实验第4天, 处死所有大鼠, 对其小肠损伤情况进行大体及病理观察并评分, 采用免疫组织化学方法检测小肠黏膜中Occludin蛋白的表达和分布, 采用Western blot方法检测小肠组织中Occludin蛋白、ERK、p38和磷酸化ERK(p-ERK)、磷酸化p38(p-p38)蛋白表达水平.
结果: 损伤组大鼠小肠大体和病理损伤评分均高于对照组(P<0.05), 瑞巴派特组大鼠小肠大体和病理损伤评分均低于损伤组(P<0.05); Occludin蛋白在损伤组中表达水平较对照组明显降低(P<0.05), 而在瑞巴派特处理组中的表达水平较损伤组增高(P<0.05); 与对照组相比, 损伤组中p-ERK蛋白和p-p38表达水平增高(P<0.05), 而瑞巴派特处理中的表达水平较损伤组降低(P<0.05).
结论: 瑞巴派特对大鼠NSAIDs相关性小肠损伤有一定的保护作用, 其机制可能通过抑制丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPKs)信号通路中ERK和p38蛋白的磷酸化, 上调小肠黏膜中紧密连接Occludin蛋白表达, 从而改善小肠黏膜屏障功能.
核心提示: 研究显示瑞巴派特对非甾体类抗炎药(non-steroid anti-inflammatory drugs, NSAIDs)相关性小肠损伤有一定的保护作用, 但其机制尚不明确. 本研究显示: 瑞巴派特对双氯芬酸引起的小肠损伤的保护作用至少部分是通过抑制细胞外信号调节激酶/丝裂原活化蛋白激酶通路(ERK/MAPK)和p38/MAPK信号通路的磷酸化、上调紧密连接蛋白Occludin而实现的.
引文著录: 刘晨晨, 段兆涛, 袁芳岑, 姜宗丹, 汪志兵, 杨小兵, 王劲松, 张振玉. 瑞巴派特对大鼠非甾体类抗炎药相关性小肠损伤的保护作用及机制. 世界华人消化杂志 2015; 23(24): 3838-3845
Revised: July 13, 2015
Accepted: July 24, 2015
Published online: August 28, 2015
AIM: To investigate the effect of rabamipide on non-steroid anti-inflammatory drug (NSAID) induced enteropathy in rats and the possible mechanism.
METHODS: Thirty male Sprague-Dawley rats were randomized into three groups: a control group, a diclofenac induced injury group, and a rabamipide pretreatment group. Intestinal injury was induced in rats of the diclofenac induced injury group and rabamipide pretreatment group by intragastric administration of diclofenac (7.5 mg/kg) once per day for continuous 4 d. The rabamipide pretreatment group was pretreated with rabamipide 100 mg/(kg•d) orally once daily 1 h before the administration of diclofenac. The control group received 0.9% NaCl by gavage during the same period. All the rats were sacrificed on the 4th day. Small intestinal injuries were assessed for histopathological damage and macroscopic injury and recorded as corresponding scores. Immunohistochemistry and Western blot were used to detect the distribution and expression of intestinal epithelial tight junction protein occludin. The expression of ERK, p38, phosphorylated ERK (p-ERK) and phosphorylated p38 (p-p38) was determined by Western blot.
RESULTS: Compared with the control group, histopathological and macroscopic scores of intestinal damage were significantly increased in the diclofenac induced injury group (P < 0.05). Intestinal damage scores in the rabamipide pretreatment group were significantly decreased compared with those in the diclofenac induced injury group (P < 0.05). Compared with the control group, expression of occludin in the diclofenac induced injury group was decreased significantly (P < 0.05), while that in the rabamipide pretreatment group increased significantly compared with the diclofenac induced injury group (P < 0.05). Significant activation of ERK and p38 was seen in the diclofenac induced injury group compared with the control group (P < 0.05), and pretreatment with rabamipide significantly inhibited the activation of ERK and p38 compared with the diclofenac induced injury group (P < 0.05).
CONCLUSION: Rabamipide has a protective effect on NSAID induced enteropathy in rats, probably by increasing the expression of occludin protein and inhibiting the activation of ERK as well as p38 signaling pathways.
- Citation: Liu CC, Duan ZT, Yuan FC, Jiang ZD, Wang ZB, Yang XB, Wang JS, Zhang ZY. Protective effect of rabamipide on non-steroid anti-inflammatory drug induced enteropathy in rats. Shijie Huaren Xiaohua Zazhi 2015; 23(24): 3838-3845
- URL: https://www.wjgnet.com/1009-3079/full/v23/i24/3838.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i24.3838
自1898年阿司匹林首次合成以来, 非甾体类抗炎药(non-steroid anti-inflammatory drugs, NSAIDs)以其良好的解热、镇痛、抗炎、抗风湿、抗血小板等功效而一直广泛用于临床. 世界范围内每天约有3000万人在使用NSAIDs, 每天的药费约20亿美元[1,2]. 尽管NSAIDs有着悠久的历史和良好的疗效, 但其不良反应是伴随NSAIDs难以避开的话题[3-6], 尤其是随着双气囊小肠镜和胶囊内镜技术的发展, 临床中发现长期服用NSAIDs的患者中小肠损伤的发生率并不低[7,8], Graham等[9]报道了长期服用NSAIDs的人群中小肠损伤的发生率是70%. 一些NSAIDs相关性小肠损伤诸如穿孔、溃疡、出血等往往是致命的, 可引起严重的临床后果[3-6]. 但目前NSAIDs相关性小肠损伤的机制尚不明确, 临床中尚缺乏有效防治NSAIDs相关性小肠损伤的药物. Fujimori等[10]与Niwa等[11]在临床研究中发现瑞巴派特对双氯芬酸引起的小肠损伤有一定的保护作用, 但具体机制未明. 本实验通过给以NSAIDs相关性肠损伤模型大鼠瑞巴派特进行干预, 旨在研究瑞巴派特对NSAIDs相关性小肠损伤中大鼠紧密连接蛋白Occludin表达的影响, 并探讨其可能的机制, 为临床有效治疗NSAIDs相关性小肠损伤提供一定的理论依据.
清洁级2月龄♂健康SD大鼠30只, 体质量为180-200 g[南京医科大学附属南京医院动物实验中心提供, 许可证号为SYXK(苏)2009-0015]. 双氯芬酸钠双释放肠溶胶囊(商品名: 戴芬, 产品批号91184)购自德国Temmler Werke GmnH公司. 瑞巴派特购自湖北康宝泰精细化工有限公司(批号: 1206002). 两种药物均溶于生理盐水中, 经过超声乳化后制成悬浊液. β-actin、ERK、p-38、磷酸化ERK(p-ERK)、磷酸化p38(p-p38)、Occludin抗体购自Cell signal公司.
1.2.1 动物分组: 将30只大鼠随机分为3组, 每组10只; 即阴性对照组、双氯芬酸损伤组、瑞巴派特保护组.
1.2.2 造模: 大鼠适应性观察1 wk后开始造模, 每次灌胃前禁食不禁水12 h, 灌胃剂量约2 mL/100 g. 双氯芬酸剂量7.5 mg/(kg•d), 瑞巴派特剂量100 mg/(kg•d); 损伤组给予双氯芬酸灌胃; 瑞巴派特保护组先给予瑞巴派特灌胃, 1 h后再给以双氯芬酸灌胃; 阴性对照组大鼠给予相同剂量0.9%NaCl溶液灌胃; 1次/d, 持续4 d. 造模期间大鼠正常饮食饮水, 末次灌胃后大鼠禁食不禁水18 h, 在10%水合氯醛(剂量约0.35 mL/100 g)腹腔麻醉下取材并处死.
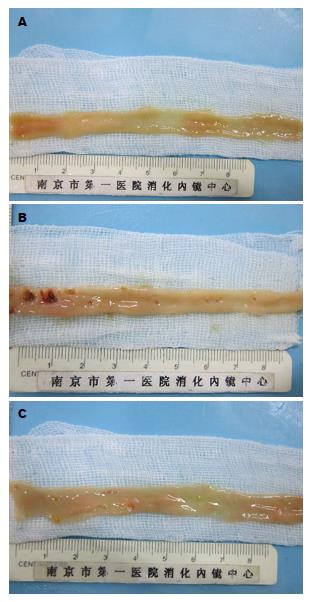
1.2.3 标本处理: 大鼠麻醉后仰卧位固定, 沿着腹中线切开腹壁, 逐层分离腹腔组织, 打开腹腔后观察腹腔情况, 分离肠系膜, 距回盲瓣15 cm处切取回肠肠段2 cm, 用冷PBS缓冲液冲洗干净内容物后拍照, 按文献报道的方法记录小肠黏膜损伤情况. 然后, 40 g/L甲醛溶液固定, 常规石蜡包埋切片, HE染色, 显微镜下观察组织学改变; 取距回盲瓣20 cm处肠段, -80 ℃保存待用; 将剩余小肠肠腔剪开, 观察小肠大体损伤情况.
1.2.4 小肠黏膜大体评分: 沿肠系膜对侧切开小肠, 用冷PBS缓冲液漂洗3遍, 在解剖显微镜(10×)进行小肠黏膜损伤大体评分, 按照修改后的Reuter方法进行小肠损伤情况评分: 未见明显损伤, 0分; 局灶性充血, 但未见溃疡形成, 1分; 有溃疡形成, 但无充血及肠管增厚, 2分; 溃疡形成伴有炎症反应(1处)为3分; 溃疡形成伴炎症反应(2处及2处以上), 4分; 主要病变部位长度在1-2 cm之间, 5分; 主要病变部位长度>2 cm, 6分; 肠管出现轻度粘连(容易解除的粘连), 计分增加1分; 出现明显粘连, 计分增加2分.
1.2.5 小肠黏膜组织学评分: 采用Chiu氏6级评分法评定小肠黏膜损伤程度: 小肠黏膜绒毛正常, 0分; 绒毛顶端上皮下出现囊状间隙, 并伴有毛细血管充血, 1分; 上皮下间隙扩大, 固有层中度水肿, 中央乳糜管扩张, 2分; 固有层明显水肿, 小肠黏膜上皮层细胞变性、坏死, 少数绒毛顶端脱落, 3分; 上皮细胞层变性坏死、脱落, 部分绒毛脱落, 固有层裸露, 毛细血管扩张、充血, 4分; 绒毛脱落, 固有层崩解, 出血或溃疡形成, 5分. 光镜下每个样本随机计数20个视野.
1.2.6 组织学观察: 小肠组织用4%甲醛固定24 h, 脱水, 透明, 石蜡包埋, 切片, HE染色, 光学显微镜下观察.
1.2.7 Occludin免疫组织化学染色: 采用Envision法, 石蜡切片脱蜡至水, 蛋白酶E 37 ℃ 10 min消化, PBS冲洗, 加Occludin抗体4 ℃过夜, PBS冲洗, 加Envision二抗37 ℃ 30 min, PBS冲洗, DAB显色, 镜下控制显色时间, 苏木精复染, 脱水, 透明, 树胶封片. 染色结果的判断参照Brown等[12]的方法并稍作修改, 在200倍镜下观察5个视野, 每个视野随机观察100个细胞; 细胞染色强度评分: 无着色0分; 淡黄色1分; 棕黄色2分; 棕褐色3分. 染色细胞阳性数:<5个/视野0分; 5-25个/视野1分; 26-50个/视野2分;>50个/视野3分. 根据染色强度或阳性细胞数确定表达强度, 阴性(-)0分; 弱阳性(+)1-3分; 中度阳性(++)4-5分; 强阳性(+++)6分.
1.2.8 Western blot检测: 取约100 mg小肠黏膜组织, 加蛋白裂解液4 ℃裂解, 离心后取上清液, 加蛋白上样缓冲液, 煮沸5 min, 进行SDS-PAGE, 转膜, 封闭后分别加Occludin、p38、ERK、磷酸化ERK(p-ERK)、磷酸化p38(p-p38)、β-actin的一抗, 4 ℃过夜, 加辣根过氧化物酶标记的二抗, 孵育后用增强化学发光法显色, 摄片, 使用Image J 1. 44p软件分析目的蛋白条带灰度值与内参β-actin条带灰度值的比值, 作为目的蛋白的相对表达量.
统计学处理 采用SPSS17.0软件进行统计分析, 实验数据用mean±SD表示, 多组间比较采用One-way ANOVA分析, 两组间比较采用t检验, P<0.05为差异有统计学意义.
双氯芬酸损伤组大鼠死亡1只, 解剖后发现肠管穿孔, 腹腔粘连严重. 阴性对照组、瑞巴派特保护组均无大鼠死亡, 阴性对照组大鼠小肠组织未见明显损伤; 双氯芬酸损伤组小肠损伤较重, 腹腔内见肠管粘连, 伴肠壁增厚、充血水肿和扩张, 小肠黏膜可见多处散发充血、糜烂及溃疡灶, 可见穿孔; 瑞巴派特保护组大体情况明显好转, 肠管粘连及水肿不明显, 可见黏膜轻微红肿、散在糜烂点及小溃疡. 与对照组相比, 损伤组大体评分明显升高(大体评分: 5.3分±2.0分, P<0.01)(图1); 给予瑞巴派特处理后, 大体评分明显降低(大体评分: 2.5分±1.1分, P<0.05)(图1).
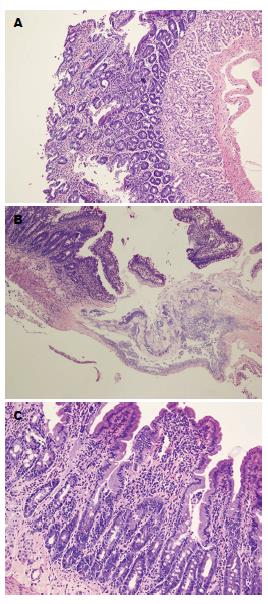
阴性对照组大鼠小肠黏膜上皮结构完整, 腺体排列紧密, 形态正常, 未见溃疡及糜烂等损伤; 双氯芬酸损伤组小肠绒毛结构消失, 可见坏死、糜烂及多处溃疡形成, 固有层内可见大量炎性细胞浸润, 黏膜上皮结构损伤明显, 部分完全破坏; 瑞巴派特保护组大鼠小肠损伤较轻, 未见穿孔, 可见黏膜少量充血, 偶见溃疡及散在糜烂点, 黏膜上皮结构基本完整. 与对照组相比, 损伤组病理学评分明显升高(镜下评分: 5.2分±1.9分)(P<0.01)(图2); 给予瑞巴派特处理后, 大体评分明显降低(镜下评分: 2.6分±1.0分)(P<0.05)(图2).
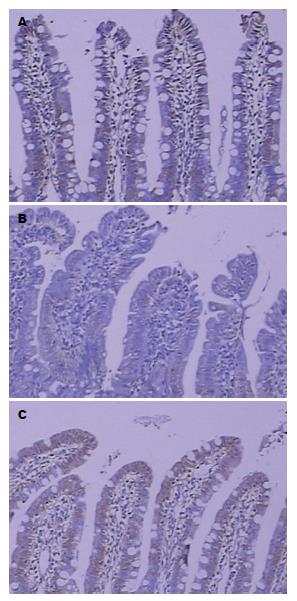
根据免疫组织化学的结果, 阴性对照组中Occludin蛋白主要分布在小肠黏膜上皮细胞膜中, 呈表达较强的棕褐色信号, 强阳性表达率为60%(6/10), 表达评分为5.2分±1.1分; 损伤组Occludin蛋白表达明显减弱, 呈较低表达, 强阳性率为11.1%(1/9), 表达评分为2.8分±1.8分; 瑞巴派特保护组可见Occludin蛋白的棕色信号表达较损伤组高, 强阳性率为40%(4/10), 表达评分为4.9分±1.1分. 与阴性对照组相比, 双氯芬酸损伤组Occludin表达明显减少(P<0.01)(图3); 与双氯芬酸损伤组相比, 瑞巴派特保护组Occludin表达明显增加(P<0.01)(图3).
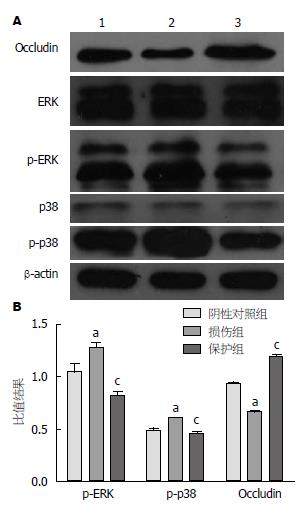
损伤组大鼠小肠组织中Occludin的表达明显低于对照组(P<0.05), 而瑞巴派特保护组Occludin蛋白的表达高于损伤组(P<0.05)(图4); ERK和p38在对照组、损伤组和瑞巴派特保护组的表达水平无明显差异(任何两组比较均P>0.05); 损伤组中p-ERK和p-p38蛋白的表达明显高于对照组(均P<0.05), 而瑞巴派特处理组p-ERK和p-p38蛋白的表达低于损伤组(均P<0.05)(图4).
NSAIDs是治疗多种疾病的基础用药, 在世界范围内有着广泛的应用, 但长期服用NSAIDs而引起胃肠道损伤是临床上常见的现象[13]. 质子泵抑制剂(proton pump inhibitor, PPI)对NSAIDs相关胃黏膜损伤有良好的防治作用[14], 但对NSAIDs相关性小肠损伤的防治效果甚微[15,16], 有研究[17]结果显示PPI可能通过引起肠道菌群紊乱而加重NSAIDs相关性小肠损伤. NSAIDs相关性肠病早期临床表现不明显, 但长期应用NSAIDs引起的出血、蛋白丢失、狭窄、穿孔等并发症可能会引起严重的临床后果[3-6]. 虽然选择性环氧合酶-2(cyclooxygenase-2, COX-2)抑制剂塞来昔布只引起轻微的小肠损伤, 但长期服用选择性COX-2抑制剂可以增加心血管不良事件的发生率, 所以临床上仍倾向于给患者选择传统NSAIDs[18]. 目前NSAIDs相关性小肠损伤的机制尚不明确, 临床中出现这种小肠损伤后除了停用NSAIDs药物之外尚缺乏有效的治疗措施; 而许多患者由于基础疾病的原因停用NSAIDs药物又有一定的风险, 因此寻找有效的防治NSAIDs相关性小肠损伤的药物迫在眉睫.
瑞巴派特是常用的胃黏膜保护剂, 首先由日本合成, 在临床中常与抑酸剂联用治疗胃溃疡、十二指肠溃疡和胃炎等. 瑞巴派特主要通过降低超氧化物产量、抑制髓过氧化物酶的活性等而产生作用, 可增加黏液分泌、刺激前列腺素的产生, 具有抗炎、清除氧自由基的作用[19]. 有研究[10,11]显示, 瑞巴派特可以防治双氯芬酸引起的小肠黏膜损伤, 对肠黏膜的炎症有一定的抑制作用. 因此, 明确瑞巴派特对NSAIDs相关性小肠损伤的保护作用及机制对临床中有效防治NSAIDs相关性小肠损伤有一定的指导意义.
本研究参考了陈汉卿等[20]的造模方法, 以双氯芬酸制造大鼠NSAIDs相关性小肠损伤模型, 实验过程中仅损伤组中1只大鼠意外死亡, 解剖后可见小肠损伤严重, 其余大鼠均成活. 实验结果显示, 与损伤组大鼠相比, 瑞巴派特保护组大鼠小肠的大体和病理损伤均明显减轻(二者均P<0.05). 因此, 我们认为瑞巴派特对NSAIDs相关性小肠损伤有一定的保护作用.
Occludin蛋白是紧密连接的重要组成部分, 对维持肠黏膜屏障的功能有重要作用; 在肠黏膜上皮中, 当Occludin蛋白表达减少时, 肠黏膜通透性增高、屏障功能减弱, 从而引起小肠黏膜损伤[21]. 细胞外信号调节激酶/丝裂原活化蛋白激酶通路(ERK/MAPK)是经典的细胞信号转导途径, ERK/MAPK信号通路的激活参与了NSAIDs相关性胃肠道损伤的过程[22,23]. p38/MAPK是多条信号途径的交汇点和共同通路, 在生理条件下呈现低表达, 而在应激和损伤刺激等条件下发生磷酸化而激活, 在应激和炎症反应调控中具有重要作用. 有研究[24,25]发现, ERK信号通路对包括Occludin在内的多种紧密连接蛋白的表达有重要的调节作用, ERK蛋白能够通过自身磷酸化过程调控Occludin蛋白的表达, 进而影响黏膜屏障功能. 有研究[26]证实p38/MAPK对消化系上皮增生、分化、凋亡有重要的调节作用. 研究[27]显示, 阿司匹林可呈剂量和时间依赖性地抑制肠上皮细胞的增殖、损伤肠上皮细胞紧密连接. 本实验中, 在应用双氯芬酸造模后, 大鼠小肠组织中紧密连接蛋白Occludin表达量明显下降, 而瑞巴派特保护组中Occludin表达量较损伤组明显上调; 在本实验中, 与损伤组大鼠相比, 瑞巴派特保护组大鼠小肠的大体和病理损伤均明显减轻(二者均P<0.05). 由此, 可以得出瑞巴派特对NSAIDs相关性小肠损伤的保护作用至少部分与上调小肠黏膜中紧密连接蛋白Occludin的表达有关. ERK蛋白和p38蛋白在损伤组磷酸化程度明显增加, 而瑞巴派特保护组磷酸化程度较损伤组明显减低; ERK/MAPK和p38/MAPK信号通路均参与了瑞巴派特对大鼠小肠黏膜的保护作用. 因此, 瑞巴派特对大鼠小肠黏膜保护作用至少部分是通过抑制ERK/MAPK和p38/MAPK信号通路的磷酸化、上调紧密连接蛋白Occludin的表达而实现的.
总之, 瑞巴派特对大鼠NSAIDs相关性小肠损伤有一定的保护作用; 其机制可能是: (1)通过抑制双氯芬酸引起的ERK/MAPK的磷酸化、上调紧密连接蛋白Occludin的表达, 增强了小肠上皮黏膜屏障功能; (2)通过抑制双氯芬酸引起的p38/MAPK的磷酸化, 减轻了双氯芬酸对小肠黏膜上皮细胞的促凋亡等损伤作用, 进而起到保护肠黏膜、促进损伤修复的作用.
非甾体类抗炎药(non-steroid anti-inflammatory drugs, NSAIDs)以其良好的解热、镇痛、抗炎、抗风湿等疗效而广泛应用于临床. 近年来, 随着双气囊小肠镜和胶囊内镜技术的发展, 临床中发现长期服用NSAIDs的患者中小肠损伤的发生率并不比上消化道损伤的发生率低, 而且后果更严重. NSAIDs相关性小肠损伤的现象及其防治引起了临床医师的共同关注.
王蒙, 副教授, 中国人民解放军第二军医大学附属东方肝胆外科医院肝外综合治疗一科
近年来, NSAIDs相关性小肠损伤及其可能引起不良临床后果引起了临床医师的共同关注. 目前这种小肠损伤的机制尚不明确, 临床中出现这种小肠损伤后除了停用NSAIDs药物之外尚缺乏有效的治疗措施. 寻找防治NSAIDs相关性小肠损伤的有效药物迫在眉睫.
Niwa和Fujimori的临床研究均发现瑞巴派特对NSAIDs相关性小肠损伤有一定的防治效果. Wallace等的研究提示质子泵抑制剂(proton pump inhibitors, PPI)对NSAIDs引起的上消化道损伤有良好的防治效果, 但对NSAIDs相关性小肠损伤效果不明显, 而且可引起肠道菌群失调而加重小肠损伤.
本文通过动物实验证实了瑞巴派特对NSAIDs相关性小肠损伤有一定的保护作用, 并探究了这种保护作用与紧密连接蛋白Occludin以及丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路的可能关系, 为阐明瑞巴派特对NSAIDs相关性小肠损伤保护作用的机制提供了一定的线索.
NSAIDs相关性小肠损伤是临床中常见的现象, 而目前尚缺乏有效的治疗措施. 临床研究提示瑞巴派特对这种肠道损伤有一定的治疗作用, 但机制未明. 本研究通过动物实验初步探讨了其可能的机制, 为临床用药提供了一定的理论依据.
紧密连接: 是上皮细胞之间的一种重要的连接复合体, 由跨膜蛋白家族、膜周蛋白家族等构成, 对细胞旁通透屏障和细胞极性的维持有重要作用; 丝裂原活化蛋白激酶(MAPK): 由一组能被不同的细胞外刺激, 如细胞因子、神经递质、激素、细胞应激及细胞黏附等激活的丝氨酸-苏氨酸蛋白激酶组成, 是信号从细胞表面到核内的重要传递者, 对细胞的生长、分化、对环境的应激适应、炎症反应等多种重要的细胞生理/病理过程有重要的调节作用.
本文探究了瑞巴派特对NSAIDs相关性小肠损伤的保护作用与紧密连接蛋白Occludin以及MAPK信号通路的可能关系, 研究构思及科研意识可以.
编辑: 韦元涛 电编:闫晋利
| 1. | O'Brien WM, Bagby GF. Rare adverse reactions to nonsteroidal antiinflammatory drugs. J Rheumatol. 1985;12:13-20. [PubMed] |
| 2. | Baltoyiannis G, Christodoulos N, Mitsis M, Stephanou D, Ioannou H, Nousias V, Kappas AM. A comparative experimental study of the effects of diclofenac and ketoprofen on the small-bowel mucosa of canines. Res Exp Med (Berl). 2001;200:125-135. [PubMed] [DOI] |
| 3. | Hatazawa R, Ohno R, Tanigami M, Tanaka A, Takeuchi K. Roles of endogenous prostaglandins and cyclooxygenase isozymes in healing of indomethacin-induced small intestinal lesions in rats. J Pharmacol Exp Ther. 2006;318:691-699. [PubMed] [DOI] |
| 4. | Allison MC, Howatson AG, Torrance CJ, Lee FD, Russell RI. Gastrointestinal damage associated with the use of nonsteroidal antiinflammatory drugs. N Engl J Med. 1992;327:749-754. [PubMed] [DOI] |
| 5. | Rimbaş M, Marinescu M, Voiosu MR, Băicuş CR, Caraiola S, Nicolau A, Niţescu D, Badea GC, Pârvu MI. NSAID-induced deleterious effects on the proximal and mid small bowel in seronegative spondyloarthropathy patients. World J Gastroenterol. 2011;17:1030-1035. [PubMed] [DOI] |
| 6. | Higuchi K, Umegaki E, Watanabe T, Yoda Y, Morita E, Murano M, Tokioka S, Arakawa T. Present status and strategy of NSAIDs-induced small bowel injury. J Gastroenterol. 2009;44:879-888. [PubMed] [DOI] |
| 7. | Sidhu R, Sanders DS, McAlindon ME, Kapur K. Capsule endoscopy for the evaluation of nonsteroidal anti-inflammatory drug-induced enteropathy: United Kingdom pilot data. Gastrointest Endosc. 2006;64:1035. [PubMed] [DOI] |
| 8. | Maiden L, Thjodleifsson B, Seigal A, Bjarnason II, Scott D, Birgisson S, Bjarnason I. Long-term effects of nonsteroidal anti-inflammatory drugs and cyclooxygenase-2 selective agents on the small bowel: a cross-sectional capsule enteroscopy study. Clin Gastroenterol Hepatol. 2007;5:1040-1045. [PubMed] [DOI] |
| 9. | Graham DY, Opekun AR, Willingham FF, Qureshi WA. Visible small-intestinal mucosal injury in chronic NSAID users. Clin Gastroenterol Hepatol. 2005;3:55-59. [PubMed] [DOI] |
| 10. | Fujimori S, Takahashi Y, Gudis K, Seo T, Ehara A, Kobayashi T, Mitsui K, Yonezawa M, Tanaka S, Tatsuguchi A. Rebamipide has the potential to reduce the intensity of NSAID-induced small intestinal injury: a double-blind, randomized, controlled trial evaluated by capsule endoscopy. J Gastroenterol. 2011;46:57-64. [PubMed] [DOI] |
| 11. | Niwa Y, Nakamura M, Ohmiya N, Maeda O, Ando T, Itoh A, Hirooka Y, Goto H. Efficacy of rebamipide for diclofenac-induced small-intestinal mucosal injuries in healthy subjects: a prospective, randomized, double-blinded, placebo-controlled, cross-over study. J Gastroenterol. 2008;43:270-276. [PubMed] [DOI] |
| 12. | Brown RS, Wahl RL. Overexpression of Glut-1 glucose transporter in human breast cancer. An immunohistochemical study. Cancer. 1993;72:2979-2985. [PubMed] [DOI] |
| 14. | Scheiman JM, Yeomans ND, Talley NJ, Vakil N, Chan FK, Tulassay Z, Rainoldi JL, Szczepanski L, Ung KA, Kleczkowski D. Prevention of ulcers by esomeprazole in at-risk patients using non-selective NSAIDs and COX-2 inhibitors. Am J Gastroenterol. 2006;101:701-710. [PubMed] [DOI] |
| 15. | Maiden L, Thjodleifsson B, Theodors A, Gonzalez J, Bjarnason I. A quantitative analysis of NSAID-induced small bowel pathology by capsule enteroscopy. Gastroenterology. 2005;128:1172-1178. [PubMed] [DOI] |
| 16. | Goldstein JL, Eisen GM, Lewis B, Gralnek IM, Zlotnick S, Fort JG. Video capsule endoscopy to prospectively assess small bowel injury with celecoxib, naproxen plus omeprazole, and placebo. Clin Gastroenterol Hepatol. 2005;3:133-141. [PubMed] [DOI] |
| 17. | Wallace JL, Syer S, Denou E, de Palma G, Vong L, McKnight W, Jury J, Bolla M, Bercik P, Collins SM. Proton pump inhibitors exacerbate NSAID-induced small intestinal injury by inducing dysbiosis. Gastroenterology. 2011;141:1314-1322, 1322.e1-e5. [PubMed] [DOI] |
| 18. | Mukherjee D, Nissen SE, Topol EJ. Risk of cardiovascular events associated with selective COX-2 inhibitors. JAMA. 2001;286:954-959. [PubMed] [DOI] |
| 19. | Naito Y, Yoshikawa T, Tanigawa T, Sakurai K, Yamasaki K, Uchida M, Kondo M. Hydroxyl radical scavenging by rebamipide and related compounds: electron paramagnetic resonance study. Free Radic Biol Med. 1995;18:117-123. [PubMed] [DOI] |
| 21. | Berkes J, Viswanathan VK, Savkovic SD, Hecht G. Intestinal epithelial responses to enteric pathogens: effects on the tight junction barrier, ion transport, and inflammation. Gut. 2003;52:439-451. [PubMed] [DOI] |
| 22. | Pan MR, Chang HC, Hung WC. Non-steroidal anti-inflammatory drugs suppress the ERK signaling pathway via block of Ras/c-Raf interaction and activation of MAP kinase phosphatases. Cell Signal. 2008;20:1134-1141. [PubMed] [DOI] |
| 23. | Samak G, Aggarwal S, Rao RK. ERK is involved in EGF-mediated protection of tight junctions, but not adherens junctions, in acetaldehyde-treated Caco-2 cell monolayers. Am J Physiol Gastrointest Liver Physiol. 2011;301:G50-G59. [PubMed] [DOI] |
| 24. | Basuroy S, Seth A, Elias B, Naren AP, Rao R. MAPK interacts with occludin and mediates EGF-induced prevention of tight junction disruption by hydrogen peroxide. Biochem J. 2006;393:69-77. [PubMed] [DOI] |
| 25. | Yang R, Harada T, Li J, Uchiyama T, Han Y, Englert JA, Fink MP. Bile modulates intestinal epithelial barrier function via an extracellular signal related kinase 1/2 dependent mechanism. Intensive Care Med. 2005;31:709-717. [PubMed] [DOI] |
| 26. | Wang H, Sun Y, Liu S, Yu H, Li W, Zeng J, Chen C, Jia J. Upregulation of progranulin by Helicobacter pylori in human gastric epithelial cells via p38MAPK and MEK1/2 signaling pathway: role in epithelial cell proliferation and migration. FEMS Immunol Med Microbiol. 2011;63:82-92. [PubMed] [DOI] |