修回日期: 2015-07-24
接受日期: 2015-08-04
在线出版日期: 2015-08-28
目的: 观察盐霉素对胰腺癌Capan-2及PANC-1细胞增殖及迁徙能力的影响, 探讨其抑制细胞迁移能力的可能作用机制.
方法: 以1、2、4、 8、10、20、40、60、80 μmol/L不同浓度的盐霉素处理Capan-2及PANC-1细胞24 h后, 利用CCK8检测细胞增殖并得出半数抑制率的药物浓度(50% inhibitory concentration of a substance, IC50). 利用Transwell实验检测细胞迁移能力的改变, 进一步分别利用Western blot及Real-time PCR检测上皮间质转化(epithelial-mesenchymal transition, EMT)关键分子E-cadherin及Vimentin的表达变化.
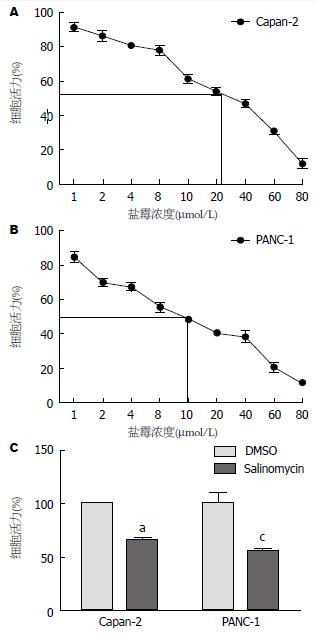
结果: 盐霉素呈浓度依赖性抑制Capan-2及PANC-1细胞的增殖, 其IC50分别为20及10 μmol/L. Transwell细胞迁移实验发现盐霉素可明显抑制细胞的迁移能力(P值
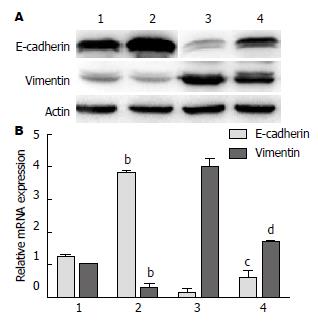
均<0.05), Western blot实验发现E-cadherin表达上调而Vimentin表达下调, 进而Real-time PCR检测后发现Capan-2细胞在DMSO对照组作用及盐霉素处理后E-cadherin基因mRNA的相对表达量分别为1.2140±0.0988 vs 3.7920±0.0733, 而Vimentin基因mRNA的相对表达量分别为0.9998±0.0332 vs 0.2756±0.1250; PANC-1细胞在DMSO对照组作用及盐霉素处理后E-cadherin基因mRNA的相对表达量分别为0.1210±0.1130 vs 0.5790±0.2230而Vimentin基因的mRNA相对表达量分别为3.9820±0.2670 vs 1.6920±0.0130, 差异均有统计学意义(均P<0.05).
结论: 盐霉素可以抑制胰腺癌细胞体外增殖及迁徙能力, 可能通过抑制EMT发生过程抑制细胞的转移能力.
核心提示: 肿瘤干细胞是导致肿瘤易复发及化疗耐药的重要原因, 本研究发现盐霉素作为一种可以有效地杀死肿瘤干细胞的抗生素, 其在胰腺癌中可以抑制胰腺癌细胞的增殖及迁徙能力, 并可能参与抑制细胞上皮间质转化(epithelial-mesenchymal transition)的发生过程.
引文著录: 许琮, 夏超, 张淑娟, 覃华, 李德民, 赵秋. 盐霉素对胰腺癌细胞体外增殖及迁移能力的影响. 世界华人消化杂志 2015; 23(24): 3831-3837
Revised: July 24, 2015
Accepted: August 4, 2015
Published online: August 28, 2015
AIM: To investigate the effect of salinomycin on proliferation and migration of pancreatic cancer cell lines Capan-2 and PANC-1 and the possible mechanisms of inhibition of cell migration.
METHODS: Canpan-2 and PANC-1 cells were treated with different concentrations of salinomycin for 24 h, while the cells treated with dimethyl sulphoxide (DMSO) were used as controls. Cell proliferation and the half maximal inhibitory concentration (IC50) of salinomycin were measured by CCK8 assay. Transwell assay was used to measure the migration of these cells which were pretreated with salinomycin at a concentration of IC50. The protein and mRNA expression of biomarkers for epithelial-mesenchymal transition (EMT) was detected by Western blot and Real-time PCR, respectively.
RESULTS: Salinomycin inhibited the proliferation of Capan-2 and PANC-1 cells in a dose-dependent manner. The IC50 values for Capan-2 and PANC-1 cells were 20 μmol/L and 10 μmol/L, respectively. Salinomycin significantly decreased the migration ability of pancreatic cancer cells as revealed by Transwell migration assay (P < 0.05). The protein expression of E-cadherin was increased while that of Vimentin was decreased after salinomycin treatment. The expression of E-cadherin mRNA was increased in both Capan-2 and PANC-1 cells (P < 0.05), while the expression of Vimentin mRNA was decreased in both Capan-2 and PANC-1 cells (P < 0.05).
CONCLUSION: Salinomycin can inhibit the proliferation and migration of Capan-2 and PANC-1 cells possibly by inhibiting the process of EMT.
- Citation: Xu C, Xia C, Zhang SJ, Qin H, Li DM, Zhao Q. Effect of salinomycin on growth and migration of pancreatic cancer cells in vitro. Shijie Huaren Xiaohua Zazhi 2015; 23(24): 3831-3837
- URL: https://www.wjgnet.com/1009-3079/full/v23/i24/3831.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i24.3831
胰腺癌是恶性程度、致死率极高的消化系肿瘤, 5年生存率往往不足5%[1]. 多数患者诊断明确时往往已处于晚期, 早已失去手术机会. 只有10%-20%的患者可以有机会进行手术切除, 但依然有大约80%的患者手术后最终依然死于此疾病, 平均生存期不超过2年[2]. 过去研究[3]发现胰腺癌细胞往往早期极易发生侵袭转移, 同时往往对传统化疗药物存在一定的耐药性是导致胰腺癌恶性程度极高、预后很差的原因. 过去几年人们研究发现肿瘤细胞中存在一类特殊的细胞群体即"肿瘤干细胞" (cancer stem cell, CSC)是一类具有自我更新和多向分化潜能的细胞群体, 有助于细胞在不同的肿瘤微环境下生存[4,5]. 自从盐霉素被发现可以选择性杀死乳腺癌干细胞以来[6], 盐霉素在其他肿瘤中的作用研究也越来越多[7-10]. 本研究旨在探索盐霉素对胰腺癌细胞转移能力的抑制作用, 找出可能的作用机制.
人胰腺癌细胞系Capan-2及PANC-1细胞均购自中国科学院上海生命科学研究院细胞资源中心; 所有细胞均使用含有10%的胎牛血清(美国Gibco公司). 1%青-链霉素的培养基培养、传代, 其中PANC-1细胞采用DMEM培养基(美国Gibco公司); Capan-2细胞采用1640培养基(美国Gibco公司); 本实验所采用的盐霉素购自美国Cayman公司, 以DMSO配置储存液浓度为5 mmol/L, -20 ℃长期保存; E-cadherin抗体购自美国ABGENT公司; Vimentin抗体购自美国CST公司; β-Actin抗体购自武汉启动子公司; CCK8检测试剂盒(武汉启动子生物有限公司).
1.2.1 细胞毒性及增殖实验: 采用CCK8检测试剂盒检测, 细胞毒性实验检测所使用盐霉素半数抑制率时的药物浓度IC50. 取对数生长期的细胞消化后以5000个细胞/孔接种于96孔板后过夜, 以1、2、4、 8、10、20、40、60、80 μmol/L不同浓度处理细胞24 h后, 加入CCK8试剂, 按说明书操作, 计算450 nm吸光度值, 细胞活力(cell viability) = (A实验组-A空白组)/(A对照组-A空白组)×100%.
1.2.2 RNA提取及Real-time PCR检测: 细胞以5×105细胞量接种于六孔板, 待细胞贴壁后分别以IC50的浓度盐霉素及DMSO处理细胞24 h后消化收集细胞沉淀, 利用TRIzol法提取细胞总RNA, 按照TaKaRa逆转录试剂盒说明书及Real-time PCR说明书进行操作, 引物序列设计如下: E-cadherin F: 5'-CCTGGGACTCCACCTACAGA-3', R: 5'-GGATGACACAGCGTGAGAGA-3'; Vimentin F: 5'-AGTCCACTGAGTACCGGAGAC-3', R: 5'-CATTTCACGCATCTGGCGTTC-3'; ACTB F: 5'-GTTGCGTTACACCCTTTCTTG-3', R: 5'-GACTGCTGTCACCTTCACCGT-3'.
1.2.3 Western blot检测: 将细胞以5×105细胞量接种于六孔板, 待细胞贴壁后分别以IC50的浓度盐霉素及DMSO处理细胞24 h后消化收集细胞沉淀, 加入适量的PMSF的NP40裂解液冰上裂解后1200 r/min离心后取上清, 利用BCA试剂盒检测蛋白浓度后以30 μg上样电泳后, NC膜转膜2 h并用脱脂牛奶封闭非特异性结合, 孵育一抗4 ℃过夜(使用5%的BSA稀释抗体, 其中E-cadherin及Vimentin抗体稀释比例均为1:1000, β-actin抗体稀释比例为1:2000), 后TBST洗膜后孵育二抗1 h后利用ECL显色法进行显影.
1.2.4 Transwell迁移实验: 利用Corning公司的0.4 μm Transwell小室检测细胞的迁移能力, 细胞迁移实验接种细胞量1000个/孔, 上室加入200 μL无血清培养基, 下室加入600 μL含10%FBS的培养基培养24 h后细胞固定0.1%结晶紫染色20 min后倒置显微镜下观察, 200倍高倍镜下随机选取六个视野计数并统计.
统计学处理 利用Graphpad Prism软件作图, SPSS17.0软件进行统计学分析, 每次实验重复3次以上, 数据用mean±SD表示, 采用χ2检验或Two-way ANOVA检验分析, P<0.05为差异具有统计学意义.
根据细胞药物毒性实验结果可发现, 盐霉素作用于Capan-2细胞对细胞活力的影响成浓度依赖性的, 随着药物浓度的增加细胞的活力逐渐下降, 其IC50约为20 μmol/L; 同样地, 盐霉素呈药物浓度依赖性的抑制PANC-1细胞的活力, 其IC50约为10 μmol/L(图1).
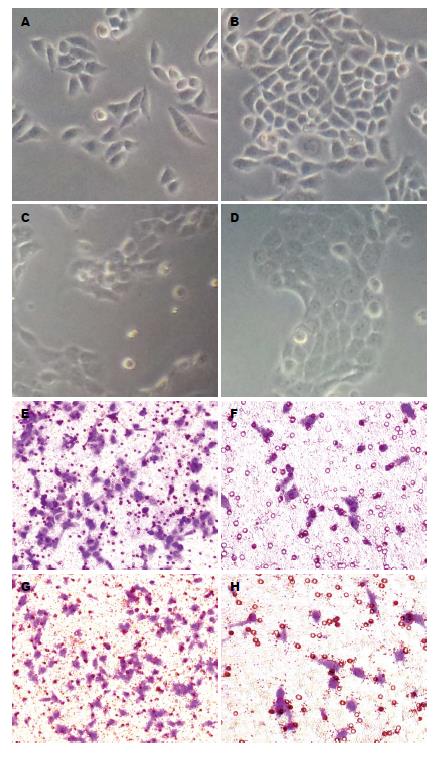
Capan-2细胞在20 μmol/L的盐霉素处理作用后细胞形态间距变窄, 细胞极性消失, 由长梭形变得卵圆形, 10 μmol/L的盐霉素作用 PANC-1细胞后细胞形态也有上述类似的变化(图2A-D); 进而行Transwell细胞迁徙实验后发现, 无论是Capan-2细胞亦或是PANC-1细胞在盐霉素作用后细胞迁徙能力明显受抑制, 200倍高倍显微镜下随机选取六个视野统计, 经分析P值分别为0.008和0.036, 差异具有统计学意义(图2E-H).
进一步我们检测EMT的标志分子的表达变化后发现, Capan-2及PANC-1细胞在盐霉素作用处理后中E-cadherin蛋白表达水平上调、Vimentin蛋白表达水平下调; 利用Real-time PCR检测后发现, Capan-2细胞在盐霉素处理前后E-cadherin基因mRNA的相对表达量分别为1.2140±0.0988 vs 3.7920±0.0733(t = 36.35, P<0.0001)而Vimentin基因mRNA的相对表达量分别为0.9998±0.0332 vs 0.2756±0.1250(t = 9.699, P = 0.0006), PANC-1细胞盐霉素处理前后E-cadherin基因mRNA的相对表达量分别为0.1210±0.1130 vs 0.579±0.2230(t = 3.173, P = 0.038)而Vimentin基因的mRNA相对表达量分别为3.9820±0.2670和1.6920±0.0130(t = 14.84, P = 0.0001)(图3).
肿瘤干细胞是导致肿瘤易复发及化疗耐药的重要原因[11], 而2008年Mani等[12]在正常乳腺导管上皮细胞及乳腺癌细胞中发现诱导细胞发生EMT后可使细胞获得干细胞的特性, 可见肿瘤干细胞特性与肿瘤细胞的侵袭转移关系密切[13]. 盐霉素作为一种抗生素对大多数革兰氏阳性菌及各种球虫有较强的抑制和杀灭作用, 过去常作为兽医领域治疗用药使用[14-16]. 然而自从2009年Gupta等[6]通过筛查16000中化学药物后发现盐霉素可以有效地杀死乳腺癌干细胞, 其抗癌效应是紫杉醇的100倍多, 其作为一种新型的抗癌药物是否能够应用于临床解决肿瘤复发转移这一难题一直以来值得人们不断深入研究探索. 本研究旨在探索盐霉素对胰腺癌细胞体外增殖及转移能力是否有抑制作用, 并进一步研究其可能的机制, 为今后的对抗胰腺癌提供新的思路.
本研究利用恶性程度及分化程度不同的胰腺癌细胞Capan-2及PANC-1细胞作为研究对象[17]. 利用CCK8检测后发现盐霉素可以抑制胰腺癌细胞的活力及增殖能力, 而且呈剂量依赖性, 其中IC50分别为20及10 μmol/L. 此外, 本研究尚发现这两种细胞在盐霉素处理后迁徙能力也明显受到抑制, 与过去在肺癌、结直肠癌及血液系统肿瘤中的研究结果一致[18-20].
临床上胰腺癌多数患者并不是死于原发灶的浸润生长, 而是死于肿瘤的广泛远处转移[21-23]. EMT是导致肿瘤侵袭转移的重要原因之一, 并与肿瘤的化疗抗性存在密切的联系[24,25]. EMT的标记分子之一是介导细胞与细胞之间相互黏附的上皮标记黏附分子E-cadherin下调, 而间质标志分子包括Vimentin、Fibronectin及N-cadherin表达的上调[26-28]. 本课题组长期致力于胰腺癌EMT的机制研究, 过去我们曾经研究[29,30]并报道过补体反应基因-32(response gene to complement-32, RGC-32)参与TGF-β诱导的胰腺癌细胞的EMT过程, 以及中药成分姜黄素在胰腺癌中可以发挥抑制EMT的重要作用[31]. 本研究发现, 盐霉素作用后的胰腺癌细胞蛋白水平上, E-cadherin表达有所上调而Vimentin则下调, 说明盐霉素可能参与抑制胰腺癌的EMT的过程. 进一步行Real-time PCR检测mRNA水平的表达后发现, 无论是Capan-2细胞还是PANC-1细胞, 在盐霉素处理作用后E-cadherin及Vimentin基因mRNA水平的变化同蛋白水平变化一致且差异具有统计学意义. 因此我们认为, 盐霉素不仅在蛋白水平还可在mRNA水平抑制EMT关键分子的表达, 从而发挥抑制细胞体外迁徙能力的作用.
总之, 本研究结果表明盐霉素可以抑制胰腺癌细胞的增殖及迁徙能力, 并可能参与抑制EMT的发生过程, 而其具体的作用机制有待进一步的探索.
胰腺癌是一种恶性程度极高的消化系肿瘤, 其早期症状隐匿, 发现时多已是晚期, 手术切除率低, 预后较差.
夏时海, 教授, 主任医师, 行政主任, 武警后勤学院附属医院肝胆胰脾科(中心); 李淑德, 教授, 中国人民解放军第二军医大学长海医院消化内科
胰腺癌的传统治疗方法如手术切除、放化疗等基本治疗手段都具有一定的缺陷和不足, 找出有效的治疗方法是我们亟待研究解决的问题.
研究发现盐霉素可以选择性杀死包括乳腺癌在内的多种肿瘤干细胞, 有研究报道称盐霉素可以抑制胰腺癌细胞增殖并抑制肿瘤干细胞表型的获得.
本研究发现盐霉素可以抑制胰腺癌细胞的增殖及迁徙能力, 并可能参与抑制上皮间质转化(epithelial-mesenchymal transition, EMT)的发生过程.
随着人们对盐霉素抑制肿瘤细胞的发生及侵袭转移作用机制研究的不断深入, 盐霉素有望成为新型、有效抗癌药物并降低肿瘤的复发率, 延长患者寿命并提高生存治疗.
上皮间质转化(EMT): 是指上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程, 在胚胎发育、慢性炎症及肿瘤转移中发挥了重要作用.
本文观察盐霉素对胰腺癌细胞株体外增殖和迁移能力的影响, 对探讨胰腺癌细胞侵袭和转移的分子机制, 有重要指导意义.
编辑: 郭鹏 电编:闫晋利
| 1. | Hidalgo M. Pancreatic cancer. N Engl J Med. 2010;362:1605-1617. [PubMed] [DOI] |
| 2. | Butturini G, Stocken DD, Wente MN, Jeekel H, Klinkenbijl JH, Bakkevold KE, Takada T, Amano H, Dervenis C, Bassi C. Influence of resection margins and treatment on survival in patients with pancreatic cancer: meta-analysis of randomized controlled trials. Arch Surg. 2008;143:75-183; discussion 183. [PubMed] [DOI] |
| 3. | Li Y, Kong D, Ahmad A, Bao B, Sarkar FH. Pancreatic cancer stem cells: emerging target for designing novel therapy. Cancer Lett. 2013;338:94-100. [PubMed] [DOI] |
| 4. | Yu Z, Pestell TG, Lisanti MP, Pestell RG. Cancer stem cells. Int J Biochem Cell Biol. 2012;44:2144-2151. [PubMed] [DOI] |
| 5. | Jeter CR, Badeaux M, Choy G, Chandra D, Patrawala L, Liu C, Calhoun-Davis T, Zaehres H, Daley GQ, Tang DG. Functional evidence that the self-renewal gene NANOG regulates human tumor development. Stem Cells. 2009;27:993-1005. [PubMed] [DOI] |
| 6. | Gupta PB, Onder TT, Jiang G, Tao K, Kuperwasser C, Weinberg RA, Lander ES. Identification of selective inhibitors of cancer stem cells by high-throughput screening. Cell. 2009;138:645-659. [PubMed] [DOI] |
| 7. | Antoszczak M, Huczyński A. Anticancer activity of polyether ionophore-salinomycin. Anticancer Agents Med Chem. 2015;15:575-591. [PubMed] |
| 8. | Arafat K, Iratni R, Takahashi T, Parekh K, Al Dhaheri Y, Adrian TE, Attoub S. Inhibitory effects of salinomycin on cell survival, colony growth, migration, and invasion of human non-small cell lung cancer A549 and LNM35: Involvement of NAG-1. PLoS One. 2013;8:e66931. [PubMed] [DOI] |
| 9. | Wang F, He L, Dai WQ, Xu YP, Wu D, Lin CL, Wu SM, Cheng P, Zhang Y, Shen M. Salinomycin inhibits proliferation and induces apoptosis of human hepatocellular carcinoma cells in vitro and in vivo. PLoS One. 2012;7:e50638. [PubMed] [DOI] |
| 10. | Calzolari A, Saulle E, De Angelis ML, Pasquini L, Boe A, Pelacchi F, Ricci-Vitiani L, Baiocchi M, Testa U. Salinomycin potentiates the cytotoxic effects of TRAIL on glioblastoma cell lines. PLoS One. 2014;9:e94438. [PubMed] [DOI] |
| 11. | Clevers H. The cancer stem cell: premises, promises and challenges. Nat Med. 2011;17:313-319. [PubMed] [DOI] |
| 12. | Mani SA, Guo W, Liao MJ, Eaton EN, Ayyanan A, Zhou AY, Brooks M, Reinhard F, Zhang CC, Shipitsin M. The epithelial-mesenchymal transition generates cells with properties of stem cells. Cell. 2008;133:704-715. [PubMed] [DOI] |
| 13. | Plaks V, Kong N, Werb Z. The cancer stem cell niche: how essential is the niche in regulating stemness of tumor cells? Cell Stem Cell. 2015;16:225-238. [PubMed] [DOI] |
| 14. | Zhou S, Wang F, Wong ET, Fonkem E, Hsieh TC, Wu JM, Wu E. Salinomycin: a novel anti-cancer agent with known anti-coccidial activities. Curr Med Chem. 2013;20:4095-4101. [PubMed] |
| 15. | D'Alessandro S, Corbett Y, Ilboudo DP, Misiano P, Dahiya N, Abay SM, Habluetzel A, Grande R, Gismondo MR, Dechering KJ. Salinomycin and other ionophores as a new class of antimalarial drugs with transmission-blocking activity. Antimicrob Agents Chemother. 2015;59:5135-5144. [PubMed] [DOI] |
| 16. | Lu D, Choi MY, Yu J, Castro JE, Kipps TJ, Carson DA. Salinomycin inhibits Wnt signaling and selectively induces apoptosis in chronic lymphocytic leukemia cells. Proc Natl Acad Sci USA. 2011;108:13253-13257. [PubMed] [DOI] |
| 17. | Sipos B, Möser S, Kalthoff H, Török V, Löhr M, Klöppel G. A comprehensive characterization of pancreatic ductal carcinoma cell lines: towards the establishment of an in vitro research platform. Virchows Arch. 2003;442:444-452. [PubMed] [DOI] |
| 18. | Fuchs D, Daniel V, Sadeghi M, Opelz G, Naujokat C. Salinomycin overcomes ABC transporter-mediated multidrug and apoptosis resistance in human leukemia stem cell-like KG-1a cells. Biochem Biophys Res Commun. 2010;394:1098-1104. [PubMed] [DOI] |
| 19. | Wang Y. Effects of salinomycin on cancer stem cell in human lung adenocarcinoma A549 cells. Med Chem. 2011;7:106-111. [PubMed] |
| 20. | Dong TT, Zhou HM, Wang LL, Feng B, Lv B, Zheng MH. Salinomycin selectively targets 'CD133+' cell subpopulations and decreases malignant traits in colorectal cancer lines. Ann Surg Oncol. 2011;18:1797-1804. [PubMed] [DOI] |
| 22. | Castellanos JA, Merchant NB, Nagathihalli NS. Emerging targets in pancreatic cancer: epithelial-mesenchymal transition and cancer stem cells. Onco Targets Ther. 2013;6:1261-1267. [PubMed] [DOI] |
| 23. | Wang Z, Li Y, Ahmad A, Banerjee S, Azmi AS, Kong D, Sarkar FH. Pancreatic cancer: understanding and overcoming chemoresistance. Nat Rev Gastroenterol Hepatol. 2011;8:27-33. [PubMed] [DOI] |
| 24. | Rhim AD, Mirek ET, Aiello NM, Maitra A, Bailey JM, McAllister F, Reichert M, Beatty GL, Rustgi AK, Vonderheide RH. EMT and dissemination precede pancreatic tumor formation. Cell. 2012;148:349-361. [PubMed] [DOI] |
| 25. | Zhan HX, Xu JW, Wu D, Zhang TP, Hu SY. Pancreatic cancer stem cells: new insight into a stubborn disease. Cancer Lett. 2015;357:429-437. [PubMed] [DOI] |
| 26. | Mitra A, Mishra L, Li S. EMT, CTCs and CSCs in tumor relapse and drug-resistance. Oncotarget. 2015;6:10697-10711. [PubMed] |
| 27. | Rokavec M, Öner MG, Li H, Jackstadt R, Jiang L, Lodygin D, Kaller M, Horst D, Ziegler PK, Schwitalla S. Corrigendum. IL-6R/STAT3/miR-34a feedback loop promotes EMT-mediated colorectal cancer invasion and metastasis. J Clin Invest. 2015;125:1362. [PubMed] [DOI] |
| 28. | Pang MF, Georgoudaki AM, Lambut L, Johansson J, Tabor V, Hagikura K, Jin Y, Jansson M, Alexander JS, Nelson CM. TGF-β1-induced EMT promotes targeted migration of breast cancer cells through the lymphatic system by the activation of CCR7/CCL21-mediated chemotaxis. Oncogene. 2015; May 11. [Epub ahead of print]. [PubMed] [DOI] |
| 29. | Zhu L, Qin H, Li PY, Xu SN, Pang HF, Zhao HZ, Li DM, Zhao Q. Response gene to complement-32 enhances metastatic phenotype by mediating transforming growth factor beta-induced epithelial-mesenchymal transition in human pancreatic cancer cell line BxPC-3. J Exp Clin Cancer Res. 2012;31:29. [PubMed] [DOI] |