修回日期: 2015-07-03
接受日期: 2015-07-13
在线出版日期: 2015-08-18
目的: 分析内脏假性动脉瘤(visceral artery pseudoaneurysms, VAPA)的临床特征与介入栓塞的应用价值.
方法: 回顾性总结42例内脏假性动脉瘤患者的临床特征和介入栓塞治疗经验. 术后均通过复查增强计算机断层扫描(computed tomography, CT)或CT血管造影(CT angiography, CTA)进行随访.
结果: 38例患者VAPA成功栓塞, 介入手术成功率为90.4%(38/42); 其中1例术后28 d死于多系统器官衰竭, 术后30 d内死亡率是2.4%(1/42). 4例再次出血患者需行二次介入手术, 术后出血均停止. 术后1-12 mo共17例肿瘤患者死亡, 死亡率为40.5%, 死因分别为原发病进展(n = 8), 多器官动能衰竭(n = 7), 心梗(n = 1)和感染性休克(n = 1). 4例需脾栓塞的患者出现栓塞后综合征. 在随访期间, 所有患者均无肝功能的变化和肠缺血, VAPA均未复发.
结论: 介入栓塞VAPA创伤小、成功率高, 尤其适用于外科手术禁忌的患者.
核心提示: 本文回顾性分析42例行介入栓塞治疗的VAPA患者的临床特征和治疗方法, 第一次血管内治疗技术成功率90.4%(38/42), 失败率9.6%(4/42), 二次成功率是100%.
引文著录: 陈鹏飞, 段旭华, 任建庄, 韩新巍, 梁惠民, 郑传胜. 内脏假性动脉瘤的血管内栓塞治疗42例. 世界华人消化杂志 2015; 23(23): 3797-3803
Revised: July 3, 2015
Accepted: July 13, 2015
Published online: August 18, 2015
AIM: To determine the clinical features and endovascular treatment of visceral artery pseudoaneurysms (VAPA).
METHODS: Clinical data and our experience with interventional treatment of 42 patients with VAPA were retrospectively analyzed. Follow-up was carried out via assessment of contrast-enhanced computed tomography or computed tomography angiography images.
RESULTS: Endovascular treatment was technically successful in 38 (90.4%) patients, of whom one died of multisystem organ failure 28 d after intervention. The 30 d mortality rate was 2.4% (1/42). Four patients required secondary interventions because of rebleeding and were successfully treated by reintervention. In the follow-up period, 17 patients suffering from cancer died from 1 to 12 mo after embolization because of disease progression (n = 8), multisystem organ failure (n = 7), myocardial infarction (n = 1), and septic shock (n = 1). Four patients suffered partial splenic infarction and post-embolization syndrome. During follow-up, no patient had hepatic insufficiency or bowel ischemia; no VAPA occurred in all patients.
CONCLUSION: Endovascular management is minimally invasive and highly successful in treating VAPA and particularly useful in poor surgical candidates.
- Citation: Chen PF, Duan XH, Ren JZ, Han XW, Liang HM, Zheng CS. Endovascular treatment of visceral artery pseudoaneurysms: Analysis of 42 cases. Shijie Huaren Xiaohua Zazhi 2015; 23(23): 3797-3803
- URL: https://www.wjgnet.com/1009-3079/full/v23/i23/3797.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i23.3797
腹腔干、肠系膜上动脉主干及其分支上的假性动脉瘤称为内脏动脉假性动脉瘤(visceral artery pseudoaneurysms, VAPA)[1]. VAPA起病隐匿、发病率低, 一旦合并假性动脉瘤腹膜内或腹膜后破裂出血均可危及生命[1,2]. 随着影像诊断技术的发展和常规使用, VAPA的检出率明显提高[3,4]. VAPA诊断是通过分析增强计算机断层扫描(computed tomography, CT)、CT血管造影(CT angiography, CTA)图像和数字减影血管造影(digtal subtraction angiography, DSA)确定的. 在增强CT图像上, 假性动脉瘤表现为从供瘤动脉侧面发出的高密度、壁光滑、边界清楚的动脉瘤瘤体, 与动脉期供瘤动脉同时强化, 持续至静脉期才缓慢消失. 假性动脉瘤的远端和近端供血动脉可经CTA或DSA图像证实[3,4]. VAPA的传统治疗方法为切除、搭桥和简单的结扎[5]; 然而目前介入栓塞治疗因创伤小、适应症广、成功率高和复发率小, 已逐渐取代外科成为治疗VAPA的新方法[3,4,6]. 本研究回顾性分析介入治疗42例VAPA的经验, 评价介入栓塞治疗VAPA可行性、有效性和安全性.
回顾性分析2009-01/2013-12收治的42例诊断为VAPA并行介入栓塞治疗的患者. 42例患者中, 男性34例, 女性8例, 年龄22-75岁, 平均61岁. 42例患者就诊时均有不同程度的临床症状, 其中有37例表现为腹痛, 33例表现为恶心和/或呕吐, 20例表现为黑粪症和/或咯血, 15例局部触诊时有明显搏动感, 8例有胆道出血, 2例有阻塞性黄疸, 2例有背部或腰痛. 10例患者因大量出血而导致血流动力学不稳定, 8例患者有失血性休克表现. 本组研究使用各型直径0.0889 cm弹簧圈和0.0457 cm弹簧圈(Cook公司生产), 350-560 µm的明胶海绵颗粒(杭州爱立康公司生产)、3 F微导管和5 F Yashiro导管(Terumo公司生产).
1.2.1 诊断: VAPA诊断是通过分析增强CT、CTA图像和DSA确定的. 因10例血流动力学不稳定的患者需急诊血管造影外, 其余32例患者均先增强CT或CTA明确VAPA的诊断; 其中28例患者行对比增强CT扫描, 4例患者行CTA检查.
1.2.2 治疗: 采用Seldinger技术经皮穿刺股动脉, 置入5 F导管鞘. 引入5 F Yashiro(Terumo)导管分别行腹腔干动脉造影, 肠系膜上动脉造影以明确靶动脉[3,4]. 如果没找到靶动脉, 则行超选择性肝动脉、脾动脉及肠系膜上动脉分支造影, 寻找靶动脉. 采用3 F微导管行超选择性造影可识别较小的靶血管. 对于累及大动脉的VAPA采用弹簧圈栓塞假性动脉瘤的近端和远端动脉, 以消除流向假性动脉瘤的正向和逆行血流[7], 称为VAPA隔绝方法A. 对于肝内和脾内的VAPA, 因无明显侧枝循环的小动脉, 采用明胶海绵颗粒阻断VAPA的远端分支血管, 再采用弹簧圈阻断较大的近端动脉[4], 称为隔绝方法B. 治疗成功的指征为最后的血管造影中、随访的CT或CTA中VAPA均完全消失.
1.2.3 术后处理及随访: 介入术后保留导管鞘1-3 d, 观察是否有出血征象, 若无则拔除导管鞘. 对于有感染症状者予以抗炎治疗, 无感染症状者预防性抗炎治疗3-7 d. 记录术后30 d内, 并发症、VAPA复发率和死亡率. 术后1和12 mo随访增强CT图像上VAPA内无对比剂填充时, 可定义为VAPA治疗成功.
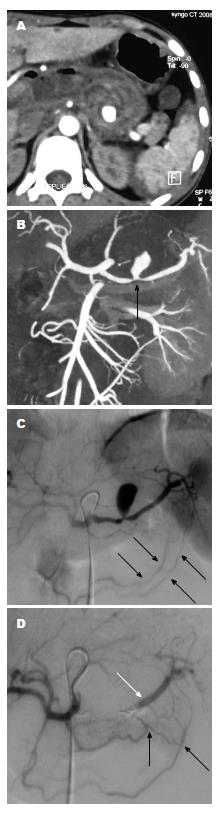
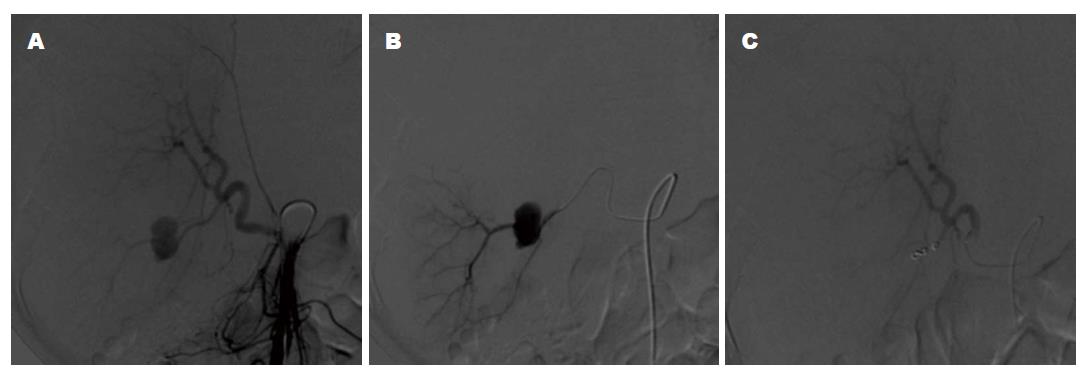
患者的临床特征如表1. 在围手术期和介入治疗过程中患者均无死亡. 42例VAPA患者DSA诊断明确. 28例患者行CT检查中25名被诊断出患有VAPA, 阳性诊断率25/28(89.3%), 另3例患者VAPA为DSA诊断; 而4例患者行CTA检查(图1A, B)时均被诊断出患有VAPA, 阳性诊断率(100%), 假性动脉瘤的远端和近端供血动脉可经CTA图像证实(图1B, C). 增强CT或CTA检查后1 d, 32例病情稳定患者直接行介入栓塞治疗; 10例患者输血治疗后血流动力学仍不稳定, 血管造影明确VAPA的诊断后行介入栓塞治疗. DSA发现假性动脉瘤的直径范围是0.4-9.6 cm, 平均4.9 cm±3.3 cm. VAPA在CT增强、CTA及DSA动脉早期即出现对比剂外溢, 形成类圆形、杵头状、不规则分叶状动脉腔外囊状影, 持续至静脉期才缓慢消失(图1,图2和图3). 42例均为单发, 瘤体最大径0.5-9.6 cm,平均约1.5 cm. 22例为类圆形, 16例为类椭圆形, 2例为杵头形, 2例为葫芦形. 38例密度均匀, 4例呈分层状密度不均.
| VAPA位置 | 病例数n(%) | 性别(男/女) | VAPA病因(n) |
| 脾外脾动脉 | 10(23.8) | 7/3 | 急性胰腺炎坏死组织清除术(5) |
| 慢性胰腺炎(2) | |||
| 胰十二指肠切除术(2) | |||
| 外科术后感染(1) | |||
| 脾内脾动脉 | 4(9.5) | 2/2 | 外伤(2) |
| 急性胰腺炎坏死组织清除术(2) | |||
| 肝外肝动脉 | 5(11.9) | 4/1 | 胰腺炎(3) |
| 胆肠吻合术(2) | |||
| 肝内肝动脉 | 5(11.9) | 3/2 | 外伤 (2) |
| 胆囊切除术(1) | |||
| PTCD(1) | |||
| TACE (1) | |||
| 胃十二指肠动脉 | 10(23.8) | 6/4 | 外科术后感染(6) |
| 胰腺炎(2) | |||
| 外科术后应激性溃疡(1) | |||
| 外科术后应激性复合性溃疡(1) | |||
| 腹腔干 | 3(7.1) | 2/1 | 胰十二指肠切除术(3) |
| 胰十二指肠动脉 | 2(4.8) | 1/1 | 胰腺炎(1) |
| 外科术后感染 (1) | |||
| 胃左动脉 | 2(4.8) | 2/0 | 胰十二指肠切除术(2) |
| 肠系膜上动脉 | 1(2.4) | 1/0 | 胰十二指肠切除术(1) |
42例患者均经导管采用隔离技术成功栓塞VAPA; 22例患者为隔离方法A; 20例患者为隔离方法B. 血管内治疗在技术成功率90.4%(38/42), 失败率9.6%例(4/42). 4例患者因再发出血需要进行二次介入手术, 均成功止血, 成功率是100%. 第1例为急性胰腺炎患者, 介入术后10 d再次出血; 第2次介入术中, DSA显示脾门处脾动脉残存部分新的VAPA形成, 采用方法A栓塞. 第2例为胰腺癌行胰头部切除术患者, VAPA位于胰十二指肠动脉, 介入术后7 d再发出血; 第2次介入术中, DSA显示胃十二指肠动脉残根部出血, 采用方法A栓塞. 第3例为肝门胆管癌外科手术患者, VAPA位于于肝内肝动脉, 介入术后6 d再发出血, DSA显示VAPA位于胃十二指肠动脉一个分支, 采用方法B栓塞. 第4例为急性重症胰腺炎患者, VAPA位于脾动脉主干, 介入术后9 d后再发出血; DSA显示一个脾内脾动脉假动脉瘤形成, 采用方法A栓塞. 该例患者介入术后39 d死于胰腺坏死引起的感染导致的多器官功能衰竭.
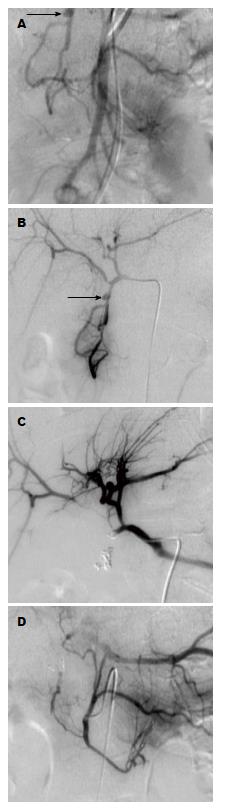
对两例特殊患者, 本研究采用了特殊栓塞方法. 第1例患者VAPA位于胃十二指肠动脉, 胃十二指肠动脉和肠系膜上动脉分支均参与供血(图2A, B), 前者是主要的供血动脉和后者一分支是次要的供血动脉. 超选择胃十二指肠动脉和肠系膜上动脉分支采用隔离法A栓塞VAPA. 第2例患者为CTA显示在脾门附近可见一个巨大的脾动脉假性动脉瘤, 先采用弹簧圈栓塞假性动脉瘤远端动脉及邻近脾脏分支动脉, 再采用弹簧圈栓塞假性动脉瘤近端动脉.
4例脾栓塞患者, 术后均出现栓塞术后综合症, 给予对症处理后均缓解. 随访期间, 所有患者均未出现肝脏功能异常、胃肠道缺血坏死等严重的栓塞并发症. 2例腹腔干假性动脉瘤患者, 1例介入术后28 d死于多器官功能衰竭和1例患者介入术后45 d死于感染性休克, 术后30 d内死亡率为2.4%(1/42). 1例晚期胰腺癌患者成功行肝动脉VAPA栓塞术, 术后49 d死于多器官功能衰竭. 术后39-325 d 17例患者死亡, 所有死亡原因均与VAPA无关; 其中8例死于恶性肿瘤进展, 7例死于多器官功能衰竭, 1例死于心肌梗死, 1例死于感染性休克.
假性动脉瘤是由腹内或腹膜后炎症、创伤或医源性因素等引起动脉壁连续性的中断造成的[3,8], 是由单层纤维组织包绕的湍流血液的囊. 假性动脉瘤自发破裂的风险非常高[9], 因此早期诊断和后续治疗至关重要. 增强CT被认为诊断VAPA的首选影像学检查, 并可推测VAPA的病因[9]. CTA不仅可以明确假性动脉瘤部位, 显示VAPA的载瘤动脉并能判定瘤底的宽窄[3]. 对于病情稳定患者, CT增强和CTA可以在有创性的血管造影之前, 能明确诊断并制订治疗方案. 然而对于血流动力学不稳定或者失血性休克的患者, 应该避免增强CT或CTA检查以减少对比剂使用量并节约时间, 急诊行诊断性血管造影. 本组病例中23.8%(10/42)的病情危重患者急诊行血管造影剂并后续介入治疗.
医源性操作是假性动脉瘤发生的首要因素, 手术、活检术及各种血管腔内治疗可直接损伤动脉血管或术后感染间接形成假性动脉瘤[3]. 本研究中, 医源性原因占71.4%(30/42). 由于医源性因素同时合并出血性休克、炎症及感染等并发症, 所有VAPA患者均暂无外科手术指征. 42例VAPA患者第一次介入手术成功率为90.4%, 第二次介入手术的成功率是100%, 术后患者均未发生肝功能不全、肠坏死等与栓塞相关的并发症. 介入栓塞治疗VAPA能最大限度保护器官功能并避免并发症发生, 为无手术指征的患者提供治愈的可能[10].
以腹腔干、肠系膜上动脉主干及其分支为主的上消化道动脉, 有丰富的侧支循环, 该处的VAPA的供血动脉有大量的侧支血管. Belli等[11]建议栓塞荷瘤动脉的近端和远端, 这样可以确保不会有侧支循环向VAPA回流供血. 介入栓塞治疗目的是从动脉循环中完全消除VAPA, 同时在隔离VAPA的治疗过程中必须确保有侧支循环持续灌注终末器官, 以防止因过度栓塞导致终末器官缺血和梗死等严重并发症的发生[12]. 本组研究中, 针对位于肝外和脾外的VAPA, 均采用隔离法A, 栓塞肝动脉和脾动脉, 但肝脏和脾脏均可以通过诸如: 胃左动脉、胃短动脉、膈动脉等侧支循环有效灌注. 对于肝内动脉、脾内动脉、胃十二指肠动脉及胃左动脉远端分支的VAPA, 采用隔离法B旷置栓塞VAPA, 因其周边侧枝循环丰富, 重建的侧枝血流能确保终末器官活性, 并保障VAPA无血流供应[3,4].
上消化道的丰富侧支循环同样能保证栓塞腹腔干的同时, 肝脏、脾脏、胰腺及胃肠道获得血液供应. Waldenberger等[13]建议通过弹簧圈栓塞腹腔干治疗动脉瘤是可行的, 且发生缺血的风险较低. 然而, 栓塞之前血管造影应明确腹腔干周围存在丰富的侧支循环, 栓塞VAPA远端供血动脉时应避免栓塞胃十二指肠动脉, 以确保肝脏侧枝循环的开通. 本研究中, 先将弹簧圈放置在远端动脉及VAPA的基底部并栓塞近端动脉使三个腹腔干假性动脉瘤被成功隔离.
胰腺炎导致胰腺消化酶溢出从而破坏邻近动脉壁, 导致脾动脉、肝动脉、胃十二指肠动脉、胰十二指肠动脉假性动脉瘤的形成[4,5,14]. 本研究中, 胰腺炎相关病例占40.5%(17/42), 4例二次介入手术的患者中, 3例为急性胰腺炎. 针对急性胰腺炎并发VAPA, 我们认为应采用隔离方法和放弃使用支架治疗腹部大动脉的假性动脉瘤, 因为胰腺炎症和感染的风险将增加支架两端新的假动脉瘤形成的机会[15]. 本研究中上消化道术后由血培养证实感染病例占19%(8/42). 两例再次出血患者中, 1例由于吻合口瘘导致术后感染; 另1例因胰腺坏死导致感染. 第二次造影时发现第1例患者发生胃十二指肠动脉分支的出血; 第2例患者发现一个新形成的VAPA. 尽管第二次介入手术成功, 但第2例患者死于因感染导致的多器官功能衰竭. 因此对于胰腺炎相关和上消化道手术的病例, 栓塞术后早期的、有效地控制胰腺炎和腹部感染, 能够有效地预防再出血和新VAPA的形成[16].
总之, CT和CTA能快速、无创地诊断并定位VAPA. 根据患者临床特征和VAPA影像表现, 选择合适的介入栓塞方案能安全、有效地治疗VAPA, 尤其是对于缺乏手术适应征及肿瘤术后的患者. 控制胰腺炎及外科术后感染能预防介入栓塞术后再出血和新的VAPA形成.
内脏动脉假性动脉瘤(visceral artery pseudoaneurysms, VAPA)的传统治疗方法为外科手术, 由于出血性休克、血流动力学不稳定、炎症、感染、外科手术后、医源性因素, VAPA患者大多无外科手术指征. 随着影像设备和诊断技术的更新和普及, VAPA的检出率明显提高, 可以及早的利用手术治疗.
李家平, 教授, 主任医师, 中山大学附属第一医院肿瘤介入科
目前计算机断层扫描(computed tomography, CT)增强和CT血管造影(CT angiography, CTA)技术能对VAPA的位置、类型、出入瘤动脉及侧枝循环代偿情况做出充分的判断和评估, 能指导临床制定快速有效控制VAPA方案.
VAPA的传统治疗方法为切除、搭桥和简单的结扎, 介入栓塞治疗因安全、快速、创伤小、适应症广、成功率高和复发率小的特点, 已成为治疗腹部真性动脉瘤和动脉性消化道出血的重要治疗手段.
本文率先对采用介入栓塞治疗VAPA这一新技术, 进行较为详细的研究, 具有较好的创新性.
本文对42例行介入治疗的VAPA患者进行回顾性分析, 初步探讨了VAPA的临床特征和介入治疗疗效, 其研究结果对临床工作有一定参考价值.
本文初步探讨了介入治疗内脏假性动脉瘤这一新技术, 其研究结果有利于指导临床对假性动脉瘤的治疗.
编辑: 郭鹏 电编:都珍珍
| 1. | Roberts KJ, McCulloch N, Forde C, Mahon B, Mangat K, Olliff SP, Jones RG. Emergency treatment of haemorrhaging coeliac or mesenteric artery aneurysms and pseudoaneurysms in the era of endovascular management. Eur J Vasc Endovasc Surg. 2015;49:382-389. [PubMed] |
| 2. | Jesinger RA, Thoreson AA, Lamba R. Abdominal and pelvic aneurysms and pseudoaneurysms: imaging review with clinical, radiologic, and treatment correlation. Radiographics. 2013;33:E71-E96. [PubMed] |
| 3. | Keeling AN, McGrath FP, Lee MJ. Interventional radiology in the diagnosis, management, and follow-up of pseudoaneurysms. Cardiovasc Intervent Radiol. 2009;32:2-18. [PubMed] [DOI] |
| 4. | Saad NE, Saad WE, Davies MG, Waldman DL, Fultz PJ, Rubens DJ. Pseudoaneurysms and the role of minimally invasive techniques in their management. Radiographics. 2005;25 Suppl 1:S173-S189. [PubMed] [DOI] |
| 5. | Gabelmann A, Görich J, Merkle EM. Endovascular treatment of visceral artery aneurysms. J Endovasc Ther. 2002;9:38-47. [PubMed] |
| 6. | Pitton MB, Dappa E, Jungmann F, Kloeckner R, Schotten S, Wirth GM, Mittler J, Lang H, Mildenberger P, Kreitner KF. Visceral artery aneurysms: Incidence, management, and outcome analysis in a tertiary care center over one decade. Eur Radiol. 2015;25:2004-2014. [PubMed] |
| 7. | Nosher JL, Chung J, Brevetti LS, Graham AM, Siegel RL. Visceral and renal artery aneurysms: a pictorial essay on endovascular therapy. Radiographics. 2006;26:1687-1704; quiz 1687. [PubMed] [DOI] |
| 8. | Balderi A, Antonietti A, Ferro L, Peano E, Pedrazzini F, Fonio P, Grosso M. Endovascular treatment of visceral artery aneurysms and pseudoaneurysms: our experience. Radiol Med. 2012;117:815-830. [PubMed] [DOI] |
| 9. | Ikeda O, Nakasone Y, Tamura Y, Yamashita Y. Endovascular management of visceral artery pseudoaneurysms: transcatheter coil embolization using the isolation technique. Cardiovasc Intervent Radiol. 2010;33:1128-1134. [PubMed] [DOI] |
| 10. | Radeleff B, Noeldge G, Heye T, Schlieter M, Friess H, Richter GM, Kauffmann GW. Pseudoaneurysms of the common hepatic artery following pancreaticoduodenectomy: successful emergency embolization. Cardiovasc Intervent Radiol. 2007;30:129-132. [PubMed] |
| 11. | Belli AM, Markose G, Morgan R. The role of interventional radiology in the management of abdominal visceral artery aneurysms. Cardiovasc Intervent Radiol. 2012;35:234-243. [PubMed] [DOI] |
| 12. | Loffroy RF, Abualsaud BA, Lin MD, Rao PP. Recent advances in endovascular techniques for management of acute nonvariceal upper gastrointestinal bleeding. World J Gastrointest Surg. 2011;3:89-100. [PubMed] |
| 13. | Waldenberger P, Bendix N, Petersen J, Tauscher T, Glodny B. Clinical outcome of endovascular therapeutic occlusion of the celiac artery. J Vasc Surg. 2007;46:655-661. [PubMed] |
| 14. | Yamamoto S, Hirota S, Maeda H, Achiwa S, Arai K, Kobayashi K, Nakao N. Transcatheter coil embolization of splenic artery aneurysm. Cardiovasc Intervent Radiol. 2008;31:527-534. [PubMed] [DOI] |
| 15. | Duan XH, Ren JZ, Zhou GF, Zheng CS, Liang HM, Dong XJ, Feng GS. Clinical features and endovascular treatment of visceral artery pseudoaneurysms. Ann Vasc Surg. 2015;29:482-490. [PubMed] |
| 16. | Jagad RB, Koshariya M, Kawamoto J, Chude GS, Neeraj RV, Lygidakis NJ. Postoperative hemorrhage after major pancreatobiliary surgery: an update. Hepatogastroenterology. 2008;55:729-737. [PubMed] |