修回日期: 2015-07-11
接受日期: 2015-07-24
在线出版日期: 2015-08-18
目的: 本研究通过建立高脂血症大鼠模型, 以法尼基衍生物X受体(farnesyl X receptor, FXR)为研究对象, 初步探讨FXR在高脂血症大鼠中的表达状况, 为防治高脂血症提供新的依据和分子理论基础.
方法: 取♂Wistar大鼠70只, 随机均分为2组, 对照组予以普通饮食、实验组予以高脂饮食. 喂食90 d, 建立高脂血症模型后, 取对照组和实验组肝脏组织: (1)应用逆转录-聚合酶链反应(RT-polymerase chain reaction, RT-PCR)技术检测两组模型肝脏组织的FXR基因表达的强度; (2)石蜡切片后用免疫组织化学SP(streptavidin-perosidase)法检测两组模型肝脏组织的FXR蛋白表达的强度.
结果: 实验组胆固醇及甘油三酯含量明显高于对照组. (1)电泳结果显示: 实验中肝脏组织扩增产物都出现了内参β-actin基因的425 bp扩增带和FXR基因的283 bp扩增带, 实验组FXR基因扩增带亮度强于对照组; (2)免疫组织化学SP法结果显示, 实验组FXR表达阳性率为79%, 对照组FXR表达阳性率为14.3%, 差异具有统计学意义(P<0.05).
结论: 实验组大鼠的FXR基因的表达较对照组明显增加, 提示我们可发展作用于FXR的药物, 为高脂血症及其相关疾病找到新的治疗方法.
核心提示: 建立高脂血症大鼠模型, 以法尼基衍生物X受体(farnesyl X receptor, FXR)为研究对象, 初步探讨FXR在高脂血症大鼠中的表达状况, 为治疗高脂血症找到新的思路.
引文著录: 张孟瑜, 王洁萍, 夏先明. FXR在高脂血症大鼠肝组织中的表达状况. 世界华人消化杂志 2015; 23(23): 3755-3760
Revised: July 11, 2015
Accepted: July 24, 2015
Published online: August 18, 2015
AIM: To establish a rat model of hyperlipidemia, detect the expression of farnesyl X receptor (FXR) in the liver tissue of model rats, and explore the role of FXR in bile acid and cholesterol metabolism in hyperlipidemia rats.
METHODS: Sixty Wistar rats were randomly divided into two groups, a control group that was fed an ordinary diet, and an experimental group that was fed a high fat diet. Regular detection of cholesterol and bile acid contents was conducted to assess whether the hyperlipidemia model was successfully established. After successful induction of hyperlipidemia, liver tissue samples were taken to detect the mRNA expression of FXR by reverse transcription-polymerase chain reaction (RT-PCR) and protein expression by immunohistochemistry.
RESULTS: In the experiment group, the contents of cholesterol and bile acid were significantly higher than those in the control group. RT-PCR analysis showed that the mRNA expression of FXR in the liver tissue was significantly higher in the experimental group than in the control group. Immunohistochemistry showed that in the experimental group, the positive expression rate of FXR was 79%, significantly higher than 14.3% in the control group (χ2 = 10.862, P < 0.05).
CONCLUSION: FXR expression increases significantly in rats with hyperlipidemia, which suggests that FXR may be used as a target for treatment of hyperlipidemia and related diseases.
- Citation: Zhang MY, Wang JP, Xia XM. FXR expression in liver tissue of hyperlipidemia rats. Shijie Huaren Xiaohua Zazhi 2015; 23(23): 3755-3760
- URL: https://www.wjgnet.com/1009-3079/full/v23/i23/3755.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i23.3755
高脂血症(hyperlipidemia)是指血浆中一种或多种脂质高于正常范围的病症, 包括胆固醇升高、甘油三酯(triglyceride, TG)升高、低密度脂蛋白(low-density lipoprotein cholesterol, LDL-C)升高等. 近年来, 随着经济的发展, 生活水平的提高, 饮食结构的改善, 出现高脂血症的患者逐年增多. 而脂质增多后, 则可能在肝脏、血管壁等组织沉积, 进而出现脂肪肝、血管腔变窄, 血管壁弹性减退, 最终导致产生动脉硬化等病症而引发心脑血管疾病, 高脂血症还可诱发胆结石、胰腺炎, 加重肝功能损害. 但目前降脂治疗的方法和手段有限, 效果欠佳, 那么是否存在更好而有效的方法呢? 基因治疗是目前尚未在临床广泛应用而又极具前景的治疗方法, 法尼基衍生物X受体(farnesyl X receptor, FXR)基因与胆汁酸的排泄及重吸收均相关[1-3], 所以本项目拟以FXR为研究对象, 研究在高脂血症大鼠肝细胞中FXR基因表达的状况, 尝试为高脂血症及其相关疾病治疗提供新的思路.
Wistar大鼠70只(♂、体质量150 g±6 g), 随机分为两组, 每组35只: 普通饮食对照组(简称对照组)、高脂饮食实验组(简称实验组). 入选大鼠未进食含其他类药物饮食, 入选前无高脂血症存在. 高脂饮食的原料: (1)猪油; (2)基础饲料; (3)丙硫氧嘧啶片; (4)胆固醇; (5)去氧胆酸钠. 在60 ℃热水中融化猪油, 研细丙硫氧嘧啶片, 在基础饲料中加入质量分数为10.0%猪油、5.0%蔗糖、4.0%胆固醇、0.5%胆酸钠、0.2%丙基硫氧嘧啶, 加水混合充分搅拌, 制备等体积大小饲料烘干备用. 主要仪器有PCR扩增仪(Bio-Rad, 美国)、低温离心机(Beckman, 美国)、显微摄像系统(PM-10A)(OLYMPUSU-TVL, 日本)等; 主要试剂有逆转录-聚合酶链反应(RT-polymerase chain reaction, RT-PCR)试剂盒(大连宝生物, TaKaRa工程有限公司)、FXR单克隆抗体(CHEMICON, 美国)等.
1.2.1 建立高脂血症大鼠模型: 实验首先制备高脂饮食建立高脂血症大鼠模型, 喂食过程中定期检测胆固醇及胆汁酸含量, 90 d后, 待到实验组血脂各项相关指标与对照组产生统计学差异[4-6], 确定建立高脂血症模型成功.
1.2.2 RT-PCR技术检测肝脏组织的FXR基因表达: 分别取对照组和实验组肝脏组织, 设定引物及内参照序列, FXR的上游引物为: 5'-CCTCATTGTCTCCCCGACTTATCCT-3', 下游引物为: 5'-GCCTCTAGAAAGCAGTGTTCACTTT-3'; β-actin作为内参对照, 上游引物为: 5'-GATGGTGGGTATGGGTCAGAA-3', 下游引物为: 5'-CTAGGAGCCAGGGCAGTAATC-3'. 提取RNA, 进行逆转录反应, 制备PCR产物, 取产物10 µL进行1%琼脂糖凝胶电泳, 确认PCR反应产物. Quantity One软件计算FXR基因与β-actin条带的光密度的相对比值, 通过半定量分析得出其在肝脏组织中RNA表达相对含量.
1.2.3 免疫组织化学SP(streptavidin-perosidase)法检测两组模型肝脏组织的FXR蛋白表达的强度: 取材, 烤片, 阻断灭活内源性过氧化物酶, 滴加一抗4 ℃冰箱孵育过夜, 滴加生物素标记二抗, DAB/H2O2反应染色, 自来水充分冲洗后, 苏木素复染, 干燥, 封片, 高倍显微镜下观察. 从每张切片随机选取5个视野, 每个视野内观察100个细胞, 阳性细胞≥10%为阳性, 否则为阴性.
统计学处理 用mean±SD表示测得数据, 采用SPSS19.0统计软件进行分析, 判断组间差异采用t检验, 免疫组织化学SP法结果采用χ2检验, P<0.05为差异有统计学意义.
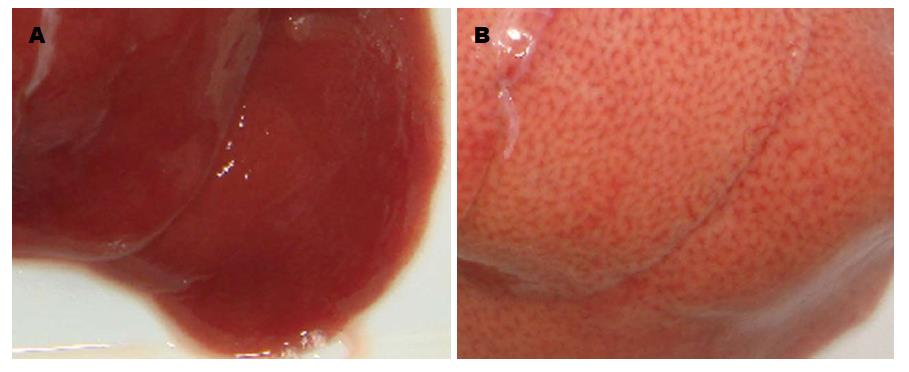
各组大鼠喂食90 d后均存活, 无一死亡, 肝脏变化情况如图1, 其血清指标如表1. 从表1可知, 实验组血液中总胆固醇(total cholesterol, TC)、LDL-C、TG升高, 而高密度脂蛋白(high-density lipoprotein cholesterol, HDL-C)降低; 与对照组比较, 差异有统计学意义(P<0.05).
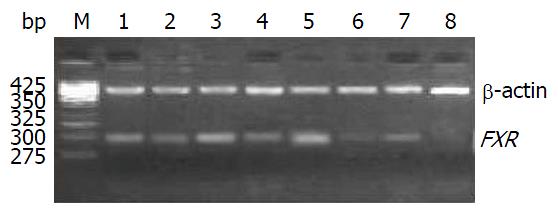
2.2.1 电泳结果显示: 实验中对照组和实验组扩增产物都出现了β-actin基因的425 bp扩增带和FXR基因的283 bp扩增带, 实验组FXR基因扩增带亮度均明显强于对照组(图2).
2.2.2 半定量结果分析: 对照组FXR基因mRNA表达较低(0.336±0.025), 实验组FXR基因mRNA表达较高(0.887±0.051); FXR基因在对照组和实验组中表达差异有统计学意义(P<0.05).
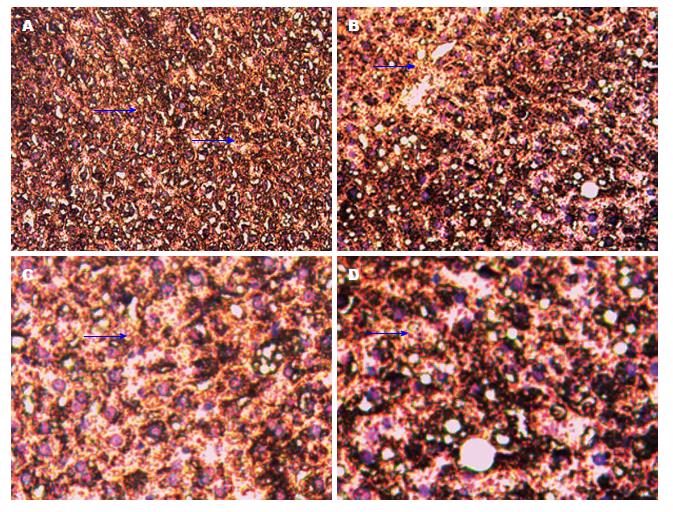
光学高倍(100倍和200倍)物镜下: 肝脏组织中FXR蛋白出现黄色染色颗粒为阳性细胞(蓝色箭头所指). 每张切片随机选取5个视野, 每个视野内观察100个细胞, 阳性细胞≥10%为阳性, 否则为阴性. χ2检验显示: 实验组FXR蛋白表达阳性率为79%, 对照组FXR蛋白表达阳性率为14.3%, 他们之间的差异有统计学意义(χ2 = 10.862, P<0.05)
(图3).
血脂包括人体血液中所含各类脂质, 主要的脂质有胆固醇、TG、LDL-C和HDL-C等. 高脂血症则主要是指胆固醇、TG、LDL-C等升高, 而上述物质升高后, 则可能出现脂质在血管壁沉积, 引起动脉硬化、中风、心肌梗死等, 这是导致冠心病形成的主要原因之一; 高脂血症还可导致脂肪肝、肝硬化、高脂血症性胰腺炎、眼底出血、周围血管疾病、高尿酸血症等疾病. 其危害性已越来越被广大普通群众所认识并积极予以治疗, 但目前降脂治疗的方法和手段有限, 是否能找到更好的方法引导我们不断思考和研究. 基因治疗是目前尚未在临床广泛应用而又极具前景的治疗方法, 而FXR基因与胆汁酸的代谢密切相关[7-9], 所以其进入了我们的思考范围.
FXR是一种孤儿核受体, 胆汁酸是内源性FXR配体, 因此FXR又被称为胆汁酸受体[10-12], 属于激素核受体超家族的一员. 具有典型的核受体结构, 即包括氨基末高度保守的DNA结合区(DNA binding domain, DBD)、羧基末端配体结合区(ligand binding domain, LBD)、氨基末端的配体非依赖性转录激活功能区(AF-1)和羧基端有一个配体依赖性激活功能区(AF-2), 铰链区(hinge region)等. FXR作为胆汁酸的受体可以通过调控参与胆汁酸代谢基因的表达来维持胆汁酸的内环境稳定, 胆盐输出泵(bile salt export pump, Bsep)和牛磺胆酸钠转运蛋白(Na+/taurocholate cotransporting polypeptide, Ntcp)均为FXR靶基因. 胆汁酸形成后, 在FXR调节下, 胆汁酸首先通过Bsep分泌至肠道, 进入肠道后, 经过一系列受体和介质的作用, 约90%胆汁酸在Ntcp协助下, 重吸收进入肝脏, 形成胆汁酸的肠肝循环; Bsep与Ntcp的表达强弱, 直接决定着胆汁酸分泌与重吸收量的多少, 从而决定着肝脏与血浆中脂质含量的多少. 而Bsep与Ntcp的表达情况, 则直接受到FXR的调节和控制[13-15]. 因此一旦FXR功能出现紊乱, 则胆汁酸排泄与重吸收出现紊乱, 造成胆汁酸淤积, 进而导致高脂血症的出现, 所以FXR的表达情况是了解和关注的重点.
本实验我们通过90 d时间高脂饮食的喂养成功建立高脂血症大鼠模型, 并且在试验中通过使用PCR, 免疫组织化学等方法进行检测, 从而证实高脂血症时大鼠的肝脏组织中FXR基因出现了明显的变化[16-18], 表达明显提高, 较对照组大为增加, 而高脂血症时TC、TG、LDL-C显著升高, HDL-C逐步下降, 由此我们初步考虑胆汁酸的增加会伴随FXR基因表达增强, 可能与增加胆汁酸的排泄有关. 上述也就提示我们, FXR的发现可能会成为高脂血症治疗新的靶点[19,20], 但FXR在肝脏组织中还有可调节的靶基因Bsep和Ntcp, 此二者在高脂血症时是否与FXR发生了同步的变化, 是否调节了FXR的作用, 尚需进一步的研究. 在目前所用降脂药物普遍存在各种各样的问题, 比如难以完全达到治疗目的、服用时间较长、胃肠道反应明显、患者耐受性差等缺点, 阻碍了其作为临床治疗药物的广泛应用, 所以, FXR基因表达状况的研究将可能有助于人们更好地认识胆汁酸代谢紊乱机制, 并为基础研究和临床治疗高脂血症与相关疾病提供新的药物治疗靶点, 找到一种新的治疗方向.
目前我国患高脂血症的病员数量在逐年增多, 降脂治疗的运用越来越广泛, 而现有降脂治疗的方法有限, 且效果并非十分理想.
李胜, 研究员, 山东省肿瘤防治研究院肝胆外科; 徐迅迪, 教授, 中南大学湘雅二医院肝胆胰外科
目前研究的热点和重点为新型的降脂方法和降脂药物, 而基因治疗是一个非常有前途但又尚未在临床广泛应用的领域.
有研究报道了法尼基衍生物X受体(farnesyl X receptor, FXR)在胆汁酸代谢中的重要作用及其在梗阻性黄疸时参与对机体功能和病理损伤的调节机制.
本文通过建立高脂血症大鼠模型, 使用PCR及免疫组织化学法初步发现了FXR在高脂血症大鼠肝组织中的表达状况.
通过初步发现FXR在高脂血症大鼠肝组织中的表达状况, 为进一步寻找作用于FXR基因的药物打下基础, 从而改善高脂血症治疗的现状.
牛磺胆酸钠转运蛋白(Na+/taurocholate cotransporting polypeptide, Ntcp): 是一种胆汁酸受体, 在胆汁酸代谢和胆固醇代谢中发挥重要作用, 重吸收胆汁酸, 稳定胆汁酸浓度; 胆盐输出泵(bile salt export pump, Bsep): 是位于肝细胞膜上介导其底物依赖ATP自细胞内转运至毛细胆管的一种膜糖蛋白, 负责排泄胆汁酸; FXR: 是一种胆汁酸受体, 属核受体超家族成员, 在胆汁酸及胆固醇代谢中具重要作用, 调节靶基因Bsep和Ntcp的功能.
本文通过建立高脂血症动物模型, 观察比较FXR在高脂血症中的表达变化, 结构清晰, 整体实验过程完整、分析合理.
编辑: 韦元涛 电编:都珍珍
| 1. | Zhu Y, Li F, Guo GL. Tissue-specific function of farnesoid X receptor in liver and intestine. Pharmacol Res. 2011;63:259-265. [PubMed] [DOI] |
| 2. | Carr RM, Reid AE. FXR agonists as therapeutic agents for non-alcoholic fatty liver disease. Curr Atheroscler Rep. 2015;17:500. [PubMed] [DOI] |
| 3. | Chen Y, Song X, Valanejad L, Vasilenko A, More V, Qiu X, Chen W, Lai Y, Slitt A, Stoner M. Bile salt export pump is dysregulated with altered farnesoid X receptor isoform expression in patients with hepatocellular carcinoma. Hepatology. 2013;57:1530-1541. [PubMed] [DOI] |
| 7. | Vaquero J, Monte MJ, Dominguez M, Muntané J, Marin JJ. Differential activation of the human farnesoid X receptor depends on the pattern of expressed isoforms and the bile acid pool composition. Biochem Pharmacol. 2013;86:926-939. [PubMed] [DOI] |
| 8. | Fiorucci S, Cipriani S, Mencarelli A, Baldelli F, Bifulco G, Zampella A. Farnesoid X receptor agonist for the treatment of liver and metabolic disorders: focus on 6-ethyl-CDCA. Mini Rev Med Chem. 2011;11:753-762. [PubMed] [DOI] |
| 9. | Matsubara T, Li F, Gonzalez FJ. FXR signaling in the enterohepatic system. Mol Cell Endocrinol. 2013;368:17-29. [PubMed] [DOI] |
| 10. | Cully M. Obesity and diabetes: FXR and JAK step up to BAT. Nat Rev Drug Discov. 2015;14:91. [PubMed] [DOI] |
| 11. | Chen WD, Wang YD, Meng Z, Zhang L, Huang W. Nuclear bile acid receptor FXR in the hepatic regeneration. Biochim Biophys Acta. 2011;1812:888-892. [PubMed] [DOI] |
| 12. | Osório J. Obesity: Gut-specific FXR agonism. Nat Rev Endocrinol. 2015;11:131. [PubMed] [DOI] |
| 13. | Hambruch E, Miyazaki-Anzai S, Hahn U, Matysik S, Boettcher A, Perović-Ottstadt S, Schlüter T, Kinzel O, Krol HD, Deuschle U. Synthetic farnesoid X receptor agonists induce high-density lipoprotein-mediated transhepatic cholesterol efflux in mice and monkeys and prevent atherosclerosis in cholesteryl ester transfer protein transgenic low-density lipoprotein receptor (-/-) mice. J Pharmacol Exp Ther. 2012;343:556-567. [PubMed] [DOI] |
| 14. | Noh K, Kim YM, Kim YW, Kim SG. Farnesoid X receptor activation by chenodeoxycholic acid induces detoxifying enzymes through AMP-activated protein kinase and extracellular signal-regulated kinase 1/2-mediated phosphorylation of CCAAT/enhancer binding protein β. Drug Metab Dispos. 2011;39:1451-1459. [PubMed] [DOI] |
| 15. | Meng Q, Chen XL, Wang CY, Liu Q, Sun HJ, Sun PY, Huo XK, Liu ZH, Yao JH, Liu KX. Alisol B 23-acetate protects against ANIT-induced hepatotoxity and cholestasis, due to FXR-mediated regulation of transporters and enzymes involved in bile acid homeostasis. Toxicol Appl Pharmacol. 2015;283:178-186. [PubMed] [DOI] |
| 16. | Thomas AM, Hart SN, Kong B, Fang J, Zhong XB, Guo GL. Genome-wide tissue-specific farnesoid X receptor binding in mouse liver and intestine. Hepatology. 2010;51:1410-1419. [PubMed] [DOI] |
| 17. | Gray MA, James Squires E. Investigation of the dominant positive effect of porcine farnesoid X receptor (FXR) splice variant 1. Gene. 2015;560:71-76. [PubMed] [DOI] |
| 18. | Modica S, Petruzzelli M, Bellafante E, Murzilli S, Salvatore L, Celli N, Di Tullio G, Palasciano G, Moustafa T, Halilbasic E. Selective activation of nuclear bile acid receptor FXR in the intestine protects mice against cholestasis. Gastroenterology. 2012;142:355-365.e1-4. [PubMed] [DOI] |
| 19. | Verbeke L, Farre R, Verbinnen B, Covens K, Vanuytsel T, Verhaegen J, Komuta M, Roskams T, Chatterjee S, Annaert P. The FXR agonist obeticholic acid prevents gut barrier dysfunction and bacterial translocation in cholestatic rats. Am J Pathol. 2015;185:409-419. [PubMed] [DOI] |
| 20. | Carotti A, Marinozzi M, Custodi C, Cerra B, Pellicciari R, Gioiello A, Macchiarulo A. Beyond bile acids: targeting Farnesoid X Receptor (FXR) with natural and synthetic ligands. Curr Top Med Chem. 2014;14:2129-2142. [PubMed] |