修回日期: 2015-06-25
接受日期: 2015-07-06
在线出版日期: 2015-08-18
目的: 评估Ⅱ-Ⅲ期直肠癌4种治疗策略疗效的差异并行预后分析.
方法: 回顾性分析2010-01/2013-12以氟尿嘧啶为基础同步放化疗的Ⅱ-Ⅲ期直肠癌的230例患者临床资料, 其中新辅助放化疗联合手术68例(A组)、术后辅助放化疗70例(B组)、新辅助放化疗未手术51例(C组)、根治性放化疗41例(D组). (新)辅助放疗剂量50 Gy/25次, 根治性放疗剂量60-66 Gy/30-33次, 手术方式为全直肠系膜切除术, 放疗与手术的间期为4-8 wk.
结果: 全组随访率93.4%, 144例随访满3年. 局部复发53例, 远处转移44例(P值
分别为0.602, 0.073); 3年总生存率(overall survival, OS)和无病生存率(disease-free survival, DFS)差异有统计学意义(P = 0.001和0.004), A组OS(86.76%)和DFS(76.27%)均高于其他3组. A组和B组肿瘤完全切除(R0)率为98.5%、78.5%. 全组急性不良反应多为1-2级. 多因素分析, 治疗方式中新辅助放化疗(P = 0.002)、年龄(P = 0.021)及全周肿瘤(P = 0.029)是预后因素.
结论: 新辅助放化疗联合手术R0切除率较高, 并且OS和DFS较高, 是Ⅱ-Ⅲ期直肠癌有效的治疗方法. 新辅助放化疗未手术、年龄及全周肿瘤是预后因素.
核心提示: 本研究以新辅助放化疗联合手术、术后辅助放化疗、新辅助放化疗未手术、根治性放化疗将患者分为4组, 结果显示新辅助放化疗联合手术R0切除率较高, 并且总生存率(overall survival)和无病生存率(disease-free survival)较高, 是Ⅱ-Ⅲ期直肠癌有效的治疗方法.
引文著录: 刘晓梅, 阿衣古丽•哈热, 再依努尔•阿不都外力, 张瑾熔, 伊斯刊达尔•阿布力米提. Ⅱ-Ⅲ期直肠癌不同治疗策略疗效的差异. 世界华人消化杂志 2015; 23(23): 3706-3713
Revised: June 25, 2015
Accepted: July 6, 2015
Published online: August 18, 2015
AIM: To compare the efficacy of four treatment strategies for stage Ⅱ-Ⅲ rectal cancer and analyze prognostic factors.
METHODS: A retrospective study was conducted on 230 patients who were pathologically diagnosed with stage Ⅱ-Ⅲ rectal cancer and underwent pelvic intensity modulated radiotherapy and concurrent fluorouracil based chemotherapy between January 2010 and December 2013 at Affiliated Tumor Hospital of Xinjiang Medical University, including 68 cases receiving neoadjuvant chemoradiotherapy combined with surgery (group A), 70 cases receiving postoperative chemoradiation (group B), 51 cases receiving neoadjuvant chemoradiotherapy without surgery (group C), and 41 cases receiving radical chemoradiation (group D). (Neo-) adjuvant radiotherapy was delivered at 50 Gy in 25 fractions, and radical radiotherapy was delivered at 60-66 Gy in 30-33 fractions. Surgical patients were treated by total mesorectal excision. Time interval between radiotherapy and surgery was 4-8 wk.
RESULTS: The follow-up rate was 93.4%, and 144 patients completed the 3-year follow-up. Local recurrence in 3 years was noted in 53 cases, and 44 cases had distant metastasis in the four groups; both the 3-year recurrence rate and distant metastasis rate had no statistical significance among different groups. The 3-year overall survival (OS) and disease-free survival (DFS) rates were statistically different (P = 0.001, 0.004). The rates of OS (86.76%) and DFS (76.27%) in group A were significantly higher than those in the other groups. Complete (R0) tumor resectability was 98.5% in group A and 78.5% in group B. Main toxicities were grade 1-2 adverse events. Multivariate analysis demonstrated that neoadjuvant chemoradiotherapy without surgery (P = 0.002), age (P = 0.021) and circumferential tumor (P = 0.029) were prognostic factors.
CONCLUSION: Neoadjuvant chemoradiotherapy combined with surgery can achieve a higher R0 resection rate and higher OS and DFS than other treatments, representing an effective method for stage Ⅱ-Ⅲ rectal cancer. Neoadjuvant chemoradiotherapy without surgery, age and circumferential tumor are prognostic factors.
- Citation: Liu XM, Ayiguli•Hare, Zaiyinuer•Abuduwaili, Zhang JR, Yisikandaer•Abulimiti. Efficacy of different treatment strategies for stage Ⅱ-Ⅲ rectal cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(23): 3706-3713
- URL: https://www.wjgnet.com/1009-3079/full/v23/i23/3706.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i23.3706
过去的20年直肠癌的治疗发生了很大变化, 手术、放疗、化疗相结合的多学科治疗模式得到重视[1], 目前许多临床随机对照研究[2-4]多是关于术前与术后放化疗的比较, 并且证实术前放化疗优于术后放化疗, 其中最经典的研究之一是2012年更新的德国CAO/ARO/AIO-94研究[4], 认为术前放化疗降低了局部复发率. 对于新辅助放化疗后未手术患者的预后情况, 目前的研究较少, 部分研究[5]也只是关于同步放化疗达到临床完全缓解后对其生存的影响; 而关于根治性放疗目前没有相关报道. 所以, 本研究对上述4种策略直肠癌患者的临床资料进行分析, 比较不同治疗策略对其生存的影响.
回顾性纳入2010-01/2013-12新疆医科大学附属肿瘤医院230例经病理证实的Ⅱ-Ⅲ期直肠癌, 均接受了盆腔调强放疗及同步氟尿嘧啶为基础的化疗. 共4种治疗方式分为4组: 新辅助放化疗联合手术68例(A组)、术后辅助放化疗70例(B组)、新辅助放化疗未手术51例(C组)、根治性放化疗41例(D组). 全组男性141例, 女性89例; 年龄22-89岁, 中位年龄57岁; 汉族153例、维吾尔族65例、其他少数民族12例; Ⅱ期患者97例、Ⅲ期133例. 高位直肠癌(距肛缘>10 cm)17例、低位(距肛缘<5 cm)120例、中位(距肛缘5-10 cm)93例. 腺癌202例, 其他病理类型28例. 化疗分为单药(卡培他滨化疗80例)和联合化疗(XELOX方案94例, FOLFOX方案56例). 管腔受侵比例分为全周(管腔周径受侵≥75%)和非全周. 根据临床查体及影像学检查采用AJCC第7版的分期标准明确临床分期[6]影像学检查包括胸片、腹部超声、肠镜、盆腔电子计算机断层扫描技术(computerized tomography, CT)或磁共振成像(magnetic resonance imaging, MRI)等. 直肠癌放化疗过程中常见的不良反应包括骨髓抑制、消化道反应和直肠黏膜反应, 参照美国肿瘤放射治疗协作组织(Radiation Therapy Oncology Group, RTOG)急性放射损伤分级标准[7]. 4组患者基线一致(P>0.05)(表1).
| 特征 | A组(n = 68) | B组(n = 70) | C组(n = 51) | D组(n = 41) | χ2值 | P值 |
| 年龄(岁) | 6.466 | 0.373 | ||||
| ≥60 | 25(36.7) | 27(38.6) | 18(35.3) | 20(48.8) | ||
| 50-59 | 22(32.4) | 21(30.0) | 10(19.6) | 11(26.8) | ||
| <50 | 21(30.9) | 22(31.4) | 23(45.1) | 10(24.4) | ||
| 性别 | 4.203 | 0.240 | ||||
| 男 | 41(60.3) | 38(54.3) | 37(72.5) | 25(61.0) | ||
| 女 | 27(39.7) | 32(45.7) | 14(27.5) | 16(39.0) | ||
| 民族 | 4.214 | 0.239 | ||||
| 汉族 | 46(67.6) | 50(71.4) | 28(54.9) | 29(70.7) | ||
| 少数民族 | 22(32.4) | 20(28.6) | 23(45.1) | 12(29.3) | ||
| 分期 | 2.916 | 0.405 | ||||
| Ⅱ | 24(35.3) | 31(44.3) | 21(41.2) | 12(29.3) | ||
| Ⅲ | 44(64.7) | 39(55.7) | 30(58.8) | 29(70.7) | ||
| 病理类型 | 4.231 | 0.238 | ||||
| 腺癌 | 61(89.7) | 65(92.9) | 42(82.4) | 34(82.9) | ||
| 非腺癌 | 7(10.3) | 5(7.1) | 9(17.6) | 7(17.1) | ||
| 化疗方式 | 2.121 | 0.548 | ||||
| 单药 | 25(36.8) | 20(28.6) | 18(35.3) | 17(41.5) | ||
| 联合 | 43(63.2) | 50(71.4) | 33(64.7) | 24(58.5) | ||
| 管腔受侵比例 | 5.309 | 0.151 | ||||
| 全周(≥75%) | 18(26.5) | 13(18.6) | 18(35.3) | 14(34.1) | ||
| 非全周 | 50(73.5) | 57(81.4) | 33(64.7) | 27(65.9) | ||
| 肿瘤位置 | 2.751 | 0.839 | ||||
| 低位 | 31(45.6) | 34(48.6) | 29(56.9) | 21(51.2) | ||
| 中位 | 32(47.0) | 29(41.4) | 20(39.2) | 17(41.5) | ||
| 高位 | 5(7.4) | 7(10.0) | 2(3.9) | 3(7.3) |
1.2.1 治疗: (1)调强放疗: 患者充盈膀胱仰卧于固定板上, 用腹部有孔体模固定, 螺旋CT增强扫描(层厚5 mm)并将图像传输至放疗计划系统, 由2名以上医师(1名主任医师)完成靶区和保护器官的勾画. 放疗靶区: 肉眼可见肿瘤靶区(gross tumor volume, GTV)为直肠肿瘤及转移淋巴结; 临床靶区(clinical target volume, CTV)为直肠肿瘤或瘤床区, 直肠系膜区, 肠周、骶前、髂内淋巴引流区及盆壁区; CTV外扩0.5-1.0 cm为计划靶区(planning target volume, PTV). 靶区上、下界分别为L5-S1椎体之间、闭孔下缘或肛门边缘. PTV至少达到95%处方剂量. 正常组织剂量限定: 双侧股骨头V50<5%、膀胱V30<50%、小肠V50<5%. 放疗采用23EX或600CD直线加速器, 分为5-7个野, 辅助放疗2 Gy/次、5次/wk、总剂量50 Gy/25次; 根治性放疗2 Gy/次、5次/wk, 总剂量60-66 Gy/30-33次; (2)化疗: 单药卡培他滨825 mg/m2, 1000-1500 mg, 口服, 2次/d, d1-14, 每3 wk重复, XELOX方案(卡培他滨1000 mg/m2bid d1-14+奥沙利铂130 mg/m2 d1, 每3 wk重复). FOLFOX方案(奥沙利铂85 mg/m2 d1+亚叶酸钙200 mg/m2 d1, 2+氟尿嘧啶400 mg/m2iv d1, 2+氟尿嘧啶600 mg/m2持续泵入22 h, d1, 2); (3)手术方式为全直肠系膜切除术. 放疗与手术的间期为4-8 wk.
1.2.2 研究终点: 3年局部复发率、总体生存率(overall survival, OS)及无病生存率(disease-free survival, DFS)为主要研究终点. 急性不良反应(骨髓抑制、消化道反应、直肠黏膜反应)和预后因素(治疗方式、年龄、病理类型、化疗方式、肿瘤位置、管腔受侵比例、局部复发、远处转移)为次要终点.
统计学处理 采用SPSS13.0统计软件, 计数资料采用χ2检验, 生存分析采用Kaplan-Meier法并Log-rank法作显著性检验, 多因素分析采用Cox风险比例模型, P<0.05为差异有统计学意义.
全组患者随访至2014-08, 随访时间10-52 mo, 中位随访25 mo, 失访15例, 随访率93.4%, 144例随访满3年.
全组局部复发53例, 其中A组10例(14.71%), B组28(40.00%)例, C组11(21.57%)例, D组4(9.76%)例(χ2 = 18.160, P = 0.001). 远处转移44例, A组6(8.82%)例, B组15(21.43%)例, C组13(25.49%)例, D组10(24.39%)例(χ2 = 6.975, P = 0.073).
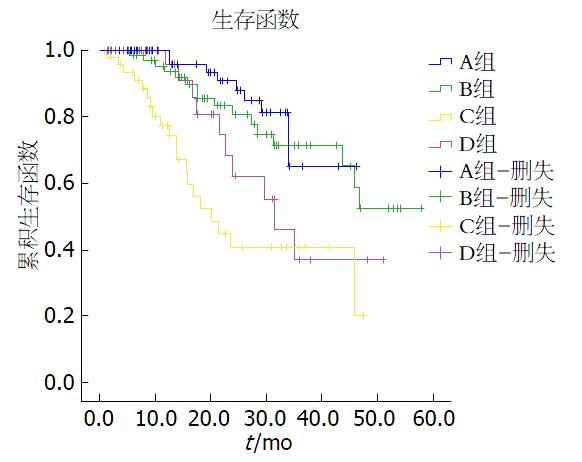
A组和B组R0切除率分别为98.5%(67例)、78.5%(55例), A组12例(17.6%)达到病理完全缓解. 4组3年OS和DFS有统计学意义(P = 0.001和0.004), A组3年OS(86.76%)和DFS(76.27%)均高于其他3组(表2). 生存曲线A组相对其他3组有生存优势, 并且D组优于C组(图1).
| 分组 | 总生存时间(mo) | 总生存率[%(n1/n)] | 无病生存时间(mo) | 无病生存率[%(n1/n)] |
| A组 | 21.43 | 86.76(59/68) | 5.22 | 76.27(45/59) |
| B组 | 24.65 | 77.14(54/70) | 10.60 | 44.44(24/54) |
| C组 | 14.92 | 60.78(31/51) | 8.94 | 51.61(16/31) |
| D组 | 16.73 | 75.61(31/41) | 5.12 | 64.52(20/31) |
| χ2值 | 23.590 | 13.125 | ||
| P值 | 0.001 | 0.004 |
全组常见的放化疗不良反应有骨髓抑制、消化道反应(恶心、呕吐)、直肠黏膜反应(肛门下坠、腹部疼痛、黏液便). 大多数急性不良反应处于1-2级. 有1例Ⅳ度骨髓抑制出现在C组中. Ⅰ度和Ⅱ度消化道反应发生率在B组较高(37.14%, P = 0.002; 15.71%, P = 0.001), 直肠黏膜反应常出现在A组中(38.24%, P = 0.001)(表3).
| 分组 | Ⅰ度骨髓抑制 | Ⅱ度骨髓抑制 | Ⅲ度骨髓抑制 | Ⅰ度消化道反应 | Ⅱ度消化系反应 | 直肠黏膜反应 |
| A组 | 17(25.00) | 10(14.71) | 2(2.94) | 9(13.24) | 1(1.47) | 26(38.24) |
| B组 | 20(28.57) | 18(25.71) | 1(1.43) | 26(37.14) | 11(15.71) | 9(12.86) |
| C组 | 7(13.73) | 10(19.61) | 3(5.88) | 7(13.73) | 0(0.00) | 3(5.88) |
| D组 | 13(31.71) | 6(14.63) | 3(7.32) | 9(21.95) | 0(0.00) | 4(9.76) |
| χ2值 | 4.940 | 3.365 | 3.110 | 14.348 | 22.592 | 26.768 |
| P值 | 0.176 | 0.339 | 0.375 | 0.002 | 0.001 | 0.001 |
治疗方式新辅助放化疗与其他方式差异有明显的统计学意义(P = 0.002), 是预后因素. 另外, 年龄(P = 0.021)及全周肿瘤(P = 0.029)也影响预后. 虽然局部复发在单因素分析中存在统计学差异, 但多因素分析局部复发并不是预后因素(表4).
| 因素 | B | SE | χ2 | g | P值 | HR值 |
| 分组 | 22.442 | 3 | 0.000 | |||
| A组 | -0.385 | 0.511 | 0.567 | 1 | 0.451 | 0.680 |
| B组 | 0.130 | 0.482 | 0.073 | 1 | 0.787 | 1.139 |
| C组 | 1.371 | 0.450 | 9.293 | 1 | 0.002 | 3.941 |
| 年龄 | 0.027 | 0.012 | 5.358 | 1 | 0.021 | 1.027 |
| 病理类型 | 0.362 | 0.406 | 0.797 | 1 | 0.372 | 1.437 |
| 化疗方式 | -0.030 | 0.331 | 0.008 | 1 | 0.929 | 0.971 |
| 局部复发 | -0.197 | 0.377 | 0.272 | 1 | 0.602 | 0.821 |
| 远处转移 | 0.109 | 0.368 | 0.087 | 1 | 0.768 | 1.115 |
| 肿瘤位置 | 3.161 | 2 | 0.206 | |||
| 低位 | 1.827 | 1.028 | 3.161 | 1 | 0.075 | 6.215 |
| 中位 | 1.777 | 1.044 | 2.896 | 1 | 0.089 | 5.910 |
| 管腔受侵比例 | -0.733 | 0.336 | 4.762 | 1 | 0.029 | 0.480 |
目前多学科治疗模式在直肠癌治疗中得到应用, 新的技术使肿瘤和患者的功能结局都有所改善[8], 但是局部复发和远处转移仍是直肠癌治疗的最大挑战. 尽管美国国家综合癌症网络(National Comprehensive Cancer Network, NCCN)直肠癌临床实践指南[9]推荐Ⅱ、Ⅲ期直肠癌行术前同步放化疗, 但实际工作中需要考虑个体差异并不能对直肠癌患者采用统一的治疗策略[10]. 如何将手术、放疗、化疗3种治疗手段完美地结合使之发挥最佳的治疗效果, 并针对不同的直肠癌患者采取个体化的治疗模式成为当前直肠癌综合治疗中迫切需要解决的问题. 因此, 我们通过对接受不同治疗策略的230例Ⅱ、Ⅲ期直肠癌进行分析, 来了解其生存的差异.
关于直肠癌治疗后局部复发的情况, 不同的研究存在差异. 德国的随机试验[4]通过对直肠癌患者进行中位11年的随访发现术前同步放化疗可以改善局控率, 这一结论在相关研究[11]中也得到证实. 相关的综述[12]也认为术前同步放化疗是直肠癌有效的治疗方法, 但由于术前影像学分期的局限性, 有可能使早期患者受到了过度治疗, 并强调术前精确分期以避免治疗不足和治疗过度. 但是一个局部晚期直肠癌治疗失败的研究[13], 发现术前同步放化疗2年内的局部控制较好, 而5年后的局部复发率术前同步放化疗明显高于术后同步放化疗(13.2% vs 4.2%), 并认为术前同步放化疗患者倾向于晚期(>5年)复发转移, 由于该研究属于回顾性研究, 不存在随机试验[4]中术后患者放化疗依从性差的问题, 可能是两者结论不同的原因. 本研究4组局部复发率没有差异, 但是根治性放化疗组复发率最低, 术后辅助放化疗组最高, 高于新辅助放化疗联合手术组. 根治性放化疗组局控较好, 除了与调强放疗计划靶区剂量适形度较好[14]、放疗剂量较高有关, 同时也与一部分拒绝手术的患者期别较早有关. 新辅助放化疗联合手术组和新辅助放化疗未手术组局部复发率相对较低, 可能是因为新辅助治疗后局控较好. 术后辅助放化疗局部复发率高, 除了与肿瘤位置[12]、切缘阳性[15]及手术与放疗的间期[16]有关, 另外一个原因是新疆医科大学附属肿瘤医院2010年开始进行直肠癌的术前治疗, 并且随着术前同步放化疗的进行其他治疗方式逐渐减少, 致使术后同步放化疗患者集中在随访前期, 随访时间长于其他组. 虽然局部复发在各组间存在差异, 但是多因素分析, 局部复发并不是预后因素. 本研究远处转移率没有统计学差异, 与既往的研究[4,11,12]结论一致.
生存率方面, 许多研究[4,17]并不认为术前同步放化疗提高了生存率, 或认为未行术前治疗的生存率高于术前治疗[18], 但是术前同步放化疗通过降期可以提高直肠癌的可切除性[19-21], 改善DFS[22], 而新辅助放化疗后的病理分期和预后相关[23]. 最新的综述[24]证实R0切除是长期生存的重要预后指标. 新辅助放化疗的患者约10%-25%达到病理完全缓解[25], 病理完全缓解和良好的预后相关[26,27]. 本研究术后同步放化疗组R0切除率78.5%(55例); 新辅助放化疗手术组R0切除率98.5%(67例)高于术后同步放化疗组, 其中12例(17.6%)达到病理完全缓解, 因此, 较高的R0切除率是A组3年OS和DFS高于其他组的原因. 新辅助放化疗未手术组生存率较低, 而且多因素分析中, 新辅助放化疗未手术是预后因素, 考虑与未行手术[28]及放疗剂量较低有关. Quirke等[2]也证明高质量的手术可以减少局部复发. 所以, 对于新辅助放化疗未手术的患者, 临床医师需要与其进行积极的沟通, 并告知手术或瘤床区补量放疗的必要性. 由于较多的Ⅲ期患者、放化疗后肿块缩小不明显外科评估后不能完全切除及拒绝手术的患者接受了根治性放化疗, 所以该组没有明显的生存优势.
在生存时间方面, 术后同步放化疗组长于其他组, 除了治疗方式的差异, 考虑也与新疆医科大学附属肿瘤医院直肠癌的术前放化疗集中在2011年以后, 随访时间相对较短有关.
多因素分析中, 除了治疗方式是预后因素, 年龄及全周肿瘤也影响预后. 相关研究[29]也证实年龄影响生存, 初诊的直肠癌年龄超过80岁生存率最低. 全周肿瘤是预后因素已在我们另外的研究[30]中证实. Yeo等[12]认为肿瘤位置也是预后因素, 并且中低位直肠癌5年局部复发率高于高位直肠癌(2.6% vs 9.8%). 由于本研究纳入的高位直肠癌(17例)较少, 并没有发现肿瘤位置对生存的影响.
直肠癌对放化疗的耐受性较好[31]尤其精确放疗技术应用后不良反应明显下降[14,32], 因不良反应而中断放化疗者也较少[33]. 本研究患者常见的放化疗不良反应有骨髓抑制、消化系反应(恶心、呕吐)、直肠黏膜反应(肛门下坠、下腹痛、黏液便). 急性不良反应大多处于1-2级, 只有1例Ⅳ度骨髓抑制出现在新辅助放化疗未手术组, 经对症处理后可以缓解, 没有因不良反应引起的死亡. 术前放化疗患者由于术后盆腔解剖结构破坏, 照射了更多的小肠易引起肠道黏膜反应. Ⅰ-Ⅱ度消化道反应常出现在术后治疗组中, 可能与术后联合化疗有关.
另外, 本研究存在以下缺陷: (1)回顾性单中心的研究且例数不多; (2)由于新疆医科大学附属肿瘤医院2010年才开始进行直肠癌术前放化疗, 致使术前放化疗患者随访时间短于其他组; (3)由于本研究整体随访时间较短, 无法比较3年之后的生存情况, 我们仍会继续随访以便观察长期的生存结果.
总之, 新辅助放化疗联合手术R0切除率较高, 并且OS和DFS高于其他方法, 是Ⅱ-Ⅲ期直肠癌治疗的有效方法. 直肠癌患者放化疗耐受性较好. 新辅助放化疗未手术、年龄和全周肿瘤是其预后因素.
近年来, 肿瘤的治疗转向个体化, 多学科治疗模式在直肠癌治疗中得到应用, 新辅助放化疗联合手术是Ⅱ-Ⅲ期直肠癌的标准治疗方案. 但是如何针对不同的直肠癌患者采取个体化的治疗模式仍是当前迫切需要解决的问题.
朱永良, 副研究员, 浙江大学医学院附属第二医院门诊楼1104室消化实验室
本研究表明新辅助放化疗联合手术R0切除率较高, 并且总生存率(overall survival, OS)和无病生存率(disease-free survival, DFS)高于其他方法, 是Ⅱ-Ⅲ期直肠癌有效的治疗方法, 样本量较大, 有一定的临床指导意义, 但仍需继续随访以便观察患者3年后的生存差异.
目前国内外许多研究是关于术前与术后治疗的比较, 但是关于未手术患者的生存情况, 国内外的报道都较少.
本研究是针对Ⅱ-Ⅲ期直肠癌的研究, 纳入了四种治疗策略, 并对各组间的局部复发率、远处转移率、总生存率、无瘤生存率以及预后影响因素进行了分析, 对临床中直肠癌的个体化治疗有一定的指导意义.
本研究对于直肠癌个体化治疗的选择有一定的参考价值, 可在一定程度上为前瞻性长期随访的临床研究提供依据.
本文简明而有特色, 科学结论较明确, 实验证据充足, 文章的科学性、创新性和可读性能较好地反映我国直肠癌临床和基础研究的先进水平.
编辑: 郭鹏 电编:都珍珍
| 1. | De Felice F, Musio D, Izzo L, Tombolini V. Neoadjuvant chemoradiotherapy for locally advanced rectal cancer: The debate continues. World J Gastrointest Oncol. 2014;6:438-440. [PubMed] [DOI] |
| 2. | Quirke P, Steele R, Monson J, Grieve R, Khanna S, Couture J, O'Callaghan C, Myint AS, Bessell E, Thompson LC. Effect of the plane of surgery achieved on local recurrence in patients with operable rectal cancer: a prospective study using data from the MRC CR07 and NCIC-CTG CO16 randomised clinical trial. Lancet. 2009;373:821-828. [PubMed] [DOI] |
| 3. | Roh MS, Colangelo LH, O'Connell MJ, Yothers G, Deutsch M, Allegra CJ, Kahlenberg MS, Baez-Diaz L, Ursiny CS, Petrelli NJ. Preoperative multimodality therapy improves disease-free survival in patients with carcinoma of the rectum: NSABP R-03. J Clin Oncol. 2009;27:5124-5130. [PubMed] [DOI] |
| 4. | Sauer R, Liersch T, Merkel S, Fietkau R, Hohenberger W, Hess C, Becker H, Raab HR, Villanueva MT, Witzigmann H. Preoperative versus postoperative chemoradiotherapy for locally advanced rectal cancer: results of the German CAO/ARO/AIO-94 randomized phase III trial after a median follow-up of 11 years. J Clin Oncol. 2012;30:1926-1933. [PubMed] [DOI] |
| 5. | Habr-Gama A, Gama-Rodrigues J, São Julião GP, Proscurshim I, Sabbagh C, Lynn PB, Perez RO. Local recurrence after complete clinical response and watch and wait in rectal cancer after neoadjuvant chemoradiation: impact of salvage therapy on local disease control. Int J Radiat Oncol Biol Phys. 2014;88:822-828. [PubMed] [DOI] |
| 6. | Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol. 2010;17:1471-1474. [PubMed] [DOI] |
| 8. | Damin DC, Lazzaron AR. Evolving treatment strategies for colorectal cancer: a critical review of current therapeutic options. World J Gastroenterol. 2014;20:877-887. [PubMed] [DOI] |
| 9. | Engstrom PF, Arnoletti JP, Benson AB, Chen YJ, Choti MA, Cooper HS, Covey A, Dilawari RA, Early DS, Enzinger PC. NCCN Clinical Practice Guidelines in Oncology: rectal cancer. J Natl Compr Canc Netw. 2009;7:838-881. [PubMed] |
| 10. | Shin US, Yu CS, Kim JH, Kim TW, Lim SB, Yoon SN, Yoon YS, Kim CW, Kim JC. Mucinous rectal cancer: effectiveness of preoperative chemoradiotherapy and prognosis. Ann Surg Oncol. 2011;18:2232-2239. [PubMed] [DOI] |
| 11. | Rahbari NN, Elbers H, Askoxylakis V, Motschall E, Bork U, Büchler MW, Weitz J, Koch M. Neoadjuvant radiotherapy for rectal cancer: meta-analysis of randomized controlled trials. Ann Surg Oncol. 2013;20:4169-4182. [PubMed] [DOI] |
| 12. | Yeo SG, Kim MJ, Kim DY, Chang HJ, Kim MJ, Baek JY, Kim SY, Kim TH, Park JW, Oh JH. Patterns of failure in patients with locally advanced rectal cancer receiving pre-operative or post-operative chemoradiotherapy. Radiat Oncol. 2013;8:114. [PubMed] [DOI] |
| 13. | Trakarnsanga A, Ithimakin S, Weiser MR. Treatment of locally advanced rectal cancer: controversies and questions. World J Gastroenterol. 2012;18:5521-5532. [PubMed] [DOI] |
| 14. | 胡 克, 庞 廷田, 杨 波, 张 福泉, 邱 杰. 直肠癌术前放疗中三维适形放疗与调强适形放疗的剂量学比较分析. 中华放射医学与防护杂志. 2010;30:310-313. |
| 15. | Nagtegaal ID, Quirke P. What is the role for the circumferential margin in the modern treatment of rectal cancer? J Clin Oncol. 2008;26:303-312. [PubMed] [DOI] |
| 16. | 田含含, 王海峰, 张瑾熔, 阿衣古丽•哈热, 伊斯刊达尔•阿布力米提. 术前放化疗与手术时间间隔对ⅢA、ⅢB期直肠癌的影响. 世界华人消化杂志. 2014;22:3918-3924. [DOI] |
| 17. | Park JH, Yoon SM, Yu CS, Kim JH, Kim TW, Kim JC. Randomized phase 3 trial comparing preoperative and postoperative chemoradiotherapy with capecitabine for locally advanced rectal cancer. Cancer. 2011;117:3703-3712. [PubMed] [DOI] |
| 18. | Schiffmann L, Klautke G, Wedermann N, Gock M, Prall F, Fietkau R, Rau B, Klar E. Prognosis of rectal cancer patients improves with downstaging by intensified neoadjuvant radiochemotherapy - a matched pair analysis. BMC Cancer. 2013;13:388. [PubMed] [DOI] |
| 19. | Engineer R, Mohandas KM, Shukla PJ, Shrikhande SV, Mahantshetty U, Chopra S, Goel M, Mehta S, Patil P, Ramadwar M. Escalated radiation dose alone vs. concurrent chemoradiation for locally advanced and unresectable rectal cancers: results from phase II randomized study. Int J Colorectal Dis. 2013;28:959-966. [PubMed] [DOI] |
| 20. | Sauer R, Becker H, Hohenberger W, Rödel C, Wittekind C, Fietkau R, Martus P, Tschmelitsch J, Hager E, Hess CF. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med. 2004;351:1731-1740. [PubMed] |
| 21. | Sebag-Montefiore D, Stephens RJ, Steele R, Monson J, Grieve R, Khanna S, Quirke P, Couture J, de Metz C, Myint AS. Preoperative radiotherapy versus selective postoperative chemoradiotherapy in patients with rectal cancer (MRC CR07 and NCIC-CTG C016): a multicentre, randomised trial. Lancet. 2009;373:811-820. [PubMed] [DOI] |
| 22. | Kang J, Jang SM, Baek JH, Lee WS, Cho TH. Short-term results and long-term oncologic outcomes between neoadjuvant chemoradiotherapy and adjuvant postoperative chemoradiotherapy for stage III rectal cancer: a case-matched study. Ann Surg Oncol. 2012;19:2494-2499. [PubMed] [DOI] |
| 23. | 肖 毅, 陆 君阳, 熊 光冰, 吴 斌, 林 国乐, 赵 林, 梁 智勇, 仲 光熙, 胡 克, 潘 卫东. 直肠癌新辅助治疗后病理分期状况与生存预后的关系. 中华外科杂志. 2014;52:99-104. |
| 24. | Mohan HM, Evans MD, Larkin JO, Beynon J, Winter DC. Multivisceral resection in colorectal cancer: a systematic review. Ann Surg Oncol. 2013;20:2929-2936. [PubMed] [DOI] |
| 25. | Garland ML, Vather R, Bunkley N, Pearse M, Bissett IP. Clinical tumour size and nodal status predict pathologic complete response following neoadjuvant chemoradiotherapy for rectal cancer. Int J Colorectal Dis. 2014;29:301-307. [PubMed] [DOI] |
| 26. | Lu JY, Xiao Y, Qiu HZ, Wu B, Lin GL, Xu L, Zhang GN, Hu K. Clinical outcome of neoadjuvant chemoradiation therapy with oxaliplatin and capecitabine or 5-fluorouracil for locally advanced rectal cancer. J Surg Oncol. 2013;108:213-219. [PubMed] [DOI] |
| 27. | Park IJ, You YN, Agarwal A, Skibber JM, Rodriguez-Bigas MA, Eng C, Feig BW, Das P, Krishnan S, Crane CH. Neoadjuvant treatment response as an early response indicator for patients with rectal cancer. J Clin Oncol. 2012;30:1770-1776. [PubMed] [DOI] |
| 28. | Williamson JS, Jones HG, Davies M, Evans MD, Hatcher O, Beynon J, Harris DA. Outcomes in locally advanced rectal cancer with highly selective preoperative chemoradiotherapy. Br J Surg. 2014;101:1290-1298. [PubMed] [DOI] |
| 29. | Morris EJ, Sandin F, Lambert PC, Bray F, Klint A, Linklater K, Robinson D, Påhlman L, Holmberg L, Møller H. A population-based comparison of the survival of patients with colorectal cancer in England, Norway and Sweden between 1996 and 2004. Gut. 2011;60:1087-1093. [PubMed] [DOI] |
| 31. | de las Heras M, Arias F, del Moral-Avila R, Gómez-Millán J, Jiménez E, Wals A, Tisaire JL, Alcantara MP. Multicenter phase II clinical trial of preoperative capecitabine with concurrent radiotherapy in patients with locally advanced rectal cancer. Clin Transl Oncol. 2013;15:294-299. [PubMed] [DOI] |
| 32. | Chao JY, Wang HM, Chiang FF, Lin JC, Chang CF, Lin JF, Yeh HL. Preoperative chemoradiotherapy with oxaliplatin and tegafur-uracil in locally advanced rectal cancer: pathologic complete response rate and preliminary results of overall and disease-free survival in a single institute in Taiwan. J Chin Med Assoc. 2014;77:128-132. [PubMed] [DOI] |