修回日期: 2015-06-26
接受日期: 2015-07-13
在线出版日期: 2015-08-18
目的: 分析β-catenin和维生素D受体(vitamin D receptor, VDR)在结肠癌中表达的意义.
方法: 通过免疫组织化学法检测65例结肠腺癌组织和癌旁组织(距肿瘤边缘>5 cm)标本中β-catenin和VDR的表达情况, 探讨了β-catenin和VDR在结肠癌中表达的意义.
结果: β-catenin的膜表达缺失, 异位表达在结肠癌和癌旁组织中(P<0.01); VDR的强阳性表达在结肠癌和癌旁组织(P<0.01); β-catenin的异常表达与VDR的表达在结肠癌组织中表达呈正相关(r = 0.98, P<0.01), 并被发现与肿瘤的淋巴结转移和浆膜浸润有关.
结论: VDR表达的降低使得维生素D与VDR的复合物减少, 可能使得β-catenin改变, 激活Wnt通路, 在多种因素作用下导致结肠癌的发生; VDR和β-catenin的异常表达的检测对结肠癌的诊断和预后判断有提示意义.
核心提示: 维生素D(vitamin D)通过与维生素D受体(vitamin D receptor, VDR)结合, 在肿瘤的治疗和预防上发挥一定作用, 但相关机制尚未明确. VDR表达的降低使得维生素D与VDR的复合物减少, 可能使得β-catenin改变, 激活Wnt通路, 在多种因素作用下导致结肠癌的发生; VDR和β-catenin的异常表达的检测对结肠癌的诊断和预后判断有提示意义.
引文著录: 张峥峥, 李娅, 王满, 徐峰. β-catenin和维生素D受体在结肠癌中表达的意义. 世界华人消化杂志 2015; 23(23): 3700-3705
Revised: June 26, 2015
Accepted: July 13, 2015
Published online: August 18, 2015
AIM: To investigate the expression of β-catenin and vitamin D receptor (VDR) in colorectal carcinoma to explore their roles in colorectal carcinoma pathogenesis.
METHODS: The expression of β-catenin and VDR was detected by immunohistochemistry in 65 colorectal carcinoma specimens and 65 normal colorectal mucosa specimens.
RESULTS: The missing expression of β-catenin on the cell membrane and ectopic expression in colorectal carcinoma specimens and normal colorectal mucosa specimens had a significant difference (P < 0.01). The strongly positive expression of VDR in colorectal carcinoma specimens and normal colorectal mucosa specimens had a significant difference (P < 0.01). The abnormal expression of β-catenin was positively correlated with that of VDR in colorectal carcinoma (r = 0.98, P < 0.01), and both were found to be associated with lymph node metastasis and tumor invasion.
CONCLUSION: Lower expression of VDR may influence β-catenin and activate the Wnt signaling pathway in human colorectal carcinoma. Detecting the abnormal expression of β-catenin and VDR may be helpful for the diagnosis and evaluation of the prognosis of colorectal carcinoma.
- Citation: Zhang ZZ, Li Y, Wang M, Xu F. Significance of β-catenin and vitamin D receptor expression in colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2015; 23(23): 3700-3705
- URL: https://www.wjgnet.com/1009-3079/full/v23/i23/3700.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i23.3700
2014年全球结肠癌患者新发病例数近137万, 目前居恶性肿瘤发病率第3位[1]. 随着近几年我国居民生活习惯、饮食结构及环境的改变, 结肠癌的发病率不断上升[2]. 据2012中国肿瘤登记年报显示, 结肠癌的发病率较前升高, 跃居第2. 大量研究表明, 维生素D通过与维生素D受体(vitamin D receptor, VDR)结合, 在包括结肠癌[3,4]、胰腺癌[5]、食管癌[6]、肺癌[7]、肝癌[8]及卵巢癌[9]等肿瘤的预防和治疗上发挥一定作用, 但对于相关机制, 研究尚未明确. 本文通过检测65例结肠腺癌组织和癌旁组织标本中β-catenin和VDR的表达情况, 探讨了β-catenin和VDR在结肠癌中表达的意义.
收集郑州大学第一附属医院手术切除的结肠腺癌组织65例和相应的癌旁组织织(距肿瘤边缘>5 cm); 所有患者既往无肠道相关疾病, 术前未进行放化疗和生物治疗; 其中男性36例, 女性29例; 年龄30-79岁, 中位年龄50岁; 有淋巴结转移54例, 无淋巴结转移11例; 按组织学分级, 高中分化19例, 低分化46例; 有浆膜浸润55例, 无浆膜浸润10例; 根据TNM分期, Ⅰ期10例、Ⅱ期1例、Ⅲ期48例、Ⅳ期6例; 鼠抗人β-catenin单克隆抗体(浓缩型)为英国Abcam公司产品; 鼠抗人VDR单克隆抗体(浓缩型)为美国Santa Cruz公司产品; 通用型SP试剂盒和DAB显色试剂盒为北京中山生物技术有限公司产品.
1.2.1 免疫组织化学检测: 取标本蜡块进行连续切片, 切片常规脱蜡, 采用链酶卵白素-生物素过氧化物酶法(streptavidin peroxidase, SP)染色. 0.01 mol/L的枸橼酸盐缓冲液微波修复抗原. 实验步骤按照试剂盒说明书进行, DAB染色, 苏木素复染, 中性树胶封固. PBS代替一抗作为阴性对照. 已知阳性片作为阳性对照.
1.2.2 结果判定: 免疫组织化学阳性信号为棕黄色颗粒. β-catenin染色结果判定标准按照Maruyama等[10]方法, 分别从细胞膜、胞浆、胞核三方面判断β-catenin在细胞内的分布: 细胞膜阳性表达细胞细胞率>70%为正常表达, 反之则为表达降低或缺失; 胞浆或胞核阳性表达细胞率>10%为异位表达. 细胞膜表达缺失与异位表达均属于异常表达.
VDR表达阳性结果判定标准按照缪玉娥等[11]方法: 每例随机测计10个高倍视野内阳性细胞的百分率, 结合染色强度进行评分. 以细胞质中出现棕黄色颗粒为阳性细胞: 阳性细胞比例 ≤ 5%计0分, 6%-10%计1分, 11%-30%计2分,>30%计3分. 胞质染色与周围间质几乎相同者计0分, 与周围间质可区分者计1分; 染色呈深棕黄色, 与间质明显区别者计3分, 介于两者之间计2分. 两者相加后评分 ≤ 1分为阴性, 2-3分为+, 4-5分为++ ,>5分为+++.
统计学处理 采用SPSS17.0统计学软件进行分析, 免疫组织化学结果相关性分析组间采用卡方检验, 不满足χ2条件(理论频数<1)时选择Fisher精确检验; 指标间采用Spearman等级相关分析, 分析均采用双侧检验, 检验水准α = 0.05. P<0.05为差异有统计学意义.
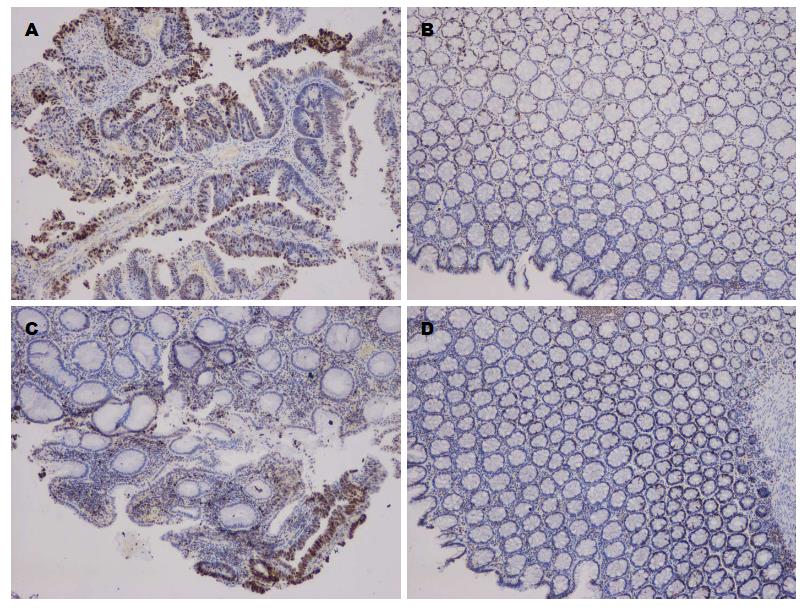
β-catenin在癌旁组织中表达于上皮细胞的细胞膜上, 而结肠癌组织中可见于部分细胞胞浆与胞核中表达(图1A, B), β-catenin在结肠癌和癌旁组织膜表达缺失分别为48、3例, 异位表达为56、1例, 异常表达为64、3例和正常表达1、62例(P<0.01).
癌旁组织中VDR强阳性表达, 表达的细胞主要为黏膜上皮细胞与腺管上皮细胞, 而在细胞中, VDR集中表达于细胞核; 结肠癌组织的细胞中VDR有不同程度的表达, 主要集中在癌巢(图1C, D); 本研究中, VDR的强阳性表达在结肠癌和癌旁组织中具有显著差异性(6 vs 23, P<0.01); VDR的非强阳性表达在结肠癌组织和癌旁组织中无显著差异性(中等阳性: 39 vs 31, 弱阳性: 20 vs 11, P>0.05).
β-catenin的异常表达与结肠癌患者的年龄、性别及分化程度无关, 而与淋巴结转移和浆膜浸润有关; 而VDR的异常表达与结肠癌患者的性别、年龄无关, 而与分化程度、淋巴结转移及浆膜浸润有关(表1).
| 因素 | n | β-catenin | χ2/(Fisher)值 | P值 | VDR | χ2/(Fisher)值 | P值 | ||
| 正常表达 | 异常表达 | + / ++ | +++ | ||||||
| 性别 | (Fisher) | 0.55 | 0.02 | 0.89 | |||||
| 男 | 36 | 1 | 35 | 23 | 13 | ||||
| 女 | 29 | 0 | 29 | 19 | 10 | ||||
| 年龄(岁) | 0.52 | 0.47 | 0.19 | 0.67 | |||||
| <50 | 22 | 0 | 22 | 15 | 7 | ||||
| ≥50 | 43 | 1 | 42 | 27 | 16 | ||||
| 淋巴转移 | 4.99 | 0.03 | (Fisher) | 0.04 | |||||
| 有 | 54 | 0 | 54 | 38 | 16 | ||||
| 无 | 11 | 1 | 10 | 4 | 7 | ||||
| 分化程度 | 2.46 | 0.12 | 34.35 | <0.01 | |||||
| 高中分化 | 19 | 1 | 18 | 2 | 17 | ||||
| 低分化 | 46 | 0 | 46 | 40 | 6 | ||||
| 浆膜浸润 | 5.59 | 0.02 | (Fisher) | 0.03 | |||||
| 有 | 55 | 0 | 55 | 39 | 16 | ||||
| 无 | 10 | 1 | 9 | 3 | 7 | ||||
结肠癌组织中β-catenin的异常表达与VDR表达的相关性分析中, 可知结肠癌组织中β-catenin的异常表达与VDR表达为正相关(r = 0.98, P<0.01); 癌旁组织中β-catenin的异常表达与VDR表达为正相关(r = 1.00, P<0.01).
结肠癌的发生是一个多级程序介导的过程[12]. 目前流行病学和基础研究[13-15]均认为维生素D为结直肠癌的保护因素; 维生素D可通过与靶细胞中的VDR结合形成复合物, 作用于靶基因上特定的DNA序列, 从而对结构基因的表达产生调节作用. 因此, 结直肠癌组织中VDR的表达水平很大程度上决定了维生素D起作用的程度.
VDR是核内生物大分子, 为类固醇激素/甲状腺激素受体超家族的成员. 人VDR基因位于染色体l2q13-14, 长约75 kb, 由9个外显子、8个内含子组成. 正常结肠黏膜有很强的VDR表达, 而结肠癌组织中VDR表达较弱, 有较多的细胞核着色淡且核中表达很不均匀. 在二甲肼诱癌实验中, 大鼠肠黏膜中的VDR表达在癌前病变时期已有显著下降, 是结肠肿瘤的发生发展过程中早期事件[16]; 有研究[17]证实缺乏VDR的小鼠, 结肠上皮细胞的增殖和氧化的DNA损伤增加, 预示VDR敲除鼠有发生结肠肿瘤的倾向; 在本研究中, VDR表达与结肠癌的分化程度、淋巴结转移及浆膜浸润密切相关, 检测VDR表达可作为结肠肿瘤预后的判断依据之一.
β-catenin是一种分子量为90 kDa多功能蛋白质, 他与E-黏附素(E-cadherin)的胞浆端相连构成E-cadherin/β-catenin复合物, 参与构成细胞间黏附连接, 对于维持上皮的极性和完整性有重要作用[18,19]. β-catenin又是Wnt信号途径的下游元件. 既往研究[20-22]表明, β-catenin的改变可激活Wnt信号通路, 这与结肠癌的始发密切相关. 李悠然等[23]指出85%遗传性和散发性的结直肠癌都是由于APC基因和β-catenin基因突变引起Wnt经典信号通路的异常激活造成. 在正常成熟细胞中, Wnt通路处于关闭状态[24], 胞质中的β-catenin大部分与突出胞膜表面的E-cadherin结合, 小部分形成蛋白多聚体, 多聚体在特定情况下可被识别降解. 而当Wnt通路被激活时, 蛋白多聚体中的β-catenin无法被降解. β-catenin在胞质中逐渐蓄积, 达到一定浓度时可转移至细胞核. 而胞核中β-catenin的积聚可启动转录, 调控相应的基因表达, 进一步介导了生长和发育信号的传递, 其过度转导和异常活化可能会引起细胞的恶性转化和肿瘤的发生[25]. 本研究中结肠腺癌中β-catenin明显异于正常大肠组织, 在胞质与胞核中异常表达也印证这一点.
有研究[26]表明, 在VDR缺失的Apcmin/+的小鼠模型中, 核内的β-catenin表达水平升高, WNT通路靶基因的表达也升高, 随之引起肿瘤的体积的增加; Guo等[27]发现, VDR可参与高血糖导致的β-catenin的核异位; 体外实验观察到的配体化的VDR与β-catenin的交互作用提示VDR的结合可以阻止β-catenin移位至核内的可能, 致使β-catenin被蛋白酶更大程度的降解. Xu等[28]通过每周3次注射1,25-羟基维生素D和类似物, 连续12 wk研究发现Apcmin/+小鼠的息肉数目和肿瘤负荷明显降低, 从而提示其与抑制小肠和结肠内β-catenin相关基因表达有关. Johnson等[29]人在体外实验中发现乳腺癌细胞中VDR的激活可以降低β-catenin的活性, 从而导致WNT信号通路受到抑制; 同样, DeWitt等[30]认为在体外, 1,25-羟基维生素D可以通过增强VDR和β-catenin相互作用从而抑制β-catenin调节基因. 以上均证实VDR的改变可以影响β-catenin的表达. 本研究中, 通过对结肠癌与癌旁组织中VDR表达与β-catenin的异常表达相关分析, 可得出两者正相关, 可推测, VDR表达的降低使得维生素D与VDR的复合物减少, 从而使得β-catenin改变, 激活Wnt通路, 在多种因素作用下导致结肠癌的发生. 总之, VDR和β-catenin异常表达的检测对结肠癌的诊断有提示意义, 给结肠癌的预防和早期诊治提供新思路.
2014年全球恶性肿瘤发病率中, 结肠癌位于第3位. 大量研究表明, 维生素D通过与维生素D受体(vitamin D receptor, VDR)结合, 在肿瘤的预防和治疗上发挥一定作用, 但发病机制尚未完全阐明.
卢宁, 副主任医师, 中国人民解放军兰州军区乌鲁木齐总医院肿瘤科
维生素D为结肠癌的保护因素, 可抑制结肠内β-catenin相关基因表达, 从而在肿瘤的预防治疗中发挥作用.
李悠然等指出近85%的结直肠癌均由Wnt经典信号通路的异常激活造成; Xu等通过外源性补充维生素D及类似物, 发现小鼠结肠息肉数目及肿瘤负荷明显降低, 提示维生素D可抑制结肠内β-catenin相关基因表达.
既往关于VDR和β-catenin表达的相关性分析中, 多为动物实验; 本文通过免疫组织化学法检测65例患者结肠腺癌组织及癌旁组织(距肿瘤边缘>5 cm)标本中β-catenin及VDR的表达情况, 探讨了β-catenin和VDR在结肠癌中表达的意义.
本研究发现, β-catenin的异常表达与结肠癌淋巴结转移及浆膜浸润有关, 而VDR的异常表达与结肠癌分化程度、淋巴结转移及浆膜浸润有关, 提示VDR和β-catenin的异常表达对结肠癌的诊断有提示意义.
本研究目标明确, 设计尚合理, 研究方法较可信, 实验数据基本可靠, 具有一定的创新性.
编辑: 郭鹏 电编:都珍珍
| 3. | Bikle DD. Vitamin D and cancer: the promise not yet fulfilled. Endocrine. 2014;46:29-38. [PubMed] [DOI] |
| 4. | Byers SW, Rowlands T, Beildeck M, Bong YS. Mechanism of action of vitamin D and the vitamin D receptor in colorectal cancer prevention and treatment. Rev Endocr Metab Disord. 2012;13:31-38. [PubMed] [DOI] |
| 7. | 胡 勇志, 周 逸鹏, 黎 书炜, 张 锡彦, 张 鹤美, 雷 永良, 张 增利, 童 建, 李 冰燕. 1,25-二羟基维生素D3增强卡铂对人肺癌A549细胞的杀伤效果. 肿瘤防治研究. 2013;40:125-130. |
| 10. | Maruyama K, Ochiai A, Akimoto S, Nakamura S, Baba S, Moriya Y, Hirohashi S. Cytoplasmic beta-catenin accumulation as a predictor of hematogenous metastasis in human colorectal cancer. Oncology. 2000;59:302-309. [PubMed] [DOI] |
| 11. | 缪 玉娥, 王 钰, 王 淄博. 胃癌及其癌旁黏膜中维生素D受体的表达. 山东大学学报(医学版). 2012;50:74-77. |
| 12. | Klampfer L. Vitamin D and colon cancer. World J Gastrointest Oncol. 2014;6:430-437. [PubMed] [DOI] |
| 13. | Larriba MJ, González-Sancho JM, Barbáchano A, Niell N, Ferrer-Mayorga G, Muñoz A. Vitamin D Is a Multilevel Repressor of Wnt/b-Catenin Signaling in Cancer Cells. Cancers (Basel). 2013;5:1242-1260. [PubMed] [DOI] |
| 18. | Ahearn TU, Shaukat A, Flanders WD, Rutherford RE, Bostick RM. A randomized clinical trial of the effects of supplemental calcium and vitamin D3 on the APC/β-catenin pathway in the normal mucosa of colorectal adenoma patients. Cancer Prev Res (Phila). 2012;5:1247-1256. [PubMed] [DOI] |
| 20. | Rosenbluh J, Wang X, Hahn WC. Genomic insights into WNT/β-catenin signaling. Trends Pharmacol Sci. 2014;35:103-109. [PubMed] [DOI] |
| 21. | Song X, Wang S, Li L. New insights into the regulation of Axin function in canonical Wnt signaling pathway. Protein Cell. 2014;5:186-193. [PubMed] [DOI] |
| 22. | 顾 国利, 魏 学明, 石 林, 任 力, 郑 爱民, 黄 蓉蓉, 胡 益云. 大肠癌E-cadherin, β-catenin, MMP-7表达及其临床意义. 世界华人消化杂志. 2007;15:1344-1345. [DOI] |
| 23. | 李 悠然, 侯 毅, 谷 云飞, 陈 邑岐, 竺 平, 王 浩. Wnt/β-catenin信号通路在结直肠癌中的研究进展. 世界华人消化杂志. 2015;23:1930-1936. [DOI] |
| 24. | Beildeck ME, Gelmann EP, Byers SW. Cross-regulation of signaling pathways: an example of nuclear hormone receptors and the canonical Wnt pathway. Exp Cell Res. 2010;316:1763-1772. [PubMed] [DOI] |
| 25. | Salim T, Sand-Dejmek J, Sjölander A. The inflammatory mediator leukotriene D4 induces subcellular β-catenin translocation and migration of colon cancer cells. Exp Cell Res. 2014;321:255-266. [PubMed] [DOI] |
| 27. | Guo J, Xia N, Yang L, Zhou S, Zhang Q, Qiao Y, Liu Z. GSK-3β and vitamin D receptor are involved in β-catenin and snail signaling in high glucose-induced epithelial-mesenchymal transition of mouse podocytes. Cell Physiol Biochem. 2014;33:1087-1096. [PubMed] [DOI] |
| 28. | Xu H, Posner GH, Stevenson M, Campbell FC. Apc(MIN) modulation of vitamin D secosteroid growth control. Carcinogenesis. 2010;31:1434-1441. [PubMed] [DOI] |
| 29. | Johnson AL, Zinser GM, Waltz SE. Vitamin D3-dependent VDR signaling delays ron-mediated breast tumorigenesis through suppression of β-catenin activity. Oncotarget. 2015;6:16304-16320. [PubMed] |
| 30. | DeWitt M, Johnson RL, Snyder P, Fleet JC. The effect of 1,25 dihydroxyvitamin D3 treatment on the mRNA levels of β catenin target genes in mice with colonic inactivation of both APC alleles. J Steroid Biochem Mol Biol. 2015;148:103-110. [PubMed] [DOI] |