修回日期: 2015-06-09
接受日期: 2015-06-24
在线出版日期: 2015-08-08
目的: 探讨microRNA-34a(miR-34a)在结肠癌组织及细胞株中的表达及临床意义.
方法: 采用实时定量PCR检测30例结肠癌组织及其癌旁正常结肠黏膜组织、结肠癌细胞株(HT29、SW620、Lovo)中miR-34a的表达水平, 分析miR-34a表达与结肠癌临床病理参数之间的关系.
结果: miR-34a在结肠癌组织中的表达水平(0.681±0.327)较癌旁正常结肠黏膜组织(1.313±0.546)显著降低(P<0.01); miR-34a在结肠癌细胞株Lovo中的表达(0.275±0.035)明显低于其在结肠癌细胞株HT29、SW620中的表达(0.757±0.044、0.614±0.046), 差异有统计学意义(均P<0.01); miR-34a的表达与结肠癌的分化程度、浸润深度、淋巴结转移及临床分期均显著相关(均P<0.05). 而miR-34a的表达与性别、年龄、肿瘤大小无关(均P>0.05).
结论: miR-34a在结肠癌组织中低表达, 可能参与结肠癌的发生发展.
核心提示: 本研究显示microRNA-34a(miR-34a)在结肠癌组织与正常结肠黏膜、不同分化程度结肠癌细胞株间存在差异表达, 且与结肠癌分化程度、浸润深度、淋巴结转移及临床分期均显著相关, miR-34a可能在结肠癌发生中发挥抑癌基因的功能, 其低表达可能参与结肠癌的发展.
引文著录: 卢书明, 张竹青, 徐梦杳, 宋波, 刘丽娜, 李岩, 李春艳. microRNA-34a在结肠癌组织中的表达及临床意义. 世界华人消化杂志 2015; 23(22): 3548-3553
Revised: June 9, 2015
Accepted: June 24, 2015
Published online: August 8, 2015
AIM: To investigate the expression of microRNA-34a (miR-34a) in human colon cancer tissues and colon cancer cell lines, and to explore its clinical significance.
METHODS: The expression of miR-34a was detected by real-time quantitative polymerase chain reaction (qRT-PCR) in 30 colon cancer tissues and matched tumor adjacent normal colon tissues as well as colon cancer cell lines (HT29, SW620 and Lovo). The relationship between the levels of miR-34a expression and the clinicopathologic features of patients with colon cancer was analyzed.
RESULTS: The expression of miR-34a in colon cancer was significantly lower than that in adjacent normal colon tissues (0.681 ± 0.327 vs 1.313 ± 0.546, P < 0.05). The expression of miR-34a in colon cancer cell line Lovo was significantly lower than that in colon cancer cell lines HT29 and SW620 (0.275 ± 0.035 vs 0.757 ± 0.04 and 0.614 ± 0.046, P < 0.05). The expression of miR-34a was significantly associated with tumor differentiation, depth of invasion, lymph node metastasis and clinical stage in patients with colon cancer (P < 0.05), but not with gender, age, or tumor size (P > 0.05).
CONCLUSION: The expression of miR-34a is down-regulated in colon cancer, which may be related to tumorigenesis and progression.
- Citation: Lu SM, Zhang ZQ, Xu MY, Song B, Liu LN, Li Y, Li CY. Clinical significance of expression of microRNA-34a in human colon cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(22): 3548-3553
- URL: https://www.wjgnet.com/1009-3079/full/v23/i22/3548.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i22.3548
微小RNA(microRNA, miRNA)是近年来新发现的一类非编码小分子RNA, 通过与靶基因序列特异性结合, 在细胞增殖、分化、凋亡等生理和病理过程中发挥重要作用, 而且与肿瘤的发生、发展密切相关[1,2]. microRNA-34(miR-34)是在进化过程中高度保守的一个miRNA家族, miR-34a是miR-34家族最常见的一种成熟体, 研究发现在miR-34a在多种恶性肿瘤中表达异常, 与肿瘤的转移、分期关系密切[3]. 本研究应用实时定量PCR方法(real-time quantitative PCR, qRT-PCR)检测miR-34a在结肠癌组织及结肠癌细胞株中的表达, 分析miR-34a与结肠癌临床病理特征的关系, 探讨miR-34a在结肠癌中表达的临床意义.
收集2013-01/2014-12大连医科大学附属第一医院诊断明确的结肠癌手术切除组织标本及对应的癌旁正常肠黏膜组织(距离肿瘤边缘至少5 cm)各30例, 40 g/L甲醛固定, 石蜡包埋. 术前均未接受放疗和化疗. 结肠癌细胞株HT29(高分化)、SW620(中分化)、Lovo(低分化)购自中国医学科学院肿瘤细胞库. 石蜡包埋组织miRNA快速提取试剂盒购自上海吉玛制药技术有限公司, TaqMan MiRNA反转录试剂盒、TaqMan univsersal PCR Master MixⅡ、TaqMan MiRNA分析试剂盒购自美国Life Technologies公司.
1.2.1 细胞培养及RNA提取: 用含有10%的胎牛血清的RPMI 1640培养基, 在37 ℃、50 mL/L CO2细胞培养箱中培养. 当细胞生长至对数生长期, 即细胞密度达106-107个/L时, 收集细胞采用TRIzol一步法提取总RNA. 结肠癌与癌旁正常肠黏膜组织中总RNA的提取均采用石蜡包埋组织miRNA快速提取试剂盒, 步骤按照说明书操作. 使用紫外分光光度计分析RNA的浓度和纯度, A260/280比值在1.8-2.1之间, 表明RNA纯度较好, 可进行下一步操作.
1.2.2 Taqman探针法qRT-PCR反应: 引物: 从GenBank中查找目的基因序列, 使用Primer-Express3.0软件进行引物设计, 由大连宝生物工程有限公司合成. 内参U6基因扩增片段长96 bp, 其上游引物为: 5'-CTCGCTTCGGCAGCACA-3', 下游引物为: 5'-AACGCTTCACGAATTTGCGT-3'; miR-34a扩增片段长152 bp, 其上游引物为: 5'-GGCAGTGTCTTAGCTGGTTG-3', 下游引物为: 5'-AAGAGCTTCCGAAGTCCTGG-3'.
逆转录反应: 将提取的总RNA稀释成2 ng/μL, 每个逆转录反应用10 ng的总RNA, 以U6基因作内参. 所有操作均在冰上进行. 逆转录反应体系为15 μL: Nuclease free water 4.16 μL, dNTP mix 0.15 μL, MultiscribeTM RT enzyme 1.0 μL, 10×RT Buffer 1.5 μL, RnaseInhibitor 0.19 μL, RT primer(miR-34a, U6) 3 μL, total RNA sample 5 μL. 混匀离心至PCR管底, 冰上放置5 min. 反应条件: 16 ℃ 30 min, 42 ℃ 30 min, 85 ℃ 5 min. 逆转录后, cDNA产物保存在-20 ℃.
定量PCR反应: 按照TaqMan®Small RNA Assay试剂盒说明书操作. qPCR反应体系为20 μL, Master MixⅡ(2×)10 μL, Small RNA Assay 1 μL, Product from RT reaction 1.33 μL, Nuclease Free Water 7.67 μL. 反应条件: 95 ℃预变性10 min, 95 ℃ 15 s, 60 ℃ 1 min, 扩增40个循环.
结果计算: miRNA表达水平用2-△△Ct表示, 其中△△Ct = (CtmiR-34a-CtU6)实验组-(CtmiR-34a-CtU6)对照组. 得出miR-34a在结肠癌组织和癌旁正常肠黏膜组织中的相对表达量.
统计学处理 采用SPSS18.0统计学软件, miR-34a在结肠癌和癌旁正常黏膜中相对表达量的比较采用t检验, miR-34a在3种结肠癌细胞株中的表达及miR-34a与结肠癌临床病理参数之间的关系比较采用单因素方差分析, P<0.05为差异有统计学意义.
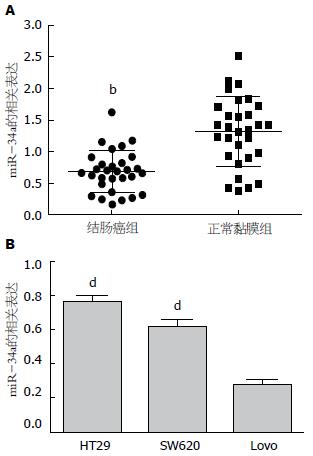
qRT-PCR检测显示miR-34a在结肠癌组织中相对表达量为0.681±0.327, 低于其在癌旁正常结肠黏膜组织中相对表达量1.313±0.546(t = 5.438, P<0.01)(图1A).
实时PCR检测显示miR-34a在结肠癌细胞株HT29、SW620、Lovo中的相对表达量分别为0.757±0.044、0.614±0.046、0.275±0.035, miR-34a在低分化结肠癌细胞株Lovo中的相对表达量明显低于其在高分化结肠癌细胞株HT29及中分化结肠癌细胞株SW620中的相对表达量(均P<0.01)(图1B).
miR-34a在低分化、浸润深度侵及浆膜、淋巴结转移、Ⅲ-Ⅳ期的结肠癌组中的相对表达量分别为0.486±0.208、0.478±0.318、0.495±0.277、0.558±0.285, 明显低于其在相应的高中分化、浸润深度未及浆膜、无淋巴结转移及Ⅰ-Ⅱ期结肠癌组中的相对表达量0.752±0.336、0.783±0.287、0.806±0.303、0.822±0.323(均P<0.05). miR-34a表达与患者性别、年龄、肿瘤大小无关(均P>0.05)(表1).
| 临床病理参数 | n | miR-34a相对表达量 | t值 | P值 |
| 性别 | 0.622 | 0.539 | ||
| 男 | 17 | 0.714±0.378 | ||
| 女 | 13 | 0.638±0.253 | ||
| 年龄(岁) | 0.285 | 0.778 | ||
| <60 | 13 | 0.701±0.384 | ||
| ≥60 | 17 | 0.666±0.286 | ||
| 肿瘤大小(cm) | 1.917 | 0.065 | ||
| <6 | 20 | 0.836±0.375 | ||
| ≥6 | 10 | 0.604±0.278 | ||
| 分化程度 | 2.090 | 0.046 | ||
| 高、中分化 | 22 | 0.752±0.336 | ||
| 低分化 | 8 | 0.486±0.208 | ||
| 浸润深度 | 2.654 | 0.013 | ||
| 未侵及浆膜 | 20 | 0.783±0.287 | ||
| 侵及浆膜 | 10 | 0.478±0.318 | ||
| 淋巴结转移 | 2.849 | 0.008 | ||
| 无 | 18 | 0.806±0.303 | ||
| 有 | 12 | 0.495±0.277 | ||
| TNM分期 | 2.376 | 0.025 | ||
| Ⅰ-Ⅱ期 | 16 | 0.822±0.323 | ||
| Ⅲ-Ⅳ期 | 14 | 0.558±0.285 |
结肠癌是最常见的消化系恶性肿瘤之一, 发病率逐年上升, 死亡率高, 严重影响人们的身体健康[4]. 结肠癌的发生与APC、k-ras、p53等基因的突变有关[5]. miRNA作为一类非编码小分子RNA, 通过参与转录后基因表达调控, 在肿瘤发生、发展过程中发挥重要作用, 其与肿瘤耐药也密切相关, 研究发现可通过调控miRNA对肿瘤进行有效的治疗, 目前miRNA已经成为肿瘤领域的研究热点[1,2,6]. 近年来miR-34家族备受关注, 其成员可以作为人类癌症预后的标志物及治疗的靶点[7,8]. miR-34a作为其家族成员之一, 在转录过程受p53基因的诱导调节, p53可内在激活miR-34a的表达, 研究[9]报道肿瘤细胞染色体杂合性缺失、p53基因突变及启动子区域CpG岛甲基化均可导致miR-34a表达水平降低, 进而通过下游的靶基因参与肿瘤细胞增殖、周期阻滞、细胞凋亡的调控. 研究[10-12]显示miR-34a具有诱导癌细胞的细胞周期G1期阻滞及细胞凋亡作用, 能够抑制癌细胞的侵袭迁移, 而且能够通过靶向调控CD44抑制肿瘤血管的生成, miR-34a被看作是一类新的抑癌基因.
研究[13-17]报道miR-34a在胃癌、肝细胞癌、乳腺癌、肾癌及前列腺癌等恶性肿瘤或其细胞系中表达明显下调, miR-34a的表达与肿瘤的淋巴结转移及分期显著相关. miR-34a还与膀胱移行细胞癌、胃癌等恶性肿瘤的复发密切相关[18,19]. miR-34a可通过下调癌细胞血管内皮生长因子(vascular endothelial growth factor, VEGF)、E2F3、SIRT1等基因的表达参与肿瘤血管生成的调节, miR-34a可能成为肿瘤患者预后的生物学标记[3]. 国外学者研究[20,21]发现在45.1%的结肠癌组织中存在miR-34a的甲基化, 启动子的甲基化导致miR-34a表达水平显著降低, miR-34a的表达与结肠癌的肝转移及淋巴结转移密切相关, 联合检测miR-34a及c-Met、β-catenin的表达对于结肠癌有预警价值. Wu等[22]也报道miR-34a在结肠癌组织的表达水平显著低于癌旁结肠黏膜, 而且在发生淋巴结转移的结肠癌组的miR-34a表达水平明显低于未发生淋巴结转移组. miR-34a的功能缺失使结肠癌细胞异常增殖, 导致结肠癌的进展[23].
我们应用实时定量PCR方法检测miR-34a在结肠癌及癌旁正常结肠黏膜组织中的表达, 结果发现miR-34在结肠癌组织中的表达水平明显低于其在癌旁正常结肠黏膜组织中的表达水平(P<0.05), 与既往研究结果相一致. 为了观察miR-34a在不同分化程度结肠癌细胞株中的差异, 我们检测miR-34a在高、中、低分化结肠癌细胞株的表达情况, 结果显示在低分化结肠癌细胞株Lovo中miR-34a的表达水平显著低于高分化结肠癌细胞株HT29及中分化结肠癌细胞株SW620中的表达水平(P<0.05). 研究从结肠癌组织及结肠癌细胞株层面观察了miR-34a表达的差异, 结果提示miR-34a可能在结肠癌的发生发展中发挥抑癌基因的功能, 为今后深入研究调控miR-34a表达对结肠癌细胞生物学行为的影响及作用机制奠定基础. 本研究还分析了miR-34a与结肠癌患者临床病理参数之间的关系, 结果发现发生低分化、浸润深度达浆膜、淋巴结转移、分期为Ⅲ-Ⅳ期的结肠癌组中miR-34a表达水平分别低于其在高中分化、浸润深度未及浆膜、未发生淋巴结转移和分期为Ⅰ-Ⅱ期结肠癌组中的表达水平, 与miR-34a在结肠癌细胞株中的表达结果一致, 提示miR-34a在结肠癌中低表达, 可能参与与结肠癌的发生发展. Liu等[24]研究发现miR-34a可通过抑制上皮生长因子受体(epidermal growth factor receptor, EGFR)信号通路调节基质金属蛋白酶7(matrix metalloproteinases 7, MMP-7)的表达, 进而调控胃癌细胞的侵袭转移力. 在人肾癌细胞中的研究[25]显示miR-34a通过靶向调控CD44的表达抑制肾癌细胞的生长及转移. miR-34a是通过何种机制促进结肠癌的侵袭转移尚不清楚, 有待于进一步研究.
研究[26]认为miR-34a的低表达与p53基因突变一致, 因此针对p53基因突变和/或miR-34a表达的调控将对癌症的治疗产生潜在的影响. 有报道miR-34a的异常表达在人乳腺癌细胞阿霉素耐药中发挥作用, 使miR-34a表达增高可通过靶向调控Notch1的表达增加乳腺癌细胞对阿霉素的药物敏感性[27]. 另有报道检测miR-34a能预测肿瘤是否出现治疗抵抗, 体外实验研究结果显示恢复或上调miR-34a的表达及功能可以预防肿瘤细胞对化疗药物的抵抗[11]. 小分子激活剂Rubone可激活miR-34a的表达, 抑制肿瘤的生长[28], 二氟化姜黄素可抑制结肠癌细胞株的生长, 与上调miR-34a的表达有关[21]. 结肠癌SW480细胞株稳定表达miR-34a可导致癌细胞的侵袭与迁移能力明显降低, 而且miR-34a可通过特异性调节Sirtuin 1/p53通路增加SW480细胞对5-氟尿嘧啶的敏感性[29]. 动物实验研究[30]显示miR-34a的过表达可抑制裸鼠移植瘤的生长及血管生成, 而且miR-34a是通过阻断VEGF的生成直接抑制肿瘤血管内皮细胞的功能发挥抑制肿瘤血管生成的作用. 因此, 随着对miR-34a研究的不断深入, miR-34a除了有望为临床上判断结肠癌进展提供一个有效的指标, 同时可为临床治疗肿瘤提供新的策略和靶点.
结肠癌的发生与k-ras、p53等基因突变有关, microRNA-34a(miR-34a)在转录过程受p53基因的诱导调节, p53内在激活miR-34a的表达. 肿瘤细胞p53基因突变及启动子区域CpG岛甲基化可导致miR-34a表达水平降低, 进而通过下游靶基因参与肿瘤细胞增殖、细胞周期及凋亡的调控, miR-34a被看作是一类新的抑癌基因.
姜又红, 教授, 研究员, 中国医科大学附属第一医院
国内外大量研究显示miR-34a与恶性肿瘤发生、发展及复发等密切相关, miR-34a在结肠癌组织中低表达, 其功能缺失使结肠癌细胞异常增殖, 促进其进展. 而miR-34a稳定高表达可预防肿瘤细胞对化疗药物的抵抗、增高对化疗药物的敏感性. 调控miR-34a的表达可对结肠癌治疗产生潜在的影响, 为临床治疗药物的研发提供新的思路.
国外研究发现在45.1%的结肠癌组织中存在miR-34a的甲基化, 启动子的甲基化导致miR-34a表达水平显著降低, miR-34a表达与结肠癌肝转移及淋巴结转移密切相关, 联合检测miR-34a及c-Met、β-catenin的表达对于结肠癌有预警价值.
检测结肠癌组织中miR-34a的表达, 可为临床判断结肠癌进展及预后提供一个有效的指标. 随着研究的深入, miR-34a有望为临床治疗结肠癌提供新的靶点.
微小RNA(miRNA): 是一类非编码小分子RNA, 通过与靶基因序列特异性结合, 在细胞增殖、分化、凋亡等生理和病理过程中发挥重要作用, 而且与肿瘤的发生、发展及肿瘤的耐药、治疗等密切相关.
该研究方法和研究结果表述较规范, 文章书写比较流畅, 研究具有一定的学术价值和实用价值.
编辑: 韦元涛 电编:闫晋利
| 1. | Taylor MA, Schiemann WP. Therapeutic Opportunities for Targeting microRNAs in Cancer. Mol Cell Ther. 2014;2:1-13. [PubMed] [DOI] |
| 2. | Thorsen SB, Obad S, Jensen NF, Stenvang J, Kauppinen S. The therapeutic potential of microRNAs in cancer. Cancer J. 2012;18:275-284. [PubMed] [DOI] |
| 3. | Maroof H, Salajegheh A, Smith RA, Lam AK. Role of microRNA-34 family in cancer with particular reference to cancer angiogenesis. Exp Mol Pathol. 2014;97:298-304. [PubMed] [DOI] |
| 4. | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013. CA Cancer J Clin. 2013;63:11-30. [PubMed] [DOI] |
| 5. | Hsieh JS, Lin SR, Chang MY, Chen FM, Lu CY, Huang TJ, Huang YS, Huang CJ, Wang JY. APC, K-ras, and p53 gene mutations in colorectal cancer patients: correlation to clinicopathologic features and postoperative surveillance. Am Surg. 2005;71:336-343. [PubMed] |
| 6. | Zhang B, Pan X, Cobb GP, Anderson TA. microRNAs as oncogenes and tumor suppressors. Dev Biol. 2007;302:1-12. [PubMed] [DOI] |
| 7. | Wang R, Ma J, Wu Q, Xia J, Miele L, Sarkar FH, Wang Z. Functional role of miR-34 family in human cancer. Curr Drug Targets. 2013;14:1185-1191. [PubMed] [DOI] |
| 8. | Maroof H, Salajegheh A, Smith RA, Lam AK. MicroRNA-34 family, mechanisms of action in cancer: a review. Curr Cancer Drug Targets. 2014;14:737-751. [PubMed] [DOI] |
| 9. | Chang TC, Wentzel EA, Kent OA, Ramachandran K, Mullendore M, Lee KH, Feldmann G, Yamakuchi M, Ferlito M, Lowenstein CJ. Transactivation of miR-34a by p53 broadly influences gene expression and promotes apoptosis. Mol Cell. 2007;26:745-752. [PubMed] [DOI] |
| 10. | Lodygin D, Tarasov V, Epanchintsev A, Berking C, Knyazeva T, Körner H, Knyazev P, Diebold J, Hermeking H. Inactivation of miR-34a by aberrant CpG methylation in multiple types of cancer. Cell Cycle. 2008;7:2591-2600. [PubMed] [DOI] |
| 11. | Hermeking H. The miR-34 family in cancer and apoptosis. Cell Death Differ. 2010;17:193-199. [PubMed] [DOI] |
| 12. | Yu G, Yao W, Xiao W, Li H, Xu H, Lang B. MicroRNA-34a functions as an anti-metastatic microRNA and suppresses angiogenesis in bladder cancer by directly targeting CD44. J Exp Clin Cancer Res. 2014;33:779. [PubMed] [DOI] |
| 13. | Stánitz E, Juhász K, Tóth C, Gombos K, Natali PG, Ember I. Evaluation of MicroRNA expression pattern of gastric adenocarcinoma associated with socioeconomic, environmental and lifestyle factors in northwestern Hungary. Anticancer Res. 2013;33:3195-3200. [PubMed] |
| 14. | Dang Y, Luo D, Rong M, Chen G. Underexpression of miR-34a in hepatocellular carcinoma and its contribution towards enhancement of proliferating inhibitory effects of agents targeting c-MET. PLoS One. 2013;8:e61054. [PubMed] [DOI] |
| 15. | Li L, Xie X, Luo J, Liu M, Xi S, Guo J, Kong Y, Wu M, Gao J, Xie Z. Targeted expression of miR-34a using the T-VISA system suppresses breast cancer cell growth and invasion. Mol Ther. 2012;20:2326-2334. [PubMed] [DOI] |
| 16. | Vogt M, Munding J, Grüner M, Liffers ST, Verdoodt B, Hauk J, Steinstraesser L, Tannapfel A, Hermeking H. Frequent concomitant inactivation of miR-34a and miR-34b/c by CpG methylation in colorectal, pancreatic, mammary, ovarian, urothelial, and renal cell carcinomas and soft tissue sarcomas. Virchows Arch. 2011;458:313-322. [PubMed] [DOI] |
| 17. | Fujita Y, Kojima K, Hamada N, Ohhashi R, Akao Y, Nozawa Y, Deguchi T, Ito M. Effects of miR-34a on cell growth and chemoresistance in prostate cancer PC3 cells. Biochem Biophys Res Commun. 2008;377:114-119. [PubMed] [DOI] |
| 18. | Andrew AS, Marsit CJ, Schned AR, Seigne JD, Kelsey KT, Moore JH, Perreard L, Karagas MR, Sempere LF. Expression of tumor suppressive microRNA-34a is associated with a reduced risk of bladder cancer recurrence. Int J Cancer. 2014; Dec 29. [Epub ahead of print]. [PubMed] [DOI] |
| 19. | Zhang H, Li S, Yang J, Liu S, Gong X, Yu X. The prognostic value of miR-34a expression in completely resected gastric cancer: tumor recurrence and overall survival. Int J Clin Exp Med. 2015;8:2635-2641. [PubMed] |
| 20. | Siemens H, Neumann J, Jackstadt R, Mansmann U, Horst D, Kirchner T, Hermeking H. Detection of miR-34a promoter methylation in combination with elevated expression of c-Met and β-catenin predicts distant metastasis of colon cancer. Clin Cancer Res. 2013;19:710-720. [PubMed] [DOI] |
| 21. | Roy S, Levi E, Majumdar AP, Sarkar FH. Expression of miR-34 is lost in colon cancer which can be re-expressed by a novel agent CDF. J Hematol Oncol. 2012;5:58. [PubMed] [DOI] |
| 22. | Wu J, Wu G, Lv L, Ren YF, Zhang XJ, Xue YF, Li G, Lu X, Sun Z, Tang KF. MicroRNA-34a inhibits migration and invasion of colon cancer cells via targeting to Fra-1. Carcinogenesis. 2012;33:519-528. [PubMed] [DOI] |
| 23. | Tazawa H, Tsuchiya N, Izumiya M, Nakagama H. Tumor-suppressive miR-34a induces senescence-like growth arrest through modulation of the E2F pathway in human colon cancer cells. Proc Natl Acad Sci U S A. 2007;104:15472-15477. [PubMed] [DOI] |
| 24. | Liu G, Jiang C, Li D, Wang R, Wang W. MiRNA-34a inhibits EGFR-signaling-dependent MMP7 activation in gastric cancer. Tumour Biol. 2014;35:9801-9806. [PubMed] [DOI] |
| 25. | Yu G, Li H, Wang J, Gumireddy K, Li A, Yao W, Tang K, Xiao W, Hu J, Xiao H. miRNA-34a suppresses cell proliferation and metastasis by targeting CD44 in human renal carcinoma cells. J Urol. 2014;192:1229-1237. [PubMed] [DOI] |
| 26. | Wong MY, Yu Y, Walsh WR, Yang JL. microRNA-34 family and treatment of cancers with mutant or wild-type p53 (Review). Int J Oncol. 2011;38:1189-1195. [PubMed] [DOI] |
| 27. | Li XJ, Ji MH, Zhong SL, Zha QB, Xu JJ, Zhao JH, Tang JH. MicroRNA-34a modulates chemosensitivity of breast cancer cells to adriamycin by targeting Notch1. Arch Med Res. 2012;43:514-521. [PubMed] [DOI] |
| 28. | Xiao Z, Li CH, Chan SL, Xu F, Feng L, Wang Y, Jiang JD, Sung JJ, Cheng CH, Chen Y. A small-molecule modulator of the tumor-suppressor miR34a inhibits the growth of hepatocellular carcinoma. Cancer Res. 2014;74:6236-6247. [PubMed] [DOI] |
| 29. | Lai M, Du G, Shi R, Yao J, Yang G, Wei Y, Zhang D, Xu Z, Zhang R, Li Y. MiR-34a inhibits migration and invasion by regulating the SIRT1/p53 pathway in human SW480 cells. Mol Med Rep. 2015;11:3301-3307. [PubMed] [DOI] |