修回日期: 2015-06-03
接受日期: 2015-07-06
在线出版日期: 2015-08-08
目的: 探讨婚育因素对中国女性食管鳞状细胞癌患者术后生存预后影响.
方法: 12041例女性食管癌患者信息均来自河南省食管癌重点开放实验室食管癌数据库, 患者均经组织病理学证实为食管鳞状细胞癌且有翔实婚育史记录及完整临床病理资料. 通过调查问卷、家访、电话问询方式进行患者生存随访. Kaplan-Meier生存曲线及Cox生存分析模型分析不同婚育因素对女性食管鳞癌患者预后影响.
结果: 校正年龄、职业、吸烟、饮酒、体质量指数和肿瘤病理分期等可能混杂因素后Cox多因素生存分析显示怀孕次数多女性预后较好(RR = 1.49, 95%CI: 1.16-1.92), 分层分析发现该生存优势也存在于高发区女性(RR = 1.41, 95%CI: 1.03-1.86)及食管癌家族史阴性女性(RR = 1.21, 95%CI: 1.04-1.41). 绝经前期女性预后明显优于围绝经期和绝经后期女性患者(P = 0.00), 尤其是来自于高发区(RR = 0.73, 95%CI: 0.62-0.86)和家族史阴性绝经前期女性(RR = 0.70, 95%CI: 0.58-0.85).
结论: 怀孕次数和经期状态可能是中国女性食管鳞癌患者术后预后影响因素, 怀孕次数多女性及绝经前期女性患者术后预后较好.
核心提示: 本研究首次报道了婚育因素对中国女性食管鳞癌患者生存预后的影响, Cox多因素生存分析结果显示经期状态和怀孕次数与女性食管癌患者预后相关, 绝经前期女性、怀孕次数多女性食管鳞癌患者术后预后较好.
引文著录: 张冬云, 刘冉, 库建伟, 刘安丽, 赵学科, 张朋, 王静, 李寅, 吴红芳, 王立东. 婚育因素对中国女性食管鳞状细胞癌患者的生存影响. 世界华人消化杂志 2015; 23(22): 3517-3525
Revised: June 3, 2015
Accepted: July 6, 2015
Published online: August 8, 2015
AIM: To determine the effects of reproductive and menstrual factors on the survival of women with esophageal squamous cell carcinoma (ESCC).
METHODS: A total of 12041 Chinese women with ESCC were enrolled in this study, and their median age was 61 years. All patients' information was retrieved from the esophageal cancer database of Henan Key Laboratory for Esophageal Cancer Research based on the records of reproduction and menstrual history. The menopausal status was categorized as pre-, peri- and post-menopausal. Questionnaire, home interview and/or telephone were performed for survival follow-up. Cox proportional hazards regression models were used for analysis of relative risks (RRs) and 95% confidence intervals (95%CIs) to determine the effects of reproductive and menstrual factors on ESCC survival.
RESULTS: Survival analysis demonstrated that patients with increased number of pregnancy had a longer survival (RR = 1.49, 95%CI: 1.16-1.92); the prolonged survival remained in patients from the high incidence area (RR = 1.41, 95%CI: 1.03-1.86) and in patients with a negative family history (RR = 1.21, 95%CI: 1.04-1.41). Pre-menopausal patients had a longer survival than peri- and postmenopausal patients (P = 0.00); this remained in patients from the high incidence area (RR for post- vs pre-menopausal, 0.73, 95%CI: 0.62-0.86) and in patients with a negative family history (RR = 0.70, 95%CI: 0.58-0.85).
CONCLUSION: Increasing number of pregnancy and premenopausal status may be favorable factors for ESCC survival in Chinese women with ESCC.
- Citation: Zhang DY, Liu R, Ku JW, Liu AL, Zhao XK, Zhang P, Wang J, Li Y, Wu HF, Wang LD. Effects of reproductive and menstrual factors on survival of women with esophageal squamous cell carcinoma. Shijie Huaren Xiaohua Zazhi 2015; 23(22): 3517-3525
- URL: https://www.wjgnet.com/1009-3079/full/v23/i22/3517.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i22.3517
中国是世界上食管癌发病率和死亡率最高的国家之一, 男性高发于女性, 且主要组织学类型为食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)[1]. 令人惊奇的是, 女性ESCC患者预后好于男性[2]. 国外关于食管癌[3,4]和其他癌症研究[5-7]也发现了癌症患者预后存在有性别间生存差异, 这提示除了吸烟、饮酒外, 男女间性激素不同可能在癌症发生、发展及预后中起一定作用. 研究发现高水平雌激素、孕激素浓度能降低上消化系肿瘤(头、颈、食管、胃)发生率[8]. 我们实验室以前研究[9,10]也显示出女性激素在食管癌发展中的保护作用及部分解释了食管癌发病率男性高于女性.
女性一生中, 经期状态、初潮年龄、怀孕次数、生产次数、初次生育孩子年龄等婚育因素会影响女性体内性激素水平. 越来越多研究证据显示婚育因素与癌症发病风险相关, 诸如食管癌[11-15]、胃癌[16,17]及胃贲门交接部腺癌[18]. 但这些能影响女性体内激素水平的婚育因素除了与癌症发病风险有关外, 是否影响女性食管癌患者预后, 至今国内研究尚无定论. 本研究主要是通过来自中国食管癌高、低发区的大样本人群研究, 探讨婚育因素对中国女性食管癌患者术后是否存在生存预后影响.
从河南省食管癌重点开放实验室已建立的生存随访食管癌资料库中, 根据生存随访结果及翔实的婚育史记录, 最终12041例女性ESCC患者进入最终分析. 依据经期状态划分标准, 其中绝经前期女性患者539例(4.5%), 中位诊断年龄42岁; 围绝经期患者2527例(20.9%), 中位诊断年龄52岁; 绝经后期患者8975例(74.6%), 中位诊断年龄64岁. 中位生存时间分别为12.3、9.0和4.8年.
1.2.1 人群生存随访、临床信息复核: 通过对河南省安阳市、林州市、河北省磁县、山西省长治市、四川省盐亭县及广东南澳岛等中国食管癌高发区及部分低发区进行食管癌现场流行病学调查, 确定食管患者, 进行入户问卷调查和生存随访, 记录患者一般资料(年龄, 性别, 家族史, 治疗医院等)、婚育因素(初潮年龄、初次生育年龄、怀孕次数、生孩子数目等). 随访截止时间为2013-12-15. 同时到相应治疗医院对患者临床病理资料(以病理诊断为准)包括患者确诊时间、病理诊断、组织类型、分化程度、TNM分期、淋巴结转移、治疗情况(外科手术、化疗、放疗)等进行复核, 未找到原始住院记录者, 不进入最终分析. 该研究已通过郑州大学第一临床学院医学研究伦理委员会批准.
1.2.2 经期状态划分标准: 本研究是基于大样本量回顾性研究, 无法得到所有患者绝经期年龄, 参考国际上关于经期状态划分标准[19], 结合中国女性一生中性激素水平变化实际情况[20,21], 我们依据患者首次确诊年龄划分为绝经前期、围绝经期和绝经后期. 其中绝经前期: 患者首次确诊年龄≤45岁; 围绝经期: 患者首次确诊年龄46-55岁; 绝经后期: 患者首次确诊年龄≥56岁.
统计学处理 采用SPSS19.0统计软件处理数据, 组间比较采用χ2检验, Kaplan-Meier生存分析、Cox多因素回归模型分析婚育因素与患者生存时间关系, 检验标准取α = 0.05. P<0.05为差异具有统计学意义.
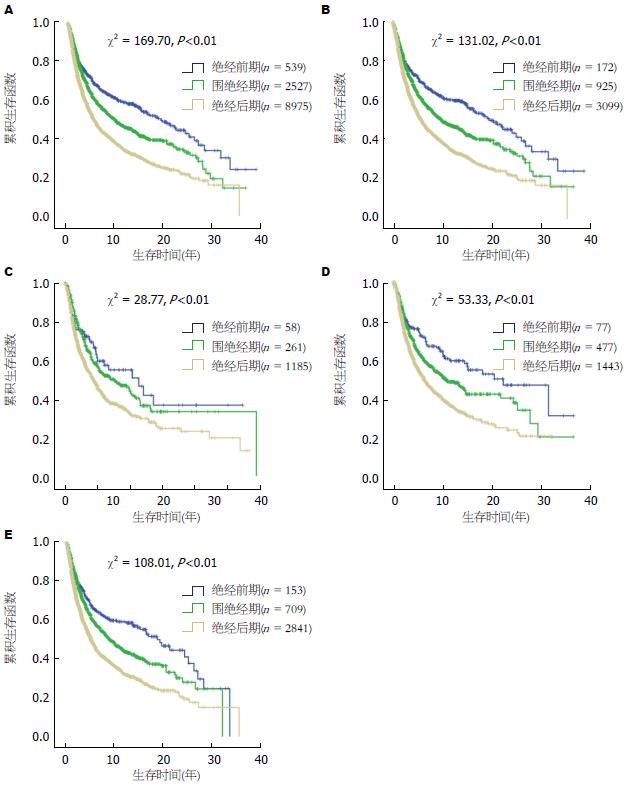
K-M生存分析显示绝经前期女性患者预后依次优于围绝经期、绝经后期女性患者(P = 0.00). 高发区、低发区的绝经前期女性, 家族史阳性、家族史阴性的绝经前期女性均显示出了这种生存优势(P = 0.00、0.00、0.00、0.00)(图1).
2.2.1 依据经期状态对女性患者进行Cox多因素生存分析: 表1显示在对所有女性ESCC患者校正年龄、职业、吸烟、饮酒、体质量指数和肿瘤病理分期等可能混杂因素后, Cox多因素生存分析显示怀孕次数多女性预后好于怀孕次数少女性(≥6次 vs ≤2次)(RR = 1.49, 95%CI: 1.16-1.92). 绝经年龄(≥56岁 vs ≤45岁)(RR = 1.21, 95%CI: 0.93-1.56), 初潮年龄(≥17岁 vs ≤14岁)(RR = 1.03, 95%CI: 0.92-1.14), 生产孩子数目(≥6个 vs ≤2个)(RR = 1.09, 95%CI: 0.85-1.34)与女性ESCC患者预后无关. 对绝经前期女性来说, 初次生育年龄早者预后好(≥25岁 vs ≤20岁)(RR = 0.51, 95%CI: 0.27-0.95), 围绝经期和绝经后期女性不显示这种生存优势(≥25岁 vs ≤20岁)(RR = 0.91、1.11, 95%CI: 0.70-1.17、0.95-1.33).
| 危险因素 | 绝经前期(n = 230) | 围绝经期(n = 1186) | 绝经后期(n = 4284) | ||||||||||||
| n | RR | 95%CI | χ2值 | P值 | n | RR | 95%CI | χ2值 | P值 | n | RR | 95%CI | χ2值 | P值 | |
| 初潮年龄(岁) | 1.84 | 0.18 | 0.16 | 0.69 | 1.49 | 0.21 | |||||||||
| ≤14 | 56 | ref | 284 | ref | 1134 | ref | |||||||||
| 15-16 | 86 | 1.68 | 0.87-3.27 | 385 | 1.02 | 0.83-1.31 | 1535 | 1.04 | 0.92-1.13 | ||||||
| ≥17 | 88 | 1.71 | 0.97-3.01 | 517 | 1.07 | 0.87-1.32 | 1615 | 1.01 | 0.91-1.13 | ||||||
| 初次生育年龄(岁) | 0.06 | 0.81 | 0.75 | 0.38 | 4.79 | 0.03 | |||||||||
| ≤20 | 13 | ref | 112 | ref | 993 | ref | |||||||||
| 21-22 | 78 | 0.91 | 0.26-2.85 | 343 | 0.95 | 0.71-1.45 | 1546 | 0.91 | 0.74-1.09 | ||||||
| 23-24 | 91 | 0.72 | 0.34-1.49 | 437 | 1.01 | 0.64-1.38 | 1308 | 0.99 | 0.83-1.16 | ||||||
| ≥25 | 48 | 0.51 | 0.27-0.95 | 294 | 0.91 | 0.70-1.17 | 437 | 1.11 | 0.95-1.33 | ||||||
| 怀孕次数(次) | 0.15 | 0.71 | 2.69 | 0.01 | 1.37 | 0.24 | |||||||||
| 1-2 | 89 | ref | 320 | ref | 522 | ref | |||||||||
| 3 | 66 | 0.91 | 0.21-3.11 | 351 | 1.51 | 0.99-2.11 | 851 | 1.24 | 0.79-1.92 | ||||||
| 4 | 41 | 1.53 | 0.38-6.11 | 253 | 1.36 | 0.98-1.86 | 1041 | 1.34 | 0.97-1.84 | ||||||
| 5 | 17 | 1.42 | 0.33-5.31 | 141 | 0.98 | 0.71-1.39 | 871 | 1.10 | 0.87-1.34 | ||||||
| ≥6 | 17 | 1.97 | 0.44-8.07 | 121 | 0.84 | 0.56-1.25 | 999 | 1.11 | 0.91-1.36 | ||||||
| 绝经年龄 (岁) | 0.01 | 0.91 | 0.46 | 0.51 | 0.39 | 0.47 | |||||||||
| ≤45 | 176 | ref | 209 | ref | 666 | ref | |||||||||
| 46-55 | 47 | 1.04 | 0.23-4.64 | 962 | 1.48 | 0.59-3.66 | 3491 | 1.07 | 0.83-1.41 | ||||||
| ≥56 | 7 | 1.24 | 0.27-5.73 | 15 | 1.35 | 0.55-3.32 | 127 | 1.17 | 0.91-1.52 | ||||||
| 生产孩子数目(个) | 0.14 | 0.71 | 0.38 | 0.54 | 1.01 | 0.04 | |||||||||
| 1-2 | 112 | ref | 403 | ref | 604 | ref | |||||||||
| 3 | 77 | 0.79 | 0.12-5.14 | 429 | 1.12 | 0.54-2.28 | 969 | 1.31 | 1.10-1.55 | ||||||
| 4 | 32 | 0.39 | 0.31-2.81 | 221 | 0.75 | 0.43-1.39 | 1157 | 1.17 | 1.01-1.35 | ||||||
| 5 | 2 | 0.56 | 0.09-3.32 | 86 | 0.85 | 0.58-1.65 | 819 | 1.30 | 1.13-1.49 | ||||||
| ≥6 | 7 | 1.04 | 0.06-3.79 | 47 | 0.59 | 0.32-1.12 | 735 | 1.28 | 1.11-1.47 | ||||||
2.2.2 依据食管癌高、低发区对女性患者进行Cox多因素分层分析: 表2中可以看出与绝经前期女性ESCC患者相比, 食管癌高发区绝经后期女性患者预后差于绝经前期和围绝经期女性患者(RR = 0.73; 95%CI: 0.62-0.86). 同时还发现在Cox多因素分层分析中虽然下述结果没有达到统计学意义, 但组内比较显示高发区怀孕次数多(≥6次 vs ≤2次)(RR = 1.41, 95%CI: 1.03-1.86)、生产孩子数目多(≥6个 vs ≤2个)(RR = 1.22; 95%CI: 1.04-1.43)及初次生育年龄早(RR = 0.78, 95%CI: 0.79-1.01)女性, 预后相对较好. 低发区的女性ESCC患者术后不存在这种生存优势(RR = 1.44、0.99、0.83; 95%CI: 0.92-2.44、0.52-1.36、0.63-1.13).
| 危险因素 | 高发区 (n = 4196) | 低发区 (n = 1504) | ||||||||
| n | RR | 95%CI | χ2值 | P值 | n | RR | 95%CI | χ2值 | P值 | |
| 经期状态 | 15.37 | 0.00 | 0.11 | 0.74 | ||||||
| 绝经前期 | 172 | ref | 58 | ref | ||||||
| 围绝经期 | 925 | 0.72 | 0.56-1.15 | 261 | 0.68 | 0.33-1.43 | ||||
| 绝经后期 | 3099 | 0.73 | 0.62-0.86 | 1185 | 0.88 | 0.64-1.21 | ||||
| 初潮年龄(岁) | 0.91 | 0.34 | 1.87 | 0.07 | ||||||
| ≤14 | 835 | ref | 639 | ref | ||||||
| 15-16 | 1536 | 0.95 | 0.84-1.07 | 470 | 1.16 | 0.98-1.39 | ||||
| ≥17 | 1825 | 1.05 | 0.95-1.17 | 395 | 0.92 | 0.75-1.15 | ||||
| 初次生育年龄(岁) | 1.57 | 0.21 | 1.56 | 0.14 | ||||||
| ≤20 | 822 | ref | 296 | ref | ||||||
| 21-22 | 1499 | 0.78 | 0.79-1.01 | 468 | 0.83 | 0.63-1.13 | ||||
| 23-24 | 1327 | 0.89 | 0.66-0.91 | 509 | 0.97 | 0.72-1.21 | ||||
| ≥25 | 548 | 1.01 | 0.89-1.15 | 231 | 0.99 | 0.77-1.29 | ||||
| 怀孕次数(次) | 2.67 | 0.10 | 1.61 | 0.21 | ||||||
| 1-2 | 662 | ref | 269 | ref | ||||||
| 3 | 922 | 1.18 | 0.83-1.69 | 346 | 1.44 | 0.66-3.14 | ||||
| 4 | 968 | 1.06 | 0.86-1.30 | 367 | 1.75 | 0.89-3.23 | ||||
| 5 | 768 | 1.11 | 0.87-1.41 | 261 | 1.20 | 0.76-1.89 | ||||
| ≥6 | 876 | 1.41 | 1.03-1.86 | 261 | 1.44 | 0.92-2.44 | ||||
| 绝经年龄(岁) | 0.29 | 0.58 | 0.02 | 0.27 | ||||||
| ≤45 | 808 | ref | 243 | ref | ||||||
| 46-55 | 3274 | 1.11 | 0.81-1.51 | 1226 | 0.99 | 0.59-1.68 | ||||
| ≥56 | 114 | 1.21 | 0.90-1.64 | 35 | 0.97 | 0.59-1.59 | ||||
| 生产孩子数目(个) | 0.03 | 0.86 | 0.51 | 0.48 | ||||||
| 1-2 | 817 | ref | 302 | ref | ||||||
| 3 | 1100 | 1.42 | 1.20-1.69 | 375 | 0.89 | 0.62-1.82 | ||||
| 4 | 1004 | 1.18 | 1.01-1.38 | 406 | 0.87 | 0.57-1.34 | ||||
| 5 | 677 | 1.24 | 1.06-1.44 | 230 | 1.01 | 0.69-1.47 | ||||
| ≥6 | 598 | 1.22 | 1.04-1.43 | 191 | 0.99 | 0.52-1.36 | ||||
2.2.3 依据食管癌患者家族史阳性、阴性对女性患者进行Cox多因素分层分析: 表3显示食管癌家族史阴性的女性患者中, 绝经后期女性预后差(RR = 0.70, 95%CI: 0.58-0.85), 怀孕次数多女性预后较好(RR = 1.21, 95%CI: 1.04-1.41); 在家族史阳性女性ESCC患者中, 生产孩子多者预后较好(RR = 1.30, 95%CI: 1.02-1.66).
| 危险因素 | 家族史阳性 (n = 1997) | 家族史阴性 (n = 3703) | ||||||||
| n | RR | 95%CI | χ2值 | P值 | n | RR | 95%CI | χ2值 | P值 | |
| 经期状态 | 0.24 | 0.62 | 15.32 | 0.00 | ||||||
| 绝经前期 | 77 | ref | 153 | ref | ||||||
| 围绝经期 | 477 | 1.37 | 0.77-2.42 | 709 | 0.54 | 0.37-0.81 | ||||
| 绝经后期 | 1443 | 0.94 | 0.81-1.37 | 2841 | 0.70 | 0.58-0.85 | ||||
| 初潮年龄(岁) | 0.41 | 0.52 | 5.01 | 0.02 | ||||||
| ≤14 | 421 | ref | 1053 | ref | ||||||
| 15-16 | 696 | 0.91 | 0.86-1.22 | 1310 | 1.14 | 1.01-1.28 | ||||
| ≥17 | 880 | 1.12 | 0.86-1.18 | 1340 | 1.05 | 0.89-1.17 | ||||
| 初次生育年龄(岁) | 1.81 | 0.13 | 0.95 | 0.33 | ||||||
| ≤20 | 393 | ref | 725 | ref | ||||||
| 21-22 | 656 | 0.88 | 0.69-1.13 | 1311 | 0.91 | 0.75-1.10 | ||||
| 23-24 | 663 | 0.99 | 0.88-1.28 | 1173 | 0.95 | 0.81-1.12 | ||||
| ≥25 | 285 | 1.10 | 0.98-1.39 | 494 | 0.96 | 0.87-1.14 | ||||
| 怀孕次数(次) | 1.26 | 0.02 | 2.78 | 0.00 | ||||||
| 1-2 | 338 | ref | 593 | ref | ||||||
| 3 | 428 | 1.32 | 0.73-2.24 | 840 | 1.36 | 1.16-1.62 | ||||
| 4 | 484 | 1.31 | 0.71-1.93 | 851 | 1.29 | 1.10-1.51 | ||||
| 5 | 334 | 0.97 | 0.71-1.34 | 695 | 1.24 | 1.07-1.44 | ||||
| ≥6 | 413 | 0.99 | 0.74-1.33 | 724 | 1.21 | 1.04-1.41 | ||||
| 绝经年龄(岁) | 0.01 | 0.63 | 0.33 | 0.49 | ||||||
| ≤45 | 375 | ref | 676 | ref | ||||||
| 46-55 | 1568 | 1.26 | 0.79-2.04 | 2932 | 1.03 | 0.75-1.43 | ||||
| ≥56 | 54 | 1.35 | 0.89-2.09 | 95 | 1.12 | 0.82-1.51 | ||||
| 生产孩子数目(个) | 0.01 | 0.92 | 0.22 | 0.63 | ||||||
| 1-2 | 409 | ref | 710 | ref | ||||||
| 3 | 533 | 1.47 | 1.15-1.91 | 942 | 1.11 | 0.73-1.69 | ||||
| 4 | 502 | 1.16 | 0.92-1.48 | 908 | 0.77 | 0.55-1.01 | ||||
| 5 | 290 | 1.35 | 1.08-1.70 | 617 | 0.95 | 0.71-1.27 | ||||
| ≥6 | 263 | 1.30 | 1.02-1.66 | 526 | 0.99 | 0.76-1.28 | ||||
本研究结果显示绝经前期女性预后好于围绝经期和绝经后期女性, 这也进一步提示女性体内性激素水平及浓度的不同可能对不同经期状态女性食管癌术后的生存差异起一定作用. 女性一生中, 绝经前期体内性激素浓度维持高水平, 经历周期性波动后(围绝经期), 降低到一个较低水平状态(绝经后期)[22]. 采用激素疗法治疗的绝经后期女性, 与未采用激素疗法的绝经后期女性相比, 食管癌发病风险明显降低[23].
关于婚育因素与消化系肿瘤发病风险关系研究[13], 国外已有诸多报道. 英国一项研究显示经期状态和绝经年龄与食管癌、胃癌发病风险相关; 美国等研究显示有哺乳史的女性, 食管癌和胃-贲门交接部腺癌发病风险降低[18,24], 来自意大利及瑞典的研究也显示生产孩子多者食管鳞癌发病风险下降[15,25]. 但是, 瑞典另外一项病例-对照研究却发现女性生育史与食管腺癌发病风险无关[26]. 先不探究出现这种不一致结果的原因, 但就由于种族的差异及所发生食管癌组织学类型的不同, 这些研究结果就并不完全适用于中国女性患者. 食管癌发生的主要组织学类型有食管鳞状细胞癌和食管腺癌, 中国主要好发食管鳞状细胞癌, 而西方国家以腺癌高发为主.
国内关于婚育因素与消化系肿瘤发病风险关系研究也存有不一致甚至相反结论. 一项研究发现绝经年龄晚, 有哺乳史者食管癌发病风险下降[12]; 另一项研究发现初次生育年龄晚者, 食管鳞癌发病风险增高[14]; 而另一项类似研究显示婚育因素与食管鳞癌或腺癌发病无关[11]. 研究者实验设计不同、样本量大小、样本来源不同及统计能力的受限等部分解释了相似研究为什么却存在有不同研究结果的原因. 此外, 这些研究样本量多在25-600之间, 随访时间短, 文章中很少提及与生存关系研究, 更不要说对患者进行进一步的多因素生存分层分析研究.
本研究通过对大样本人群进行生存分析研究, 首次揭示了与怀孕次数少的中国女性ESCC患者相比, 怀孕次数多女性患者预后较好; 分层分析显示来自食管癌高发区女性及家族史阴性女性患者存在有这种明显生存优势. 这强烈提示孕育能影响女性体内激素环境, 使体内雌、孕激素持续维持在一个高水平状态.我们实验室以前的研究结果显示正常食管上皮中虽无性激素受体表达, 但食管鳞癌组织中存在有性激素受体, 且与食管癌病变程度呈正相关关系[10]. 女性ESCC患者体内这种高浓度性激素水平影响患者生存预后的可能机制是通过与食管癌细胞膜表面相应受体结合, 激活相关信号转导途径, 抑制癌细胞分裂、增殖及转移[27]. 但奇怪的是, 处于食管癌低发区女性及食管癌家族史阳性女性, 怀孕次数增多时却没有明显延长术后生存时间. 这一点很难完全解释清楚, 部分原因可能是由于环境因素及生活方式的改变, 当地的社会经济水平及患者对疾病的认知程度不同所导致[28-31].
本研究特点在于样本量大, 约12041例女性ESCC患者入组; 随访时间达40余年及对患者进行的多层次生存分析. 生存分析中, 我们试图控制所有已知干扰因素, 包括患者年龄、职业、种族、吸烟、饮酒、体质量指数等; 同时, 除了上述因素外, 我们还把患者的病理分期作为影响预后干扰因素纳入进来进行分析, 以尽可能提高实验结果的可靠性和科学性. 但一些未知的、未被控制的干扰因素可能会影响我们实验结果, 这一点在将来相关研究中必须考虑进去. 另外,下一步研究中应从细胞水平、分子水平探讨婚育因素参与改善女性患者预后的机制所在, 以加深对食管癌分子学机制的了解. 总之, 本研究通过对来自中国食管癌高、低发区的女性食管鳞癌患者生存分析, 首次报道了婚育因素对中国女性食管鳞癌患者生存预后的影响, 并提出经期状态和怀孕次数与女性食管癌患者预后相关, 绝经前期女性、怀孕次数多女性食管鳞癌患者术后预后较好, 这在一定程度上为我国女性食管癌患者的二级预防及内分泌治疗提供了可靠的理论依据.
食管癌男性高发于女性, 且女性患者预后好于男性. 国内外相关研究均提示女性激素在食管癌的发生、发展中起一定作用. 能影响女性激素水平的婚育因素除了与癌症发病风险有关外, 是否影响中国女性食管癌患者预后, 至今尚无定论.
卢晓梅, 教授, 研究员, 新疆医科大学第一附属医院临床医学研究院
目前国内外关于此方面研究多是通过分析婚育因素与消化系肿瘤发病风险关系及采用激素替代疗法来对比分析患者发病风险有无差异, 很少涉及更深层次的分子水平机制的探讨. 下一步研究中应从细胞水平、分子水平探讨婚育因素参与改善女性患者预后的机制所在, 以加深对食管癌分子学机制的了解.
关于婚育因素与消化系肿瘤发病风险关系的研究, 国内外已有诸多报道. Green等报道经期状态和绝经年龄与食管癌、胃癌发病风险相关; Cronin-Fenton等研究有哺乳史的女性, 食管癌和胃-贲门交接部腺癌发病风险降低; Yu等报道绝经年龄晚, 有哺乳史者食管癌发病风险下降; Chen等研究发现初次生育年龄晚者, 食管鳞癌发病风险增高. 由于种族差异及样本来源、样本量大小、实验设计等的不同, 研究结果不尽一致. 但这也显示当前世界范围的肿瘤研究领域里众多科研工作者开始关注性激素与肿瘤发生、发展关系.
目前国内外开展的此方面研究多是关于婚育因素与消化系肿瘤发病风险关系研究, 鲜少涉及婚育因素与生存关系研究, 更不要说对患者进行进一步的多因素生存分层分析研究. 本研究通过对12014例中国女性食管鳞癌患者进行生存分析研究, 揭示婚育因素与中国女性食管鳞癌患者预后相关.
多因素生存分析显示绝经前期女性及怀孕次数多女性食管鳞癌患者预后较好, 推测雌激素可能对女性患食管癌后具有一定的保护作用, 进一步寻找雌激素作用机制, 这在一定程度上为我国女性食管癌患者的二级预防及内分泌治疗提供了可靠的理论依据.
食管癌患者肿瘤家族史阳性: 连续三代内发生≥2例ESCC(或其他上消化系肿瘤)的家庭; 食管癌患者肿瘤家族史阴性: 系指连续三代内发生≤1例ESCC(或其他上消化系肿瘤)的家庭.
本文研究内容有较好新颖性, 样本信息量大, 具有代表性, 文字书写逻辑性较强, 数据翔实, 统计分析科学, 有较高学术参考价值和科学价值.
编辑: 郭鹏 电编:闫晋利
| 1. | Rutegård M, Nordenstedt H, Lu Y, Lagergren J, Lagergren P. Sex-specific exposure prevalence of established risk factors for oesophageal adenocarcinoma. Br J Cancer. 2010;103:735-740. [PubMed] [DOI] |
| 2. | Chen MF, Yang YH, Lai CH, Chen PC, Chen WC. Outcome of patients with esophageal cancer: a nationwide analysis. Ann Surg Oncol. 2013;20:3023-3030. [PubMed] [DOI] |
| 3. | Bohanes P, Yang D, Chhibar RS, Labonte MJ, Winder T, Ning Y, Gerger A, Benhaim L, Paez D, Wakatsuki T. Influence of sex on the survival of patients with esophageal cancer. J Clin Oncol. 2012;30:2265-2272. [PubMed] [DOI] |
| 4. | Hiripi E, Jansen L, Gondos A, Emrich K, Holleczek B, Katalinic A, Luttmann S, Nennecke A, Brenner H. Survival of stomach and esophagus cancer patients in Germany in the early 21st century. Acta Oncol. 2012;51:906-914. [PubMed] |
| 5. | Onishi T, Oishi Y, Goto H, Yanada S, Abe K. Gender as a prognostic factor in patients with renal cell carcinoma. BJU Int. 2002;90:32-36. [PubMed] |
| 6. | McArdle CS, McMillan DC, Hole DJ. Male gender adversely affects survival following surgery for colorectal cancer. Br J Surg. 2003;90:711-715. [PubMed] |
| 7. | Warwick R, Shackcloth M, Mediratta N, Page R, McShane J, Shaw M, Poullis M. Female sex and long-term survival post curative resection for non-small-cell lung cancer. Eur J Cardiothorac Surg. 2013;44:624-630. [PubMed] [DOI] |
| 8. | Freedman ND, Lacey JV, Hollenbeck AR, Leitzmann MF, Schatzkin A, Abnet CC. The association of menstrual and reproductive factors with upper gastrointestinal tract cancers in the NIH-AARP cohort. Cancer. 2010;116:1572-1581. [PubMed] [DOI] |
| 9. | Wu C, Wang Z, Song X, Feng XS, Abnet CC, He J, Hu N, Zuo XB, Tan W, Zhan Q. Joint analysis of three genome-wide association studies of esophageal squamous cell carcinoma in Chinese populations. Nat Genet. 2014;46:1001-1006. [PubMed] [DOI] |
| 10. | Wang QM, Qi YJ, Jiang Q, Ma YF, Wang LD. Relevance of serum estradiol and estrogen receptor beta expression from a high-incidence area for esophageal squamous cell carcinoma in China. Med Oncol. 2011;28:188-193. [PubMed] [DOI] |
| 11. | Bodelon C, Anderson GL, Rossing MA, Chlebowski RT, Ochs-Balcom HM, Vaughan TL. Hormonal factors and risks of esophageal squamous cell carcinoma and adenocarcinoma in postmenopausal women. Cancer Prev Res (Phila). 2011;4:840-850. [PubMed] [DOI] |
| 12. | Yu H, Liu G, Zhao P, Zhu L. Hormonal and reproductive factors and risk of esophageal cancer in Chinese postmenopausal women: a case-control study. Asian Pac J Cancer Prev. 2011;12:1953-1956. [PubMed] |
| 13. | Green J, Roddam A, Pirie K, Kirichek O, Reeves G, Beral V. Reproductive factors and risk of oesophageal and gastric cancer in the Million Women Study cohort. Br J Cancer. 2012;106:210-216. [PubMed] [DOI] |
| 14. | Chen ZH, Shao JL, Lin JR, Zhang X, Chen Q. Reproductive factors and oesophageal cancer in Chinese women: a case-control study. BMC Gastroenterol. 2011;11:49. [PubMed] [DOI] |
| 15. | Islami F, Cao Y, Kamangar F, Nasrollahzadeh D, Marjani HA, Shakeri R, Fahimi S, Sotoudeh M, Dawsey SM, Abnet CC. Reproductive factors and risk of esophageal squamous cell carcinoma in northern Iran: a case-control study in a high-risk area and literature review. Eur J Cancer Prev. 2013;22:461-466. [PubMed] [DOI] |
| 16. | Inoue M, Ito LS, Tajima K, Yamamura Y, Kodera Y, Takezaki T, Hamajima N, Hirose K, Kuroishi T, Tominaga S. Height, weight, menstrual and reproductive factors and risk of gastric cancer among Japanese postmenopausal women: analysis by subsite and histologic subtype. Int J Cancer. 2002;97:833-838. [PubMed] |
| 17. | Persson C, Inoue M, Sasazuki S, Kurahashi N, Iwasaki M, Ye W, Tsugane S. Female reproductive factors and the risk of gastric cancer in a large-scale population-based cohort study in Japan (JPHC study). Eur J Cancer Prev. 2008;17:345-353. [PubMed] [DOI] |
| 18. | Cronin-Fenton DP, Murray LJ, Whiteman DC, Cardwell C, Webb PM, Jordan SJ, Corley DA, Sharp L, Lagergren J. Reproductive and sex hormonal factors and oesophageal and gastric junction adenocarcinoma: a pooled analysis. Eur J Cancer. 2010;46:2067-2076. [PubMed] [DOI] |
| 19. | Mellemkjaer L, Friis S, Olsen JH, Scélo G, Hemminki K, Tracey E, Andersen A, Brewster DH, Pukkala E, McBride ML. Risk of second cancer among women with breast cancer. Int J Cancer. 2006;118:2285-2292. [PubMed] |
| 22. | Trévoux R, De Brux J, Castanier M, Nahoul K, Soule JP, Scholler R. Endometrium and plasma hormone profile in the peri-menopause and post-menopause. Maturitas. 1986;8:309-326. [PubMed] |
| 23. | Green J, Czanner G, Reeves G, Watson J, Wise L, Roddam A, Beral V. Menopausal hormone therapy and risk of gastrointestinal cancer: nested case-control study within a prospective cohort, and meta-analysis. Int J Cancer. 2012;130:2387-2396. [PubMed] [DOI] |
| 24. | Wang BJ, Zhang B, Yan SS, Li ZC, Jiang T, Hua CJ, Lu L, Liu XZ, Zhang DH, Zhang RS. Hormonal and reproductive factors and risk of esophageal cancer in women: a meta-analysis. Dis Esophagus. 2015; Mar 23. [Epub ahead of print]. [PubMed] [DOI] |
| 25. | Lu Y, Lagergren J. Reproductive factors and risk of oesophageal cancer, a population-based nested case-control study in Sweden. Br J Cancer. 2012;107:564-569. [PubMed] [DOI] |
| 26. | Lagergren J, Jansson C. Sex hormones and oesophageal adenocarcinoma: influence of childbearing? Br J Cancer. 2005;93:859-861. [PubMed] |
| 27. | Chandanos E, Lagergren J. Oestrogen and the enigmatic male predominance of gastric cancer. Eur J Cancer. 2008;44:2397-2403. [PubMed] [DOI] |
| 28. | Gallus S, Bosetti C, Franceschi S, Levi F, Simonato L, Negri E, La Vecchia C. Oesophageal cancer in women: tobacco, alcohol, nutritional and hormonal factors. Br J Cancer. 2001;85:341-345. [PubMed] |
| 29. | Bouchardy C, Verkooijen HM, Fioretta G. Social class is an important and independent prognostic factor of breast cancer mortality. Int J Cancer. 2006;119:1145-1151. [PubMed] |
| 30. | Herndon JE, Kornblith AB, Holland JC, Paskett ED. Effect of socioeconomic status as measured by education level on survival in breast cancer clinical trials. Psychooncology. 2013;22:315-323. [PubMed] [DOI] |
| 31. | Ou SH, Ziogas A, Zell JA. Prognostic factors for survival in extensive stage small cell lung cancer (ED-SCLC): the importance of smoking history, socioeconomic and marital statuses, and ethnicity. J Thorac Oncol. 2009;4:37-43. [PubMed] [DOI] |