修回日期: 2015-06-14
接受日期: 2015-07-06
在线出版日期: 2015-08-08
目的: 探讨巨噬细胞活化过程中Pim-1的动态表达及抑制磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K), P38丝裂原活化蛋白激酶(P38 mitogen-activated protein kinase, P38MAPK), Janus家族酪氨酸激酶2(Janus kinase 2, JAK2), 细胞外信号调节激酶(extracellular regulated protein kinase 1/2, ERK1/2)信号关键分子后Pim-1的表达情况.
方法: 利用q-RT PCR、Western blot技术检测经脂多糖(lipopolysaccharides, LPS)处理后0、1、2、4、8、12、24 h巨噬细胞中Pim-1mRNA及蛋白的动态表达及PI3K、P38MAPK、JAK2及MEK1/2抑制剂对Pim-1蛋白表达的影响.
结果: 巨噬细胞中Pim-1的表达随LPS不同作用时间而改变, Pim-1 mRNA表达在LPS刺激后2 h达到高峰, 为基础值6倍, 12 h后Pim-1 mRNA表达回落至基础水平, LPS刺激1-8 h内Pim-1蛋白表达水平增高, 12 h后Pim-1蛋白表达回落至基础水平; PI3K、P38MAPK、JAK2及MEK1/2抑制剂均能下调巨噬细胞中Pim-1蛋白水平.
结论: Pim-1 mRNA、Pim-1蛋白的表达是巨噬细胞活化过程中的早期事件; PI3K、P38MAPK、JAK2及MEK1/2抑制剂均影响巨噬细胞中Pim-1的表达, 提示Pim-1为相关信号通路的下游分子.
核心提示: Pim-1参与细胞生存、增殖、分化、凋亡、肿瘤发生、药物抵抗等病理生理过程. 本实验组前期实验发现Pim-1能调节巨噬细胞功能、干扰炎症反应, 但巨噬细胞激活过程中Pim-1表达情况的研究尚未见报道, 巨噬细胞中调控Pim-1激酶表达信号转导途径的尚不明确.
引文著录: 肖明亚, 申月明, 曾亚, 黄倩倩, 许婧枫, 徐美华. 脂多糖诱导的M1型巨噬细胞中Pim-1的动态表达. 世界华人消化杂志 2015; 23(22): 3510-3516
Revised: June 14, 2015
Accepted: July 6, 2015
Published online: August 8, 2015
AIM: To explore the expression of Pim-1 mRNA and protein during the activation of macrophage and to assess whether inhibition of four key signaling molecules phosphatidylinositol 3-kinase (PI3K), P38 mitogen-activated protein kinase (P38MAPK), Janus kinase 2 (JAK2), and ERK kinase (MEK1/2) may influence the expression of Pim-1 protein.
METHODS: Pim-1 mRNA and protein expression was examined by real-time PCR and Western blot, respectively, in macrophage cells treated with lipopolysaccharides (LPS) for 0, 1, 2, 4, 8, 12, and 24 h. After macrophage cells were treated with inhibitor of PI3K (LY294002), P38MAPK (SB203580), MEK1/2 (AG490) or JAK2 (AG490), LPS induced up-regulation of Pim-1 expression was examined by Western blot.
RESULTS: Expression of Pim-1 changed with the time of LPS treatment. Pim-1 mRNA and protein expression was rapidly induced after LPS treatment for 1 h. Pim-1 mRNA expression reached the peak at 2 h (six-fold of the basal level), and fell back to the basal level at 12 h. Pim-1 expression was on the constant rise from 1 h to 8 h, and dropped to the basic level at 12 h. All inhibitors of the four key signaling molecules down-regulated LPS induced expression of Pim-1 protein.
CONCLUSION: Up-regulation of Pim-1 is an early event of classical activation of macrophages. Inhibitors for PI3K, P38MAPK, JAK2 and MEK1/2 suppress Pim-1 protein expression. Pim-1 may be the downstream signal molecule of PI3K, P38MAPK, JAK2 and MEK1/2 signalling pathway.
- Citation: Xiao MY, Shen YM, Zeng Y, Huang QQ, Xu JF, Xu MH. Expression of Pim-1 in classically activated macrophages induced with lipopolysaccharides. Shijie Huaren Xiaohua Zazhi 2015; 23(22): 3510-3516
- URL: https://www.wjgnet.com/1009-3079/full/v23/i22/3510.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i22.3510
巨噬细胞(macrophage)起源于骨髓粒-单系祖细胞, 具有免疫防御、免疫调节、免疫监视等多种作用, 是机体免疫的重要组成部分. 巨噬细胞分为M1型即经典活化的巨噬细胞和M2型即替代性活化的巨噬细胞, 二者是巨噬细胞一系列功能变化的两个极端状态[1], 在炎症反应过程中, 巨噬细胞被激活为M1型巨噬细胞启动炎症反应, M1型巨噬细胞不恰当地激活、促炎因子和趋化因子过度产生可导致机体损伤, 与肾小球肾炎、炎性肠病、类风湿关节炎等多种疾病相关[2], 因此研究巨噬细胞激活过程中调节其功能的关键分子将极大地帮助我们认识这一生物学过程并对免疫炎症疾病的干预和治疗具有重要的意义.
原癌基因Pim-1是从MoMuLV小鼠淋巴瘤中分离出的一个频繁活化基因, Pim-1基因编码的Pim-1蛋白属于丝氨酸/苏氨酸激酶, 亦属于钙/钙调蛋白调节激酶. Pim-1激酶在多细胞生物中高度保守、广泛表达, 与细胞生存、增殖、分化、凋亡、肿瘤发生、药物抵抗等过程有关[3]. 本实验组前期实验发现在炎症性肠病起病过程中Pim-1的表达与肠道炎症程度呈正相关, 体外实验中脂多糖(lipopolysaccharides, LPS)诱导的M1型巨噬细胞具有与体内极化的巨噬细胞相似的表型和功能,使用Pim-1抑制剂阻断Pim-1信号能干扰LPS诱导的巨噬细胞活化、削弱炎症反应, 提示Pim-1在LPS诱导的巨噬细胞功能改变中发挥重要调节作用[4]. 为进一步探讨Pim-1表达与巨噬细胞激活关系以及巨噬细胞中调控Pim-1表达的信号转导途径, 本实验利用LPS诱导小鼠巨噬细胞活化, 以Pim-1基因及蛋白表达水平与LPS作用时间为切入点, 观察小鼠巨噬细胞活化过程中Pim-1的动态表达情况; 进一步利用信号关键分子抑制剂如磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)、P38丝裂原活化蛋白激酶(P38 mitogen-activated protein kinase, P38MAPK)、Janus家族酪氨酸激酶2(Janus kinase 2, JAK2)剂及丝裂原活化蛋白激酶激酶1/2(mitogen-activated protein kinase kinase 1/2, ERK1/2)抑制剂, 初步探讨巨噬细胞中可能调控Pim-1表达的信号转导通路.
健康6-8 wk昆明种小鼠, 购自中南大学湘雅医学院实验动物中心[许可证号: SCXK(湘)2009-0004], 实验前禁食12 h, 可自由饮水, 所有实验操作根据湘雅医学院动物伦理委员会指导进行. 小鼠脱颈处死后750 mL/L乙醇浸泡5 min, 腹腔内注射无血清DMEM培养基5 mL, 轻柔腹壁, 静置5 min, 收集腹腔液, 1000 r/min, 5 min离心收集细胞. 含10%血清DMEM培养液重悬细胞, 调整小鼠腹腔巨噬细胞浓度至1.0×106/mL待用. DMEM高糖培养基购自HyClone公司; LPS购自Sigma公司; TRIzol购自Invitrogen公司; Pim-1、GADPH引物购自上海生工生物工程公司; 兔抗Pim-1多克隆抗体(ab85898)购自abcam公司; 兔抗GADPH多克隆抗体购自杭州贤至生物科技有限公司; LY294002(PI3K抑制剂)、SB203580(p38MAPK抑制剂)、AG490(JAK抑制剂)、U0126(MEK1/2抑制剂)购自碧云天生物技术研究所. 上述信号分子抑制剂由DMSO溶解, 各抑制剂中DMSO终浓度均为0.1%.
1.2.1 细胞培养: 将小鼠腹腔巨噬细胞用DMEM培养基(其中含有10%胎牛血清、100 U/mL青霉素及100 mg/L链霉素)培养于37 ℃、50 mL/L CO2环境, 需要药物处理的细胞于贴壁24-48 h加入相应剂量药物, 在选定的时间点收集细胞样品进行检测.
1.2.2 诱导干预: 在小鼠腹腔巨噬细胞培养液中分别加入LPS, LPS最终浓度为1 μg/mL, 分别在LPS干预1、2、4、8、12、24 h后收集细胞, 以未做处理细胞为对照, 进行Pim-1 mRNA及蛋白检测.
1.2.3 不同信号通路抑制剂对LPS诱导活化的巨噬细胞中Pim-1表达的影响: 在巨噬细胞培养液中分别加入LY294002(PI3K抑制剂, 终浓度为30 μmol/L)、SB203580(p38MAPK抑制剂, 终浓度为10 μmol/L)、AG490(JAK抑制剂, 终浓度为100 μmol/L)、U0126(MEK1/2抑制剂, 终浓度为20 μmol/L)、DMSO(终浓度为0.1%), 以未做处理细胞为对照组. 各组细胞预处理1 h后, 然后加入终浓度为1 μg/mL的LPS处理2 h, 收集各组细胞, 进行Pim-1蛋白检测.
1.2.4 提取总RNA及q-RT PCR分析: 根据TOKARA公司提供的说明书, 使用TRIzol试剂, 辅以氯仿、异丙醇和750 mL/L 乙醇提取已处理的小鼠腹腔巨噬细胞总RNA. 用紫外分光光度计测定溶解后的RNA浓度, 取1 μg反转录为cDNA, 采用q-RT PCR技术定量相关基因的转录水平. 设计的扩增引物序列: Pim-1引物序列: Sense: 5'-GGAAGTGGTCCTGTTGAAGAAG-3', Antisense: 5'-CTCCTCGTTCGGTGATAAAGTC-3'; GADPH引物序列: Sense: 5'-GGTGAAGGTCGGTGTGAACG-3', Antisense: 5'-CTCGCTCCTGGAAGATGGTG-3'. 反应条件如下: 95 ℃预热变性30 s, 95 ℃变性5 s, 60 ℃退火34 s, 40个循环, 实验结果采用2-△△Ct方法对数据进行统计学分析.
1.2.5 免疫印迹法检测Pim-1的表达: 细胞用RIPA裂解液于冰上裂解30 min, 离心(12000 g 10 min, 4 ℃)取上清, 测定蛋白浓度, 将蛋白与上样缓冲液混匀制成样品, 100 ℃加热10 min. 制备10%分离胶和5%浓缩胶, 上样总蛋白为50 μg, 加入电泳缓冲液, 80 V电泳30 min, 待进入分离胶后改为120 V约1.5 h, 电转移蛋白至PVDF膜上(300 mA, 2 h), 5%脱脂奶粉封闭60 min后加入一抗(Pim-1一抗稀释比1:1500, GADPH一抗稀释比1:1000), 4 ℃孵育过夜, TBST(TBS+0.05%Tween-20)洗膜3次, 每次15 min, 然后加入二抗, 室温孵育1 h, TBST洗膜3次, 每次15 min, 然后进行化学发光测定, 显影结果使用Photoshop 软件进行分析.
统计学处理 SPSS19.0统计软件处理实验数据, 计量资料采用mean±SD表示, 采用单因素方差分析比较各组资料间的差异, P<0.05表示差异具有统计学意义.
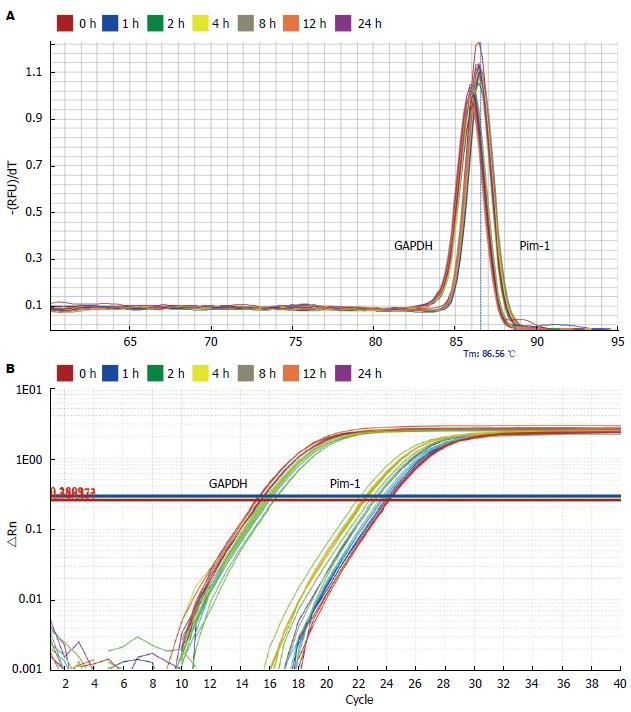
以GADPH为内参, 应用q-RT PCR技术对小鼠腹腔巨噬细胞RNA样本中Pim-1 RNA含量进行了检测. 对照组、LPS(1 μg/mL)处理1、2、4、8、12、24 h组, Pim-1 mRNA相对表达量分别为0.914±0.171、3.922±0.614、6.000±0.434、3.405±0.588、1.936±0.248、1.231±0.310、1.244±0.277. LPS刺激后巨噬细胞中Pim-1 mRNA表达水平迅速上调, 1、2、4、8 h组Pim-1 mRNA表达较对照组上调, 2 h达到高峰(P<0.05). LPS作用12 h后Pim-1 mRNA表达回到基础水平(图1).
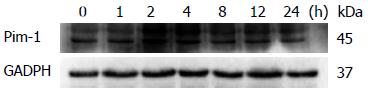
Western blot结果显示: 对照组, LPS处理1、2、4、8、12、24 h组Pim-1/GADPH光密度扫描比值分别为0.876±0.098、1.130±0.114、1.232±0.0882、1.148±0.112、1.127±0.053、1.061±0.193、0.923±0.124. LPS刺激后巨噬细胞中Pim-1蛋白表达水平迅速上调, LPS刺激1、2、4、8 h组Pim-1蛋白表达增多(P<0.05), LPS作用12 h后Pim-1蛋白表达回到基础水平(图2).
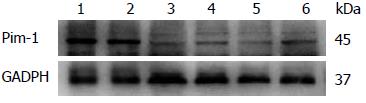
Western blot结果显示: 空白组、DMSO组、PI3K抑制剂组、P38抑制剂组、MEK1/2抑制剂组、JAK抑制剂组中Pim-1/GADPH光密度扫描比值分别为为1.344±0.177、1.209±0.148、0.961±0.258、0.743±0.081、0.759±0.141、0.854±0.060. PI3K抑制剂组、P38抑制剂组、MEK1/2抑制剂组及JAK抑制剂组中巨噬细胞中Pim-1蛋白表达与对照组相比, 差别具有统计学意义(P<0.05)(图3).
活化的巨噬细胞是多种功能的统一体, 是固有免疫的重要组成部分. 在体外培养条件下LPS诱导产生的M1型巨噬细胞中诱生型一氧化氮合酶(inducible nitric oxide synthase, iNOS)的表达水平及活性均显著增加, 信号转导和转录活化因子1(signal transducers and activator of transcription 1, STAT1)、激活蛋白-1(active protein-1, AP-1)和核因子κB(nuclear factor-kappa B, NF-κB)等转录因子活化, 促使促炎性细胞因子白介素-1(interleukin-1, IL-1)、IL-6、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)等大量表达及释放, 具有与体内极化的巨噬细胞相似的表型和功能, 诱发炎症反应、介导细胞免疫和组织损伤[5,6].
Pim-1基因编码的分子量为44和33 kDa的Pim-1蛋白, 属于丝/苏氨酸激酶, 亦属于钙离子/钙调蛋白调节激酶, 前者半衰期约1 h, 后者半衰期约为10 min. Pim-1激酶的表达亦受到许多细胞因子的调控, 如受体酪氨酸激酶FLT3、热休克蛋白90、热休克蛋白70、eIF-4E等[3]. 本实验中在LPS刺激1 h后即可检测Pim-1 mRNA表达增高, 高峰出现在1-2 h, 为对照组的6倍且持续至少8 h. 与Zhu等[7]在B淋巴细胞研究的Pim-1时程变化的结果相似, Zhu等利用抗CD40抗体刺激B淋巴细胞, 细胞中Pim-1 mRNA 30 min即可检测到表达上调, 并至少持续4 h, 峰值在加CD40后的30-60 min达高峰, 是对照的4.5倍. 外源性刺激物作用后的胸腺母细胞、嗜铬细胞瘤细胞及脑组织中Pim-1 mRNA也与本实验有相似变化趋势[8,9]. Pim-1 mRNA水平在加入LPS刺激后迅速上升, 符合其即刻早期基因[8-10]的特点. LPS刺激能迅速诱导巨噬细胞中Pim-1蛋白表达, LPS刺激1 h即可检测到Pim-1蛋白水平增高, 其蛋白水平升高至少持续8 h, 在12 h后蛋白表达回落至基础水平. Pim-1激酶活性的增加主要是由于Pim-1蛋白含量的增加而非特异性Pim-1活性的增加[11,12], 提示巨噬细胞活化过程中Pim-1激酶活性增加. 我们前期试验发现Pim-1抑制剂组肠组织中p-NF-κB、P65、iNOS表达与对照组相比明显下降, 且小鼠腹泻血便症状减轻, 肠组织病理学损伤减轻[13], 本实验Pim-1 mRNA及蛋白在LPS刺激后迅速表达上调, 且高峰出现早, 表明Pim-1主要在巨噬细胞活化的早期阶段发挥其调节作用.
既往淋巴瘤细胞及胸腺母细胞中的研究[10,14]发现Pim-1 mRNA的表达与蛋白表达平行. 本实验中小鼠巨噬细胞在LPS刺激2 h后Pim-1 mRNA达到高峰, Pim-1激酶维持增高水平, 12 h后Pim-1 mRNA及蛋白即回落至基础水平, Pim-1蛋白表与Pim-1 mRNA的表达相比较并未发现有明显的滞后.
Pim-1在巨噬细胞功能调控中发挥了重要作用, 我们前期试验中体内体外实验证实阻断Pim-1能显著抑制巨噬细及结肠组织中NF-κB P65、iNOS、TNF-α的表达, 调控巨噬细胞功能. 有研究[15,16]报道: 抑制JAK2负性调控LPS刺激后小鼠巨噬细胞Raw64.7中炎症介质iNOS、IL-1、IL-6、TNF-α的产生, 且IL-6的减少与JAK2、IKKβ抑制有关, 与ERK/MEK、P38、PI3K抑制剂无关. 目前研究认为Pim家族的诱导表达与JAK/STAT的激活关系密切, 尤其是JAK2/STAT5a的激活在细胞因子/生长因子诱导Pim-1表达的过程中发挥重要作用. Pim-1基因启动子上ISFR/GAS序列能直接与活化的STAT3/STAT5结合而上调Pim-1基因表达[17,18]. 本实验中干扰JAK2/STATs信号转导通路抑制Pim-1表达与Krumenacker等[19]在小鼠pre-TNB2淋巴细胞中研究结果一致. Pim-1可能是JAK2信号的下游分子, JAK2/STAT信号转导途径介导Pim-1及其相关分子表达, 继而调控巨噬细胞的分化及功能.
Pim-1的表达还受其他多种信号传导通路调控, 且在不同遗传背景及微环境下调控Pim-1表达的信号通路存在显著差异[20]. MAPK在真核细胞中普遍表达, 巨噬细胞中MAPK活化是致炎因子产生的关键, MAPK亚家族成员P38-MAPK、MEK/ERK活化的标志是其磷酸化形式表达量的增多. 既往研究提示, 1 μg/mL LPS可诱导巨噬细胞中P38、ERK立即表达, LPS刺激30 min后p-P38、p-ERK蛋白水平达到高峰[21], 比本实验中Pim-1蛋白表达高峰更早出现. Tu等[22]、Willert等[23]报道P38-MAPK、MEK/ERK正向调控Pim-1表达, 与本实验中P38MAPK、MEK1/2信号转导通路调控Pim-1表达结果一致. Pim-1和Akt激酶是体内调节细胞生长增殖以及新陈代谢的两大主要激酶, 研究[24]表明Pim-1是Akt信号的下游分子, Pim-1介导PI3k/Akt的多种生物学功能. Jin等[25]研究发现选择性Ⅰ类PI3K抑制剂GDC-0941能通过抑制Pim-1表达水平, 与本实验中PI3K信号转导通路调控Pim-1表达结果一致.
在炎症性肠病(inflammatory bowel disease, IBD)病变肠道黏膜中, 大量聚集的巨噬细胞不仅是主要的抗原提呈细胞, 决定T细胞免疫反应类型, 还能介导炎症反应、分泌多种炎症活性物质, 在IBD发生发展中发挥重要作用[26]. 随着生活条件及诊疗水平的提高, IBD发病率在全球呈上升趋势[27]. 目前尚无有效治愈该疾病的方法, 当前IBD治疗以5-氨基水杨酸类和糖皮质激素等传统药物为主, 但其有效率低, 不良反应不容忽视. 随着对IBD发病机制深入研究, 以IBD免疫和炎症反应过程的不同环节为靶点的生物治疗成为研究的热点. 本实验组研究发现Pim-1能调控巨噬细胞功能, 巨噬细胞中Pim-1的表达受ERK、P38MAPK、PI3K、JAK2/STATs等多种信号的调控, 且巨噬细胞中Pim-1的表达调控并不完全依赖于其中某一信号转导途径, Pim-1可能是多种炎症相关信号途径的下游分子及交汇点. 既往实验发现敲除Pim-1基因或抑制Pim-1激酶活性对Pim-1高表达的异常细胞有致死性作用, 而对正常细胞及个体生长没有明显的影响[28], 且能改善对免疫调节剂的抵抗[29]. 综合研究提示Pim-1有望成为IBD治疗靶点. Pim-1小分子抑制剂SGI-1776已进入临床试验阶段, 对慢性淋巴细胞白血病和前列腺癌细胞具有显著的细胞毒性效应. 尽管目前还没有Pim-1激酶抑制剂治疗炎性肠病的临床试验, 但是这些研究成果为开发治疗IBD新靶点药物提供了思路.
Pim-1能调控免疫细胞功能及核因子κB(nuclear factor-kappa B, NF-κB)、白介素-6 (interleukin-6, IL-6)等免疫-炎症因子的释放, 且由于Pim-1激酶独特结构, 使得Pim-1小分子抑制剂有高度选择性, 不会产生明显不良反应, 并能改善对免疫调节剂的抵抗, 在治疗免疫-炎症性疾病方面显示出巨大的潜力.
郭潮潭, 教授, 研究员, 浙江省医学科学院
Pim-1在肿瘤诊断、预后判断中有着重要的作用, Pim-1信号应用于临床治疗是近年来研究的热点. Pim-1小分子抑制剂SGI-1776已进入临床试验阶段, 对慢性淋巴细胞白血病和前列腺癌细胞具有显著的细胞毒性效应, 但免疫炎症性疾病中Pim-1的研究还需进一步深入.
Krumenacker等报道pre-TNB2淋巴细胞中Prolactin介导的Pim-1表达与Janus家族酪氨酸激酶2(Janus kinase2, JAK2)信号有关, Buckley等报道Prolactin可通过Ras丝裂原活化蛋白激酶(Ras mitogen-activated protein kinase, Ras-MAPK)和磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)信号途径使Pim-1启动子的PRL受体激活, 从而介导Pim-1的表达, 而不完全依赖于JAK2/信号转导和转录活化因子 (signal transducers and activator of transcription, STAT)信号. Block等发现胰腺癌细胞株Panc-1中, IL-6/JAK/STAT3信号传导途径介导Pim-1表达, 抑制STAT3可以诱导丝裂原活化蛋白激酶激酶1/2(mitogen-activated protein kinase kinase 1/2, ERK1/2)磷酸化介导Pim-1蛋白水平上调.
首次探讨了巨噬细胞活化过程中Pim-l的表达情况, 提示Pim-1在巨噬细胞活化早期阶段发挥调节作用. 同时发现巨噬细胞中Pim-1表达受PI3K、P38MAPK、MEK/ERK、JAK2/STATs信号调控, Pim-1可能是多种信号转导途径的下游分子及交汇点.
本文研究了Pim-1表达与巨噬细胞活化的关系及巨噬细胞中调控Pim-1表达的信号分子, 为进一步研究Pim-1在炎症反应中的作用机制提供了基础, 为后续利用Pim-1信号作为新的抗炎靶点提供了铺垫.
早期即刻基因: 静息细胞中在生长因子、神经递质等胞外信号刺激后立即表达的且表达不被蛋白合成抑制剂阻止、不需要重新合成蛋白质的基因.
本文具有一定程度的创新性, 对临床控制炎症有指导性意义.
编辑: 郭鹏 电编:闫晋利
| 1. | Gordon S, Martinez FO. Alternative activation of macrophages: mechanism and functions. Immunity. 2010;32:593-604. [PubMed] [DOI] |
| 2. | Singh A, Talekar M, Raikar A, Amiji M. Macrophage-targeted delivery systems for nucleic acid therapy of inflammatory diseases. J Control Release. 2014;190:515-530. [PubMed] [DOI] |
| 3. | Blanco-Aparicio C, Carnero A. Pim kinases in cancer: diagnostic, prognostic and treatment opportunities. Biochem Pharmacol. 2013;85:629-643. [PubMed] [DOI] |
| 4. | Shen YM, Zhao Y, Zeng Y, Yan L, Chen BL, Leng AM, Mu YB, Zhang GY. Inhibition of Pim-1 kinase ameliorates dextran sodium sulfate-induced colitis in mice. Dig Dis Sci. 2012;57:1822-1831. [PubMed] [DOI] |
| 5. | Stout RD, Jiang C, Matta B, Tietzel I, Watkins SK, Suttles J. Macrophages sequentially change their functional phenotype in response to changes in microenvironmental influences. J Immunol. 2005;175:342-349. [PubMed] |
| 6. | Vogel SN, Marshall ST, Rosenstreich DL. Analysis of the effects of lipopolysaccharide on macrophages: differential phagocytic responses of C3H/HeN and C3H/HeJ macrophages in vitro. Infect Immun. 1979;25:328-336. [PubMed] |
| 7. | Zhu N, Ramirez LM, Lee RL, Magnuson NS, Bishop GA, Gold MR. CD40 signaling in B cells regulates the expression of the Pim-1 kinase via the NF-kappa B pathway. J Immunol. 2002;168:744-754. [PubMed] |
| 8. | Feldman JD, Vician L, Crispino M, Tocco G, Baudry M, Herschman HR. Seizure activity induces PIM-1 expression in brain. J Neurosci Res. 1998;53:502-509. [PubMed] |
| 9. | Liu W, Feldman JD, Machado HB, Vician LJ, Herschman HR. Expression of depolarization-induced immediate early gene proteins in PC12 cells. J Neurosci Res. 2003;72:670-678. [PubMed] [DOI] |
| 10. | Buckley AR, Buckley DJ, Leff MA, Hoover DS, Magnuson NS. Rapid induction of pim-1 expression by prolactin and interleukin-2 in rat Nb2 lymphoma cells. Endocrinology. 1995;136:5252-5259. [PubMed] [DOI] |
| 11. | Swords R, Kelly K, Carew J, Nawrocki S, Mahalingam D, Sarantopoulos J, Bearss D, Giles F. The Pim kinases: new targets for drug development. Curr Drug Targets. 2011;12:2059-2066. [PubMed] |
| 12. | Xu D, Allsop SA, Witherspoon SM, Snider JL, Yeh JJ, Fiordalisi JJ, White CD, Williams D, Cox AD, Baines AT. The oncogenic kinase Pim-1 is modulated by K-Ras signaling and mediates transformed growth and radioresistance in human pancreatic ductal adenocarcinoma cells. Carcinogenesis. 2011;32:488-495. [PubMed] [DOI] |
| 14. | Rohwer F, Todd S, McGuire KL. The effect of IL-2 treatment on transcriptional attenuation in proto-oncogenes pim-1 and c-myb in human thymic blast cells. J Immunol. 1996;157:643-649. [PubMed] |
| 15. | Lee C, Oh JI, Park J, Choi JH, Bae EK, Lee HJ, Jung WJ, Lee DS, Ahn KS, Yoon SS. TNF α mediated IL-6 secretion is regulated by JAK/STAT pathway but not by MEK phosphorylation and AKT phosphorylation in U266 multiple myeloma cells. Biomed Res Int. 2013;2013:580135. [PubMed] [DOI] |
| 16. | Kou X, Qi S, Dai W, Luo L, Yin Z. Arctigenin inhibits lipopolysaccharide-induced iNOS expression in RAW264.7 cells through suppressing JAK-STAT signal pathway. Int Immunopharmacol. 2011;11:1095-1102. [PubMed] [DOI] |
| 17. | Wang Z, Bhattacharya N, Weaver M, Petersen K, Meyer M, Gapter L, Magnuson NS. Pim-1: a serine/threonine kinase with a role in cell survival, proliferation, differentiation and tumorigenesis. J Vet Sci. 2001;2:167-179. [PubMed] |
| 18. | Paukku K, Silvennoinen O. STATs as critical mediators of signal transduction and transcription: lessons learned from STAT5. Cytokine Growth Factor Rev. 2004;15:435-455. [PubMed] [DOI] |
| 19. | Krumenacker JS, Narang VS, Buckley DJ, Buckley AR. Prolactin signaling to pim-1 expression: a role for phosphatidylinositol 3-kinase. J Neuroimmunol. 2001;113:249-259. [PubMed] |
| 20. | Moser KM, Kidikoro Y, Marsh J, Sgroi V. Biologic half-life and organ distribution of radiolabeled human PiM and PiZ alpha-1-antitrypsin in the dog. J Lab Clin Med. 1978;91:214-222. [PubMed] |
| 21. | Han J, Lee JD, Bibbs L, Ulevitch RJ. A MAP kinase targeted by endotoxin and hyperosmolarity in mammalian cells. Science. 1994;265:808-811. [PubMed] |
| 22. | Tu ML, Wang HQ, Sun XD, Chen LJ, Peng XC, Yuan YH, Li RM, Ruan XZ, Li DS, Xu YJ. Pim-1 is up-regulated by shear stress and is involved in shear stress-induced proliferation of rat mesenchymal stem cells. Life Sci. 2011;88:233-238. [PubMed] [DOI] |
| 23. | Willert M, Augstein A, Poitz DM, Schmeisser A, Strasser RH, Braun-Dullaeus RC. Transcriptional regulation of Pim-1 kinase in vascular smooth muscle cells and its role for proliferation. Basic Res Cardiol. 2010;105:267-277. [PubMed] [DOI] |
| 24. | Sussman MA. Mitochondrial integrity: preservation through Akt/Pim-1 kinase signaling in the cardiomyocyte. Expert Rev Cardiovasc Ther. 2009;7:929-938. [PubMed] [DOI] |
| 25. | Jin L, Tabe Y, Lu H, Borthakur G, Miida T, Kantarjian H, Andreeff M, Konopleva M. Mechanisms of apoptosis induction by simultaneous inhibition of PI3K and FLT3-ITD in AML cells in the hypoxic bone marrow microenvironment. Cancer Lett. 2013;329:45-58. [PubMed] [DOI] |
| 26. | Heinsbroek SE, Gordon S. The role of macrophages in inflammatory bowel diseases. Expert Rev Mol Med. 2009;11:e14. [PubMed] [DOI] |
| 27. | Fumery M, Dauchet L, Vignal C, Gower-Rousseau C. [Epidemiology, risk factors and factors associated with disabling course in inflammatory bowel disease]. Rev Prat. 2014;64:1210-1215. [PubMed] |
| 28. | Laird PW, van der Lugt NM, Clarke A, Domen J, Linders K, McWhir J, Berns A, Hooper M. In vivo analysis of Pim-1 deficiency. Nucleic Acids Res. 1993;21:4750-4755. [PubMed] |