修回日期: 2015-05-31
接受日期: 2015-06-10
在线出版日期: 2015-07-28
目的: 观察电针对功能性消化不良(functional dyspepsia, FD)肝郁脾虚模型大鼠中枢及外周胃肠激素: 降钙素基因相关肽(calcitonin gene-related peptide, CGRP)及其相应受体-受体活性修饰蛋白质1(receptor activity modifying protein 1, RAMP1)的影响.
方法: 将48只SD大鼠随机分为空白组、模型组和电针组, 每组16只. 除正常组以外, 剩余两组大鼠采用郭氏夹尾刺激法(14 d, 2次/d)+不规则饮食法(逢单日禁食, 饮水正常)+冰生理盐水灌胃法(-7 ℃ 0.9%NaCl注射液2 mL, 2次/d)的多因素干预法造模. 造模成功后进行电针治疗, 治疗时间为28 d, 1次/24 h. 治疗结束后分别对3组大鼠进行灌胃处理, 解剖取材, 测定胃内残留率及小肠推进率; 免疫印迹法(Western blot)分别测定各组下丘脑、胃、肠的CGRP、RAMP1含量.
结果: 与空白组相比, 模型组大鼠胃内残留率明显升高, 小肠推进率显著降低(P<0.001), 模型组大鼠胃窦、空肠的CGRP及其受体RAMP1的表达含量均明显升高(P<0.05), 模型组大鼠下丘脑CGRP及其受体RAMP1的表达含量明显升高(P<0.01); 与模型组相比, 电针组胃内残留率显著降低(P<0.001), 小肠推进率明显升高(P<0.01), 电针组大鼠中枢与外周的CGRP及其受体RAMP1的含量显著降低, 且均有显著性差异(P<0.05).
结论: 电针能够显著地降低外周及其受体RAMP1的水平, 从而达到降低胃肠道的敏感性的作用. 同样, 对中枢的CGRP及其受体的表达有着显著的影响, 提示电针是通过脑-肠轴调节脑肠肽的分泌, 从而调节胃肠道的活动, 这可能是电针治疗FD的脑-肠轴机制.
核心提示: 本研究通过电针后对中枢下丘脑及外周胃窦、空肠组织中降钙素基因相关肽(calcitonin gene-related peptide)及其受体受体活性修饰蛋白质1(receptor activity modifying protein 1)表达的影响, 以明确电针治疗功能性消化不良(functional dyspepsia)的起效部位及可能的效应机制.
引文著录: 徐派的, 辛玉, 张红星, 周利, 杨云. 电针对功能性消化不良肝郁脾虚型大鼠中枢及外周降钙素基因相关肽及受体活性修饰蛋白的影响. 世界华人消化杂志 2015; 23(21): 3433-3439
Revised: May 31, 2015
Accepted: June 10, 2015
Published online: July 28, 2015
AIM: To observe the influence of electric acupuncture (EA) on central and peripheral calcitoningene-related peptide (CGRP) and receptor activity modifying protein 1 (RAMP1) expression in functional dyspepsia (FD) rats with liver stagnation and spleen deficiency.
METHODS: Forty-eight rats were randomly divided into three groups (n = 16 each): a blank group, a model group, and an EA group. Except for the blank group, the other two groups underwent modeling by tail clamp stimulation (14 d, 2 times/d), giving an irregular diet (fasting every other day, with free access to water), and gavage of ice physiological saline (-7 ℃ 0.9% NaCl injection 2 mL, 2 times/d). As FD was successfully induced, EA treatment started (4 wk, once a day). After 28 d, the rats were killed to take tissue samples. The rates of gastric emptying and small intestinal transit were determined; the expression levels of CGRP and its receptor RAMP1 in the hypothalamus, stomach, and intestine were measured by Western blot.
RESULTS: Compared with the blank group, gastric emptying rate significantly increased (P < 0. 001), small intestinal transit rate significantly decreased (P < 0.001), the levels of CGRP and RAMP1 expression in the stomach and intestine significantly increased (P < 0.05), and their expression levels in the hypothalamus significantly increased (P < 0.01) in the model group. Compared with the model group, gastric emptying rate significantly decreased (P < 0.001), small intestinal transit rate significantly increased (P < 0.01), and the expression levels of both central and peripheral CGRP and RAMP1 significantly decreased (P < 0.05) in the EA group.
CONCLUSION: EA treatment can significantly decrease peripheral CGRP and its receptor RAMP1 expression, thereby promoting gastrointestinal motility and reducing the sensitivity of the gastrointestinal tract. Similarly, EA has a significant effect on the expression of CGRP and its receptor in the central nervous system, indicating that EA regulates the brain gut peptide through the brain-gut axis and thereby regulates gastrointestinal activity.
- Citation: Xu PD, Xin Y, Zhang HX, Zhou L, Yang Y. Influence of electro-acupuncture on central and peripheral calcitonin gene-related peptide and receptor modifying protein 1 expression in functional dyspepsia rats with liver stagnation and spleen deficiency. Shijie Huaren Xiaohua Zazhi 2015; 23(21): 3433-3439
- URL: https://www.wjgnet.com/1009-3079/full/v23/i21/3433.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i21.3433
功能性消化不良(functional dyspepsia, FD)是以持续或反复发作上腹痛、上腹胀、早饱、嗳气、恶心等上腹部症状为主要表现, 而血生化和内镜等检查无异常发现, 难以用器质性疾病解释的一种功能性胃肠疾病[1]. 流行病学资料[2]显示, 世界范围内人群消化不良的发病率达10%-30%. FD症状反复而持久, 严重影响患者的生活质量, 而且常会伴有失眠、焦虑、抑郁、头痛、头昏等其他功能性症状, 且多伴有精神因素[3], 已逐渐成为严重危害人类健康的常见疾病. 目前认为FD是一种生物-心理-社会病证, 其病因和发病机制至今尚未清楚, 通常被认为是多种综合因素共同作用的结果, 精神心理因素被认为对此病发病起到重要的作用[4].
现代中医认为本病应归于胃脘痛、嘈杂、痞满、反酸、呕吐等范畴. 病性属本虚标实之证. 病位在胃, 而又涉及肝脾两脏, 以肝郁气滞、肝旺乘脾、脾胃虚弱、运化失职、胃失通降为其最基本病机. FD是针灸临床的优势病种, 大量研究[5-8]表明, 电针足三里穴、太冲穴对FD具有显著治疗作用. 研究电针对FD治疗的作用及机制的探讨将为针灸治疗FD提供全新的研究资料和重要线索, 具有较好的经济和社会效益. 本课题采用临床常用的电针疗法, 以FD肝郁脾虚证大鼠为受试对象, 观察电针对FD肝郁脾虚模型大鼠中枢及外周胃肠激素降钙素基因相关肽(calcitonin gene-related peptide, CGRP)及其相应受体-受体活性修饰蛋白质1(receptor activity modifying protein 1, RAMP1)的影响, 探讨电针治疗FD的脑-肠轴机制.
采用SPF级成年雌雄各半Sprague-Dawley大鼠48只(体质量200 g±20 g), 由湖北省医学科学研究院实验动物中心提供(动物合格证号: 42000600005079)动物喂养于SPF动物房, 饲养温度20 ℃-25 ℃, 湿度50%-70%. 适应性喂养1 wk后开始实验. Mouse Anti-β-actin Monoclonal Antibody(购自天津三箭公司#KM9001); Rabbit Anti-CRCP Monoclonal antibody(购自epitomics公司#6785-1); Rabbit Anti-RAMP1 Polyclonal antibody(购自博奥森公司#BS-1567R); 过硫酸铵(购自上海国药#10002618); 丙烯酰胺、甲叉丙烯酰胺、Tris-Base、十二烷基硫酸钠SDS、甘氨酸Glycine、N,N,N',N'-四甲基乙二胺TEMED、苯甲基磺酰氟(PMSF)(均购自Amresco公司); PageRuler prestained protein ladder(购自Thermo公司#26616); 显影定影液(购自Kodak公司#6610190); 脱脂奶粉(伊利牌); Bradford蛋白浓度测定试剂盒(购自碧云天•中国, Cat. No: P0006); 细胞核蛋白与细胞浆蛋白抽提试剂盒(购自碧云天•中国, Cat. No: P0028 P0033); 一抗二抗去除液(购自碧云天•中国, Cat. No: P0025)等. 华佗牌32号25 mm(1寸) 和13 mm(0.5寸)无菌针灸针(苏州医疗用品厂有限公司), HANS-200A韩式穴位神经刺激仪(南京济生医疗科技有限公司); 电泳电源DYY-6C型电源(北京六一仪器厂); 迷你电泳槽(北京六一Catalog #DYZC-24DN); 转膜芯l(北京六一Catalog #DYZC-40D); PVDF膜Millipore(CAT.NO.IPVH00010); 滤纸(Whatman, 3MM CHR); 自制大鼠鼠衣及悬吊装置等. 营养性半固体糊的制备: 取10 g羧甲基纤维素钠, 溶于250 mL 蒸馏水中, 分别加入16 g奶粉, 8 g糖, 8 g淀粉和2 g活性炭末, 搅拌均匀, 配制成300 mL约300 g的黑色半固体糊状物. 取材当日制备放置于冰箱冷藏, 用时提前2 h取出并恢复至室温.
1.2.1 动物分组及造模: 48只大鼠随机分为3组, 即: 空白组(Blank)、模型组(Model)、电针组(electro acupuncture, EA). 除空白组外, 其他2组均采用郭氏夹尾刺激法[9](14 d, 2次/d)+不规则饮食法[10](逢单日禁食, 饮水正常)+冰生理盐水灌胃法(-7 ℃ 0.9%NaCl注射液2 mL, 2次/d)的多因素干预法造模. 将每组同笼大鼠, 用长海绵钳夹大鼠尾巴远端1/3处, 以不破皮为度(如有抓伤破皮, 则用0.5%碘伏消毒受伤部位以防感染), 令其暴怒, 寻衅与其他大鼠撕打, 以激怒全笼大鼠. 刺激30 min/次, 间隔不少于4 h 刺激1次, 2次/d, 连续刺激14 d; 逢单日禁食, 双日给予称质量好的200 g食物, 饮水正常; 将存放于-7 ℃冰箱的0.9%NaCl注射液, 用大鼠灌胃针抽取2 mL灌胃, 2次/d, 分别于09:00和15:00. 造模成功标志是大鼠毛发枯乱发黄、便溏、饮食量显著减少、活跃程度减弱、扎堆甚至倦卧, 情绪由开始的易怒烦躁转为情绪低落等[11].
1.2.2 电针治疗: 造模成功后称各组大鼠质量, 第2天开始电针治疗, 连续治疗28 d. 电针治疗组大鼠穿鼠衣束缚后悬挂于自制悬挂装置上, 取大鼠的"后三里"(后肢关节下方腓骨头内5 mm处)、"太冲"(后肢足背第1、2趾骨间凹陷处)的定位[12]. 用32号1寸(25 mm)毫针针刺大鼠的双侧"后三里"穴位0.3-0.5寸; 用32号0.5寸(13 mm)毫针针刺大鼠的双侧"太冲"穴位0.1-0.2寸, 快速捻转至针下沉涩感后, 接韩氏治疗仪, 采用疏密波, 频率2 Hz/100 Hz, 强度1 mA, 30 min/次, 每24 h治疗1次.
1.2.3 取材: (1)胃肠组织取材: 治疗28 d后, 禁食不禁饮水24 h, 次日称其质量后禁水2 h后各组大鼠按2 mL/100 g给予营养固体糊灌胃, 30 min后予10%水合氯醛(0.35 mL/100 g)麻醉后固定大鼠四肢, 剖开腹腔, 结扎胃贲门和幽门, 取胃用滤纸拭干后称全质量, 然后沿胃大弯剪开胃体, 洗去胃内容物后拭干, 称胃净质量. 剪取胃窦部分放于冻存管中; 同时迅速取出小肠, 测量后用冰生理盐水冲洗干净, 剪取空肠部置于冻存管中. 一并置于液氮中迅速冻存, 放置于-80 ℃冰箱中待测; (2)下丘脑取材: 大鼠断头后, 轻轻剥离脑组织, 剪断视神经, 将取出的大脑放置于干冰上进行取材, 取出的下丘脑放入1.5 mL灭菌的离心管中, 液氮瓶中迅速冷冻, -80 ℃冰箱保存备用.
1.2.4 指标检测: (1)一般情况: 每日观察大鼠的精神状态、姿势、皮毛色泽、活动度、对束缚的反应性、眼裂黏膜色泽、耳郭色泽以及粪便等全身情况. 记录大鼠每日饮食量、饮水量、体质量等指标; (2)胃排空和小肠推进率的测定: 以胃全质量和胃净质量的差值为胃残留物质量, 以此与所给糊重的百分比为胃内残留率. 并结合比较各组的胃排空. 测量幽门到盲肠全长(L1)及幽门至黑色半固体糊前沿的距离(L2), 小肠推进率(%) = L2/L1×100%, 并结合比较各组的小肠推进率; (3)免疫印迹(Western blot)法测定CGRP、RAMP1蛋白表达量: 样品制备: 剪取约50 mg组织, 加入1 mL总蛋白提取液, 匀浆直到组织充分破碎后收集好细胞, 加入1 mL总蛋白提取液, 匀浆离心后取适量上清液. Bradford蛋白浓度测定试剂盒测定蛋白浓度. 细胞核蛋白与细胞浆蛋白抽提试剂盒提取蛋白. 用10%-12%的SDS-PAGE分离蛋白质, 每个泳道蛋白上样量30 μg. SDS-PAGE电泳完成后进行转膜: 将PAGE凝胶中的蛋白质电转移至硝酸纤维素膜上, 电转完毕后, 将电转膜置于5%的脱脂奶粉(PBS配制)中封闭, 37 ℃ 1 h. PBST漂洗3次. 根据实验需要和设计选择合适的酶标二抗和稀释浓度(用含0.5%脱脂奶粉的PBS稀释), 每个加样槽中加入二抗1 mL左右室温下于摇床孵育1 h或4 ℃过夜, 注意保证膜的所有部分同溶液接触. 弃去二抗, 膜条仍置于加样槽, 每个槽加2-3 mL PBST, 上摇床洗涤洗涤5-10 min, 换液, 反复4次. 将膜取出并吸走多余的反应底物, 贴在玻璃纸上, 加底物, 做化学发光, 得到胶片. 阳性条带以Quantity One 4.62版凝胶光密度分析软件进行分析, 测其累积光密度(integrated optical density, IOD)参考值.
统计学处理 应用SPSS16.0统计软件进行统计分析, 数据以mean±SD表示. 首先进行正态性、方差齐性检验. 分别采用单因素方差分析进行组间比较分析, 等级资料采用秩和检验, P<0.05为差异有统计学意义.
实验前各组大鼠精神状态良好、饮食饮水量正常、动作敏捷、皮毛光亮、耳郭呈淡粉色、叫声清脆响亮、球形粪便且干稀适中; 造模后各组大鼠神态倦怠、烦躁、饮食饮水量均减少、静卧少动、毛发枯黄散乱无光泽、胡须下垂、耳郭色淡、吱吱细叫、大便稀溏不成形; 经28 d治疗后电针组大鼠精神状态均较前明显好转, 饮食饮水量增多、大鼠活动较前增多、毛发整洁、耳廓呈淡粉色、粪便转干.
表1可见, 与正常组大鼠相比较, 模型组大鼠的胃内残留率明显增高, 小肠推进率明显降低(P<0.01); 与模型组相比, 电针治疗组大鼠的胃内残留率明显降低, 小肠推进率明显增高(P<0.01), 这提示了电针能够显著地促进胃肠动力, 降低胃肠道敏感性.
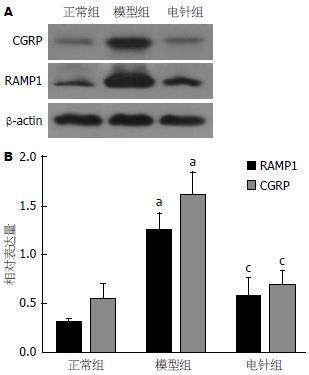
如图1所示: 与空白组相比, 模型组大鼠胃窦CGRP、RAMP1表达水平明显升高(P<0.05), 说明造模后各组大鼠胃窦中CGRP、RAMP1表达水平升高; 与模型组相比, 电针治疗组胃窦CGRP、RAMP1表达水平明显降低(P<0.05), 说明经电针治疗后, 能够降低FD肝郁脾虚型大鼠胃窦的CGRP、RAMP1表达水平, 从而降低胃肠道的敏感性, 以达到治疗目的.
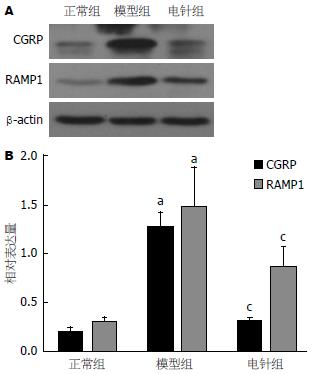
如图2所示: 与空白组相比, 模型组大鼠空肠CGRP、RAMP1表达水平明显升高(P<0.05), 说明造模后各组大鼠空肠中CGRP、RAMP1表达水平升高; 与模型组相比, 电针治疗组空肠CGRP、RAMP1表达水平明显降低(P<0.05), 说明经电针治疗后, 能够降低FD肝郁脾虚型大鼠空肠的CGRP、RAMP1表达水平.
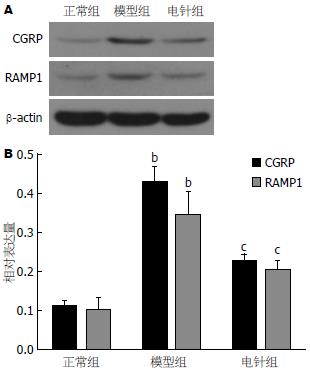
如图3所示: 与空白组相比, 模型组大鼠下丘脑CGRP、RAMP1表达水平明显升高(P<0.01), 说明造模后各组大鼠下丘脑中CGRP、RAMP1表达水平升高; 与模型组相比, 电针治疗组下丘脑CGRP、RAMP1表达水平明显降低(P<0.05), 说明经电针治疗后, 能够降低FD肝郁脾虚型大鼠下丘脑的CGRP、RAMP1表达水平.
FD是具有胃肠动力障碍与感觉异常并存、多症状重叠、易反复发作、较难治愈等特点的疾病. 其发病机制目前尚不清楚, 大量研究[13-16]提示可能与胃肠道动力障碍、胃排空延迟、脑-肠轴与脑肠肽的改变、内脏高敏感性、胃酸分泌异常、幽门螺杆菌或其他病原体感染、社会精神心理因素、遗传易感性、饮食、环境、生活方式等多种因素有关. 近年来, 有关于脑-肠轴及脑肠肽与FD的研究成为焦点, 研究者普遍认为脑-肠轴双向通路功能障碍引起的胃肠道动力和感觉异常, 是导致FD发生的重要病理生理机制, 与之相关的内环境紊乱引发的脑肠肽水平异常是FD的重要病因之一.
CGRP是广泛分布于中枢和外周神经系统的神经肽, 其功能呈多样性, 如有舒张血管和收缩心肌的作用, 抑制血管平滑肌细胞增殖和凋亡, 参与调节神经和消化系统功能. 现代研究无论是中枢还是外周CGRP的释放均参与了内脏敏感性变化, 内脏高敏感性一直被认为是功能性胃肠道疾病发生的主要机制之一[17]. CGRP还能够抑制胃酸的分泌、增加胃黏膜血流、痛觉调制、减缓胃肠运动、抑制炎症反应、拮抗自由基损伤及调节胃肠激素分泌等方面保护胃肠道功能. CGRP生物效应的发挥同样依靠与其受体的结合, 而其功能的多样性可能与受体跨膜信号转导的信号整合有关. 目前发现CGRP受体是由3个组分组成: 降钙素受体样受体(calcitonin receptor-like receptor, CRLR)、RAMP1和受体组分蛋白质(receptor component protein, RCP). 其中RAMP1与血管活性肠肽1受体(vasoactive intestinal peptide receptor 1, VPAC1)、垂体腺苷酸环化酶激活肽受体、甲状旁腺素1(parathyroid hormone 1, PTH1)、甲状旁腺素2(parathyroid hormone 2, PTH2)和胰高血糖素受体也有一定的相互作用[18,19]. 有学者检测FD患者胃黏膜中CGRP的浓度, 发现CGRP浓度高于健康对照组, 提示这可能与胃机械感觉过敏有关, 表明CGRP可能参与FD的病理生理过程[20].
目前临床对FD的治疗, 主要采用促胃肠动力、内脏感觉调节、抗焦虑和抑郁等药物治疗[21]. 由于FD发病机制复杂且发病多样, 患者临床表现差异大, 药物治疗难以适应复杂的个体差异. 非药物疗法治疗FD, 尤其是应用针刺疗法治疗FD, 经大量临床和实验资料表明[22], 疗效显著, 有极好的应用前景, 显示出独特的优势.
本课题以夹尾等多种刺激手法使大鼠激怒、疲劳、饮食失节, 形成最接近肝郁脾虚的FD证型, 通过电针足三里穴和太冲穴的治疗对FD肝郁脾虚型大鼠治疗前后一般状态的观察、胃排空、小肠推进率的检测以及中枢和外CGRP、RAMP1水平的表达的测定, 进一步证实电针对FD有显著疗效, 并且能够有效地促进胃肠道动力, 降低胃肠道敏感性, 降低中枢和外周CGRP、RAMP1水平的表达. 这种通过调节神经内分泌网络, 调节外周特别是中枢的脑肠肽的分泌水平, 使胃肠动力及感觉恢复正常, 这可能是电针治疗FD的脑-肠轴机制, 但是电针通过脑-肠轴调节胃肠道相关的中枢靶点核团, 还有待我们进一步的研究.
功能性消化不良(functional dyspepsia, FD)是功能性胃肠病(functional gastrointestinal disorders, FGIDS)的一种, 给患者、家庭和社会带来较重的精神、生活和经济负担, 因此寻求有效的防治措施是医学领域的重要任务之一. 针刺治疗FD历史悠久, 疗效显著, 在临床上的运用已经较为成熟.
唐文富, 教授, 主任医师, 四川大学华西医院中西医结合科; 郑培永, 研究员, 上海中医药大学脾胃病研究所, 上海中医药大学附属龙华医院消化内科
目前有关针灸治疗FD的研究多是临床研究, 虽然肯定其疗效和安全性, 但是对其治疗机制的研究较少, 因此对针灸的疗效缺乏理论的支持. 本课题组一直对针灸治疗FD进行大量临床实验, 并成功的以大鼠为对象复制符合中医肝郁脾虚病机的FD模型进行电针治疗, 以明确针灸起效的神经生理机制.
国内外学者对FD发病过程中"生理-心理-社会模式"的重视, 越来越多的学者坚信脑-肠轴在FD的发病中起重要的作用, 刘未艾等实验结果发现模型组大鼠胃动素(motilin, MTL)和胃泌素(gastrin, Gas)含量下降, 血管活性肠肽(vasoactive intestinal peptide, VIP)含量升高, 胃排空及小肠推进明显减慢, 证实FGIDS的发病与胃肠激素分泌失调和胃肠动力障碍有一定的关系.
本研究以降钙素基因相关肽及其受体受体活性修饰蛋白质1为切入点, 观察电针治疗后, 其相应的作用靶点脑肠肽表达水平的改变, 能够对电针治疗FD的作用部位有客观的评价, 以探讨电针治疗FD可能的作用机制.
对针灸治疗功能性胃肠病的机制研究, 特别是对脑-肠轴和脑肠肽的研究, 一方面能够进一步明确功能性胃肠病的发病机制; 另一方面也对针灸的临床疗效提供更多的依据, 同时也具有较高的社会效益和经济效益.
本文研究电针通过调控脑-肠轴调节胃肠道活动治疗FD的机制. 该研究对阐明针灸治疗功能性疾病的神经生理机制具有较为重要的意义.
编辑: 郭鹏 电编:都珍珍
| 1. | Tack J, Talley NJ, Camilleri M, Holtmann G, Hu P, Malagelada JR, Stanghellini V. Functional gastroduodenal disorders. Gastroenterology. 2006;130:1466-1479. [PubMed] [DOI] |
| 2. | Voiosu TA, Giurcan R, Voiosu AM, Voiosu MR. Functional dyspepsia today. Maedica (Buchar). 2013;8:68-74. [PubMed] |
| 9. | 郭 海军, 林 洁, 李 国成. 功能性消化不良的动物模型研究. 中国中西医结合消化杂志. 2001;9:141-142. |
| 13. | Futagami S, Shimpuku M, Yin Y, Shindo T, Kodaka Y, Nagoya H, Nakazawa S, Fujimoto M, Izumi N, Ohishi N. Pathophysiology of functional dyspepsia. J Nippon Med Sch. 2011;78:280-285. [PubMed] [DOI] |
| 16. | Hyman PE. Will the Rome criteria help pediatrics? J Pediatr Gastroenterol Nutr. 2008;47:700-703. [PubMed] [DOI] |
| 17. | 章 菲菲, 莫 剑忠. 降钙素基因相关肽在内脏敏感性改变机制中的作用. 胃肠病学和肝病学杂志. 2005;14:200-202. |
| 18. | Christopoulos A, Christopoulos G, Morfis M, Udawela M, Laburthe M, Couvineau A, Kuwasako K, Tilakaratne N, Sexton PM. Novel receptor partners and function of receptor activity-modifying proteins. J Biol Chem. 2003;278:3293-3297. [PubMed] [DOI] |
| 19. | Pondel MD, Mould R. Cloning and transcriptional analysis of the mouse receptor activity modifying protein-1 gene promoter. BMC Mol Biol. 2005;6:7. [PubMed] [DOI] |
| 20. | Kawamura A, Adachi K, Takashima T, Murao M, Katsube T, Yuki M, Watanabe M, Kinoshita Y. Prevalence of functional dyspepsia and its relationship with Helicobacter pylori infection in a Japanese population. J Gastroenterol Hepatol. 2001;16:384-388. [PubMed] [DOI] |
| 21. | Brun R, Kuo B. Functional dyspepsia. Therap Adv Gastroenterol. 2010;3:145-164. [PubMed] [DOI] |