修回日期: 2015-05-31
接受日期: 2015-06-10
在线出版日期: 2015-07-28
目的: 研究慢性乙型、丙型肝炎患者体内炎性反应与铁代谢调节的相互作用机制.
方法: 纳入慢性乙型、丙型肝炎患者各45例、健康成人90例(各对照45例), 分为慢性乙型肝炎患者组(HBV组)、慢性丙型肝炎患者组(HCV组)及对照组, ELISA法检测血清铁调素(hepcidin)、白介素-6(interleukin 6, IL-6)、肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α), 全自动生化仪检测丙氨酸转氨酶(alanine transaminase, ALT)、天冬氨酸转氨酶(aspartate aminotransferases, AST)、血清铁(Fe). 选取慢性丙型肝炎患者肝脏及十二指肠标本15例(HCV组)、慢性乙型肝炎患者肝脏及十二指肠标本12例(HBV组)和对照组12例, 免疫组织化学检测肝脏铁调素(hepcidin)及十二指肠膜铁转运蛋白(ferroportin)表达情况, 肝脏铁蓝染色检测肝脏铁蓄积情况.
结果: 与对照组比较, HBV、HCV组血清铁调素水平及肝脏铁调素表达均降低(P<0.05); 十二指肠膜铁转运蛋白表达均升高(P<0.05), HCV组升高更明显(P<0.05), 肝脏铁蓝染色的阳性表达均升高(P<0.05), HCV组升高更明显(P<0.05). HBV及HCV组十二指肠膜铁转运蛋白表达与肝脏铁调素表达均呈负相关(r = -0.638, P<0.05; r = -0.538, P<0.05), 与血清铁调素均呈负相关(r = -0.407, P<0.05; r = -0.519, P<0.05), 与血清Fe均呈正相关(r = 0.611, P<0.05; r = 0.637, P<0.05). 在HBV组, 血清铁调素与IL-6及TNF-α均呈负相关(r = -0.510, P<0.05; r = -0.450, P<0.05); 在HCV组, 血清铁调素与IL-6呈负相关(r = -0.620, P<0.05), 与TNF-α呈正相关(r = 0.243, P<0.05).
结论: 慢性乙型、丙型肝炎患者体内铁调素水平下调并通过上调膜铁转运蛋白的表达导致体内血清铁水平升高及肝铁蓄积, HCV组肝铁蓄积更明显.
核心提示: 慢性乙型、丙型肝炎患者体内铁调素水平下调并通过上调膜铁转运蛋白的表达导致体内血清铁水平升高及肝脏铁蓄积, 通过调控铁调素和膜铁转运蛋白的水平以控制肝脏铁蓄积从而控制慢性乙型、丙型肝炎患者肝脏损伤进程, 有望成为临床治疗慢性乙型、丙型肝炎病毒感染的新靶点.
引文著录: 余琳娜, 吕佳珺, 朱云珍, 戴虹, 董向前, 段丽平, 杨刚, 柳唯意, 马岚青. 慢性乙型、丙型肝炎患者肝脏铁调素表达的下调. 世界华人消化杂志 2015; 23(21): 3366-3373
Revised: May 31, 2015
Accepted: June 10, 2015
Published online: July 28, 2015
AIM: To explore the mechanism underlying the interaction between inflammatory reaction and iron metabolism regulation in patients with chronic hepatitis B (CHB) or chronic hepatitis C (CHC).
METHODS: Forty-five patients with CHB, 45 patient with CHC, and 90 healthy volunteers were included. Serum levels of hepcidin, interleukin-6 (IL-6), and tumor necrosis factor alpha (TNF-α) were measured by ELISA. Serum levels of alanine transaminase (ALT), aspartate aminotransferases (AST), and iron (Fe) were also measured. Liver and duodenum specimens were taken from 15 CHC patients, 12 CHB patients, and 12 normal controls to detect the expression of hepcidin and ferroportin by immunohistochemistry and liver iron by iron blue staining.
RESULTS: Serum and hepatic hepcidin levels in the CHC and CHB groups were significantly lower than those of the control group (P < 0.05). Compared with the control group, ferroportin expression in the duodenum was significantly increased (P < 0.05) and the positive rate of liver iron blue staining was significantly higher in the CHC and CHB groups (P < 0.05), especially in the CHC group. There was a negative correlation between ferroportin expression in the duodenum and hepatic (r = -0.638, P < 0.05; r = -0.538, P < 0.05) and serum levels of hepcidin (r = -0.407, P < 0.05; r = -0.519, P < 0.05) in CHC and CHB patients. There was a positive correlation between ferroportin expression in the duodenum and serum iron (r = 0.611, P < 0.05; r = 0.637, P < 0.05) in CHC and CHB patients, between serum hepcidin and IL-6 and TNF-α in CHB patients (r = -0.510, P < 0.05; r = -0.450, P < 0.05), and between serum hepcidin and IL-6 in CHB patients (r = -0.620, P < 0.05). There was a positive correlation between serum hepcidin and TNF-α in CHB patients (r = 0.243, P < 0.05).
CONCLUSION: In CHC and CHB patients, lowered hepcidin level and increased ferroportin expression may cause an increase in serum and liver iron accumulation. Hepatic iron accumulation is more obvious in CHC patients.
- Citation: Yu LN, Lv JJ, Zhu YZ, Dai H, Dong XQ, Duan LP, Yang G, Liu WY, Ma LQ. Liver hepcidin expression is down-regulated in patients with chronic hepatitis B or hepatitis C. Shijie Huaren Xiaohua Zazhi 2015; 23(21): 3366-3373
- URL: https://www.wjgnet.com/1009-3079/full/v23/i21/3366.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i21.3366
铁作为血红素和肌红蛋白(非血红素铁蛋白)的辅因子, 在人体的生理活动中, 是一种必不可少的元素; 然而, 过量的铁亦会对机体产生毒性作用[1]. 过量的铁蓄积可以通过诱导活性氧(reactive oxygen species, ROS)的产生而造成肝损伤[2]. 膳食铁的吸收是由二价金属离子转运体1(divalent metal transporter 1, DMT1)把其运至细胞内的, DMT1是存在于十二指肠的主要铁转运蛋白[3,4]. 铁调素(hepcidin)主要由肝脏实质细胞产生[5], 最近的研究[6]发现在被细菌激活的噬中性细胞和巨噬细胞中也会合成微量的铁调素. 膜铁转运蛋白1(ferroportin 1, FPN1)是一种铁转运体[7,8], 在十二指肠上皮细胞和脾脏巨噬细胞细胞膜上表达丰富, 作为铁调素的受体, 是铁从细胞内转运至血清内的唯一通道蛋白[9], 参与铁转运以及体内铁代谢的调节, 其表达异常会导致严重的铁代谢紊乱. 铁调素是维持铁代谢动态平衡的重要介质, 通过一种翻译后机制, 负性调节膜铁转运蛋白的表达水平[10]. 降低铁调素的表达会提高膜铁转运蛋白在十二指肠和巨噬细胞上的表达, 导致肠道铁吸收和内皮系统铁释放增加[11]. 在临床上我们发现慢性乙型、丙型肝炎患者常有铁代谢指标的异常, 但慢性乙型肝炎肝铁蓄积的报道比较少见, 关于慢性乙型、丙型肝炎患者铁代谢紊乱发生的机制尚不完全清楚. 我们评估了慢性乙型和丙型肝炎患者血清生化指标, 肝脏铁调素及十二指肠膜铁转运蛋白表达情况, 旨在探讨慢性乙型、丙型肝炎患者体内炎性反应与铁代谢调节的相互作用机制.
纳入2010-09/2012-09在昆明医科大学第一附属医院消化内科及感染科住院的慢性乙型肝炎患者组(HBV组)、慢性丙型肝炎患者组(HCV组)血清各45例, 体检健康成年人血清90例(各对照45例). 选取2010-09/2012-09在昆明医科大学第一附属医院住院的慢性丙型肝炎患者肝脏及十二指肠标本15例、慢性乙型肝炎患者肝脏及十二指肠标本12例以及排除HBV、HCV、十二指肠疾患及全身铁代谢疾病患者对照组12例. 符合2010版中国慢性乙型肝炎防治指南和2004年制定的中国慢性丙型肝炎防治指南的诊断标准[12]. 排除标准: 合并其他系统急、慢性感染患者; 合并甲、乙、丙、丁、戊型肝炎患者; 合并恶性肿瘤性疾病患者; 围手术期患者; 合并药物性肝损患者; 有长期大量饮酒史患者; 合并非酒精性脂肪肝患者; 合并上消化道出血患者; 急、慢性肝衰竭患者.
仪器和试剂: 低温高速离心机(Heraeus公司), 超低温冰箱(Forma公司), 日立7170A全自动生化仪(日立公司), Hepcidin-ELISA试剂盒[瑞士巴亨(Bachem)公司], 炎性细胞因子[白介素-6(interleukin 6, IL-6)、肿瘤坏死因子-α
(tumor necrosis factor alpha, TNF-α)]-ELISA试剂盒(R&D公司), 肝普鲁士蓝-铁染色试剂盒(Chemservic公司), anti-prohepcidin(Rabbit, 1:1000 dilution)(Bioss公司), anti-ferroportin antibody(Rabbit, 1:1000 dilution)(Pierce公司), HRP-conjugated goat anti-rabbit IgG(Boster Biol Tech公司), 免疫组织化学检测试剂盒及DAB显色试剂盒(北京中杉金桥生物技术有限公司).
对受试者于早晨空腹状态下进行血液样本采集, 血液样本收集之后, 立即分离出血清于-80 ℃冰箱保存备用. 采用相应的ELISA试剂盒检测血清铁调素、IL-1、IL-6、TNF-α, 全自动生化仪检测血清丙氨酸转氨酶(alanine transaminase, ALT)、天冬氨酸转氨酶(aspartate aminotransferases, AST)、铁(Fe). 在患者中, 15例HCV患者、12例HBV患者和12例对照组患者均患有上腹部隐痛或不适, 有做胃镜检查指征并给予胃镜检查, 排除十二指肠炎、消化性溃疡及胃癌等疾病, 进行十二指肠组织活检, 获得十二指肠样本. 有行肝穿刺指征者并签署了知情同意书, 获得肝脏组织标本. 本项研究由昆明医科大学伦理委员会批准, 并按照准则进行. 把肝脏和十二指肠活检标本浸泡于40 g/L的甲醛缓冲液中后, 石蜡包埋、切片(5 μm厚度)、免疫组织化学和肝脏铁蓝染色、镜检. 免疫组织化学检测肝脏铁调素及十二指肠膜铁转运蛋白表达情况, 肝脏铁蓝染色检测肝铁蓄积情况, 使用Image-Pro Plus6.0对免疫组织化学结果进行半定量分析计算IOD值, 并对结果进行统计学分析. 以上操作均严格按照说明书进行.
统计学处理 采用SPSS17.0统计软件进行数据分析, 计量资料采用mean±SD表示, 两组间比较, 如数据符合正态分布采用t检验, 如符合偏态分布则采用秩和检验, 相关分析采用Pearson直线相关分析, P<0.05为差异有统计学意义.
与对照组比较, HBV及HCV组血清IL-6、TNF-α、ALT、AST、Fe水平均明显升高(P<0.05), HBV、HCV组血清铁调素水平明显低于对照组(P<0.05), HCV组降低更明显(P<0.05)(表1).
血清铁调素和IL-6、TNF-α进行相关性分析发现, 在HBV组, 血清铁调素与IL-6、TNF-α均呈负相关(r = -0.510, P<0.05; r = -0.450, P<0.05); 在HCV组, 血清铁调素与IL-6呈负相关(r = -0.620, P<0.05), 与TNF-α呈正相关(r = 0.243, P<0.05).
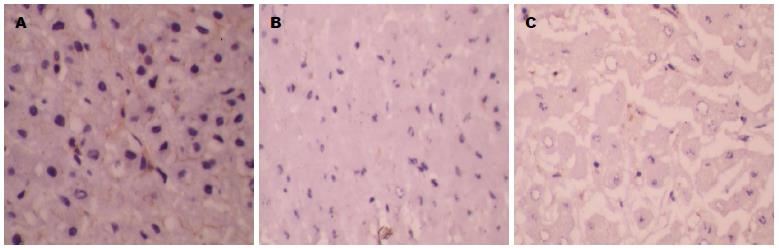
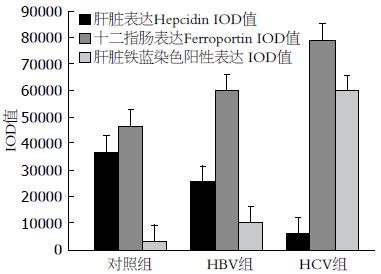
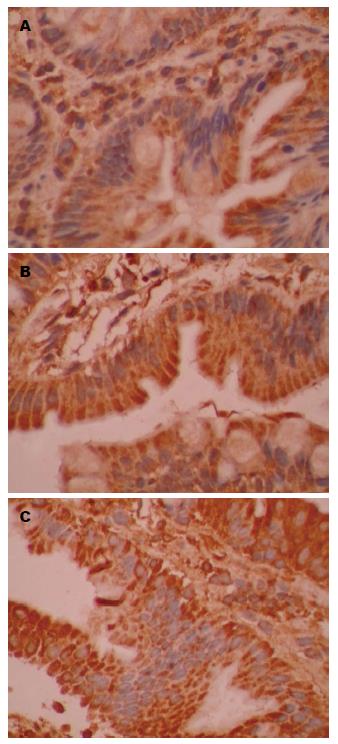
HBV、HCV组肝脏铁调素表达均较对照组明显降低(P<0.05)(图1, 2), HBV、HCV组十二指肠膜铁转运蛋白表达均较对照组明显增加(P<0.05), HCV组增加更为明显(P<0.05)(图2, 3).
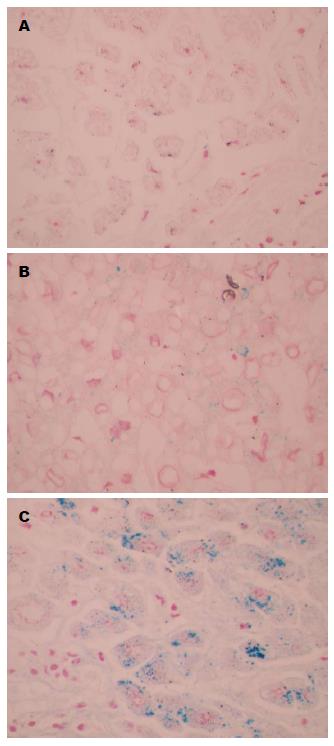
对照组、HBV组、HCV组肝脏铁蓝染色阳性表达的IOD值(mean±SD)分别为3241±326, 10211±1442, 59600±1817, HBV组、HCV组肝脏铁蓝染色的阳性表达均较对照组明显增加(P<0.05), HCV组增加更为明显(P<0.05)(图2, 4).
十二指肠膜铁转运蛋白表达和临床指标进行相关性分析发现, HBV及HCV组十二指肠膜铁转运蛋白表达与相关炎性细胞因子(IL-6、TNF-α)、肝功能指标(ALT、AST)均无明显相关关系, 与肝脏铁调素表达及血清铁调素水平呈显著负相关, 与血清Fe呈显著正相关(表2).
| 指标 | 分组 | r值 | P值 |
| 血清Fe | HBV组 | 0.611 | 0.001 |
| HCV组 | 0.637 | 0.001 | |
| ALT | HBV组 | 0.198 | 0.113 |
| HCV组 | 0.153 | 0.092 | |
| AST | HBV组 | 0.202 | 0.076 |
| HCV组 | 0.168 | 0.134 | |
| IL-6 | HBV组 | 0.153 | 0.073 |
| HCV组 | 0.179 | 0.078 | |
| TNT-α | HBV组 | 0.179 | 0.102 |
| HCV组 | 0.118 | 0.139 | |
| 血清铁调素 | HBV组 | -0.407 | 0.001 |
| HCV组 | -0.519 | 0.001 | |
| 肝脏铁调素 | HBV组 | -0.638 | 0.001 |
| HCV组 | -0.538 | 0.001 |
铁调素主要由肝脏实质细胞产生[5], 是铁进入血液循环的一个关键调节器[13], 通过抑制膜铁转运蛋白而发挥功能[10]. 膜铁转运蛋白是一种铁转运体[7,8], 他是铁转运出细胞的唯一通道蛋白[9], 参与肠道铁吸收和内皮系统铁释放[14]. 铁调素结合膜铁转运蛋白, 导致其内吞和降解[10], 从而抑制肠道铁吸收和内皮系统铁释放. 因此, 铁调素和膜铁转运蛋白的表达与机体铁代谢密切相关. Nishina等[11]曾报道, HCV转基因小鼠膜铁转运蛋白在十二指肠和巨噬细胞的表达显著上调. 然而, Nishina等[11]使用的HCV转基因小鼠模型的特点是缺乏肝脏炎症. 因此, 动物模型与具有血清IL-6水平升高的慢性丙型肝炎患者不同[15].
已有研究[16,17]证明, 慢性丙型肝炎患者有高水平的血清铁和肝脏铁蓄积. Sebastiani等[18]通过回顾性研究发现, 慢性乙型肝炎患者肝脏铁沉积和血清铁水平升高都很常见. Nagashima等[19]发现在慢性HBV和HCV感染中铁调素明显降低且降低的程度与体内铁总量负性相关. 铁调素的表达在丙型肝炎患者中低于乙型肝炎患者[20]. 与此前研究结果一致, 本研究证实了慢性乙型、丙型肝炎患者具有高水平的血清铁以及低水平的血清铁调素和肝脏铁调素. 这一结果提示肝脏铁调素水平的高低直接影响血清铁调素的水平. 此外, 研究结果显示十二指肠膜铁转运蛋白表达均明显上调, HCV组上调更明显, 这个观察结果与目前已经阐明的铁调素的功能一致, 当降低血清铁调素的水平时, 十二指肠膜铁转运蛋白水平增加, 在某种程度上增加慢性乙型、丙型肝炎患者肠道铁吸收, 导致血清铁呈高水平. 然而, 不排除高水平的血清铁可能是由于慢性乙型、丙型肝炎患者内皮系统膜铁转运蛋白表达增加所致. 最后, 本研究发现肝脏铁蓝染色阳性表达均较对照组明显增加, HCV组增加更明显, 提示慢性丙型肝炎与慢性乙型肝炎患者相比, 肝铁蓄积现象更明显, 说明十二指肠膜铁转运蛋白表达可能与肝铁蓄积密切相关, 十二指肠膜铁转运蛋白表达越多, 肝铁蓄积越明显. 有趣的是, 体外实验结果表明, 在肝癌细胞系中铁抑制了HCV的复制[21,22], 这些研究结果表明铁可以发挥抗病毒的作用, 提示肝脏铁蓄积可能是肝炎病毒感染后的一种防御性反应, 但铁蓄积又会对肝脏产生毒性作用.
已有研究[23]认为HBV、HCV患者体内TNF-α生成均会增加, HBV患者体内TNF-α水平上调可能是通过上调位于MHC区的6号染色体上的TNF-α基因完成的. 在HBV患者体内TNF-α可使肠道铁吸收及铁蛋白合成减少, 但机制尚不明确[24], HCV患者体内TNF-α上调机制也尚未完全明确, 本研究发现HBV、HCV组TNF-α水平均较对照组明显增加, 与此前已有研究相符. 此外, 研究发现在HBV组, TNF-α与铁调素呈负相关; 在HCV组, TNF-α与铁调素呈正相关, 提示TNF-α在HBV、HCV患者体内可能通过不同的机制参与体内铁代谢的调节, 我们推测在HBV组, TNF-α通过某种途径负反馈调节铁调素的生成, 而在HCV组则正反馈调节铁调素的生成. 铁过载和炎症能够明显诱导铁调素的表达[25,26], 红细胞生成、缺铁和缺氧可下调铁调素的表达[27]. IL-6是一种强有力的刺激肝铁调素表达的刺激因子[26,28]. 然而, 高水平的血清铁、IL-6以及肝脏中沉积的铁并没有造成慢性乙型、丙型肝炎患者铁调素的高水平. 事实上, 在慢性丙型肝炎患者中IL-6对铁调素的调控接受细胞因子信号传导抑制蛋白-1(suppressor of cytokine signaling-1, SOCS-1)和细胞因子信号传导抑制蛋白-3(suppressor of cytokine signaling-3, SOCS-3)的调节, 病毒复制量下降的细胞中的SOCS-1可能导致IL-6在上游促进铁调素的生成, 病毒复制量增加的细胞中的SOCS-3可能导致IL-6在上游抑制铁调素生成[19,29]; 在慢性乙型肝炎患者中, IL-6可以增加4-羟基苯丙胺(4-hydroxyamphetamine, HAMP)基因的转录活性[11,30], 本研究发现HBV、HCV组IL-6与铁调素均呈负相关, 看似与现存研究结果相矛盾, 说明HBV患者体内可能也存在SOCS-3调节途径. Liu等[31]研究显示铁调素有细胞内抗病毒作用, HCV感染后反馈性下调其表达. 尽管丙型肝炎病毒抑制铁调素表达的确切机制尚不完全清楚, 但是认为丙型肝炎病毒蛋白诱导的ROS抑制了铁调素的表达[11,32], 这有力的说明了, 慢性丙型肝炎患者体内ROS介导的信号转导对抗了炎症和铁感应通路对铁调素的调节, 而慢性乙型肝炎患者体内对铁调素的调节确切机制尚不完全清楚.
本研究发现HBV、HCV组十二指肠膜铁转运蛋白的表达与IL-6、TNF-α均无明显相关关系, 提示IL-6、TNF-α等HBV、HCV感染后产生的一系列细胞炎性因子可能是通过调节铁调素的水平间接调节膜铁转运蛋白的表达进而参与铁代谢的调节. 此外, HBV、HCV组十二指肠膜铁转运蛋白的表达与ALT、AST均无明显相关关系, 慢性乙型、丙型肝炎患者肝脏铁含量均较对照组增加, 而肝脏铁含量水平增加会导致肝脏损伤的发生和进展, 提示膜铁转运蛋白可能是通过上调血清铁水平导致肝脏铁蓄积间接参与肝脏损伤的发生和进展. 因此, 通过调控铁调素和膜铁转运蛋白的水平以控制肝脏铁蓄积从而控制慢性乙型、丙型肝炎患者肝脏损伤进程, 有望成为临床治疗慢性乙型、丙型肝炎病毒感染的新靶点.
在临床上常常发现慢性乙型、丙型肝炎患者有铁代谢指标的异常, 本文评估了慢性乙型、丙型肝炎患者血清生化指标, 肝脏铁调素及十二指肠膜铁转运蛋白表达情况, 旨在探讨慢性乙型、丙型肝炎患者体内炎性反应与铁代谢调节的相互作用机制.
阴赪宏, 研究员, 首都医科大学附属北京友谊医院感染与急救医学
已有研究证明, 慢性丙型肝炎患者有高水平的血清铁和肝脏铁蓄积. Sebastiani等通过回顾性研究发现, 慢性乙型肝炎患者有肝脏铁沉积和血清铁水平升高. Nagashima等发现在慢性HBV和HCV感染中铁调素明显降低且降低的程度与体内铁总量负性相关.
本研究评估了慢性乙型、丙型肝炎患者血清生化指标, 肝脏铁调素及十二指肠膜铁转运蛋白表达情况, 探讨慢性乙型、丙型肝炎患者体内炎性反应与铁代谢调节的相互作用机制, 寻找临床治疗慢性乙型、丙型肝炎病毒感染的新靶点.
铁调素: 是肝脏分泌的一种小分子肽, 属防卫素蛋白家族. 机体铁状况、贫血、缺氧、细菌、致炎物质和细胞因子等均可影响铁调素的表达水平. 铁调素具有抑制某些细菌和真菌生长繁殖的作用, 是机体"天然免疫"重要的效应分子, 同时可抑制肠道铁吸收和单核巨噬细胞系统铁释放, 是一种重要的负性铁调节激素, 在遗传性血色病、慢性病贫血等铁代谢相关性疾病发病机制方面发挥着重要作用, 可能是机体铁稳态调控途径中关键性的效应分子.
本文主要研究了慢性乙型、丙型肝炎患者体内炎性反应与铁代谢调节的相互作用机制, 为慢性乙型、丙型肝炎的治疗打下了一定的基础.
编辑: 韦元涛 电编:都珍珍
| 1. | Hentze MW, Muckenthaler MU, Andrews NC. Balancing acts: molecular control of mammalian iron metabolism. Cell. 2004;117:285-297. [PubMed] [DOI] |
| 2. | Fujita N, Horiike S, Sugimoto R, Tanaka H, Iwasa M, Kobayashi Y, Hasegawa K, Ma N, Kawanishi S, Adachi Y. Hepatic oxidative DNA damage correlates with iron overload in chronic hepatitis C patients. Free Radic Biol Med. 2007;42:353-362. [PubMed] [DOI] |
| 3. | Viatte L, Lesbordes-Brion JC, Lou DQ, Bennoun M, Nicolas G, Kahn A, Canonne-Hergaux F, Vaulont S. Deregulation of proteins involved in iron metabolism in hepcidin-deficient mice. Blood. 2005;105:4861-4864. [PubMed] [DOI] |
| 4. | Mackenzie B, Garrick MD. Iron Imports. II. Iron uptake at the apical membrane in the intestine. Am J Physiol Gastrointest Liver Physiol. 2005;289:G981-G986. [PubMed] [DOI] |
| 5. | Zhao C, Fang CY, Tian XC, Wang L, Yang PY, Wen YM. Proteomic analysis of hepatitis B surface antigen positive transgenic mouse liver and decrease of cyclophilin A. J Med Virol. 2007;79:1478-1484. [PubMed] [DOI] |
| 6. | Peyssonnaux C, Zinkernagel AS, Datta V, Lauth X, Johnson RS, Nizet V. TLR4-dependent hepcidin expression by myeloid cells in response to bacterial pathogens. Blood. 2006;107:3727-3732. [PubMed] [DOI] |
| 7. | Abboud S, Haile DJ. A novel mammalian iron-regulated protein involved in intracellular iron metabolism. J Biol Chem. 2000;275:19906-19912. [PubMed] [DOI] |
| 8. | Satoh K, Nigro P, Matoba T, O'Dell MR, Cui Z, Shi X, Mohan A, Yan C, Abe J, Illig KA. Cyclophilin A enhances vascular oxidative stress and the development of angiotensin II-induced aortic aneurysms. Nat Med. 2009;15:649-656. [PubMed] [DOI] |
| 9. | Hunter HN, Fulton DB, Ganz T, Vogel HJ. The solution structure of human hepcidin, a peptide hormone with antimicrobial activity that is involved in iron uptake and hereditary hemochromatosis. J Biol Chem. 2002;277:37597-37603. [PubMed] [DOI] |
| 10. | Nemeth E, Tuttle MS, Powelson J, Vaughn MB, Donovan A, Ward DM, Ganz T, Kaplan J. Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing its internalization. Science. 2004;306:2090-2093. [PubMed] [DOI] |
| 11. | Nishina S, Hino K, Korenaga M, Vecchi C, Pietrangelo A, Mizukami Y, Furutani T, Sakai A, Okuda M, Hidaka I. Hepatitis C virus-induced reactive oxygen species raise hepatic iron level in mice by reducing hepcidin transcription. Gastroenterology. 2008;134:226-238. [PubMed] [DOI] |
| 13. | Ganz T. Hepcidin, a key regulator of iron metabolism and mediator of anemia of inflammation. Blood. 2003;102:783-788. [PubMed] [DOI] |
| 14. | Fraenkel PG, Traver D, Donovan A, Zahrieh D, Zon LI. Ferroportin1 is required for normal iron cycling in zebrafish. J Clin Invest. 2005;115:1532-1541. [PubMed] [DOI] |
| 15. | Migita K, Abiru S, Maeda Y, Daikoku M, Ohata K, Nakamura M, Komori A, Yano K, Yatsuhashi H, Eguchi K. Serum levels of interleukin-6 and its soluble receptors in patients with hepatitis C virus infection. Hum Immunol. 2006;67:27-32. [PubMed] [DOI] |
| 16. | Hézode C, Cazeneuve C, Coué O, Roudot-Thoraval F, Lonjon I, Bastie A, Duvoux C, Pawlotsky JM, Zafrani ES, Amselem S. Liver iron accumulation in patients with chronic active hepatitis C: prevalence and role of hemochromatosis gene mutations and relationship with hepatic histological lesions. J Hepatol. 1999;31:979-984. [PubMed] [DOI] |
| 17. | Fujita N, Sugimoto R, Takeo M, Urawa N, Mifuji R, Tanaka H, Kobayashi Y, Iwasa M, Watanabe S, Adachi Y. Hepcidin expression in the liver: relatively low level in patients with chronic hepatitis C. Mol Med. 2007;13:97-104. [PubMed] [DOI] |
| 18. | Sebastiani G, Tempesta D, Alberti A. Hepatic iron overload is common in chronic hepatitis B and is more severe in patients coinfected with hepatitis D virus. J Viral Hepat. 2012;19:e170-e176. [PubMed] [DOI] |
| 19. | Nagashima M, Kudo M, Chung H, Ishikawa E, Hagiwara S, Nakatani T, Dote K. Regulatory failure of serum prohepcidin levels in patients with hepatitis C. Hepatol Res. 2006;36:288-293. [PubMed] [DOI] |
| 20. | Kotta-Loizou I, Vassilaki N, Pissas G, Kakkanas A, Bakiri L, Bartenschlager R, Mavromara P. Hepatitis C virus core+1/ARF protein decreases hepcidin transcription through an AP1 binding site. J Gen Virol. 2013;94:1528-1534. [PubMed] [DOI] |
| 21. | Fillebeen C, Rivas-Estilla AM, Bisaillon M, Ponka P, Muckenthaler M, Hentze MW, Koromilas AE, Pantopoulos K. Iron inactivates the RNA polymerase NS5B and suppresses subgenomic replication of hepatitis C Virus. J Biol Chem. 2005;280:9049-9057. [PubMed] [DOI] |
| 22. | Fillebeen C, Pantopoulos K. Iron inhibits replication of infectious hepatitis C virus in permissive Huh7.5.1 cells. J Hepatol. 2010;53:995-999. [PubMed] [DOI] |
| 23. | Miyachi H, Kobayashi Y, Relja B, Fujita N, Iwasa M, Gabazza EC, Takei Y. Effect of suppressor of cytokine signaling on hepcidin production in hepatitis C virus replicon cells. Hepatol Res. 2011;41:364-374. [PubMed] [DOI] |
| 24. | Kowdley KV. TNF-alpha in chronic hepatitis C: the smoking gun? Am J Gastroenterol. 1999;94:1132-1135. [PubMed] [DOI] |
| 25. | Pigeon C, Ilyin G, Courselaud B, Leroyer P, Turlin B, Brissot P, Loréal O. A new mouse liver-specific gene, encoding a protein homologous to human antimicrobial peptide hepcidin, is overexpressed during iron overload. J Biol Chem. 2001;276:7811-7819. [PubMed] [DOI] |
| 26. | Lee P, Peng H, Gelbart T, Wang L, Beutler E. Regulation of hepcidin transcription by interleukin-1 and interleukin-6. Proc Natl Acad Sci USA. 2005;102:1906-1910. [PubMed] [DOI] |
| 27. | Nicolas G, Chauvet C, Viatte L, Danan JL, Bigard X, Devaux I, Beaumont C, Kahn A, Vaulont S. The gene encoding the iron regulatory peptide hepcidin is regulated by anemia, hypoxia, and inflammation. J Clin Invest. 2002;110:1037-1044. [PubMed] [DOI] |
| 28. | Nemeth E, Rivera S, Gabayan V, Keller C, Taudorf S, Pedersen BK, Ganz T. IL-6 mediates hypoferremia of inflammation by inducing the synthesis of the iron regulatory hormone hepcidin. J Clin Invest. 2004;113:1271-1276. [PubMed] [DOI] |
| 29. | Gu JM, Lim SO, Oh SJ, Yoon SM, Seong JK, Jung G. HBx modulates iron regulatory protein 1-mediated iron metabolism via reactive oxygen species. Virus Res. 2008;133:167-177. [PubMed] [DOI] |
| 30. | Olmez OF, Gurel S, Yilmaz Y. Plasma prohepcidin levels in patients with chronic viral hepatitis: relationship with liver fibrosis. Eur J Gastroenterol Hepatol. 2010;22:461-465. [PubMed] [DOI] |
| 31. | Liu H, Trinh TL, Dong H, Keith R, Nelson D, Liu C. Iron regulator hepcidin exhibits antiviral activity against hepatitis C virus. PLoS One. 2012;7:e46631. [PubMed] [DOI] |
| 32. | Miura K, Taura K, Kodama Y, Schnabl B, Brenner DA. Hepatitis C virus-induced oxidative stress suppresses hepcidin expression through increased histone deacetylase activity. Hepatology. 2008;48:1420-1429. [PubMed] [DOI] |