修回日期: 2015-05-22
接受日期: 2015-06-10
在线出版日期: 2015-07-18
目的: 对益生菌增效治疗幽门螺杆菌(Helicobacter pylori, H. pylori)感染的系统评价/Meta分析进行再评价研究.
方法: 计算机检索CBM、CNKI、Wanfang Data、VIP Data、the Cochrane library、PubMed、Embase数据库, 收集关于益生菌增效治疗H. pylori感染的系统评价/Meta分析文章, 检索时间均从建库至2014-10. 由两位研究者按照纳入排除标准独立筛选文献、提取资料后, 采用OQAQ(Overview Quality Assessment of Questionnaire)量表评价纳入研究质量, 并采用GRADE(Grade of Recommendation, Assessment, Development, and Evaluation)系统进行证据质量分级.
结果: 共纳入11个相关Meta分析, 11个研究均评价了益生菌增效治疗H. pylori的根除率及总不良反应发生率, 其中3个研究详细评价了抗H. pylori具体不良反应发生率, OQAQ平均得分3.82分. GRADE系统的证据质量评价结果显示证据质量等级普遍较低.
结论: 当前益生菌增效治疗H. pylori感染具有一定的优势, 但Meta分析的总体质量较差, 证据水平较低, 临床医生应根据实际情况进行循证决策.
核心提示: 当前益生菌增效治疗幽门螺杆菌(Helicobacter pylori)感染有一定的优势, 建议根据益生菌的种类选择、治疗剂量、疗程及如何与其他药物合用等进一步开展大样本高质量的临床研究, 以期为临床实践提供高质量的证据.
引文著录: 周本刚, 肖政, 汪成琼, 刘梅, 李仕宇, 陈安海. 益生菌增效治疗幽门螺杆菌感染的Meta分析再评价. 世界华人消化杂志 2015; 23(20): 3326-3336
Revised: May 22, 2015
Accepted: June 10, 2015
Published online: July 18, 2015
AIM: To evaluate the relevant systematic reviews/meta-analyses that focused on probiotics as adjunctive therapy for Helicobacter pylori (H. pylori) infection.
METHODS: The systematic reviews/meta-analyses on probiotics as adjunctive therapy for H. pylori infection were searched in CBM, CNKI, Wanfang database, VIP Database, the Cochrane library, PubMed and Embase from inception to October 2014. Two reviewers screened the literature according to the inclusion criteria and extracted the data. The Overview Quality Assessment Questionnaire (OQAQ) was used to evaluate the quality of the included studies, and the GRADE system was used to evaluate the quality of evidence.
RESULTS: A total of 11 relevant meta-analyses were included, all of which evaluated the rate of H. pylori eradication and incidence of overall side effects (three evaluated the anti-H. pylori therapy-related side effects in detail). The mean OQAQ score was 3.82. Based on the GRADE system, the evidence quality was generally low.
CONCLUSION: Probiotics as adjunctive therapy for H. pylori infection have certain advantages, however, the overall quality of meta-analyses is poor, and the evidence level is low. Physicians should make an evidence-based decision according to the real condition.
- Citation: Zhou BG, Xiao Z, Wang CQ, Liu M, Li SY, Chen AH. Probiotics as adjunctive therapy for Helicobacter pylori infection: An overview of meta-analyses. Shijie Huaren Xiaohua Zazhi 2015; 23(20): 3326-3336
- URL: https://www.wjgnet.com/1009-3079/full/v23/i20/3326.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i20.3326
幽门螺杆菌(Helicobacter pylori, H. pylori)是一种定植于胃黏膜内的微需氧型的革兰阴性杆菌[1]. 目前已公认H. pylori与慢性胃炎、消化性溃疡、胃癌及胃黏膜相关性淋巴组织淋巴瘤密切相关[2], 世界卫生组织已把H. pylori列为Ⅰ类致癌因子[3]. 近年来由于抗生素的不合理应用, H. pylori对常用抗生素的耐药性越来越高, 以致目前推荐的H. pylori根除方案-传统三联疗法, 根除率在70%左右, 而H. pylori作为感染性疾病, 其根除率应高于90%[4]; 即使是含铋剂的四联疗法、序贯疗法、左氧氟沙星三联疗法或伴同疗法仍无法获得100%的根除率[2]. 此外, 抗生素的联合大量应用可导致肠道正常菌群失调, 出现腹胀、恶心、腹泻及便秘等一系列不良反应[5], 给临床治疗带来一定困难. 因此, 如何提高H. pylori的根除率, 降低其不良反应的发生率, 是广大临床医师最关注的问题. 近年来, 益生菌制剂的广泛应用为H. pylori的根除提供了新的思路.
益生菌(probiotic)是指适量给予对宿主健康有益的一些活的微生物[6]. 常见的菌株包括: 乳酸菌属, 芽孢杆菌属, 非常驻菌属; 根据所含菌种数可分为多联活菌制剂和单菌制剂[5]. 近年来国内外已公开发表多篇关于益生菌增效治疗H. pylori感染的系统评价/Meta分析文章, 但因纳入的研究质量各异, 尚缺乏再评价研究. 本研究旨在系统检索当前可得最佳证据, 循证评价益生菌增效治疗H. pylori感染的系统评价/Meta分析的方法学质量及其对结果的影响, 并运用GRADE(Grade of Recommendation, Assessment, Development, and Evaluation)系统对主要结局指标进行证据质量分级, 以期为临床医师合理选择最佳临床方案提供参考依据.
系统检索CBM、CNKI、Wanfang Data、VIP Data、the Cochrane library、PubMed、Embase数据库, 中文检索词为: 幽门螺杆菌、益生菌、乳酸菌、双歧杆菌、酵母菌、乳球菌、链球菌、肠球菌、微生态制剂、系统评价、系统综述、Meta分析、荟萃分析、循证分析、循证评价; 英文检索词为: Helicobacter pylori、Hp、H. pylori、Campylobacter pyloridis、probiotic、probiotics、Lactobacillus、Lactococcus、Bifidbacterium、yeast、yogurt、Saccharomyces、Streptococcus、Enterococcus、meta-analysis、systematic review; 根据不同的数据库特点, 采取主题检索与自由词检索结合的方式, 检索时间均为建库至2014-10, 无语种限制. 本研究不包括尚未公开发表的文献.
1.2.1 纳入标准: (1)研究对象: H. pylori感染需要根除的患者; (2)研究设计类型: Meta分析、系统评价; (3)结局指标: H. pylori根除率, 抗H. pylori相关性总不良反应发生率, 具体不良反应(腹泻、恶心、呕吐、上腹痛等)发生率; (4)干预措施: 试验组单独采用益生菌或益生菌联合与对照组相同的疗法, 对照组采用常规疗法(三联疗法、四联疗法、序贯疗法、单药等)或空白对照; (5)若2篇文献的结果雷同, 选择研究较多、数据更为全面的文献.
1.2.2 排除标准: (1)会议摘要, 评论; (2)只能获取摘要, 无法获取全文; (3)除外被完全更新的文献(否则即使部分重叠也被纳入).
1.2.3 文献筛选与资料提取: 由2名研究者根据纳入及排除标准独立浏览题目和摘要筛选文献, 必要时阅读全文取舍, 对符合标准的全文, 使用统一资料提取表提取数据, 提取完成后进行交叉核对, 如有争议则通过讨论解决或由第三方裁决. 资料提取内容如下: 作者、出处、发表时间、研究人群、纳入研究的总数、试验组及对照组干预措施、试验组及对照组的事件发生数、H. pylori的根除率、总不良反应发生率、亚组分析结果等. 只提取纳入研究中结局指标数据全面的资料.
1.2.4 文献质量和证据质量评价: 由2名研究者使用OQAQ(Overview Quality Assessment of Questionnaire)量表[7-9]独立评价SR/Meta分析的方法学质量, 不一致时找第三方协商或裁定. OQAQ量表共有9个方面10个条目, 前9个条目被评为是(报告并正确使用), 部分或不清楚(报告不全或部分正确)和否(没有报告或不正确), 第10个条目是对整个文献质量进行打分, 评价者根据前面9个问题的情况给1-7分, 1分代表该系统评价不符合标准, 7分代表该系统评价完全符合标准. 若前9项有1个以上条目回答为"不能确定", 则表明该系统评价存在"小的缺陷"; 若条目2、4、6、8中有回答为"否"者, 则说明存在"大的缺陷". 一般有明显缺陷者, 其综合评分为1分, 大的缺陷评为3分, 有小的缺陷者评分为5分. 7分代表无缺陷, ≥5分表示仅有极小或小缺陷(Good), 3-4分表示大缺陷(Poor), ≤2分表示极大缺陷(Very Poor). 应用GRADE系统[10]对系统评价/Meta分析的单个结局指标进行证据质量分级. 证据质量分级如下: (1)高质量(进一步研究不可能改变该疗效评估结果的可信度); (2)中等质量(进一步研究很可能影响该疗效评估结果的可信度, 且可能改变该评估结果); (3)低质量(进一步研究极有可能影响该疗效评估结果的可信度, 且该评估结果很可能改变); (4)极低质量(任何疗效评估结果都很不确定). 证据质量评定采用GRADEpro 3.6.1软件[11]由2名研究者同时进行, 出现意见分歧时通过协商解决.
统计学处理 (1)统一采用RR及其95%CI(或P值)表示结果效应的大小, 若Meta分析中为OR值, 则通过GRADEpro 3.6.1软件转换成RR值; (2)若SR/Meta分析中由于异质性检验选择模型错误, 则运用RevMan5.3软件进行校正, I2≤50%, P>0.1时采用固定效应模型(fixed effects model, FEM), P≤0.1, I2>50%时采用随机效应模型(random effects model, REM), P<0.05为差异有统计学意义.
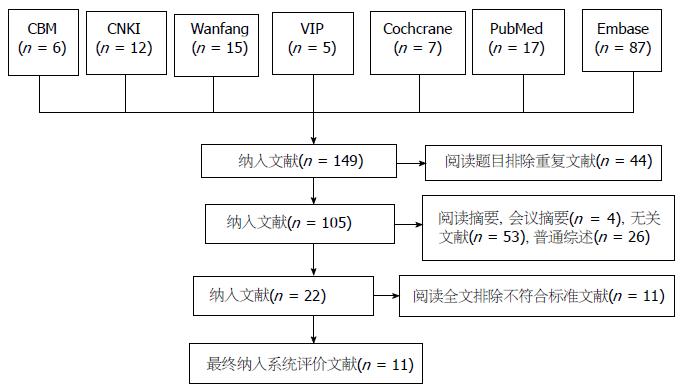
共检索文献149篇, 阅读题目排除重复文献44篇, 阅读摘要: 排除会议摘要4篇, 无关文献53篇, 普通综述26篇, 剩下文献22篇, 进一步查阅全文, 排除不符合标准文献11篇, 最终纳入11篇Meta分析[12-22], 文献筛选流程如图1.
本研究纳入2007-2014年间Meta分析文献共11篇, 中文文献5篇[15,17,18,21,22],
英文文献6篇[12-14,16,19,20], 其中发表地区为中国的有9篇[12,14,15,17-22], 约占总数的80.0%. 研究人群来源于亚洲、欧洲、南美洲, 纳入的人群中包括儿童和成人, 治疗对象包括初次治疗和复治(补救治疗)患者, 在11个研究中, 有8项研究[12,14,16-18,20-22]纳入随机对照试验(randomized controlled trial, RCT), 有1项[19]研究纳入平行对照试验, 有2项[13,15]纳入的为RCT或半RCT. 11个研究均报道了H. pylori的根除率和治疗过程中总不良反应的发生率. 有4个研究[14,16,17,21]评价了益生菌联合三联疗法(TT)根除H. pylori感染疗效, 有5个研究[13,14,16,19,20]评价了某种类型的益生菌联合三联、四联或序贯疗法的疗效, 具体信息详如表1.
| 纳入研究 | 发表时间 | 发表国家 | 纳入RCT数 | 研究对象 | 干预措施 | 结局指标 | 质量 | ||
| 病例数 | 研究人群 | 试验组 | 对照组 | ||||||
| Tong等[12] | 2007 | 中国 | 14 | 1671 | A、E、SA | P+TT或QT | TT或QT | (1)(2) | 4 |
| Sachdeva等[13] | 2009 | 印度 | 10a | 963 | A、E、SA | FMP, FMP+TT或QT | TT或QT或none | (1)(2) | 4 |
| Zou等[14] | 2009 | 中国 | 8 | 766 | E | P(LB)+TT | TT | (1)(2) | 5 |
| 龚芳红等[15] | 2009 | 中国 | 15a | 1572 | A | P, P+TT或QT | TT或QT | (1)(2) | 1 |
| Szajewska等[16] | 2010 | 波兰 | 5 | 1307 | A、E | P(SB)+TT | TT | (1)(2) | 5 |
| 李生等[17] | 2012 | 中国 | 15 | 1816 | A、E、SA | P+TT | TT | (1)(2) | 2 |
| 徐舒佳[18] | 2012 | 中国 | 25 | 3628 | A、E、SA | P+others | others | (1)(2) | 2 |
| Wang等[19] | 2013 | 中国 | 10b | 1469 | A、E、SA | P(LB+BB)+TT或ST或QT | TT或ST或QT | (1)(2) | 5 |
| Zheng等[20] | 2013 | 中国 | 9 | 1163 | A、E、SA | P(LB)+TT或ST | TT或ST | (1)(2) | 6 |
| 刘鹏鸿等[21] | 2014 | 中国 | 12 | 2480 | A、E | P+TT | TT | (1)(2) | 2 |
| 谢春红等[22] | 2014 | 中国 | 11 | 769 | A、E、SA1 | P+TT或ST | TT或ST | (1)(2) | 6 |
| 纳入研究 | 发表时间 | Q1 | Q2 | Q3 | Q4 | Q5 | Q6 | Q7 | Q8 | Q9 | Q10 | 缺陷 | 质量 |
| Tong等[12] | 2007 | Y | Y | Y | Y | Y | P | Y | P1 | Y | 4 | Major | Poor |
| Sachdeva等[13] | 2009 | Y | Y | Y | C | Y | P | Y | Y | Y | 4 | Major | Poor |
| Zou等[14] | 2009 | Y | Y | Y | Y | Y | P | Y | Y | Y | 5 | Minor | Good |
| 龚芳红等[15] | 2009 | Y | N | Y | N | N | N | Y | Y | Y | 1 | Extensive | Very Poor |
| Szajewska等[16] | 2010 | Y | Y | Y | Y | Y | Y | Y | P1 | Y | 5 | Minor | Good |
| 李生等[17] | 2012 | Y | N | Y | Y | Y | P | Y | Y | Y | 2 | Extensive | Very Poor |
| 徐舒佳[18] | 2012 | Y | Y | Y | N | Y | Y | Y | P1 | Y | 2 | Extensive | Very Poor |
| Wang等[19] | 2013 | Y | Y | Y | Y | Y | P | Y | Y | Y | 5 | Minor | Good |
| Zheng等[20] | 2013 | Y | Y | Y | Y | Y | Y | Y | Y | Y | 6 | Minor | Good |
| 刘鹏鸿等[21] | 2014 | Y | N | Y | C | Y | P | Y | Y | Y | 2 | Extensive | Very Poor |
| 谢春红等[22] | 2014 | Y | Y | Y | Y | Y | Y | Y | Y | Y | 6 | Minor | Good |
| 合计/均值2 | Y = 11 | Y = 8/ N = 3 | Y = 11 | Y = 7/ C = 2/ N = 2 | Y = 10/ N = 1 | Y = 4/ N = 1/ P = 6 | Y = 11 | Y = 8/ P = 3 | Y = 11 | 3.822 | Good(5)/Poor(2)/Very Poor(4) | ||
11个研究的总体质量较差, OQAQ评分在1-6分之间, 其平均得分为3.82. 5个研究存在小的缺陷(≥5分), 方法学质量为"Good"; 2个研究存在大缺陷(3-4分), 方法学质量为"Poor"; 4个研究存在极大缺陷(≤2分), 方法学质量为"Very poor". 有3个研究[12,16,18]计算模型选择错误, 但在更正模型后未改变原结局指标的方向. 详细评分如表2.
2.4.1 H. pylori的根除率: 11个Meta分析均评价了益生菌增效治疗H. pylori感染的根除率, 各研究结果均显示益生菌治疗组能有效提高H. pylori的根除率(表3). 有5个研究[13,14,16,19,20]明确了益生菌类型, 研究结果显示益生菌发酵奶(FMP)、乳酸菌(LB)、布拉氏酵母菌(SB)等在根除H. pylori有一定的疗效, 这5个研究的方法学质量较高, 但受到原始研究质量的影响, Zou等[14]的研究GRADE证据等级为"低级", 其他4个研究为"中级". Tong等[12]的研究中评价了初治和复治患者H. pylori的根除率, Meta分析结果显示, 按意向性治疗分析(intention-to-treat analysis, ITT), 益生菌增效治疗组较未联合益生菌组能有效提高初治患者H. pylori的根除率(RR = 1.13, 95%CI: 1.07-1.18, P = 0.0002), 也能提高复治患者的根除率(RR = 1.17, 95%CI: 1.03-1.24, P = 0.0002). 龚芳红等[15]研究评价了联合运用益生菌制剂和单独使用益生菌制剂与常规疗法相比治疗H. pylori的疗效, 研究结果显示, 与对照组相比, 联合应用益生菌制剂可以提高抗H. pylori感染治疗中的清除率(RR = 1.03, 95%CI: 1.07-1.11, P = 0.003), 单独应用益生菌制剂清除H. pylori感染差异无统计学意义(RR = 0.95, 95%CI: 0.74-1.09, P = 0.60), 但这2个研究的方法学质量较低, 且存在研究的局限性(隐藏和盲法的缺失), 不精确性(样本量较小)及发表性偏倚等降级因素, GRADE证据等级为"极低级". 谢春红等[22]是一项关于儿童初治患者研究, 经Meta分析发现, 与单用三联疗法或序贯疗法相比, 按ITT分析, 益生菌联合三联疗法或序贯疗法能有效提高H. pylori的根除率(RR = 1.20, 95%CI: 1.10-1.30, P<0.0001), 该研究OQAQ评分为6分, 方法学质量较高, 且GRADE证据等级为"高级", 提示在儿童初治患者中, 益生菌联合三联疗法或序贯疗法在提高H. pylori的根除率方面具有积极的作用.
| 纳入研究 | 发表时间 | H. pylori的根除率(关键结局) | 总不良反应发生率(重要结局) | ||||
| 总病例数 | 结果 | GRADE分级 | 总病例数 | 结果 | GRADE分级 | ||
| Tong等[12] | 2007 | 1074a 208b | ↑ | 中级1 极低级125 | 625 | ↓ | 低级14 |
| Sachdeva等[13] | 2009 | 943 | ↑ | 中级1 | 719 | ? | 极低级14 |
| Zou等[14] | 2009 | 766 | ↑ | 低级14 | 459 | ? | 极低级124 |
| 龚芳红等[15] | 2009 | 1572c 138d | ↑ ? | 极低级15 极低级145 | 536 | ↓ | 极低级145 |
| Szajewska等[16] | 2010 | 915 | ↑ | 中级1 | 1305 | ↓ | 低级12 |
| 李生等[17] | 2012 | 1805 | ↑ | 低级15 | 1464 | ↓ | 极低级125 |
| 徐舒佳[18] | 2012 | 3236 | ↑ | 中级1 | 3057 | ↓ | 低级12 |
| Wang等[19] | 2013 | 1409 | ↑ | 中级1 | 978 | ↓ | 低级14 |
| Zheng等[20] | 2013 | 1163 | ↑ | 中级1 | 739 | ? | 低级14 |
| 刘鹏鸿等[21] | 2014 | 2480 | ↑ | 中级1 | 2336 | ↓ | 低级12 |
| 谢春红等[22] | 2014 | 769 | ↑ | 高级 | 600 | ↓ | 低级24 |
2.4.2 总不良反应的发生率: 11个Meta分析均评价了在抗H. pylori治疗过程中总不良反应的发生率(表3). 有8个研究[12,15-19,21,22]结果均显示相比不含益生菌常规疗法, 益生菌联合治疗组能有效降低总不良反应的发生率; 有3个研究[13,14,20]结果显示, 益生菌试验组与对照组(不含益生菌的常规疗法)间差异无统计学意义. 徐舒佳[18]的研究在计算总不良反应的发生率时, 在I2 = 79%时作者错误选用FEM, 修正为REM后, 差异仍有统计学意义(RR = 0.56, 95%CI: 0.43-0.74, P<0.0001). 由于纳入原始研究的局限性(隐藏和盲法的缺失), 不精确性(样本量较小)及不一致性等降级因素的存在, GRADE证据等级为"低级"或"极低级".
2.4.3 H. pylori的根除率(亚组特征): (1)乳酸菌的种类分层: Zou等[14]的研究将乳酸菌分为3个亚组: 干酪乳杆菌, 嗜酸乳杆菌, 罗伊乳杆菌(表4), 研究人群来源于欧洲, 经Meta分析结果显示, 嗜酸乳杆菌联合三联疗法较单独三联疗法可提高H. pylori的根除率(RR = 1.14, 95%CI: 1.06-1.18), 但由于存在研究的局限性, 纳入的样本量较小, 不符合最优样本量(optimal information size, OIS)标准, 存在不精确性, GRADE证据质量为"低级"; 干酪乳杆菌、罗伊乳杆菌联合三联疗法较对照组差异无统计学意义, GRADE证据等级分别为"低级"和"极低级"; (2)益生菌的种类分层: 徐舒佳[18]的研究将益生菌分5个亚组: 益生菌混合制剂、乳酸菌、酵母菌、克劳氏芽孢杆菌、酪酸梭菌组(表4), 研究人群主要来源于亚洲、欧洲, 部分来源于南美洲, 研究结果显示, 益生菌混合制剂、乳酸菌、酵母菌联合治疗组可有效提高H. pylori的根除率, 但该研究的OQAQ评分为2分, 方法学质量较低, 鉴于纳入原始研究的局限性, GRADE证据等级为"中级". 克劳氏芽孢杆菌、酪酸梭菌联合治疗组由于纳入的原始研究样本量较小, 可能存在发表性偏倚, GRADE证据等级为"极低级"; (3)按益生菌疗程分组: 徐舒佳[18]的研究将纳入的24个RCT按益生菌疗程分为≤2 wk和>2 wk 2组(表4), 经Meta分析发现, 益生菌疗程≤2 wk(RR = 1.15, 95%CI: 1.09-1.20)和>2 wk(RR = 1.13, 95%CI: 1.08-1.17)均能有效提高H. pylori的根除率, 结果提示益生菌2 wk疗程的效果显著, 而延长治疗时间并不增加疗效. 由于受纳入原始研究局限性的影响, GRADE证据等级为"中级"; (4)按纳入前患者有无症状分组: Zou等[14]的研究将来源于欧洲的人群分为有症状组与无症状组(表4), 经Meta分析发现, 与单纯三联疗法相比, 有症状组的乳酸菌联合三联疗法组可有效提高H. pylori的根除率(RR = 1.16, 95%CI: 1.09-1.21), 而无症状组显示试验组与对照组差异无统计学意义, 提示乳酸菌联合三联疗法可提高有症状组的H. pylori的根除率, 但由于受纳入原始研究的局限性影响, GRADE证据等级为"中级". (5)按患者年龄分组: 徐舒佳[18]的研究结果显示, 与对照组相比, 益生菌联合治疗组能有效提高H. pylori的根除率, 与年龄无关(表4). 鉴于纳入原始研究的局限性, GRADE证据等级为"中级".
| 亚组分类 | 纳入研究 | 发表时间 | 亚组特征 | 研究人群 | 总病例数 | 描述性比较风险 | RR(95%CI) | GRADE分级 | |
| 对照风险a(不用P药)(每千人) | 干预风险(用P药)(每千人) | ||||||||
| 乳酸菌 | Zou等[14] | 2009 | 干酪乳杆菌 | E | 368 | 713 | 791(706-862) | 1.11(0.99-1.21) | 低级14 |
| Zou等[14] | 2009 | 嗜酸乳杆菌 | E | 365 | 821 | 936(871-969) | 1.14(1.06-1.18) | 低级14 | |
| Zou等[14] | 2009 | 罗伊乳杆菌 | E | 33 | 625 | 994(219-819) | 1.59(0.35-1.31) | 极低级145 | |
| 益生菌种类 | 徐舒佳[18] | 2012 | 混合制剂 | A, E, SA | 1165 | 725 | 826(783-870) | 1.14(1.08-1.2) | 中级1 |
| 徐舒佳[18] | 2012 | 乳酸菌 | A, E | 797 | 775 | 883(837-914) | 1.14(1.08-1.18) | 中级1 | |
| 徐舒佳[18] | 2012 | 酵母菌 | A, E | 875 | 708 | 800(751-850) | 1.13(1.06-1.2) | 中级1 | |
| 徐舒佳[18] | 2012 | 克劳氏芽孢菌 | A, E | 302 | 600 | 690(582-780) | 1.15(0.97-1.3) | 极低级145 | |
| 徐舒佳[18] | 2012 | 酪酸梭菌 | A | 97 | 880 | 933(774-986) | 1.06(0.88-1.12) | 极低级145 | |
| 益生菌疗程 | 徐舒佳[18] | 2012 | ≤2 wk | A, E | 1397 | 707 | 813(771-849) | 1.15(1.09-1.2) | 中级1 |
| 徐舒佳[18] | 2012 | >2 wk | A, E, SA | 1839 | 742 | 838(801-868) | 1.13(1.08-1.17) | 中级1 | |
| 纳入前 有无症状 | Zou等[14] | 2009 | 有症状组 | E | 484 | 775 | 899(844-937) | 1.16(1.09-1.21) | 中级1 |
| Zou等[14] | 2009 | 无症状组 | E | 222 | 775 | 806(682-883) | 1.04(0.88-1.14) | 低级14 | |
| 年龄 | 徐舒佳[18] | 2012 | 儿童组 | A, E, SA | 455 | 662 | 77(695-847) | 1.17(1.05-1.28) | 中级1 |
| 徐舒佳[18] | 2012 | 成人组 | A, E | 2781 | 738 | 83(804-856) | 1.13(1.09-1.16) | 中级1 | |
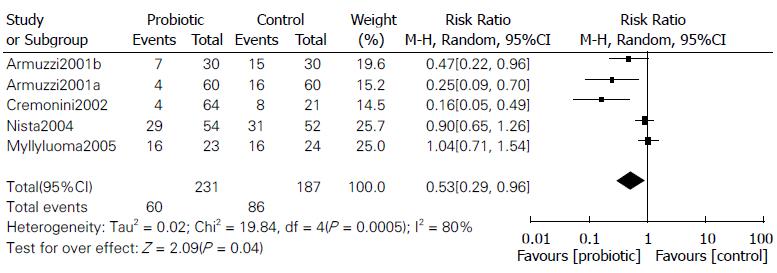
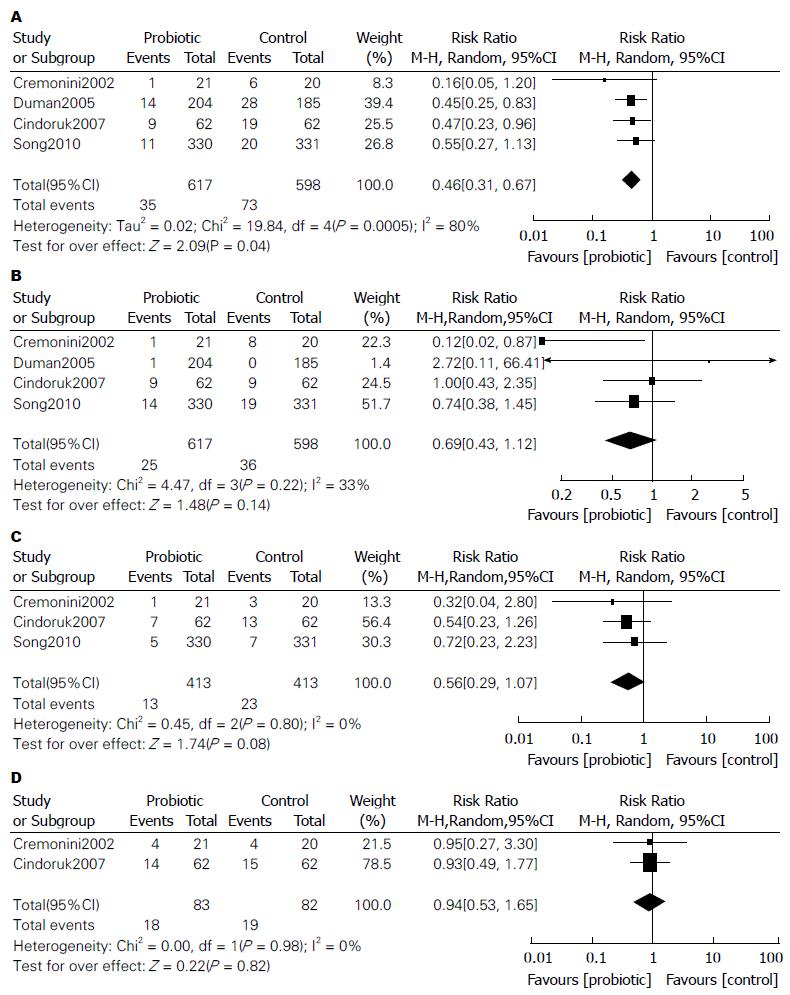
2.4.4 抗H. pylori相关具体不良反应发生率: 如表5所示, 有3个研究[12,14,16]详细评价了益生菌对治疗过程中具体不良反应的影响, 研究人群主要来源于亚洲、欧洲, 与对照组相比, Tong等[12]研究结果显示益生菌可降低腹泻、上腹痛、恶心、味觉紊乱/口干的发生率, Zou等[14]研究结果显示乳酸菌可有效降低腹泻、味觉紊乱/口干、上腹胀气/饱胀的发生率, Szajewska等[16]研究结果显示, 布拉氏酵母菌可降低腹泻的发生率, 但在上腹痛、恶心、味觉紊乱、上腹胀气/饱胀上, 两组间差异无统计学意义. 其中Tong等[12]纳入的5个原始研究[23-27]中"味觉紊乱的发生率", Szajewska等[16]研究中"腹泻(4个原始研究[25,28-30])、味觉紊乱(4个原始研究[25,28-30]、恶心(3个原始研究[25,29,30])、上腹胀气/饱胀的发生率(2个原始研究[25,29])"等结局指标计算模型选用错误, 纠正计算模型后未改变原结局指标方向(图2, 3). 然而, 由于纳入原始研究的局限性, 不精确性(样本量较小)等降级因素, GRADE证据等级为"低级"或"极低级".
| 不良反应类型 | 纳入研究 | 发表时间 | 研究人群 | 总病例数 | 描述性比较风险 | RR(95%CI) | GRADE分级 | |
| 对照风险a(不用P药)(每千人) | 干预风险(用P药)(每千人) | |||||||
| 腹泻(I) | Tong等[12] | 2007 | A, E | 997 | 161 | 61(40-90) | 0.38(0.25-0.56) | 低级14 |
| Zou等[14] | 2009 | E | 375 | 187 | 51(24-49) | 0.27(0.13-0.53) | 低级14 | |
| Szajewska等[16] | 2010 | A, E | 1215 | 122 | 57(39-84) | 0.47(0.32-0.69) | 低级14 | |
| 上腹痛(I) | Tong等[12] | 2007 | E | 608 | 230 | 157(104-226) | 0.68(0.45-0.98) | 低级14 |
| Szajewska等[16] | 2010 | A, E | 826 | 99 | 62(27-140) | 0.62(0.27-1.41) | 低级14 | |
| 恶心(N) | Tong等[12] | 2007 | E | 608 | 252 | 164(113-229) | 0.65(0.45-0.91) | 低级14 |
| Szajewska等[16] | 2010 | A, E | 826 | 56 | 31(16-60) | 0.56(0.29-1.08) | 低级14 | |
| 味觉紊乱(N) | Tong等[12] | 2007 | E | 419 | 460 | 224(124-419) | 0.53(0.27-0.91) | 极低级124 |
| Zou等[14] | 2009 | E | 225 | 315 | 94(47-176) | 0.3(0.15-0.56) | 低级14 | |
| Szajewska等[16] | 2010 | A, E | 1215 | 60 | 43(21-89) | 0.72(0.35-1.48) | 低级14 | |
| 上腹胀气/饱胀(N) | Zou等[14] | 2009 | E | 222 | 405 | 219(134-336) | 0.54(0.33-0.83) | 低级14 |
| Szajewska等[16] | 2010 | A, E | 165 | 232 | 218(123-382) | 0.94(0.53-1.65) | 低级45 | |
近年来, 随着微生态医学的兴起, 益生菌制剂在临床中得到了广泛的应用, 尤其在胃肠疾病中应用引起关注. 然而, 益生菌防治H. pylori感染的机制尚未完全阐明, 目前研究证明, 益生菌可能通过以下几种机制防治H. pylori感染[5,31-34]: (1)产生抑制或杀灭H. pylori的物质: 体外试验及动物实验研究证明益生菌可通过产生脂肪酸、细菌素、乳酸、过氧化氢等抑制或杀灭H. pylori; (2)竞争性抑制H. pylori的定植: 某些益生菌可定植于胃内, 与H. pylori竞争黏附于胃黏膜结合位点, 从而竞争性的抑制H. pylori的黏附; (3)抑制H. pylori感染后的炎症反应: 研究证明乳酸杆菌可抑制H. pylori所致的白介素-8分泌, 从而降低胃黏膜的炎症反应; (4)减少不良反应, 提高患者的依从性: 益生菌通过改善肠道菌群失调, 降低抗菌药物所致的腹泻、便秘等不良反应, 提高患者的依从性, 从而提高H. pylori的根除率. 系统评价/Meta分析被公认为评价临床疗效、制订临床指南和规范的基石, 特别是国际Cochrane协作网生产的系统评价, 因其严格的管理和质量保障系统, 生产的系统评价和Meta分析真实、可信[35]. 系统评价再评价(overviews of reviews)是全面收集同一疾病或同一健康问题的治疗、病因、诊断和预后等方面的相关系统评价进行再评价的一种综合研究方法, 他从更高层面对系统评价证据进行综合, 所含信息量更大, 临床适用性更强[36]. 本文比较全面的收集了关于益生菌增效治疗H. pylori感染的循证医学证据.
本次研究结果显示: (1)在根除率方面: 与常规疗法(三联疗法、四联疗法、序贯疗法等)相比, 益生菌增效治疗可提高初治患者H. pylori的根除率, 对复治患者也有一定的积极作用; 含乳酸菌、双歧杆菌、布拉氏酵母菌的益生菌在H. pylori的根除率上差异不明显; 益生菌2 wk疗程效果显著, 而延长治疗时间并不增加疗效; 单独益生菌治疗H. pylori感染可能有一定的积极作用; 在提高H. pylori的根除率上对纳入前有症状的患者明显, 但与年龄无关; 由于益生菌种类、剂量、疗程均不限, 因此上述结果有待进一步研究证实; (2)在不良反应方面: 益生菌可降低抗H. pylori治疗过程中的总不良反应发生率, 尤其是腹泻的发生率, 对上腹痛、恶心、味觉紊乱也有一定的积极作用, 但仍需进一步研究提供证据.
本文纳入11个Meta分析中的人群主要来源于亚洲、欧洲、南美洲, 人群适用范围较广. 然而, 本研究采用GRADE系统对其结局指标进行证据质量分级, 仅谢春红等[22]研究在H. pylori的根除率上为"高级", 其他研究的GRADE证据分级为"中级"、"低级"或"极低级", 这主要是由于纳入原始研究的局限性(盲法和隐藏的缺失), 不精确性(样本量较小)及可能存在发表性偏倚等降级因素, 故仍需进一步开展大样本高质量的RCT来证实.
本研究的局限性: (1)本研究纳入的11个Meta分析中原始研究有重叠, 对结果有一定的影响; (2)本研究纳入的Meta分析OQAQ平均分为3.82分, 存在大的缺陷, 总体质量较差, 除Zheng等[20]、谢春红等[22]2项研究质量较高外, 其他文献普遍存在文献检索不够全面系统, 对纳入的研究可能存在选择偏倚, 对原始研究的质量评价不恰当、数据合并不合理等问题, 使研究的可信性下降; (3)本研究无Cochrane系统评价, Cochrane系统评价被认为是最高级别的证据, 非Cochrane系统评价的制作质量可能不及Cochrane系统评价, 这使得研究结果的可靠性及真实性降低; (4)本研究仅纳入已发表的文献, 未检索尚未公开发表的文献, 可能存在发表偏倚.
总之, 本研究显示益生菌增效治疗H. pylori感染有一定的优势, 但基于原始研究的质量和GRADE分级, 建议临床医师根据临床实践情况进行循证决策. 在临床研究方面, 建议根据益生菌的种类选择、治疗剂量、疗程及如何与其他药物合用等进一步开展大样本高质量的RCT来证实; 在系统评价方面, 建议研究者最好运用国际Cochrane协作网提供的严格方案来生产系统评价/Meta分析, 以期得出更可靠的结论, 从而更好的指导临床实践.
目前临床上幽门螺杆菌(Helicobacter pylori, H. pylori)的根除面临两大难题: 抗生素的耐药导致H. pylori的根除率下降及抗生素的联合大量应用导致不良反应的发生, 近年来大量研究发现益生菌可提高H. pylori的根除率, 降低其抗生素相关性不良反应的发生.
刘纯杰, 研究员, 中国人民解放军军事医学科学院生物工程研究所
近年来有关益生菌增效治疗H. pylori感染的原始研究和系统评价/Meta分析文章层出不穷, 然而, 由于纳入研究的方法学质量和局限性, 尚缺乏再评价研究.
系统评价/Meta分析被公认为评价临床疗效、制订临床指南和规范的基石, 而系统评价再评价则从更高层面对系统评价证据进行综合, 所含信息量更大, 临床适用性更强; GRADE(Grade of Recommendation, Assessment, Development, and Evaluation)系统是2000年建立的用于评价证据质量和推荐等级的系统, 已被WHO、Cochrane协作网等一批著名机构的所采用, 杨克虎及曾宪涛等已发表了多篇文章, 详细地介绍了系统评价再评价及GRADE系统及软件的发展和运用.
近年来国内外已公开发表多篇关于益生菌增效治疗H. pylori感染的系统评价/Meta分析文章, 但因纳入的研究质量各异, 且多数研究未对研究结果进行证据评价, 本研究除了运用OQAQ(Overview Quality Assessment of Questionnaire)量表偱证评价此类研究的方法学质量, 同时运用GRADE系统对主要结局指标进行证据质量分级, 提供了比较全面、详细的表格信息, 可为临床医师合理选择最佳临床方案提供参考依据.
益生菌增效治疗H. pylori感染具有一定的优势, 但Meta分析的总体质量较差, 证据水平较低, 临床医生应根据实际情况进行循证决策.
系统评价再评价(overviews of reviews): 是全面收集同一疾病或同一健康问题的治疗、病因、诊断和预后等方面的相关系统评价进行再评价的一种综合研究方法;
益生菌(probiotic): 是指适量给予对宿主健康有益的一些活的微生物. 常见的菌株包括: 乳酸菌属, 芽孢杆菌属, 非常驻菌属; 根据所含菌种数可分为多联活菌制剂和单菌制剂.
近年来, 在医学研究领域里的系统评价/Meta分析的文献数量逐年增多, 对这类文献中相关同一类别的多个系统评价/Meta分析进行方法学质量和报告质量再评价和综合分析, 可以为读者提供更加全面、综合、准确的信息, 同时对于指导临床实践和规范Meta分析有较好的帮助.
编辑: 韦元涛 电编:闫晋利
| 1. | Dunn BE, Cohen H, Blaser MJ. Helicobacter pylori. Clin Microbiol Rev. 1997;10:720-741. [PubMed] |
| 2. | Malfertheiner P, Megraud F, O'Morain CA, Atherton J, Axon AT, Bazzoli F, Gensini GF, Gisbert JP, Graham DY, Rokkas T. Management of Helicobacter pylori infection--the Maastricht IV/ Florence Consensus Report. Gut. 2012;61:646-664. [PubMed] [DOI] |
| 3. | Fuccio L, Zagari RM, Minardi ME, Bazzoli F. Systematic review: Helicobacter pylori eradication for the prevention of gastric cancer. Aliment Pharmacol Ther. 2007;25:133-141. [PubMed] [DOI] |
| 4. | Graham DY, Lu H, Yamaoka Y. A report card to grade Helicobacter pylori therapy. Helicobacter. 2007;12:275-278. [PubMed] [DOI] |
| 6. | Reid G, Jass J, Sebulsky MT, McCormick JK. Potential uses of probiotics in clinical practice. Clin Microbiol Rev. 2003;16:658-672. [PubMed] [DOI] |
| 8. | Oxman AD, Guyatt GH. Validation of an index of the quality of review articles. J Clin Epidemiol. 1991;44:1271-1278. [PubMed] [DOI] |
| 9. | 王 应强, 罗 倩倩, 李 幼平, 邓 绍林, 李 向莲, 韦 诗友. 对射频消融术与肝切除术治疗小肝癌系统评价/Meta分析的方法学质量再评价. 中国偱证医学杂志. 2014;14:561-574. |
| 11. | 曾 宪涛, 田 国祥, 牛 玉明, 孙 竹, 李 胜, 冷 卫东. GRADE profiler软件的使用简介. 中国循证心血管医学杂志. 2011;3:390-392. |
| 12. | Tong JL, Ran ZH, Shen J, Zhang CX, Xiao SD. Meta-analysis: the effect of supplementation with probiotics on eradication rates and adverse events during Helicobacter pylori eradication therapy. Aliment Pharmacol Ther. 2007;25:155-168. [PubMed] [DOI] |
| 13. | Sachdeva A, Nagpal J. Effect of fermented milk-based probiotic preparations on Helicobacter pylori eradication: a systematic review and meta-analysis of randomized-controlled trials. Eur J Gastroenterol Hepatol. 2009;21:45-53. [PubMed] [DOI] |
| 14. | Zou J, Dong J, Yu X. Meta-analysis: Lactobacillus containing quadruple therapy versus standard triple first-line therapy for Helicobacter pylori eradication. Helicobacter. 2009;14:97-107. [PubMed] [DOI] |
| 16. | Szajewska H, Horvath A, Piwowarczyk A. Meta-analysis: the effects of Saccharomyces boulardii supplementation on Helicobacter pylori eradication rates and side effects during treatment. Aliment Pharmacol Ther. 2010;32:1069-1079. [PubMed] [DOI] |
| 18. | 徐 舒佳. 益生菌联合疗法根除幽门螺杆菌的荟萃分析. 浙江: 浙江大学 2012; . |
| 19. | Wang ZH, Gao QY, Fang JY. Meta-analysis of the efficacy and safety of Lactobacillus-containing and Bifidobacterium-containing probiotic compound preparation in Helicobacter pylori eradication therapy. J Clin Gastroenterol. 2013;47:25-32. [PubMed] [DOI] |
| 20. | Zheng X, Lyu L, Mei Z. Lactobacillus-containing probiotic supplementation increases Helicobacter pylori eradication rate: evidence from a meta-analysis. Rev Esp Enferm Dig. 2013;105:445-453. [PubMed] [DOI] |
| 21. | 刘 鹏鸿, 霍 丽娟. 益生菌联合三联疗法根除幽门螺杆菌的Meta分析. 中华实验和临床感染病杂志: 电子版. 2014;8:379-383. |
| 23. | Armuzzi A, Cremonini F, Bartolozzi F, Canducci F, Candelli M, Ojetti V, Cammarota G, Anti M, De Lorenzo A, Pola P. The effect of oral administration of Lactobacillus GG on antibiotic-associated gastrointestinal side-effects during Helicobacter pylori eradication therapy. Aliment Pharmacol Ther. 2001;15:163-169. [PubMed] [DOI] |
| 24. | Armuzzi A, Cremonini F, Ojetti V, Bartolozzi F, Canducci F, Candelli M, Santarelli L, Cammarota G, De Lorenzo A, Pola P. Effect of Lactobacillus GG supplementation on antibiotic-associated gastrointestinal side effects during Helicobacter pylori eradication therapy: a pilot study. Digestion. 2001;63:1-7. [PubMed] [DOI] |
| 25. | Cremonini F, Di Caro S, Covino M, Armuzzi A, Gabrielli M, Santarelli L, Nista EC, Cammarota G, Gasbarrini G, Gasbarrini A. Effect of different probiotic preparations on anti-helicobacter pylori therapy-related side effects: a parallel group, triple blind, placebo-controlled study. Am J Gastroenterol. 2002;97:2744-2749. [PubMed] [DOI] |
| 26. | Nista EC, Candelli M, Cremonini F, Cazzato IA, Zocco MA, Franceschi F, Cammarota G, Gasbarrini G, Gasbarrini A. Bacillus clausii therapy to reduce side-effects of anti-Helicobacter pylori treatment: randomized, double-blind, placebo controlled trial. Aliment Pharmacol Ther. 2004;20:1181-1188. [PubMed] [DOI] |
| 27. | Myllyluoma E, Veijola L, Ahlroos T, Tynkkynen S, Kankuri E, Vapaatalo H, Rautelin H, Korpela R. Probiotic supplementation improves tolerance to Helicobacter pylori eradication therapy--a placebo-controlled, double-blind randomized pilot study. Aliment Pharmacol Ther. 2005;21:1263-1272. [PubMed] [DOI] |
| 28. | Duman DG, Bor S, Ozütemiz O, Sahin T, Oğuz D, Iştan F, Vural T, Sandkci M, Işksal F, Simşek I. Efficacy and safety of Saccharomyces boulardii in prevention of antibiotic-associated diarrhoea due to Helicobacterpylori eradication. Eur J Gastroenterol Hepatol. 2005;17:1357-1361. [PubMed] [DOI] |
| 29. | Cindoruk M, Erkan G, Karakan T, Dursun A, Unal S. Efficacy and safety of Saccharomyces boulardii in the 14-day triple anti-Helicobacter pylori therapy: a prospective randomized placebo-controlled double-blind study. Helicobacter. 2007;12:309-316. [PubMed] [DOI] |
| 30. | Song MJ, Park DI, Park JH, Kim HJ, Cho YK, Sohn CI, Jeon WK, Kim BI. The effect of probiotics and mucoprotective agents on PPI-based triple therapy for eradication of Helicobacter pylori. Helicobacter. 2010;15:206-213. [PubMed] [DOI] |
| 33. | Gotteland M, Brunser O, Cruchet S. Systematic review: are probiotics useful in controlling gastric colonization by Helicobacter pylori? Aliment Pharmacol Ther. 2006;23:1077-1086. [PubMed] [DOI] |
| 34. | 何 晨熙, 刘 改芳. 益生茵在根除幽门螺杆菌治疗中的作用. 胃肠病学和肝病学杂志. 2014;23: 839-842. |