修回日期: 2015-05-20
接受日期: 2015-06-01
在线出版日期: 2015-07-18
目的: 本研究通过建立胆管癌大鼠模型, 以胆盐输出泵(bile salt export pump, Bsep)为研究对象, 初步探讨Bsep在胆管癌大鼠中的表达状况, 以期为治疗胆管癌的找到新的手段和方法.
方法: 取♂Wistar大鼠(体质量160 g±8 g)60只, 随机分为2组, 每组30只: 普通饮食对照组(简称对照组)予以普通饮食、3'-甲基-4,4'-二甲基氨偶氮苯(3'-Me-DAB)饮食实验组(简称实验组)予以含3'-Me-DAB饮食. 经过20 wk, 建立胆管癌大鼠模型, 取对照组和实验组胆管组织: (1)石蜡切片后用免疫组织化学SP(streptavidin-perosidase)法检测两组模型胆管组织的Bsep表达的强度; (2)Western blot法检测两组模型胆管组织的Bsep蛋白表达的强度.
结果: 免疫组织化学SP法及Western blot法结果均显示, 对照组Bsep表达阳性率高于实验组(66.21% vs 18.75%, χ2 = 10.11, P<0.05; 0.886±0.017 vs 0.297±0.011, P<0.05).
结论: 实验组大鼠的Bsep基因的表达较对照组减少, 提示我们在胆管癌的治疗中, Bsep有成为新的治疗靶点的可能.
核心提示: 建立胆管癌大鼠模型, 以胆盐输出泵(bile salt export pump, Bsep)为研究对象, 初步探讨Bsep在胆管癌大鼠中的表达状况, 以期为治疗胆管癌的找到新的手段和方法.
引文著录: 张孟瑜, 王洁萍, 冯春红, 李波, 夏先明. 胆盐输出泵在胆管癌大鼠胆管组织中的表达状况. 世界华人消化杂志 2015; 23(20): 3254-3258
Revised: May 20, 2015
Accepted: June 1, 2015
Published online: July 18, 2015
AIM: To develop a rat model of bile duct cancer and detect bile salt export pump (Bsep) expression in bile duct tissues of this model, in order to provide a new method for the prevention and treatment of bile duct cancer.
METHODS: Sixty Wistar rats were randomly divided into either a control group or an experimental group, with 30 rats in each group. The control group was fed an ordinary diet, and the experimental group was fed a 3'-Me-DAB diet. After 20 wk, the bile duct cancer model was successfully established. Bile duct tissues were taken from rats in both groups to detect the expression of Bsep by immunohistochemistry (streptavidin-peroxidase) and Western blot.
RESULTS: Both immunohistochemistry and Western blot analyses showed that the expression levels of Bsep were significantly higher in the control group than in the experiment group (66.21% vs 18.75%, χ2 = 10.11, P < 0.05; 0.886 ± 0.017 vs 0.297 ± 0.011, P < 0.05).
CONCLUSION: The expression of Bsep protein decreases significantly in rats with bile duct cancer, which suggests that drugs targeting Bsep may be a new therapeutic strategy for bile duct cancer.
- Citation: Zhang MY, Wang JP, Feng CH, Li B, Xia XM. Bile salt export pump expression in bile duct tissues of rats with bile duct cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(20): 3254-3258
- URL: https://www.wjgnet.com/1009-3079/full/v23/i20/3254.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i20.3254
胆管癌是肝胆系统中常见的也是难治的恶性肿瘤之一, 研究资料显示, 其发病率在近年呈升高的趋势, 但目前各种治疗方法和手段想要达到良好的效果仍然存在较大的难度. 现治疗胆管癌的方法是首选手术切除, 但手术有适应证和局限性, 首先手术切除率不高, 其次术后5年生存率也不高, 对合并严重心肺功能障碍, 肿瘤已发生浸润或转移者, 已失去了手术的条件, 但介入、放化疗等非手术治疗方法效果有限. 那么, 是否能寻求更为有效的方法呢? 而基因治疗是目前尚未广泛应用又极具前景的治疗方式, 所以, 我们尝试从相关基因入手, 胆盐输出泵(bile salt export pump, Bsep)基因与胆汁酸的排泄有关, 我们已进行实验证明其在肝胆系统部分疾病, 如高脂血症大鼠肝脏组织中表达增加, 那么他在肿瘤组织(胆管癌组织)中是否有表达呢? 目前尚无明确的研究, 因此, 本项目拟以Bsep为研究对象, 研究在胆管癌大鼠胆管细胞中Bsep基因表达的状况, 尝试为胆管癌治疗提供新的思路.
健康成年♂Wistar大鼠60只, 体质量160 g±8 g, 由泸州医学院动物实验中心提供. 所使用试剂及仪器包括: Western blot试剂盒(购自大连宝生物TaKaRa工程有限公司); Bsep单克隆抗体(购自CHEMICON公司, 美国); 冰冻切片机、HFsafe生物安全柜、显微摄像系统(PM-10A)等.
1.2.1 胆管癌大鼠模型制备: ♂Wistar大鼠随机分为2组, 每组30只: 普通饮食对照组(简称对照组)予以普通饮食、3'-甲基-4,4'-二甲基氨偶氮苯(3'-Me-DAB)饮食实验组(简称实验组)予以含3'-Me-DAB饮食. 实验组饲以含3'-Me-DAB饮食, 连续20 wk后改为自由进食. 对照组, 自由饮水及进食. 每天观察动物的精神状态、饮食状况及皮毛的变化等一般情况. 于实验第8、16、20 wk, 分别取出模型组动物各2、2、2只, 剖腹观察胆管情况, 记录胆管的形态质地等的变化, 20 wk后经病理检查证实胆管癌大鼠模型建立成功.
1.2.2 实验步骤: 取对照组和实验组胆管组织: (1)石蜡切片后用免疫组织化学SP法检测两组模型胆管组织的Bsep表达的强度; (2)Western blot法检测两组模型胆管及肝脏组织的Bsep蛋白表达的强度. Quantity One软件计算比较Western blot产物条带与β-actin条带的光密度的相对比值, 通过分析, 最终得出其在胆管组织中表达相对含量.
1.2.3 观察指标: Bsep在胆管癌大鼠胆管组织中表达情况.
统计学处理 采用SPSS19.0统计软件进行分析, 统计学方法测得数据用mean±SD表示, 判断组间差异采用t检验及χ2检验, P<0.05为差异有统计学意义.
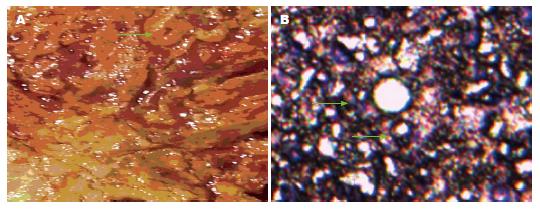
实验组大鼠自第6周开始, 逐渐出现进食量下降, 部分体质量与对照组相比明显偏低, 喂食至20 wk后死亡3只. 对照组大鼠生长较好, 未出现死亡病例. 20 wk后经病理检查证实已建立胆管癌大鼠模型, 实验组大鼠胆管肿瘤组织主要集中在肝门部及部分右肝组织(图1).
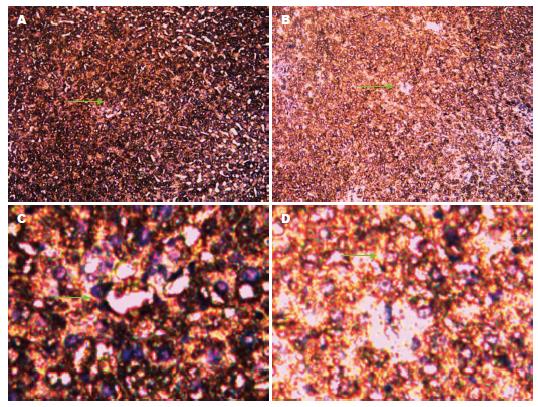
光学高倍(100倍及200倍)物镜下: 胆管组织中Bsep蛋白出现黄色染色颗粒为阳性细胞(绿色箭头所指). 每张切片随机选取6个视野, 每个视野内观察80个细胞, 阳性细胞≥10%为阳性, 否则为阴性. χ2检验显示: 实验组Bsep蛋白表达阳性率为18.75%, 对照组Bsep蛋白表达阳性率为66.21%(χ2 = 10.11, P<0.05), 差异有统计学意义(图2).
我们发现, 在160 kDa处出现了Bsep蛋白表达, 利用Quantity One软件, 我们得到实验组Bsep蛋白表达较低(0.297±0.011), 对照组Bsep蛋白表达较高(0.886±0.017); Bsep蛋白在对照组和实验组中表达差异有统计学意义(P<0.05)(图3).
胆管癌是肝胆系统常见的恶性肿瘤之一, 目前胆管癌的病因及发病机制尚不完全清楚, 经研究认为其发病是各种因素综合作用的结果, 且所经历的过程较长, 各种影响状况和条件较多. 现阶段我们可以得知的是, 胆管结石、先天性胆管扩张、华支睾吸虫、原发性硬化性胆管炎等都可能与胆管癌发病相关, 但具体的步骤、过程和变化途径并不十分明确. 由于胆管癌综合产生的因素较多, 所以目前的治疗有各种困难存在. 就现阶段的治疗方法来讲, 早期的特别是中下段胆管癌可以行根治性的手术切除, 但一旦肿瘤发生周围组织浸润或远处转移, 在身体其他器官发现了肿瘤病灶, 那么手术则不能再作为首选的治疗手段, 而介入治疗、化疗、放疗等治疗方法效果有限, 即便是经过上述的治疗, 胆管癌的复发率、转移率也较高, 5年生存率并未取得理想的结果, 其治疗方法有待提高. 所以, 我们反复思考, 能不能找到一种行之有效的办法呢? 而就目前而言, 基因治疗是一种尚未广泛应用又极具前景的治疗方案, 可能对胆管癌的治疗产生革命性的变化, 而Bsep基因与胆汁酸排泄有关[1-3], 如Bsep基因功能紊乱, 胆汁酸淤积形成胆管结石; 进而可能导致胆管细胞的恶变. 因此, Bsep基因进入了我们的思考范围并引导我们设计了上述的对比试验, 以期能发现一些与胆管癌相关的变化[4-6].
我们已有实验证实法尼基衍生物X受体(farnesyl derivatives X receptor, FXR)在胆管癌大鼠肝脏中的表达减弱, 那么, 作为FXR的靶基因, Bsep在胆管癌大鼠胆管组织中是否出现了相似的变化, 继续引导我们深入研究和思考. Bsep属于ATP结合盒超家族蛋白(ATP binding cassette, ABC), 在人类中其基因位于第2条染色体长臂上2q24-31, 其编码的蛋白叫ABCB11蛋白, 也称Bsep, 其对胆汁酸盐的排泄、胆汁酸盐浓度的稳定和胆汁酸盐的肠肝循环等生理功能具有重要作用[7-9]. 胆汁酸的肝肠循环需要各种转运体的参与, 且他们之间需相互调节来完成, 首先肝细胞合成胆汁酸, 接下来胆汁酸经Bsep作用主动分泌后转运至胆道[10-12], 而当胆汁酸进入肠道后, 重吸收过程则有所不同, 其中游离胆汁酸(石胆酸除外)在小肠和结肠通过扩散作用被动重吸收, 结合胆汁酸在回肠通过小肠刷状缘钠盐依赖的胆汁酸转运体(apical sodium-dependent bile acid transporte, ASBT), 胆汁酸结合蛋白和基侧膜的终末腔面钠盐依赖的胆汁酸转运体(terminal apical sodium-dependent bile acid transporter, tASBT)依次作为介质, 最终重吸收入门静脉. 而如果胆汁排泄障碍, Bsep功能紊乱, 则可能出现胆汁淤积, 而由于胆汁淤积, 胆固醇沉积, 胆色素析出, 则可能形成结石[13-15], 而胆管结石的存在, 正是我们目前了解的可能产生胆管癌的原因之一. 所以, Bsep基因的表达情况是我们所关注的重点.
我们在设计的试验中观察发现, 通过20 wk时间含3'-Me-DAB饮食的喂养成功建立胆管癌大鼠模型, 并且在试验中通过使用免疫组织化学, Western blot等方法进行检测, 从而证实胆管癌大鼠的胆管组织中Bsep基因出现了明显的变化, 表达降低显著, 较对照组有明显的减少, 说明胆管癌时胆汁酸的排泄开始紊乱, 出现了显而易见的困难[16-18], 由此我们初步考虑如果胆汁酸增加, 则会伴随Bsep基因表达增强, 从而加快胆汁酸的排泄, 而胆管癌时则出现了胆汁酸的代谢障碍, 大量胆汁酸在肝内无法排出, 胆固醇和胆色素的沉积刺激胆管上皮细胞, 进一步可能导致胆管细胞出现恶变. 在目前所用治疗胆管癌的药物普遍存在不同种类的问题, 可能无法完全达到治疗目的、服用时间长、胃肠道反应大, 患者可持续接受性差等缺点, 上述情况阻碍了其作为临床治疗药物的广泛应用, 但目前尚无可直接作用于胆管癌相关基因又可在临床广泛应用的药物. 在此, Bsep基因表达变化的发现, 可能为基础研究和临床治疗胆管癌提供新的药物治疗靶点[19,20], 找到一种新的治疗手段和方向.
胆管癌的发生发展过程非常复杂, 目前临床上一些手术及非手术治疗手段有限, 且效果并非十分理想.
刘金钢, 教授, 博士生导师, 中国医科大学附属盛京医院外科
目前研究的热点和重点为新型的治疗胆管癌的方法和药物, 而基因治疗是目前尚未广泛应用又极具前景的治疗方式, 所以尝试从相关基因入手, 为胆管癌治疗提供新的思路.
有研究介绍了Bsep基因在胆结石豚鼠肝组织中的表达情况, 初步阐明Bsep基因在胆结石豚鼠肝组织中表达下调可能与结石形成有关.
本文从胆管癌相关基因Bsep入手, 初步发现了Bsep在胆管癌组织中的表达状况, 为胆管癌治疗找寻新的方法.
通过初步发现Bsep在胆管癌大鼠胆管组织中的表达状况, 为进一步寻找作用于Bsep基因的药物打下基础, 从而改善胆管癌治疗的现状.
胆盐输出泵(Bsep): 是位于肝细胞毛细胆管面上的重要转运体, 对胆汁酸盐的排泄、浓度稳定的维持和胆汁酸盐的肠肝循环等生理功能具有重要作用.
本文立题新颖, 课题设计合理, 数据分析方法正确, 具有一定的科研价值.
编辑: 韦元涛 电编:闫晋利
| 1. | Pedersen JM, Matsson P, Bergström CA, Hoogstraate J, Norén A, LeCluyse EL, Artursson P. Early identification of clinically relevant drug interactions with the human bile salt export pump (BSEP/ABCB11). Toxicol Sci. 2013;136:328-343. [PubMed] [DOI] |
| 2. | Ogimura E, Sekine S, Horie T. Bile salt export pump inhibitors are associated with bile acid-dependent drug-induced toxicity in sandwich-cultured hepatocytes. Biochem Biophys Res Commun. 2011;416:313-317. [PubMed] [DOI] |
| 3. | Guyot C, Hofstetter L, Stieger B. Differential effects of membrane cholesterol content on the transport activity of multidrug resistance-associated protein 2 (ABCC2) and of the bile salt export pump (ABCB11). Mol Pharmacol. 2014;85:909-920. [PubMed] [DOI] |
| 4. | Warner DJ, Chen H, Cantin LD, Kenna JG, Stahl S, Walker CL, Noeske T. Mitigating the inhibition of human bile salt export pump by drugs: opportunities provided by physicochemical property modulation, in silico modeling, and structural modification. Drug Metab Dispos. 2012;40:2332-2341. [PubMed] [DOI] |
| 5. | Dawson S, Stahl S, Paul N, Barber J, Kenna JG. In vitro inhibition of the bile salt export pump correlates with risk of cholestatic drug-induced liver injury in humans. Drug Metab Dispos. 2012;40:130-138. [PubMed] [DOI] |
| 6. | Saber S, Vazifehmand R, Bagherizadeh I, Kasiri M. A novel ABCB11 mutation in an Iranian girl with progressive familial intrahepatic cholestasis. Indian J Hum Genet. 2013;19:366-368. [PubMed] [DOI] |
| 7. | Chen Y, Vasilenko A, Song X, Valanejad L, Verma R, You S, Yan B, Shiffka S, Hargreaves L, Nadolny C. Estrogen and Estrogen Receptor-α-Mediated Transrepression of Bile Salt Export Pump. Mol Endocrinol. 2015;29:613-626. [PubMed] [DOI] |
| 8. | Stieger B. Role of the bile salt export pump, BSEP, in acquired forms of cholestasis. Drug Metab Rev. 2010;42:437-445. [PubMed] [DOI] |
| 9. | Kis E, Ioja E, Rajnai Z, Jani M, Méhn D, Herédi-Szabó K, Krajcsi P. BSEP inhibition: in vitro screens to assess cholestatic potential of drugs. Toxicol In Vitro. 2012;26:1294-1299. [PubMed] [DOI] |
| 10. | Ulzurrun E, Stephens C, Crespo E, Ruiz-Cabello F, Ruiz-Nuñez J, Saenz-López P, Moreno-Herrera I, Robles-Díaz M, Hallal H, Moreno-Planas JM. Role of chemical structures and the 1331T>C bile salt export pump polymorphism in idiosyncratic drug-induced liver injury. Liver Int. 2013;33:1378-1385. [PubMed] [DOI] |
| 11. | Kubitz R, Dröge C, Kluge S, Stross C, Walter N, Keitel V, Häussinger D, Stindt J. Autoimmune BSEP Disease: Disease Recurrence After Liver Transplantation for Progressive Familial Intrahepatic Cholestasis. Clin Rev Allergy Immunol. 2015;48:273-284. [PubMed] [DOI] |
| 12. | Hrycay E, Forrest D, Liu L, Wang R, Tai J, Deo A, Ling V, Bandiera S. Hepatic bile acid metabolism and expression of cytochrome P450 and related enzymes are altered in Bsep (-/-) mice. Mol Cell Biochem. 2014;389:119-132. [PubMed] [DOI] |
| 13. | Köck K, Ferslew BC, Netterberg I, Yang K, Urban TJ, Swaan PW, Stewart PW, Brouwer KL. Risk factors for development of cholestatic drug-induced liver injury: inhibition of hepatic basolateral bile acid transporters multidrug resistance-associated proteins 3 and 4. Drug Metab Dispos. 2014;42:665-674. [PubMed] [DOI] |
| 14. | Kubitz R, Dröge C, Stindt J, Weissenberger K, Häussinger D. The bile salt export pump (BSEP) in health and disease. Clin Res Hepatol Gastroenterol. 2012;36:536-553. [PubMed] [DOI] |
| 15. | Stieger B. The role of the sodium-taurocholate cotransporting polypeptide (NTCP) and of the bile salt export pump (BSEP) in physiology and pathophysiology of bile formation. Handb Exp Pharmacol. 2011;205-259. [PubMed] [DOI] |
| 16. | Rodrigues AD, Lai Y, Cvijic ME, Elkin LL, Zvyaga T, Soars MG. Drug-induced perturbations of the bile acid pool, cholestasis, and hepatotoxicity: mechanistic considerations beyond the direct inhibition of the bile salt export pump. Drug Metab Dispos. 2014;42:566-574. [PubMed] [DOI] |
| 17. | Morgan RE, Trauner M, van Staden CJ, Lee PH, Ramachandran B, Eschenberg M, Afshari CA, Qualls CW, Lightfoot-Dunn R, Hamadeh HK. Interference with bile salt export pump function is a susceptibility factor for human liver injury in drug development. Toxicol Sci. 2010;118:485-500. [PubMed] [DOI] |
| 18. | Aleo MD, Luo Y, Swiss R, Bonin PD, Potter DM, Will Y. Human drug-induced liver injury severity is highly associated with dual inhibition of liver mitochondrial function and bile salt export pump. Hepatology. 2014;60:1015-1022. [PubMed] [DOI] |
| 19. | Garzel B, Yang H, Zhang L, Huang SM, Polli JE, Wang H. The role of bile salt export pump gene repression in drug-induced cholestatic liver toxicity. Drug Metab Dispos. 2014;42:318-322. [PubMed] [DOI] |
| 20. | Treiber A, Äänismaa P, de Kanter R, Delahaye S, Treher M, Hess P, Sidharta P. Macitentan does not interfere with hepatic bile salt transport. J Pharmacol Exp Ther. 2014;350:130-143. [PubMed] [DOI] |