修回日期: 2014-11-21
接受日期: 2014-11-27
在线出版日期: 2015-01-18
目的: 分析糖原合酶激酶3β(glycogen synthase kinase 3β, GSK-3β)在雷公藤甲素(triptolide, TPL)诱导胰腺癌细胞AsPC-1凋亡中的作用.
方法: 体外培养胰腺癌细胞AsPC-1, 采用TPL处理AsPC-1细胞及采用GSK-3β抑制剂LiCl预处理AsPC-1, 流式细胞仪分析细胞凋亡情况及采用Western blot分析GSK-3β、p-糖原合酶激酶-3β(p-glycogen synthase kinase-3β, p-GSK-3β)及B细胞淋巴瘤-2(B-cell lymphoma-2, Bcl-2)等蛋白表达水平.
结果: 6.54 ng/mL及15.51 ng/mL TPL处理对AsPC-1细胞活性有显著的抑制作用, 分别为39.64%及52.19%, 经LiCl预处理后其抑制作用减弱为27.36%及41.94%; 采用LiCl预处理组的细胞凋亡情况较相应浓度未经LiCl预处理组AsPC-1细胞的凋亡率降低; 经TPL处理后AsPC-1细胞中p-GSK-3β水平显著增加, 而GSK-3β的表达水平无显著性变化; 采用LiCl预处理后AsPC-1细胞中p-GSK-3β的表达水平增加, GSK-3β的表达水平无显著性变化, 且凋亡相关因子Bcl-2、B细胞淋巴瘤-xl(B-cell lymphoma-xl, Bcl-xl)及髓样细胞白血病-1(myeloid cell leukemia-1, Mcl-1)的表达水平降低.
结论: p-GSK-3β水平增加能够抑制TPL诱导的胰腺癌细胞的凋亡.
核心提示: 本研究采用流式细胞仪及Western blot检测雷公藤甲素(triptolide, TPL)处理后的胰腺癌细胞凋亡及p-糖原合酶激酶-3β(p-glycogen synthase kinase-3β, p-GSK-3β)、B细胞淋巴瘤-2(B-cell lymphoma-2)以及GSK-3β蛋白表达. 提示TPL可能是通过调节凋亡相关基因p-GSK-3β蛋白的表达最终诱导胃癌细胞胰腺癌细胞凋亡的重要机制.
引文著录: 毛振江, 李国庆, 黄靓, 南华大学附属第二医院湖南省衡阳市421001. GSK-3β在雷公藤甲素诱导胰腺癌细胞凋亡中的作用. 世界华人消化杂志 2015; 23(2): 256-260
Revised: November 21, 2014
Accepted: November 27, 2014
Published online: January 18, 2015
AIM: To investigate the role of glycogen synthase kinase 3β (GSK-3β) in triptolide induced apoptosis of pancreatic cancer cells.
METHODS: Pancreatic cancer AsPC-1 cells were treated with triptolide in the presence or absence of GSK-3β inhibitor LiCl. Cell apoptosis was assessed using flow cytometry. The expression of GSK-3β, p-glycogen synthase kinase-3β (p-GSK-3β) and B-cell lymphoma-2 (Bcl-2) proteins was detected by Western blot.
RESULTS: Treatment with triptolide (TPL) at 6.54 ng/mL and 15.51 ng/mL significantly reduced the growth of AsPC-1 cells, and the rates of reduced growth were 39.64% and 52.19%, respectively. LiCl pretreatment reduced the rates of reduced growth to 27.36% and 41.94%, respectively. LiCl pretreatment significantly reduced the apoptosis rate of AsPC-1 cells. Triptolide treatment significantly increased the level of p-GSK-3β in AsPC-1 cells, but had no significant impact on GSK-3β expression; LiCl pretreatment significantly increased the expression level of p-GSK-3β in AsPC-1 cells, had no significant impact on GSK-3β expression, and significantly reduced the expression of apoptosis-related factors Bcl-2, B-cell lymphoma-xl (Bcl-xl) and myeloid cell leukemia-1 (Mcl-1).
CONCLUSION: The increased level of p-GSK-3βcan inhibit triptolide induced pancreatic cancer cell apoptosis.
- Citation: Mao ZJ, Li GQ, Huang J. Role of GSK-3β in triptolide induced apoptosis of pancreatic cancer cells. Shijie Huaren Xiaohua Zazhi 2015; 23(2): 256-260
- URL: https://www.wjgnet.com/1009-3079/full/v23/i2/256.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i2.256
胰腺癌是一种恶性程度高的消化系肿瘤, 流行病学研究[1-3]显示近年来其发病率有上升趋势, 且表现出病程短、发现晚、转移早及预后差等特点. 目前主要的治疗手段为手术切除, 但大多患者发现时就属中晚期, 仅极小部分病灶是可以切除, 5年生存率低于5%. 雷公藤甲素(triptolide, TPL)是从雷公藤中提取的一种环氧二萜单体[4], 多项研究显示其具有明显的抑制胰腺癌细胞增殖, 促进凋亡及控制转移的作用, 能够阻断细胞周期, 抗细胞增殖的作用[5,6]. 糖原合酶激酶3(glycogen synthase kinase 3, GSK3)为一种调控多种细胞功能的关键酶[7], 有GSK-3α和GSK-3β两种单体, 有研究显示抑制GSK3的活性能够通过c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)介导的通路触发胰腺癌细胞的细胞凋亡[8], 本研究采用GSK-3β的抑制剂LiCl改变其活性对其在TPL在诱导胰腺癌细胞凋亡中的作用机制进行了分析.
TPL购自福州迈新; DMEM培养基、胎牛血清购自GIBCO; 0.25%胰酶、MTT试剂盒、BCA蛋白定量试剂盒、LiCl购自Sigma; 磷酸化GSK-3β、GSKβ及B细胞淋巴瘤-2(B-cell lymphoma-2, Bcl-2)等抗体购自Cell Signal公司; CO2恒温培养箱购自SANYO; Western blot电泳仪及酶标仪购自BIO-RAD; 流式细胞仪购自Becton-Dickinson Calid.
1.2.1 细胞培养及处理: 胰腺癌细胞株AsPC-1购自上海睿智化学研究有限公司, 在含10%胎牛血清的DMEM完全培养基在37 ℃、50 mL/L CO2及90%相对湿度的培养箱中培养.
1.2.2 药物处理: 将TPL用二甲基亚砜(dimethyl sulfoxide, DMSO)溶解配制成1 μg/mL的溶液, 再根据实验要求配制成相应浓度; 将处于对数期的AsPC-1细胞常规传代, 细胞培养24 h后, 再加入不同TPL药物浓度(6.54 ng/mL及15.51 ng/mL, 药物浓度的确定标准为人体服用最小剂量和最大剂量后血液浓度的1/10)的培养液同时设置对照组加入等体积培养液, 另设置LiCl(10 mmoL)预孵育后的TPL药物浓度(6.54 ng/mL及15.51 ng/mL)组, 每组设3个复孔.
1.2.3 4,5-二甲基噻唑-2(4,5-dimethyl-2-thiazolyl-2,5-diphenyl-2-H-tetrazolium bromide, MTT)比色法检测各组细胞增殖情况: 各组细胞培养48 h后, 吸净培养基, 加入2 mg/mL的MTT溶液50 μL/孔, 参照试剂盒说明书, 在570 nm波长下, 采用酶标仪检测各孔A值计算生长抑制率. 生长抑制率 = (1-药物处理组A值/对照组A值)×100%.
1.2.4 流式细胞仪检测各组细胞凋亡情况: 经处理培养后48 h的细胞, 将细胞经预冷PBS洗涤后, 用750 mL/L乙醇于-20 ℃条件下固定过夜, 洗涤离心15 min, 弃上清, 再用PBS洗涤2遍后调整细胞浓度, 加入10 μg/mL碘化丙啶(propidium iodide, PI)及0.1%RNaseA的PBS 500 μL, 避光染色30 min, 上机.
1.2.5 Western blot检测各组细胞中GSK-3β、p-GSK-3β及Bcl-2等的表达水平: 收集细胞, PBS洗涤后加入裂解液(50 mmol/L Tris-HCl pH 8.0, 150 mmoL PMSF, 0.1%NP-40, 蛋白酶抑制剂)混匀超声破碎冰浴裂解30 min, 12000 r/min离心15 min后取上清, 采用BCA法检测蛋白浓度; 取上述制备的蛋白样品50 μg上样到15%SDS-PAGE凝胶, 电泳完毕后将蛋白电转至NC膜, 用5%脱脂奶粉封闭, 分别加一抗, 37 ℃孵育2 h, 经0.1%TBST漂洗后加二抗(1:2000)室温孵育2 h, TBST洗膜后加ECL, X光胶片定影, 扫描后用IPP6.0进行图像分析.
统计学处理 运用SPSS17.0软件, 定量数据运用mean±SD表示, 定量资料采用t检验进行统计学分析, P<0.05表示差异有统计学意义.
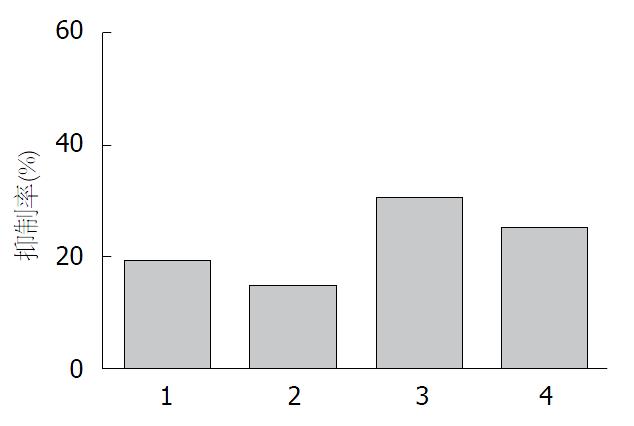
对胰腺癌细胞AsPC-1的抑制作用 经MTT法对各组胰腺癌AsPC-1细胞的活性进行检测结果显示, 经6.54 ng/mL及15.51 ng/mL TPL处理对AsPC-1细胞活性有显著的抑制作用, 分别为39.64%及52.19%, 经LiCl预处理后其抑制作用减弱为27.36%及41.94%(图1).
经流式细胞仪对各组细胞的凋亡情况进行比较结果显示, 在TPL处理组AsPC-1细胞的凋亡率显著增加, 且高浓度TPL促进细胞凋亡情况更为显著, 而采用LiCl预处理组的细胞凋亡情况较相应浓度未经LiCl预处理组AsPC-1细胞的凋亡率降低(表1).
| 分组 | 凋亡率 |
| 对照组 | 1.72±0.13 |
| 6.54 ng/mL TPL | 14.91±1.85 |
| 15.51 ng/mL TPL | 26.17±2.36 |
| 6.54 ng/mL TPL + LiCl | 8.42±1.47 |
| 15.51 ng/mL TPL + LiCl | 14.73±3.04 |
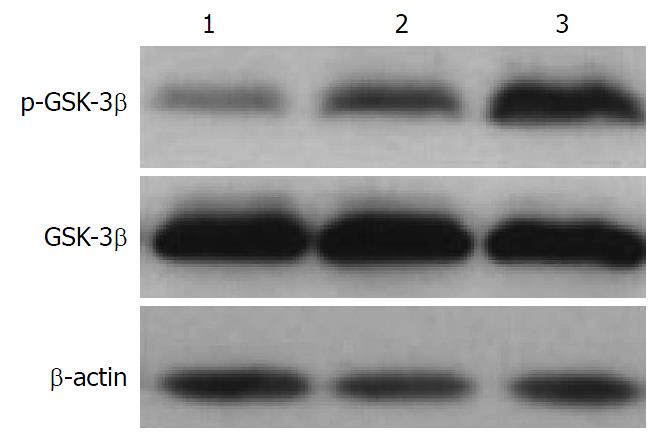
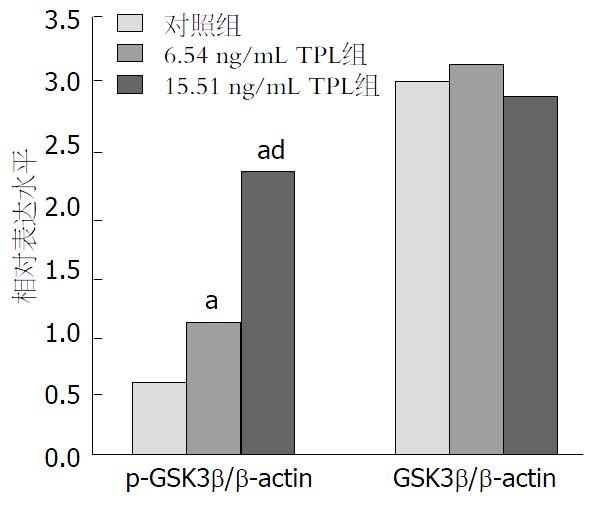
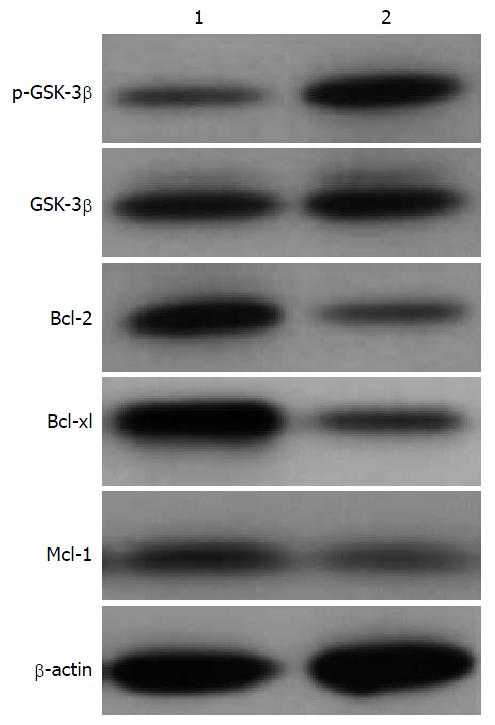
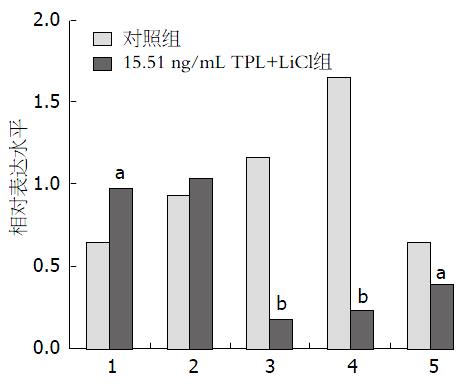
经TPL处理后AsPC-1细胞中p-GSK-3β水平显著增加, 且随着TPL浓度的增加p-GSK-3β的表达水平也随之增加, 而GSK-3β的表达水平无显著性变化(图2, 图3); 采用GSK-3β抑制剂LiCl预处理后AsPC-1细胞中p-GSK-3β的表达水平增加, GSK-3β的表达水平无显著性变化, 且凋亡相关因子Bcl-2、B细胞淋巴瘤-xl(B-cell lymphoma-xl, Bcl-xl)及髓样细胞白血病-1(myeloid cell leukemia-1, Mcl-1)的表达水平降低(图4, 图5).
胰腺癌作为恶性程度极高的消化系肿瘤, 约占全身恶性肿瘤的2%, 其发病率与死亡率相近, 中位生存期不足6 mo[9], 整体生存时间不超过两年. 由于其发病隐匿、位置深、病情发展快及恶性程度高等原因, 大多数患者就诊时已属晚期, 成为全球医疗界肿瘤诊治的难题[10,11]. 雷公藤是我国传统中药, 性温、味苦涩具有活筋活络、祛风除湿等功效. 其主要制剂TPL研究表明具有抗炎、抗生育、抗肿瘤及免疫抑制等作用, 研究表明对于多种肿瘤细胞具有较强的抑制作用[12]. 师宪平等[13]的研究采用TPL诱导淋巴细胞瘤细胞凋亡与对照组相比X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein, XIAP)及Mcl-1等的表达差异显著, 且存在剂量、时间依赖性. 周淑华[14]采用双向电泳技术分析TPL诱导胰腺癌细胞凋亡中差异表达蛋白结果显示角蛋白18与对照组比差异显著, 且存在时间及剂量效应关系.
GSK3是一种可以调控多种细胞功能的关键酶, 是调节糖原合成的关键激酶, 磷酸化糖原合酶并使之失活, 从而抑制糖原合成存进糖代谢[15]. GSK-3β N端第九位丝氨酸及GSK-3α第21位丝氨酸被包括丝氨酸/苏氨酸蛋白激酶(receptor serine/threonine kinases, AKT)、cAMP蛋白激酶A(cyclic-amp dependent protein kinase A, PKA)及蛋白激酶C(protein kinase C system, PKC)等在内的多种激酶磷酸化, 调节GSK的活性, 因此GSK参与到多种信号通路的调节[15-17]. 研究[18,19]表明GSK3的激活在多种情况下参与到细胞凋亡过程, 有研究表明GSK-3β的激活参与到抑癌蛋白肿瘤坏死因子相关的凋亡诱导配体(TNF-related apoptosis-inducing ligand, TRAIL)的抵抗过程, 后者为一种诱导细胞凋亡的配体, 是公认的抗癌物质. Saiprasad等[7]研究表明GSK-3β参与到PIK3/AKT介导的细胞凋亡过程. 本研究为了分析GSK-3β在TPL诱导胰腺细胞凋亡中的作用, 采用LiCl进行预处理AsPC-1, 结果表明, 采用TPL处理AsPC-1细胞, 细胞凋亡率显著升高, 而采用LiCl预处理的AsPC-1细胞的生长抑制情况显著改善, 细胞凋亡率也较相应浓度TPL处理的AsPC-1细胞显著降低, 采用Western blot分析经AsPC-1细胞相关蛋白表达情况, 显示经TPL处理后的细胞p-GSK-3β的表达水平显著升高, 且随着TPL的浓度升高而升高, 但GSK-3β的表达水平无显著性改变; 经LiCl预处理的AsPC-1细胞中凋亡相关因子Bcl-2、Bcl-xl及Mcl-1的表达水平降低.
总之, p-GSK-3β参与了胰腺癌AsPC-1细胞的凋亡过程, 其磷酸化水平增加能够抑制TPL诱导的胰腺癌细胞的凋亡.
胰腺癌是一种恶性程度很高的癌症, 其5年生存率<1%, 是临床中发现的预后最差的恶性肿瘤之一. 胰腺癌的发生和发展与肿瘤细胞的增殖与凋亡密切相关, p-糖原合酶激酶-3β(p-glycogen synthase kinase-3β, p-GSK-3β)、B细胞淋巴瘤-2(B-cell lymphoma-2, Bcl-2)以及GSK-3β为近年来研究最为常见的凋亡因子, 以其为药物抑制肿瘤生长的靶点具有前瞻性和实用性.
夏时海, 副教授, 副主任医师, 武警后勤学院附属医院肝胆胰脾科(中心)
国内外的许多研究均表明, p-GSK-3β、Bcl-2以及GSK-3β 3个蛋白是决定细胞凋亡的重要因素, 而雷公藤甲素(triptolide, TPL)对胰腺癌有治疗作用首先见于2012年美国学者的报道, 但关于其是否可影响p-GSK-3β、Bcl-2以及GSK-3β 3个蛋白的报道还没有报道, 因此研究其可填补这方面的空白.
目前的研究已经证实TPL对如白血病、乳腺癌及肺癌等多种癌症癌细胞组织中的p-GSK-3β、Bcl-2以及GSK-3β 3个酶蛋白表达均有一定的调控作用, 但关于其对胰腺癌的报道仅见于有治疗作用, 调控上述3个酶蛋白的表达还没有文献报道.
本研究显示TPL处理后可显著促进胰腺癌细胞中p-GSK-3β水平表达, 而GSK-3β的表达以及Bcl-2的表达水平无显著性变化, 提示TPL对胰腺癌的治疗可能是单纯通过调节GSK-3β信号通路中p-GSK-3β蛋白表达实现的, 这可能是其诱导胰腺癌细胞凋亡的重要机制.
研究显示TPL可在体外诱导胰腺癌细胞的凋亡, 并呈剂量和时间依赖性, 这些都提示, 调节凋亡相关基因p-GSK-3β表达是其可能作用机制, 但对TPL是否还可诱导其他肿瘤细胞凋亡, 其介导途径又是哪些均需进一步深入研究.
本文实验设计合理, 方法应用得当, 研究结果具有一定的科学与可读性.
编辑: 韦元涛 电编:闫晋利
| 1. | 顾 凯, 吴 春晓, 鲍 萍萍, 王 春芳, 彭 鹏, 龚 杨明, 向 泳梅, 黄 哲宙, 金 凡, 郑 莹. 上海市胰腺癌流行现况、回顾与比较分析. 外科理论与实践. 2009;14:510-515. |
| 4. | 胡 永红, 曾 克勤, 张 明敏, 涂 胜豪, 赖 先阳, 张 玮琛. 雷公藤甲素对胶原诱导的关节炎大鼠滑膜细胞核转录因子κB表达与活性的影响. 中华风湿病学杂志. 2004;8:515-518. |
| 5. | Shao H, Ma J, Guo T, Hu R. Triptolide induces apoptosis of breast cancer cells via a mechanism associated with the Wnt/β-catenin signaling pathway. Exp Ther Med. 2014;8:505-508. [PubMed] |
| 6. | Wu J, Li QQ, Zhou H, Lu Y, Li JM, Ma Y, Wang L, Fu T, Gong X, Weintraub M. Selective tumor cell killing by triptolide in p53 wild-type and p53 mutant ovarian carcinomas. Med Oncol. 2014;31:14. [PubMed] [DOI] |
| 7. | Saiprasad G, Chitra P, Manikandan R, Sudhandiran G. Hesperidin induces apoptosis and triggers autophagic markers through inhibition of Aurora-A mediated phosphoinositide-3-kinase/Akt/mammalian target of rapamycin and glycogen synthase kinase-3 beta signalling cascades in experimental colon carcinogenesis. Eur J Cancer. 2014;50:2489-2507. [PubMed] [DOI] |
| 8. | Wei M, Zhang M, Adams A, Duan Y. JNK and AKT/GSK3β signaling pathways converge to regulate periodontal ligament cell survival involving XIAP. Biochem Biophys Res Commun. 2014;448:485-491. [PubMed] [DOI] |
| 11. | Löhr JM, Haas SL, Kröger JC, Friess HM, Höft R, Goretzki PE, Peschel C, Schweigert M, Salmons B, Gunzburg WH. Encapsulated cells expressing a chemotherapeutic activating enzyme allow the targeting of subtoxic chemotherapy and are safe and efficacious: data from two clinical trials in pancreatic cancer. Pharmaceutics. 2014;6:447-466. [PubMed] [DOI] |
| 15. | 宋 晓红, 翁 丹卉, 邢 辉, 卢 运萍, 王 世宣, 马 丁. 糖原合酶激酶-3β磷酸化抑制顺铂诱导卵巢癌细胞凋亡的研究. 华中科技大学学报(医学版). 2009;38:645-648. |
| 16. | Sokolosky M, Chappell WH, Stadelman K, Abrams SL, Davis NM, Steelman LS, McCubrey JA. Inhibition of GSK-3β activity can result in drug and hormonal resistance and alter sensitivity to targeted therapy in MCF-7 breast cancer cells. Cell Cycle. 2014;13:820-833. [PubMed] [DOI] |
| 17. | Singh V, Lin R, Yang J, Cha B, Sarker R, Tse CM, Donowitz M. AKT and GSK-3 are necessary for direct ezrin binding to NHE3 as part of a C-terminal stimulatory complex: role of a novel Ser-rich NHE3 C-terminal motif in NHE3 activity and trafficking. J Biol Chem. 2014;289:5449-5461. [PubMed] [DOI] |
| 18. | Zhang JS, Herreros-Villanueva M, Koenig A, Deng Z, de Narvajas AA, Gomez TS, Meng X, Bujanda L, Ellenrieder V, Li XK. Differential activity of GSK-3 isoforms regulates NF-κB and TRAIL- or TNFα induced apoptosis in pancreatic cancer cells. Cell Death Dis. 2014;5:e1142. [PubMed] [DOI] |
| 19. | Beurel E, Blivet-Van Eggelpoël MJ, Kornprobst M, Moritz S, Delelo R, Paye F, Housset C, Desbois-Mouthon C. Glycogen synthase kinase-3 inhibitors augment TRAIL-induced apoptotic death in human hepatoma cells. Biochem Pharmacol. 2009;77:54-65. [PubMed] [DOI] |