修回日期: 2014-11-21
接受日期: 2014-12-05
在线出版日期: 2015-01-18
目的: 检测PIK3CA、PIK3CB和多药耐药基因1(muhidrug resistance 1, MDR-1)、肺耐药蛋白(lung cancer resistance protein, LRP)、谷胱甘肽转移酶π(glutathione-S-transferase π, GST-π)、DNA拓扑异构酶Ⅱ(DNA topoisomeraseⅡ, TopoⅡ)在大肠癌中的表达, 探讨PIK3CA、PIK3CB对大肠癌多药耐药性的影响.
方法: 应用免疫组织化学EnVision法检测316例大肠癌组织中PIK3CA、PIK3CB、MDR-1、LRP、GST-π和TopoⅡ的表达情况, 并结合临床病理因素进行分析.
结果: 316例大肠癌中, PIK3CA、PIK3CB的表达与肿瘤的分化程度、淋巴结转移成正相关, 其相关系数分别为0.136、0.168. MDR基因在大肠癌组织中的阳性率分别为: MDR-1为72.78%(230/316)、LRP为70.89%(224/316)、TOPⅡ为77.53%(245/316)及GST-π为76.58%(242/316). 经Spearman相关性分析, PIK3CA、PIK3CB的表达与多药耐药蛋白MDR-1、LRP、GST-π的表达均成正相关, 相关系数分别为0.288、0.128、0.197. 316例大肠癌患者的中位生存期为60 mo, 5年生存率为47.5%, Kaplan-Meier分析结果显示, PIK3CA与PIK3CB同时高表达、淋巴结转移、MDR-1( + )、GST-π( + )患者术后5年生存率明显降低. Cox比例风险模型显示, PIK3CA( + )PIK3CB( + )、淋巴结转移、MDR-1、GST-π是影响大肠癌患者预后的独立因素.
结论: PIK3CA、PIK3CB与大肠癌的多药耐药密切相关, PIK3CA、PIK3CB、淋巴结转移、MDR-1、GST-π是影响大肠癌患者预后的独立因素, 检测PIK3CA、PIK3CB为临床合理选择化疗药物、初步判断预后具有重要参考价值.
核心提示: PIK3CA、PIK3CB与大肠癌的多药耐药密切相关, PIK3CA、PIK3CB、淋巴结转移、多药耐药基因1(multidrug resistance-1)、谷胱甘肽转移酶π(glutathione-S-transferase π)是影响大肠癌患者预后的独立因素, 检测PIK3CA、PIK3CB为临床合理选择化疗药物、初步判断预后具有重要参考价值.
引文著录: 温菲菲, 吴淑华, 李扬扬, 高向前, 何双. 大肠癌组织中PIK3CA、PIK3CB蛋白与多药耐药基因产物表达的相关性及其临床意义. 世界华人消化杂志 2015; 23(2): 202-209
Revised: November 21, 2014
Accepted: December 5, 2014
Published online: January 18, 2015
AIM: To investigate the clinical significance of expression of PIK3CA, PIK3CB and proteins associated with multidrug resistance (MDR) in colorectal cancer (CRC) and to analyze their correlations.
METHODS: Immunohistochemistry was employed to detect the expression of PIK3CA, PIK3CB, multidrug resistance-1 (MDR-1), lung cancer resistance protein (LRP), glutathione-S-transferase π (GST-π), and DNA topoisomerase Ⅱ (Topo Ⅱ) in 316 CRC specimens. Patients were followed annually by telephone or at an outpatient clinic.
RESULTS: The overexpression rates of MDR-1, LRP, Topo II, and GST-π in CRC were found to be 72.78%, 70.89%, 77.53%, and 76.58%, respectively. Correlation analysis showed that PIK3CA and PIK3CB expression exhibited a positive correlation with MDR-1, LRP, and GST-π expression (r = 0.288, 0.128, and 0.197, respectively; P<0.05). PIK3CA and PIK3CB expression was correlated with the degree of tumor differentiation and lymph node metastasis (P<0.05). Kaplan-Meier analysis revealed that the 5-year survival rate was significantly correlated with lymph node metastasis, positive expression of PIK3CA and PIK3CB, and negative expression of GST-π and MDR-1. Multivariate analysis revealed that GST-π and MDR-1 expression and lymph node metastasis could serve as independent predictive factors of overall survival.
CONCLUSION: The expression of both PIK3CA and PIK3CB is increased and related to the development and progression of CRC and MDR. The combined detection of PIK3CA and PIK3CB is of great significance for prognostic evaluation and therapy optimization in patients with CRC.
- Citation: Wen FF, Wu SH, Li YY, Gao XQ, He S. Expression of PIK3CA, PIK3CB and proteins associated with multidrug resistance in colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2015; 23(2): 202-209
- URL: https://www.wjgnet.com/1009-3079/full/v23/i2/202.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i2.202
大肠癌是我国常见的消化系肿瘤, 目前大肠癌的治疗仍以手术辅助以放化疗为主, 而肿瘤细胞对化疗药物的耐药性严重地影响了大肠癌的临床化疗效果. 临床上大约有50%的大肠癌化疗患者完全对化疗药物产生耐药性[1]. 肿瘤的耐药机制复杂, 有关研究显示, 细胞信号通路异常不仅参与肿瘤的发生, 并且与肿瘤细胞的耐药性密切相关[2,3]. 本实验通过检测磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinases, PI3K)/AKT信号通路中关键分子PIK3CA、PIK3CB及多药耐药基因肺耐药蛋白(lung cancer resistance protein, LRP)、谷胱甘肽转移酶π(glutathione-S-transferase π, GST-π)、DNA拓扑异构酶Ⅱ(DNA topoisomeraseⅡ, TopoⅡ)、多药耐药基因1(multidrug resistance 1, MDR-1)在大肠癌组织中的表达情况, 探讨PIK3CA、PIK3CB与大肠癌多药耐药的相关性, 为临床合理选择化疗药物及判断预后提供有价值的标志物.
收集滨州医学院附属医院病理科2005-01/2009-01存档的结直肠癌蜡块共316例, 选取所有病例均为首次发现, 术前未行任何放化疗, 术后均进行了联合化疗. 分化程度: 高分化161例, 中、低分化155例; 管状腺癌281例, 黏液腺癌35例; 淋巴结转移者192例, 无淋巴结转移者124例. 所有标本均经 40 g/L甲醛固定, 常规石蜡包埋. 小鼠抗人PI3KCA、PIK3CB蛋白单克隆抗体浓缩液购自Abcam公司. 鼠抗人LRP、GST-π、TopoⅡ、MDR-1单克隆抗体及通用型二抗和其他辅助试剂购自福州迈新生物技术有限公司.
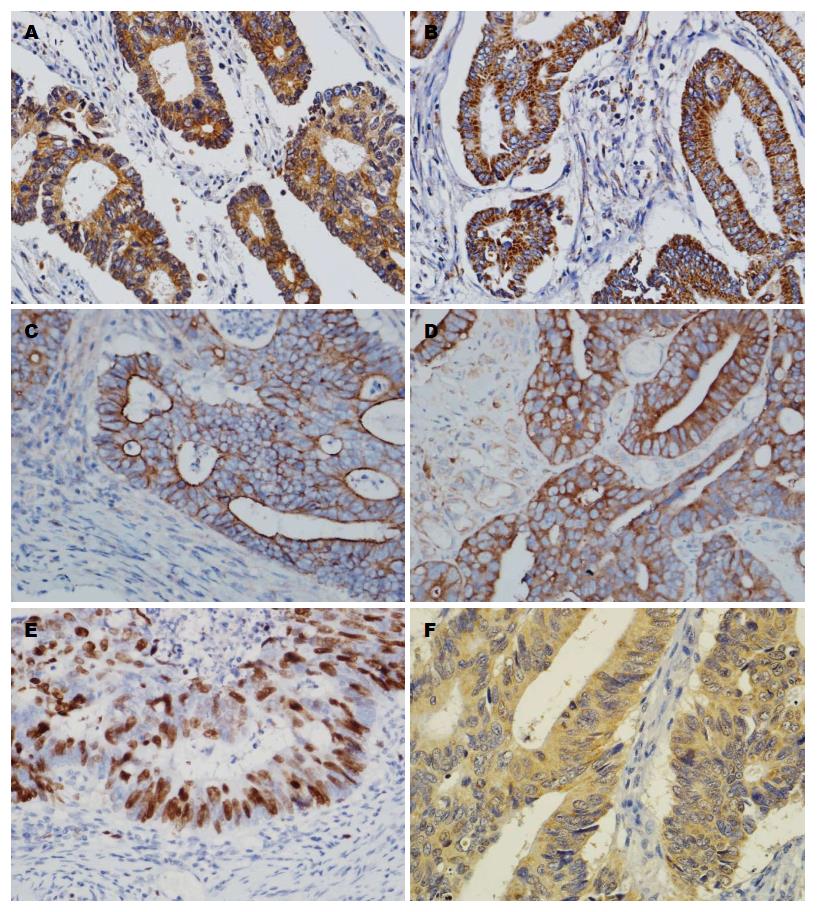
1.2.1 免疫组织化学染色: 所有标本用40 g/L甲醛固定, 石蜡包埋, 3 μm厚度连续切片. 脱蜡至水, 用3%的H2O2去除内源性过氧化酶活性, 柠檬酸高压抗原修复, 分别稀释加入一抗, 1∶150鼠抗人PI3KCA蛋白单克隆抗体, 1∶250鼠抗人PI3KCB蛋白单克隆抗体、鼠抗人LRP、GST-π、MDR-1和TopoⅡ单克隆抗体, 4 ℃孵育过夜, PBS冲洗, 加通用型二抗, DAB显色, 苏木素复染, 脱水透明, 封固. 用PBS代替一抗作空白对照, 用已知PIK3CA蛋白阳性表达的脑组织切片、已知PI3KCB蛋白阳性的扁桃体组织切片及MDR-1、LRP、GST-π、TopoⅡ阳性的乳腺癌组织切片作阳性对照.
1.2.2 结果判断: 以细胞膜、质或核内出现黄色颗粒为阳性标志, 每张切片光镜下(400×)观察10个视野, 每个视野计数100个细胞, 共计1000个细胞, 根据细胞染色强度和阳性细胞比例判定实验
结果: 细胞质或核无色为0分、淡黄色为1分、棕黄色为2分、棕褐色为3分; 阳性细胞数 ≤ 5%为0分, 6%-25%为1分、26%-50%为2分、51%-75%为3分、>75%为4分. 上述两分相乘 ≥ 4分判为阳性, <4分判为阴性.
统计学处理 采用SPSS19.0统计软件. 组间比较及蛋白表达与临床病理参数之间的相关性分析采用χ2检验; 蛋白表达的相关关系采用Spearman相关分析法; 生存分析采用Kaplan-Meier法, 并以Log-rank法检验, 采用Cox比例风险回归模型进行多因素生存分析. P<0.05为差异有统计学意义.
在316例大肠癌中, PIK3CA、PIK3CB的表达与患者的年龄、性别、肿瘤的大小、部位、组织学类型均无相关性, 差异无统计学意义(P>0.05). PIK3CA、PIK3CB的表达与肿瘤的分化程度、淋巴结转移成正相关, 其相关系数分别为0.136、0.168, PIK3CA、PIK3CB均为阳性者在高分化大肠癌中的表达明显高于低分化大肠癌; 在腺癌中的表达明显高于在黏液腺癌中的表达, 其关联性分析结果差异具有统计学意义(P<0.05)(表1, 图1A, B).
| 临床病理参数 | PIK3CA(+)PIK3CB(+) | PIK3CA(+)PIK3CB(-) | PIK3CA(-)PIK3CB(+) | PIK3CA(-)PIK3CB(-) | χ2值 | P值 | r值 |
| 年龄(岁) | 6.867 | 0.076 | 0.018 | ||||
| < 60 | 56 | 16 | 64 | 28 | |||
| ≥ 60 | 92 | 12 | 28 | 20 | |||
| 性别 | 4.088 | 0.252 | 0.035 | ||||
| 男 | 80 | 10 | 50 | 22 | |||
| 女 | 68 | 18 | 42 | 26 | |||
| 大小(cm) | 6.037 | 0.114 | -0.137 | ||||
| < 5 | 60 | 13 | 48 | 28 | |||
| ≥ 5 | 88 | 15 | 44 | 20 | |||
| 肿瘤部位 | 3.528 | 0.317 | 0.001 | ||||
| 结肠 | 72 | 16 | 52 | 20 | |||
| 直肠 | 76 | 12 | 40 | 28 | |||
| 分化程度 | 19.699 | 0.015 | 0.136 | ||||
| 高 | 82 | 13 | 55 | 11 | |||
| 中 | 50 | 11 | 26 | 27 | |||
| 低 | 16 | 4 | 11 | 10 | |||
| 组织学类型 | 14.052 | 0.021 | 0.129 | ||||
| 管状腺癌 | 134 | 22 | 82 | 43 | |||
| 黏液腺癌 | 14 | 6 | 10 | 5 | |||
| 浸润深度 | 11.646 | 0.147 | -0.082 | ||||
| 黏膜及黏膜下层 | 8 | 0 | 5 | 5 | |||
| 肌层 | 27 | 12 | 20 | 12 | |||
| 外膜 | 113 | 16 | 67 | 31 | |||
| 淋巴结转移 | 12.987 | 0.005 | 0.168 | ||||
| 有 | 98 | 22 | 50 | 22 | |||
| 无 | 50 | 6 | 42 | 26 |
316例大肠癌中, MDR基因在大肠癌组织中的阳性率分别为: MDR-1为72.78%(230/316)、LRP为70.89%(224/316)、TOPⅡ为77.53%(245/316)及GST-π为76.58%(242/316). PIK3CA、PIK3CB的表达与多药耐药蛋白MDR-1、LRP、GST-π的表达均成正相关, 相关系数分别为0.288、0.128、0.197, 其关联性分析结果差异具有统计学意义(P<0.05), 与TopⅡ的表达无明显相关性, 差异无统计学意义(P>0.05)(表2, 图1).
| 耐药蛋白 | PIK3CA(+)PIK3CB(+) | PIK3CA(+)PIK3CB(-) | PIK3CA(-)PIK3CB(+) | PIK3CA(-)PIK3CB(-) | χ2值 | P值 | r值 |
| MDR-1 | 37.656 | 0.001 | 0.288 | ||||
| (+) | 122 | 22 | 68 | 18 | |||
| (-) | 26 | 6 | 24 | 30 | |||
| LRP | 23.608 | 0.023 | 0.128 | ||||
| (+) | 110 | 18 | 75 | 21 | |||
| (-) | 38 | 10 | 17 | 27 | |||
| TopⅡ | 30.508 | 0.204 | -0.072 | ||||
| (+) | 112 | 13 | 86 | 34 | |||
| (-) | 36 | 15 | 6 | 14 | |||
| GST-π | 39.882 | 0.001 | 0.197 | ||||
| (+) | 120 | 22 | 80 | 20 | |||
| (-) | 28 | 6 | 12 | 28 |
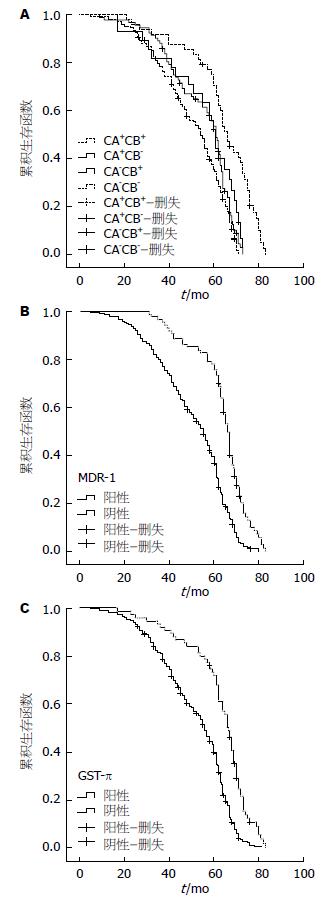
316例大肠癌患者的中位生存期为60 mo, 5年生存率为47.5%, 在PIK3CA( + )PIK3CB( + )组、PIK3CA( + )PIK3CB(-)组、PIK3CA(-)PIK3CB( + )组、PIK3CA(-)PIK3CB(-)组4组中, 平均生存时间分别54、61、61、66 mo. Kaplan-Meier分析结果显示, PIK3CA与PIK3CB同时高表达的患者术后5年生存率明显降低, 与其他3组[PIK3CA( + )PIK3CB(-)组、PIK3CA(-)PIK3CB( + )组、PIK3CA(-)PIK3CB(-)组]比较差异有统计学意义(P<0.05); 而PIK3CA与PIK3CB同时低表达的患者术后生存率明显升高, 与其他3组比较差异有统计学意义(P<0.05). 淋巴结转移、MDR-1( + )、GST-π( + )患者术后5年生存率明显低于未有淋巴结转移、MDR-1(-)、GST-π(-)患者, 生存曲线如图2. 多因素生存分析结果显示, PIK3CA( + )PIK3CB( + )、淋巴结转移、MDR-1、GST-π是影响大肠癌患者预后的独立因素, 而患者年龄、性别、肿瘤大小、部位、分化程度、组织学类型、浸润深度以及LRP、TopeⅡ均不是影响大肠癌预后的独立因素(表3).
| 参数 | β | SE | Wald | df | Exp(β) | 95%CI | P值 |
| PIK3CA(+)PIK3CB(+) | 0.960 | 0.231 | 17.312 | 1 | 2.611 | 0.954-3.138 | 0.000 |
| 淋巴结转移 | 0.292 | 0.127 | 5.303 | 1 | 1.339 | 1.044-1.716 | 0.021 |
| MDR-1 | 0.659 | 0.151 | 19.112 | 1 | 1.932 | 1.438-2.596 | 0.000 |
| GST-π | 0.487 | 0.160 | 9.266 | 1 | 1.627 | 1.189-2.225 | 0.002 |
大肠癌又称结直肠癌, 其发病率在我国仅次于胃癌和食管癌, 并且有年轻化和逐年上升的趋势[4]. 目前, 临床上大肠癌的治疗仍以手术联合放化疗为主, 对于失去手术机会或转移性大肠癌则采用化疗、放疗等综合治疗措施, 以延长患者生存期. 然而, 肿瘤细胞对化疗药物的MDR严重地影响了临床化疗效果. 肿瘤的MDR是指某种化疗药物作用于肿瘤后, 肿瘤细胞不仅对该种药物产生耐药, 而且对未接触过的、结构和机制均不同的多种抗肿瘤药物也产生交叉耐药[5]. 因此临床常联合检测多个MDR基因产物以期能更客观地反映肿瘤细胞对化疗药物的耐药性. 目前临床常用的耐药基因MDR-1、LRP、GST-π、TopoⅡ均可以间接反映肿瘤组织中MDR的情况[6]. 本研究结果显示, 结直肠癌中MDR-1的阳性表达率为72.78%、LRP阳性表达率为72.78%, TopoⅡ的阳性表达率为77.53%、GST-π阳性表达率为76.58%, 提示大肠癌中存在MDR现象.
研究表明许多因素可以影响化疗药物的敏感性, 包括药物的靶点发生变化、细胞信号转导通路的异常改变和细胞凋亡的逃逸等[7-9]. 其中, 细胞信号转导通路的异常与肿瘤耐药密切相关, 已成为研究肿瘤靶点治疗及耐药的热点[2]. PI3K/AKT信号通路在细胞生长、增殖及生存过程中发挥着重要作用[10,11], 与人类多种肿瘤的发生、发展密切相关, 其异常活化在促进正常细胞向癌细胞转化中发挥重要作用[12-15]. 其中, PI3Ks作为该通路的核心分子, 其催化亚基PIK3C的4个亚单位中, 由PIK3CA和PIK3CB在促进肿瘤的发生发展[16-18]. 本研究中, 大肠癌组织中PIK3CA、PIK3CB均为阳性的表达率为46.84%, 明显高于其他3组的表达率, 在与临床病理因素的相关性分析中显示大肠癌的分化程度、淋巴结转移与PIK3CA、PIK3CB表达呈正相关, 我们认为, PIK3CA、PIK3CB在大肠癌的发生发展中起着协同作用, PI3K蛋白在临床分期越晚、病理分级越低的癌组织中其蛋白表达阳性率越高, 其表达还与淋巴结转移及远处转移等临床病理因素有关, 提示PI3K与大肠癌的增生、转移及浸润有关.
近年来发现PI3K/AKT信号通路不仅与肿瘤的发生发展, 还与多药耐药存在密切联系[19,20]. Jamieson等[21]用A66高度特异性和选择性抑制PIK3CA, 结果表明抑制PIK3CA可以阻止生长因子信号传导, 抑制肿瘤的生长, 降低肿瘤细胞对化疗的抵抗. Jeong等[22]发现靶向抑制PIK3CB, 能促进卵巢癌耐药细胞的凋亡, 增加耐药细胞对紫杉醇化疗的敏感性. 目前公认的肿瘤细胞耐药机制是MDR1基因产物P-糖蛋白(P-glycoprotein, P-gp)过度表达. P-gp是一种跨膜转运蛋白, 可以将药物从细胞内泵到胞外, 降低细胞内药物浓度, 导致肿瘤耐药[23]. 因此, 规避P-gp的介导的多药耐药仍是临床防止多药耐药主要的策略. 以往研究表明, PI3K/AKT信号通路异常激活可上调多药耐药基因的表达, 导致耐药[24,25]. García等[26]发现, 抑制PI3K/AKT通路可以下调其下游核因子κB(nuclear factor kappa B, NF-κB)的活性, 进而抑制P-gp的表达. 同时, 可以促进化疗药物诱导的细胞凋亡, 提高肿瘤细胞的对化疗药物的敏感性, 逆转耐药. 本实验结果表明, PIK3CA和PIK3CB的表达与多药耐药基因MDR-1(r = 0.288), LRP(r = 0.128)和GST-π(r = 0.197)密切相关. 我们推测, 大肠癌组织p110α和p110β的高表达, 可增强NF-κB活性, 激活MDR-1基因的转录, 增加P-gp的表达, 导致大肠癌产生耐药.
Ogino等[27]研究发现PIK3CA基因突变与大肠癌术后患者的生存率有关, PIK3CA基因突变的大肠癌患者生存时间显著降低. 本实验通过随访316例大肠癌术后患者, 发现大肠癌的预后不仅与分化程度、淋巴结转移等临床病理因素有关, 而且PIK3CA、PIK3CB的表达水平也与大肠癌患者预后密切相关. 尤其是PIK3CA、PIK3CB同时高表达的患者死亡率更高, 预后更差. 我们认为, PIK3CA、PIK3CB可作为判断大肠癌恶性程度及预后的分子生物学指标. Cox比例风险回归模型结果显示, PIK3CA、PIK3CB、淋巴结转移、MDR-1、GST-π均是影响大肠癌患者预后的独立因素, 可作为大肠癌预后中重要的独立参考指标.
随着靶向药物研究进展, 个性化治疗已经成为恶性肿瘤临床治疗的发展方向, 在很大程度上改善了治疗效果. 通过靶向药物阻断PI3K/AKT信号转导通路抗肿瘤的治疗方案已受到人们的高度重视并开始应用于临床. 酪氨酸激酶受体抑制剂如: 西妥昔单抗、吉非替尼等, 是一类新型的靶向药物, 能特异性结合表皮生长因子受体(epidermal growth factor receptor, EGFR), 阻断EGFR介导的下游PI3K/AKT信号转导通路, 抑制肿瘤细胞的增殖[28]. 然而, 研究[29]发现大多数患者并未明显受益, 表明该类患者对治疗存在着原发性或继发性的耐受. 临床回顾性研究证明[30,31], PIK3CA基因突变状态与西妥昔单抗的疗效密切相关, PIK3CA基因突变的患者疗效低, 反之疗效高. 另外发现, EGFR过度表达且PIK3CA无突变的患者应用西妥昔单抗后, 仍有部分患者化疗失败. 本研究显示, 大肠癌的耐药不仅与PIK3CA的异常表达相关, 而且与另一亚单位PIK3CB的异常表达有关. 我们推测, 在靶向EGFR突变治疗失败的大肠癌中, 在靶向药物所作用的PI3K/AKT信号转导通路中, 除PIK3CA突变外, 其他位点的突变同样可影响疗效, 如PIK3CB突变也可导致EGFR靶向治疗失败, 其机制还有待于进一步研究.
总之, PIK3CA、PIK3CB在大肠癌组织中高表达, 其表达不仅与大肠癌的分化、淋巴结转移等临床病理因素相关, 而且与多药耐药基因MDR-1、LRP、GST-π明显相关. 因此, 同步检测PIK3CA、PIK3CB蛋白对于临床预测大肠癌的恶性程度、初步判断预后以及合理的筛选有效化疗药物具有重要的意义.
大肠癌是我国常见的消化系肿瘤, 化疗耐药严重影响了临床化疗效果, 探讨磷脂酰肌醇3-激酶(phosphatidylino-sitol 3-kinases, PI3Ks)与大肠癌耐药的关系, 对临床判断预后以及合理的筛选有效的化疗药物具有重要的意义.
邓庆, 副研究员, 上海人类基因组研究中心功能基因组部
研究表明大肠癌中存在多药耐药(multidrug resistance, MDR)现象, 而PI3Ks在肿瘤的发生发展中具有重要的作用. 因此, 明确PI3Ks与大肠癌多药耐药的相关性, 成为亟待研究的问题.
研究表明, PI3K/AKT信号通路在细胞生长、增殖及生存过程中发挥着重要作用, 与人类多种肿瘤的发生、发展密切相关, 其异常活化在促进正常细胞向癌细胞转化中发挥重要作用.
本文通过检测PIK3CA、PIK3CB与多药耐药基因在大肠癌中的表达, 通过随访探讨与预后有关的因素, 明确了PIK3CA、PIK3CB与大肠癌的多药耐药密切相关, PIK3CA、PIK3CB、淋巴结转移、MDR-1、谷胱甘肽转移酶π(glutathione-S-transferase π, GST-π)是影响大肠癌患者预后的独立因素.
本文研究发现同步检测PIK3CA、PIK3CB蛋白对于临床预测大肠癌的恶性程度、初步判断预后以及合理的筛选有效化疗药物具有重要的意义.
肿瘤的多药耐药(MDR): 指某种化疗药物作用于肿瘤后, 肿瘤细胞不仅对该种药物产生耐药, 而且对未接触过的、结构和机制均不同的多种抗肿瘤药物也产生交叉耐药.
本文通过免疫组织化学方法分析了PIK3CA、PIK3CB与大肠癌的多药耐的相关性, 发现PIK3CA、PIK3CB、淋巴结转移、MDR-1、GST-π是影响大肠癌患者预后的独立因素, 检测PIK3CA、PIK3CB为临床合理选择化疗药物、初步判断预后具有重要参考价值. 本研究统计学方法正确, 可行性强, 观察指标明确, 对大肠癌的预后、耐药性具有指导意义.
编辑: 韦元涛 电编:闫晋利
| 1. | 李 长龙, 柯 贤福, 郭 红刚, 卢 领群, 戴 方伟, 萨 晓婴. 长春新碱诱导建立人结肠癌多药耐受性小鼠模型及MDR1和MRP1基因表达. 中国实验动物学报. 2012;20:56-61. |
| 2. | Liang J, Ge F, Guo C, Luo G, Wang X, Han G, Zhang D, Wang J, Li K, Pan Y. Inhibition of PI3K/Akt partially leads to the inhibition of PrP(C)-induced drug resistance in gastric cancer cells. FEBS J. 2009;276:685-694. [PubMed] [DOI] |
| 3. | Carnero A. The PKB/AKT pathway in cancer. Curr Pharm Des. 2010;16:34-44. [PubMed] [DOI] |
| 4. | Kerr D. Clinical development of gene therapy for colorectal cancer. Nat Rev Cancer. 2003;3:615-622. [PubMed] [DOI] |
| 5. | Gillet JP, Gottesman MM. Mechanisms of multidrug resistance in cancer. Methods Mol Biol. 2010;596:47-76. [PubMed] [DOI] |
| 6. | 周 庚寅, 张 晓芳. 肿瘤多药耐药机制及其逆转. 临床与实验病理学杂志. 2009;25:348-351. |
| 7. | Xia L, Zhang D, Du R, Pan Y, Zhao L, Sun S, Hong L, Liu J, Fan D. miR-15b and miR-16 modulate multidrug resistance by targeting BCL2 in human gastric cancer cells. Int J Cancer. 2008;123:372-379. [PubMed] [DOI] |
| 8. | Xie X, Tang B, Zhou J, Gao Q, Zhang P. Inhibition of the PI3K/Akt pathway increases the chemosensitivity of gastric cancer to vincristine. Oncol Rep. 2013;30:773-782. [PubMed] [DOI] |
| 9. | Liu L, Ning X, Sun L, Zhang H, Shi Y, Guo C, Han S, Liu J, Sun S, Han Z. Hypoxia-inducible factor-1 alpha contributes to hypoxia-induced chemoresistance in gastric cancer. Cancer Sci. 2008;99:121-128. [PubMed] |
| 10. | Owonikoko TK, Khuri FR. Targeting the PI3K/AKT/mTOR pathway: biomarkers of success and tribulation. Am Soc Clin Oncol Educ Book. 2013;. [PubMed] [DOI] |
| 11. | Yuan TL, Cantley LC. PI3K pathway alterations in cancer: variations on a theme. Oncogene. 2008;27:5497-5510. [PubMed] [DOI] |
| 12. | Kolasa IK, Rembiszewska A, Felisiak A, Ziolkowska-Seta I, Murawska M, Moes J, Timorek A, Dansonka-Mieszkowska A, Kupryjanczyk J. PIK3CA amplification associates with resistance to chemotherapy in ovarian cancer patients. Cancer Biol Ther. 2009;8:21-26. [PubMed] [DOI] |
| 13. | Samuels Y, Ericson K. Oncogenic PI3K and its role in cancer. Curr Opin Oncol. 2006;18:77-82. [PubMed] [DOI] |
| 14. | Armaghany T, Wilson JD, Chu Q, Mills G. Genetic alterations in colorectal cancer. Gastrointest Cancer Res. 2012;5:19-27. [PubMed] |
| 15. | Catasus L, Gallardo A, Cuatrecasas M, Prat J. PIK3CA mutations in the kinase domain (exon 20) of uterine endometrial adenocarcinomas are associated with adverse prognostic parameters. Mod Pathol. 2008;21:131-139. [PubMed] |
| 16. | Janku F, Tsimberidou AM, Garrido-Laguna I, Wang X, Luthra R, Hong DS, Naing A, Falchook GS, Moroney JW, Piha-Paul SA. PIK3CA mutations in patients with advanced cancers treated with PI3K/AKT/mTOR axis inhibitors. Mol Cancer Ther. 2011;10:558-565. [PubMed] [DOI] |
| 17. | Dbouk HA, Backer JM. A beta version of life: p110β takes center stage. Oncotarget. 2010;1:729-733. [PubMed] |
| 19. | Zhang J, Roberts TM, Shivdasani RA. Targeting PI3K signaling as a therapeutic approach for colorectal cancer. Gastroenterology. 2011;141:50-61. [PubMed] [DOI] |
| 20. | Wee S, Wiederschain D, Maira SM, Loo A, Miller C, deBeaumont R, Stegmeier F, Yao YM, Lengauer C. PTEN-deficient cancers depend on PIK3CB. Proc Natl Acad Sci U S A. 2008;105:13057-13062. [PubMed] [DOI] |
| 21. | Jamieson S, Flanagan JU, Kolekar S, Buchanan C, Kendall JD, Lee WJ, Rewcastle GW, Denny WA, Singh R, Dickson J. A drug targeting only p110α can block phosphoinositide 3-kinase signalling and tumour growth in certain cell types. Biochem J. 2011;438:53-62. [PubMed] [DOI] |
| 22. | Jeong JY, Kim KS, Moon JS, Song JA, Choi SH, Kim KI, Kim TH, An HJ. Targeted inhibition of phosphatidyl inositol-3-kinase p110β, but not p110α, enhances apoptosis and sensitivity to paclitaxel in chemoresistant ovarian cancers. Apoptosis. 2013;18:509-520. [PubMed] [DOI] |
| 23. | El-Readi MZ, Hamdan D, Farrag N, El-Shazly A, Wink M. Inhibition of P-glycoprotein activity by limonin and other secondary metabolites from Citrus species in human colon and leukaemia cell lines. Eur J Pharmacol. 2010;626:139-145. [PubMed] [DOI] |
| 24. | Kuo MT, Liu Z, Wei Y, Lin-Lee YC, Tatebe S, Mills GB, Unate H. Induction of human MDR1 gene expression by 2-acetylaminofluorene is mediated by effectors of the phosphoinositide 3-kinase pathway that activate NF-kappaB signaling. Oncogene. 2002;21:1945-1954. [PubMed] [DOI] |
| 25. | Barancík M, Bohácová V, Sedlák J, Sulová Z, Breier A. LY294,002, a specific inhibitor of PI3K/Akt kinase pathway, antagonizes P-glycoprotein-mediated multidrug resistance. Eur J Pharm Sci. 2006;29:426-434. [PubMed] [DOI] |
| 26. | García MG, Alaniz LD, Cordo Russo RI, Alvarez E, Hajos SE. PI3K/Akt inhibition modulates multidrug resistance and activates NF-kappaB in murine lymphoma cell lines. Leuk Res. 2009;33:288-296. [PubMed] [DOI] |
| 27. | Ogino S, Nosho K, Kirkner GJ, Shima K, Irahara N, Kure S, Chan AT, Engelman JA, Kraft P, Cantley LC. PIK3CA mutation is associated with poor prognosis among patients with curatively resected colon cancer. J Clin Oncol. 2009;27:1477-1484. [PubMed] [DOI] |
| 28. | Broadbridge VT, Karapetis CS, Price TJ. Cetuximab in metastatic colorectal cancer. Expert Rev Anticancer Ther. 2012;12:555-565. [PubMed] [DOI] |
| 29. | Sartore-Bianchi A, Martini M, Molinari F, Veronese S, Nichelatti M, Artale S, Di Nicolantonio F, Saletti P, De Dosso S, Mazzucchelli L. PIK3CA mutations in colorectal cancer are associated with clinical resistance to EGFR-targeted monoclonal antibodies. Cancer Res. 2009;69:1851-1857. [PubMed] [DOI] |
| 30. | Mao C, Yang ZY, Hu XF, Chen Q, Tang JL. PIK3CA exon 20 mutations as a potential biomarker for resistance to anti-EGFR monoclonal antibodies in KRAS wild-type metastatic colorectal cancer: a systematic review and meta-analysis. Ann Oncol. 2012;23:1518-1525. [PubMed] [DOI] |
| 31. | Bardelli A, Siena S. Molecular mechanisms of resistance to cetuximab and panitumumab in colorectal cancer. J Clin Oncol. 2010;28:1254-1261. [PubMed] [DOI] |