修回日期: 2014-11-27
接受日期: 2014-12-05
在线出版日期: 2015-01-18
目的: 探讨锚蛋白重复序列(gann ankyrin repeats, Gankyrin)在炎症相关肿瘤进展中的作用机制.
方法: 将36只同系C57BL/6♂鼠随机分为3组, 其中12只服用2.5%葡聚糖硫酸钠盐(dextran sodium sulfate, DSS)饮水建立溃疡性结肠炎(ulcerative colitis, UC)模型, 其中12只首日腹腔注射氧化偶氮甲烷(azoxymethane, AOM), 10 d后开始服用2%DSS 7 d, 恢复正常饮水2 wk后再次口服2%DSS共3个循环, 建立结肠炎相关肿瘤(colitis-associated cancer, CAC)模型, 另有12只同种系小鼠口服普通饮水饲养作为对照组. 分别采用病理组织学苏木精-伊红(hematoxylin & eosin, HE)染色观察结肠组织; 并用实时荧光定量PCR方法检测3组结肠组织中Gankyrin的mRNA水平; 采用双荧光报告系统检测Gankyrin对肿瘤坏死因子(tumor necrosis factor, TNF)-α和白介素(interleukin, IL)-1β刺激下核因子-κB(nuclear factor-κB, NF-κB)转录活性的影响, 同时用免疫印迹方法检测转染效率.
结果: 病理组织学HE染色证实了UC和CAC小鼠模型的建立; 3组小鼠结肠组织中Gankyrin mRNA表达明显不同, 在肿瘤组织中Gankyrin mRNA水平明显高于炎症组织; 在HCT116细胞中过表达Gankyrin能够明显抑制TNF-α和IL-1β刺激引起的NF-κB转录活性, 而干涉Gankyrin后得到的结果则相反.
结论: 在肠炎进展至肠癌过程中Gankyrin的表达明显上调, 可能通过NF-κB信号通路参与肠炎相关肿瘤的调控.
核心提示: 锚蛋白重复序列(gann ankyrin repeats, Gankyrin)是一种新型癌基因, 本研究利用肠炎相关肿瘤动物模型, 发现Gankyrin很可能是在炎性因子刺激(肿瘤坏死因子和白介素-1β等)作用下表达量持续增多, 进而加速了肿瘤的形成; 而在此过程中Gankyrin很有可能是通过参与重要炎症信号通路核因子-κB(nuclear factor-κB)的活性调节实现的.
引文著录: 王少鑫, 靳宝锋, 崔立红. 锚蛋白重复序列通过NF-κB信号通路参与肠炎相关肿瘤的调控. 世界华人消化杂志 2015; 23(2): 189-195
Revised: November 27, 2014
Accepted: December 5, 2014
Published online: January 18, 2015
AIM: To explore the role of gann ankyrin repeats (Gankyrin) in inflammation-induced cancer.
METHODS: Thirty-six C57BL/6 male mice were randomly divided into three groups, namely, a ulcerative colitis (UC) group which was given 2.5% dextran sodium sulfate (DSS) in drinking water, a colitis-associated cancer (CAC) group which was intraperitoneally injected with azoxymethane (AOM) on the first day and given 2% DSS in drinking water, and a control group which was given only drinking water. Colon tissues were taken on the last day and observed by microscopy after hematoxylin & eosin (HE) staining. Gankyrin mRNA expression in colon tissue was detected by real-time polymerase chain reaction (RT-PCR). The effect of Gankyrin on the tumor necrosis factor (TNF)-α and interleukin (IL)-1β-induced nuclear factor-κB (NF-κB) transcription activity was assessed by knocking Gankyrin down with siRNA or overexpressing Gankyrin using dual-luciferase report system and Western blot.
RESULTS: UC and CAC were successfully induced as evidenced by HE staining. Gankyrin mRNA level was significantly higher in tumor tissues than in colitis tissues. In HCT116 cells, overexpression of Gankyrin significantly suppressed the TNF-α and IL-1β-induced NF-κB transcription activity; however, Gankyrin knockdown significantly enhanced the TNF-α and IL-1β-induced NF-κB transcription activity.
CONCLUSION: Up-regulated Gankyrin expression in colon cancer may be involved in regulating cancer via the NF-κB signaling pathway.
- Citation: Wang SX, Jin BF, Cui LH. Gankyrin regulates colitis-associated cancer via NF-κB signaling pathway. Shijie Huaren Xiaohua Zazhi 2015; 23(2): 189-195
- URL: https://www.wjgnet.com/1009-3079/full/v23/i2/189.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i2.189
炎症与肿瘤等复杂疾病的发生发展密切相关, 慢性炎症是肿瘤发生的重要决定因素之一. 据估计在全世界范围内死于肿瘤的患者中有1/5的人存在过感染或炎症反应[1]. 若微生物的感染、自身免疫系统疾病以及原因不明的各种致炎因素持续存在, 就会增加机体肿瘤发生的危险. 但不是所有炎症和感染都会导致肿瘤的发生, 因此炎症诱导肿瘤发生的机制已经成为国际研究的热点问题.
结直肠癌(colorectal cancer, CRC)是严重影响人类生存的常见消化系恶性肿瘤, 位居西方国家的第3位. 据报道CRC的全国发病率以5%的速度增长, 每年的新发病例高达40万, 死亡率以3.05%的速度增长[2]. 结肠癌的发生与肠道炎症反应密切相关, 在结肠肿瘤组织中存在有大量的炎性细胞浸润. 锚蛋白重复序列(gann ankyrin repeats, Gankyrin)是近年来新发现的一个癌基因, 研究[3,4]表明Gankyrin参与NIH3T3细胞的恶性转化, 并在肿瘤的转移中发挥作用. 核因子-κB(nuclear factor-κB, NF-κB)是炎症反应的关键作用因子, 已经被证实在促进肿瘤发生过程中发挥重要作用[4,5]. 本研究中采用肠炎相关肠癌(colitis-associated cancer, CAC)的小鼠肿瘤模型模拟溃疡性结肠炎(ulcerative colitis, UC)进展至结肠癌的过程, 探讨Gankyrin可能通过NF-κB信号通路在炎症进展肿瘤中发挥调控作用.
选取中国人民解放军军事医学科学院动物中心C57BL/6♂鼠共36只, 周龄6-8 wk, 体质量约22-24 g, 在军事医学科学院SPF级无菌环境中饲养, 用于溃疡性结肠炎、结肠炎相关肿瘤小鼠模型建立. 实时荧光定量PCR所需试剂盒: 逆转录试剂盒和PCR反应试剂盒均购自TaKaRa公司, 货号分别为DRR036A和DRR081A. 动物模型建立所需试剂: 氧化偶氮甲烷(azoxymethane, AOM)购自Sigma公司(A5486); 葡聚糖硫酸钠盐(dextran sodium sulfate, DSS)(MW: 36000-50000)购自MP Biomedicals公司(0216011050); α-Tubulin购自Sigma公司(T5168). 试剂: 人结肠癌HCT116细胞系为国家生物医学分析中心细胞生物学实验室保存. 实时荧光定量PCR引物由美国Invitrogen公司合成, 引物序列为Gankyrin: 上游: 5'-TGCTCCTTGAGTCACCAGAA-3', 下游: 3'-GCATCCACAAACATCCAAGA-5'; GAPDH: 上游: 5'-CCAGGTGGTCTCCTCTGACTTC-3', 下游: 3'-GTGGTCGTTGAGGGCAATG-5'. 转染试剂Lipofectamine 2000和细胞因子肿瘤坏死因子(tumor necrosis factor, TNF)-α和白介素(interleukin, IL)-1β均购自美国Invitrogen公司, Flag鼠单抗、Gankyrin兔多抗和α-微管蛋白抗体购自美国Santa Cruz公司.
1.2.1 动物模型建立: 将实验中的36只C57BL/6♂鼠分别按以下方法分组建模: (1)取12只C57BL/6♂鼠服用2.5%DSS饮水, 持续给药6 d再观察4 d, 建立溃疡性结肠炎小鼠模型为UC组; (2)取12只C57BL/6♂鼠于第1天进行AOM腹腔注射, 浓度为8.5 mg/kg; 10 d后开始服用2%DSS饮水, 持续给药6 d后换正常饮用水, 恢复2 wk; 再重复2%DSS饮水6 d, 恢复2 wk; 第3个循环后, 恢复4 wk, 整个实验过程共84 d, 建立结肠炎相关肠癌小鼠模型为CAC组; (3)另取12只C57BL/6♂鼠作为对照组, 与肿瘤组小鼠同时处死. 3组小鼠实验结束时处死, 取全结肠采用Swiss-roll的方式翻卷成年轮状置于40 g/L甲醛中固定, 然后将样本固定24 h后进行石蜡包埋, 并3 μm厚连续切片, 行常规病理学苏木精/伊红(hematoxylin & eosin, HE)染色.
1.2.2 实时荧光定量PCR: 取正常对照小鼠和溃疡性结肠炎模型小鼠的结肠末端5 mm组织及CAC模型小鼠的结肠肿瘤组织5 mm, 放于1 mL TRIzol中于-80 ℃冰箱贮存. 待动物模型全部完成后进行实时荧光定量PCR检测(real-time PCR, RT-PCR). 具体过程如下: 总RNA提取: 将组织用TRIzol裂解, 待室温放置15 min后转至EP管中; 再加用氯仿充分震荡30 s, 室温放置5 min; 4 ℃离心12000 r/min, 15 min; 将上层水相吸出转至另一EP管中; 加等体积异丙醇, 充分混匀后室温放置10 min; 4 ℃离心12000 r/min, 10 min, 弃上清; 加预冷750 mL/L乙醇500 μL, 反复吹匀; 4 ℃离心6000 r/min, 5 min; 弃上清, 室温干燥15 min, 后溶解于20 μL DEPC水中.
cDNA合成: 逆转录体系包括总RNA 2 μg、5×Primerscript 4 μL及DEPC水补齐, 共20 μL, 反应程序为: 37 ℃ 15 min→85 ℃ 5 s→4 ℃终止. RT-PCR: PCR反应体系, 包括SYBR premix Ex Taq Ⅱ(2×)12.5 μL + ROX Reference Dye(50×)0.5 μL + DEPC水9 μL + 总RNA反转录cDNA 1 μL + Primers 2 μL, 总体积共25 μL. PCR循环(95 ℃ 30 min→95 ℃ 5 s→60 ℃ 31 s)×40个循环.
1.2.3 双荧光报告系统检测: 将HCT116细胞种于24孔板中, 检测过表达Gankyrin对NF-κB转录活性影响时, 将pNF-κB-luc 0.1 μg及海肾报告基因(Renilla-luc)0.01 μg和质粒pcDNA3.0-flag-gankyrin 0.2 μg或pcDNA-flag-vector 0.2 μg共转入细胞中, 6 h后换新鲜1640培养基, 转染24 h后加入TNF-α和IL-1β(终浓度均为10 ng/mL), 刺激6 h后用冰PBS洗细胞, 然后每孔加入裂解缓冲液(Passive Lysis Buffer)100 μL, 室温裂解15 min, 收集细胞裂解液, 高速离心30 s, 取上清. 用荧光素酶检测系统测定NF-κB的转录活性. 检测干涉Gankyrin对NF-κB转录活性影响时, 共转染上述报告基因及siRNA, 具体过程与前类似, siRNA终浓度为50 nmoL, 间隔24 h, 再转染1次, 24 h后加入TNF-α和IL-1β(终浓度10 ng/mL)刺激, 刺激6 h后裂解细胞, 然后利用双荧光报告系统检测NF-κB转录活性.
1.2.4 Western blot: 将过表达和干涉Gankyrin后的细胞裂解液中加入等量2×蛋白质缓冲液, 沸水浴变性10 min; 冷却至室温后进行Western blot. 电泳时, 浓缩胶电压为恒压80 V, 分离胶电压为120 V; 转印至PVDF膜, 转印所需电流为250 mA; 转印完成后, PVDF膜用5%的脱脂奶粉封闭1 h; 一抗孵育1 h, TBST洗膜3次, 每次5 min; 二抗孵育1 h, TBST洗膜3次, 每次5 min; 最后进行显影. 一抗分别为抗Flag鼠单抗(1∶5000)和抗Gankyrin兔多抗(1∶500), α-Tubulin为内参.
统计学处理 研究中采用SPSS13.0软件进行统计分析, 计量资料以mean±SD表示, 不同组间均数比较采用Student's t检验或单因素方差分析, P<0.05为差异具有统计学意义(n = 12/组).
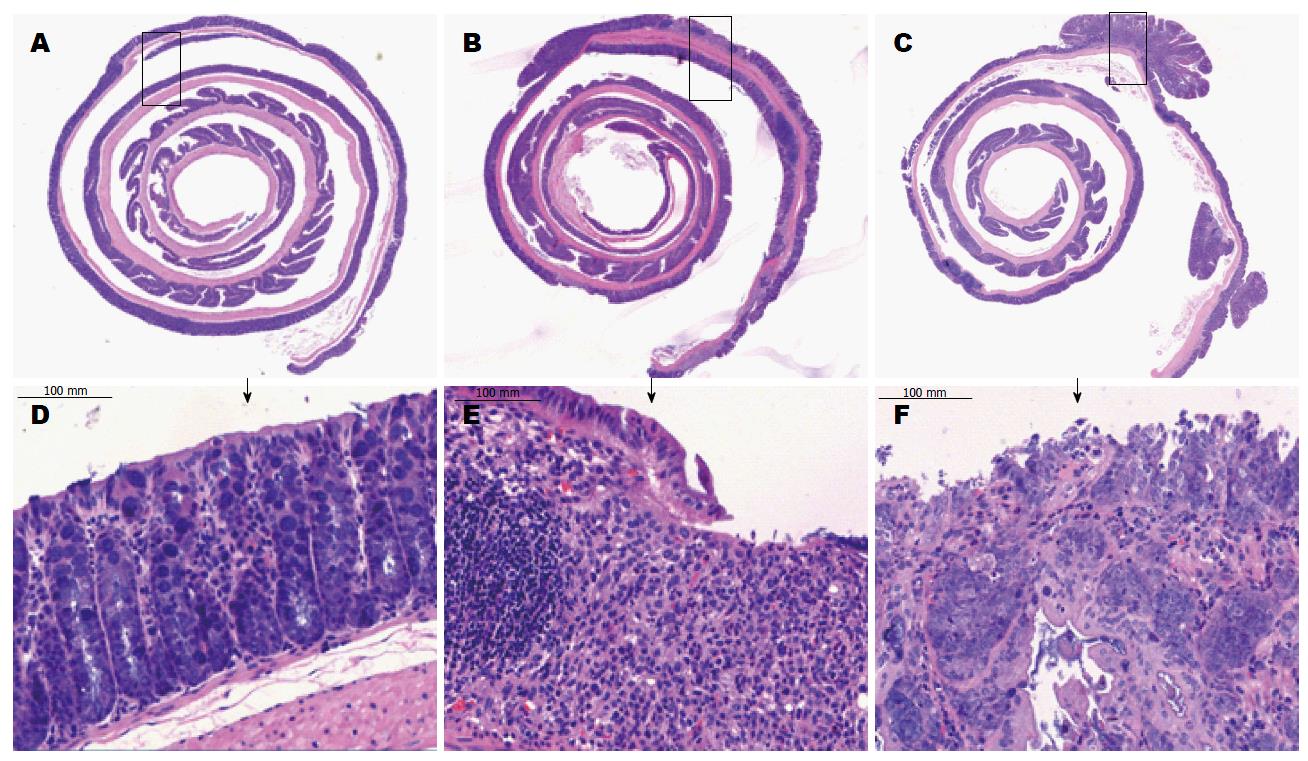
在溃疡性结肠炎和结肠炎相关肿瘤小鼠模型建立后, 取小鼠全结肠组织进行病理学HE检测(图1), 在大体标本(×2)和放大标本(×200)可见正常组小鼠结肠上皮细胞呈圆柱状, 形态规则, 排列整齐, 细胞核呈圆形或卵圆形, 染色质细颗粒状, 可见散在淋巴细胞和杯状细胞; 而UC组小鼠全结肠黏膜中有间断黏膜消失, 上皮细胞层脱落, 大量淋巴细胞浸润(×200), 其中尤以结肠末端黏膜炎症较重, 黏膜剥脱范围较大; 而CAC组小鼠结肠有多个肿瘤形成, 可见大量上皮细胞呈异型性, 细胞大小不一, 形态多样, 排列紊乱, 核大而浓染, 细胞层次增多(×200).
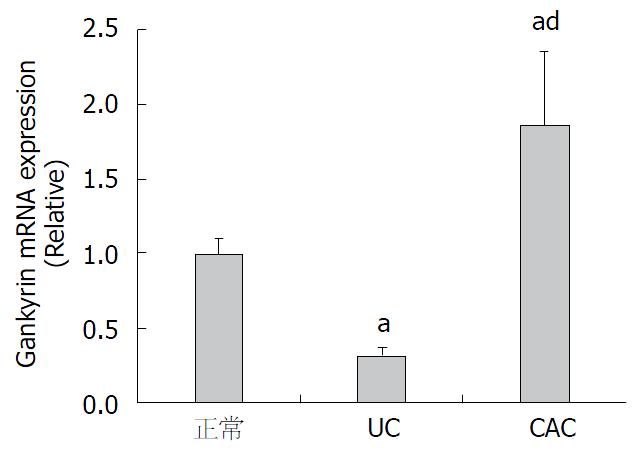
取正常小鼠结肠末端组织、UC组小鼠结肠末端炎症组织和CAC组小鼠结肠肿瘤组织进行Gankyrin mRNA检测, 如图2结果提示Gankyrin mRNA表达水平在UC组织中明显降低, 约为正常结肠组织的1/3(32%), 而CAC组织中明显升高, 约为正常结肠的1.86倍. 3组Gankyrin mRNA表达水平两两比较差异明显, 具有统计学意义(P<0.05或P<0.01, n = 12/组).
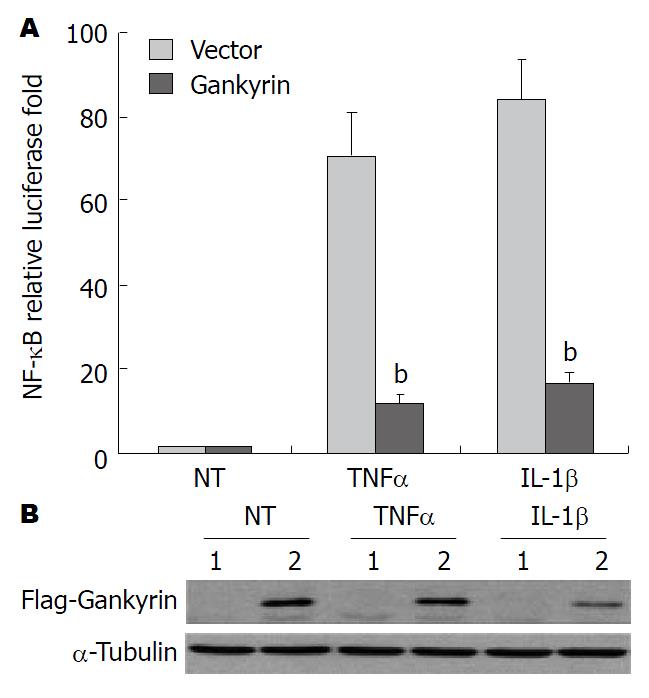
在HCT116细胞中过表达flag-Gankyrin进行NF-κB转录活性检测, 结果如图3A所示, 与未处理细胞相比, 在TNF-α或IL-1β刺激后NF-κB转录活性均有明显升高, 均在10倍以上; 但与转染对照质粒相比, 过表达Gankyrin能够显著抑制TNF-α和IL-1β刺激的NF-κB转录活性(P<0.01). 同时采用Western blot检测Gankyrin过表达转染效果, 如图3B所示.
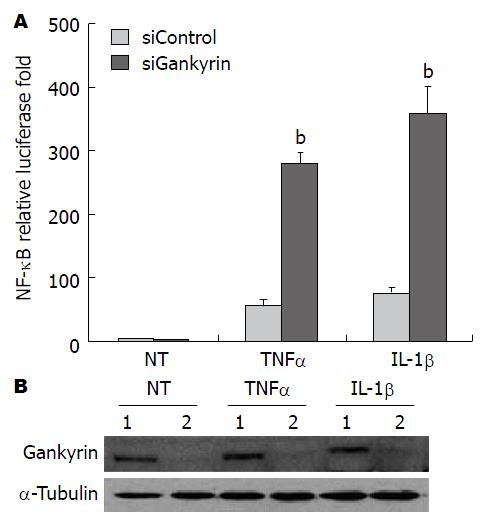
在HCT116细胞中, 检测干涉Gankyrin后在不同刺激下NF-κB转录活性的变化, 结果提示: 与未处理组细胞相比, 在TNF-α或IL-1β两种刺激下NF-κB转录活性均明显升高; 但与对照干涉细胞相比, 敲低Gankyrin能够显著增强TNF-α和IL-1β刺激下诱导的NF-κB转录活性(图4A)(P<0.01). 用Western blot方法检测Gankyrin的干涉效果, 结果表明在蛋白质水平上Gankyrin表达被有效抑制(图4B).
CRC是临床上最常见恶性肿瘤之一. 据统计, 全世界每年有超过一百万CRC新发病例[6], 结肠癌已成为世界上第3位的常见恶性病. CAC作为CRC的一种亚型, 结肠炎症程度与结肠癌的发生率呈正相关; 炎性肠病患者诊断8-10年以后CRC的发生风险以每年0.5%-1.0%的速度递增[7]. 长期结肠炎患者多死于结肠炎并发症如出血、穿孔等, 其中又有一半患者死于结肠癌并发症[8]. 因此如何阻止结肠炎症进展为肿瘤, 发现调控炎症相关肿瘤发生发展的关键分子机制, 遏制肿瘤生长并指导治疗, 已经成为近年研究的热点科学问题.
Gankyrin是近年来发现的一种新型癌基因, 目前研究发现在宫颈癌、肝癌、胆管癌、乳腺癌等中高表达, 其表达水平与肿瘤的浸润深度、分级分期以及肿瘤的转移等密切相关[5,9-12]. 研究[9,10,13,14]认为, Gankyrin可能通过调节细胞内重要的抑癌基因p53和Rb的功能, 调控低氧诱导因子(hypoxia inducible factor-1, HIF-1)或调控STAT3/Akt或IL-8通路等在细胞的增殖中发挥作用. 另有研究[15]报道, Gankyrin表达水平与结肠肿瘤进程相关, 而肠道内存在的大量致病菌诱发的慢性炎症是结肠恶性肿瘤形成的主要病因之一[16], 推测Gankyrin在炎症向肿瘤进展中可能发挥作用, 但其作用机制尚无相关研究报道.
NF-κB是生物体内炎症反应的关键作用因子, 已经被证实与细胞的许多生命现象如炎症、免疫反应、增殖、凋亡、肿瘤进展和分化等相关, 在各种炎症、肿瘤以及免疫反应中发挥重要作用[17-19]. 机体内炎症细胞NF-κB信号通路激活是通过使IκB的激酶(IκB kinase, IKK)发生磷酸化修饰及抑制IκB蛋白质降解来实现的. 一旦NF-κB被激活, 会促使这些炎性细胞分泌大量细胞因子、生长因子、炎症趋化因子和抗细胞凋亡因子, 作用于周围组织细胞, 促进肿瘤细胞的增殖. 已有报道, NF-κB的激活与多种恶性肿瘤, 如前列腺癌[20]、乳腺癌[21,22]、卵巢癌[23]、肾癌[24]、肺癌、食管癌[25]、胃癌[26]以及结肠癌等[27,28]的病变进程密切相关, 且已在病情和预后研究中被证实. 另有研究报道在结肠炎相关肿瘤的动物模型NF-κB能够促进结肠肿瘤的形成, 而NF-κB多态性也与肿瘤易感性相关[29,30]. 因此推测Gankyrin有可能通过调控NF-κB信号通路在炎症向肿瘤的进程中发挥作用.
本研究利用肠炎相关肿瘤的动物模型, 发现Gankyrin在炎症和肿瘤状态下表达明显不同, Gankyrin在肠炎中表达水平明显低于结肠肿瘤; 同时在HCT116细胞中炎症因子刺激下低水平Gankyrin能够明显促进NF-κB转录活性. 因此提示Gankyrin很可能是在炎性因子刺激(TNF-α、IL-1β等)作用下表达量持续增多, 进而加速了肿瘤的形成; 而在此过程中Gankyrin很有可能是通过参与重要炎症信号通路NF-κB的活性调节实现的. 此结果为炎症相关肿瘤进展的调控机制研究提出了新的线索和思路, 是肿瘤相关重要调控通路关键分子网络的重要补充, 同时也为肿瘤诊断标志物提供了新的选择. 然而, 关于结肠炎中Gankyrin的表达水平明显低于正常组织的原因尚不清楚, 其在炎症进展至肿瘤过程中是如何参与对NF-κB的信号调控, 其具体机制还有待进一步深入研究.
结直肠癌(colorectal cancer, CRC)是严重影响人们生存质量的最常见恶性肿瘤之一, 长期慢性结肠炎症增加了结肠癌发生的风险, 深入探讨结肠炎相关肿瘤(colitis-associated cancer, CAC)的发病机制对延长肠炎患者生存期、降低CRC发病率具有重要意义.
刘杰民, 副主任医师, 贵州省人民医院消化内镜科
氧化偶氮甲烷联合葡聚糖硫酸钠盐诱导的结肠炎相关肿瘤(colitis-associated cancer, CAC)模型能够很好的模拟溃疡性结肠炎进展至结肠癌的病变过程, 已广泛用于炎症诱导肿瘤的发病机制研究, 也为研究某些炎性介质和分子在CAC发生中的关键作用提供了重要线索.
锚蛋白重复序列(gann ankyrin repeats, Gankyrin)是近年来发现的一种新型癌基因, 在多种恶性肿瘤, 如宫颈癌、胆管癌以及结肠癌中均高表达, 且其表达水平与肿瘤分期、转移, 以及细胞增殖等密切相关.
有报道Gankyrin与结肠癌进展相关, 而结肠癌是与炎症密切相关的恶性肿瘤, 已有研究证实在CAC的动物模型中核因子-κB(nuclear factor-κB, NF-κB)可以促进肿瘤的形成. 故推测Gankyrin有可能通过调控NF-κB信号通路在炎症向肿瘤的进程中发挥作用.
Gankyrin在CAC进程中的作用机制研究, 为炎症相关肿瘤的调控机制研究提出了新的线索和思路, 是对肿瘤相关调控通路及关键分子网络的重要补充, 同时也为肿瘤诊断标志物提供了新的选择.
结直肠癌(CRC): 是结肠癌的一种亚型, 是由炎症性肠病反复发作、逐渐进展导致的结肠癌;
核因子-κB(NF-κB): 是一种重要的转录因子, 参与了大量与细胞凋亡、病毒复制、肿瘤增殖、炎症和各种自身免疫疾病密切相关的基因调控.
本研究探讨Gankyrin在炎症相关肿瘤进展中的作用机制, 发现在肠炎进展至肠癌过程中Gankyrin的表达明显上调, 可能通过NF-κB信号通路参与炎症相关肿瘤的调控, 此结果为进一步研究炎症相关肿瘤调控机制奠定了坚实的基础.
编辑: 韦元涛 电编:闫晋利
| 1. | Balkwill F, Mantovani A. Inflammation and cancer: back to Virchow? Lancet. 2001;357:539-545. [PubMed] [DOI] |
| 3. | Yu H, Kortylewski M, Pardoll D. Crosstalk between cancer and immune cells: role of STAT3 in the tumour microenvironment. Nat Rev Immunol. 2007;7:41-51. [PubMed] [DOI] |
| 4. | Grivennikov S, Karin M. Autocrine IL-6 signaling: a key event in tumorigenesis? Cancer Cell. 2008;13:7-9. [PubMed] [DOI] |
| 5. | Gao L, Xie H, Dong L, Zou J, Fu J, Gao X, Ou L, Xiang S, Song H. Gankyrin is essential for hypoxia enhanced metastatic potential in breast cancer cells. Mol Med Rep. 2014;9:1032-1036. [PubMed] [DOI] |
| 6. | Tenesa A, Dunlop MG. New insights into the aetiology of colorectal cancer from genome-wide association studies. Nat Rev Genet. 2009;10:353-358. [PubMed] [DOI] |
| 7. | Eaden JA, Abrams KR, Mayberry JF. The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut. 2001;48:526-535. [PubMed] [DOI] |
| 8. | Lakatos PL, Lakatos L. Risk for colorectal cancer in ulcerative colitis: changes, causes and management strategies. World J Gastroenterol. 2008;14:3937-3947. [PubMed] [DOI] |
| 9. | Zheng T, Hong X, Wang J, Pei T, Liang Y, Yin D, Song R, Song X, Lu Z, Qi S. Gankyrin promotes tumor growth and metastasis through activation of IL-6/STAT3 signaling in human cholangiocarcinoma. Hepatology. 2014;59:935-946. [PubMed] [DOI] |
| 10. | Bai Z, Tai Y, Li W, Zhen C, Gu W, Jian Z, Wang Q, Lin JE, Zhao Q, Gong W. Gankyrin activates IL-8 to promote hepatic metastasis of colorectal cancer. Cancer Res. 2013;73:4548-4558. [PubMed] [DOI] |
| 11. | Qian YW, Chen Y, Yang W, Fu J, Cao J, Ren YB, Zhu JJ, Su B, Luo T, Zhao XF. p28(GANK) prevents degradation of Oct4 and promotes expansion of tumor-initiating cells in hepatocarcinogenesis. Gastroenterology. 2012;142:1547-1558.e14. [PubMed] [DOI] |
| 12. | Fu XY, Wang HY, Tan L, Liu SQ, Cao HF, Wu MC. Overexpression of p28/gankyrin in human hepatocellular carcinoma and its clinical significance. World J Gastroenterol. 2002;8:638-643. [PubMed] |
| 13. | Dawson S, Higashitsuji H, Wilkinson AJ, Fujita J, Mayer RJ. Gankyrin: a new oncoprotein and regulator of pRb and p53. Trends Cell Biol. 2006;16:229-233. [PubMed] [DOI] |
| 14. | Song X, Wang J, Zheng T, Song R, Liang Y, Bhatta N, Yin D, Pan S, Liu J, Jiang H. LBH589 Inhibits proliferation and metastasis of hepatocellular carcinoma via inhibition of gankyrin/STAT3/Akt pathway. Mol Cancer. 2013;12:114. [PubMed] [DOI] |
| 15. | Tang S, Yang G, Meng Y, Du R, Li X, Fan R, Zhao L, Bi Q, Jin J, Gao L. Overexpression of a novel gene gankyrin correlates with the malignant phenotype of colorectal cancer. Cancer Biol Ther. 2010;9:88-95. [PubMed] [DOI] |
| 16. | Zhong L, Zhang X, Covasa M. Emerging roles of lactic acid bacteria in protection against colorectal cancer. World J Gastroenterol. 2014;20:7878-7886. [PubMed] [DOI] |
| 17. | Karin M. NF-kappaB as a critical link between inflammation and cancer. Cold Spring Harb Perspect Biol. 2009;1:a000141. [PubMed] [DOI] |
| 18. | Lupia E, Pigozzi L, Goffi A, Hirsch E, Montrucchio G. Role of phosphoinositide 3-kinase in the pathogenesis of acute pancreatitis. World J Gastroenterol. 2014;20:15190-15199. [PubMed] [DOI] |
| 19. | Han Y, Ma TM, Lu ML, Ren L, Ma XD, Bai ZH. Role of moxibustion in inflammatory responses during treatment of rat ulcerative colitis. World J Gastroenterol. 2014;20:11297-11304. [PubMed] [DOI] |
| 20. | Luk SU, Xue H, Cheng H, Lin D, Gout PW, Fazli L, Collins CC, Gleave ME, Wang Y. The BIRC6 gene as a novel target for therapy of prostate cancer: dual targeting of inhibitors of apoptosis. Oncotarget. 2014;5:6896-6908. [PubMed] |
| 21. | Becker-Weimann S, Xiong G, Furuta S, Han J, Kuhn I, Akavia UD, Pe'er D, Bissell MJ, Xu R. NFkB disrupts tissue polarity in 3D by preventing integration of microenvironmental signals. Oncotarget. 2013;4:2010-2020. [PubMed] |
| 22. | Khan S, Lopez-Dee Z, Kumar R, Ling J. Activation of NFkB is a novel mechanism of pro-survival activity of glucocorticoids in breast cancer cells. Cancer Lett. 2013;337:90-95. [PubMed] [DOI] |
| 23. | Chen J, Li Z, Chen AY, Ye X, Luo H, Rankin GO, Chen YC. Inhibitory effect of baicalin and baicalein on ovarian cancer cells. Int J Mol Sci. 2013;14:6012-6025. [PubMed] [DOI] |
| 24. | Ozbek E, Aliskan T, Otunctemur A, Calik G, Cakir S, Dursun M, Somay A. Comparison of tumor grade and stage with nuclear factor kappa b and p38 mitogene activated protein kinase expressions in renal cell cancer. Arch Ital Urol Androl. 2012;84:53-60. [PubMed] |
| 25. | Nguyen MH, Ueda K, Nakamura Y, Daigo Y. Identification of a novel oncogene, MMS22L, involved in lung and esophageal carcinogenesis. Int J Oncol. 2012;41:1285-1296. [PubMed] [DOI] |
| 26. | Kwon HC, Kim SH, Oh SY, Lee S, Lee JH, Jang JS, Kim MC, Kim KH, Kim SJ, Kim SG. Clinicopathologic significance of expression of nuclear factor-κB RelA and its target gene products in gastric cancer patients. World J Gastroenterol. 2012;18:4744-4750. [PubMed] [DOI] |
| 27. | Karin M, Cao Y, Greten FR, Li ZW. NF-kappaB in cancer: from innocent bystander to major culprit. Nat Rev Cancer. 2002;2:301-310. [PubMed] [DOI] |
| 28. | Moorchung N, Kunwar S, Ahmed KW. An evaluation of nuclear factor kappa B expression in colorectal carcinoma: an analysis of 50 cases. J Cancer Res Ther. 2014;10:631-635. [PubMed] [DOI] |
| 29. | Greten FR, Eckmann L, Greten TF, Park JM, Li ZW, Egan LJ, Kagnoff MF, Karin M. IKKbeta links inflammation and tumorigenesis in a mouse model of colitis-associated cancer. Cell. 2004;118:285-296. [PubMed] [DOI] |
| 30. | Sun XF, Zhang H. NFKB and NFKBI polymorphisms in relation to susceptibility of tumour and other diseases. Histol Histopathol. 2007;22:1387-1398. [PubMed] |