修回日期: 2015-05-21
接受日期: 2015-06-01
在线出版日期: 2015-07-08
目的: 检测垂体肿瘤转化基因1(pituitary tumor-transforming gene 1, PTTG1)、基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)及MMP-9在胃癌中的表达, 分析三者在胃癌表达中的相关性, 探讨他们在胃癌发生、发展、转移、预后中起的重要作用.
方法: 采用免疫组织化学SP法检测80例胃癌组织中PTTG1、MMP-2及MMP-9的表达情况并分析三者表达与胃癌临床病例参数的关系及三者的相关性.
结果: PTTG1、MMP-2及MMP-9的表达均与胃癌的组织学分级、临床分期及淋巴结转移密切相关(均P<0.05), 而与年龄、性别及组织学类型无关(均P>0.05). 三者在胃癌中的表达强度呈显著正相关(P<0.05).
结论: PTTG1、MMP-2及MMP-9的表达在胃癌的发生发展侵袭和转移中起着重要的作用, 均可作为判定胃癌恶性程度, 评估其侵袭性及转移的分子生物学指标.
核心提示: 本文通过检测垂体肿瘤转化基因1(pituitary tumor-transforming gene 1, PTTG1)、基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)及MMP-9在胃癌中的表达, 探讨PTTG1、MMP-2及MMP-9在胃癌的发生发展侵袭和转移中起着重要的作用. 结果提示PTTG1、MMP-2及MMP-9均可作为判定胃癌恶性程度, 评估其侵袭性及转移的分子生物学指标.
引文著录: 温福海, 孙连美, 李洪利, 尹崇高. 垂体肿瘤转化基因1、基质金属蛋白酶-2及基质金属蛋白酶-9在胃癌组织中表达的意义. 世界华人消化杂志 2015; 23(19): 3147-3151
Revised: May 21, 2015
Accepted: June 1, 2015
Published online: July 8, 2015
AIM: To detect the expression of pituitary tumor-transforming gene 1 (PTTG1), matrix metalloproteinase (MMP)-2 and MMP-9 in gastric carcinoma and explore the role of PTTG1, MMP-2 and MMP-9 in the development, metastasis and prognosis of gastric carcinoma.
METHODS: Expression of PTTG1, MMP-2 and MMP-9 in 80 gastric carcinoma tissues was detected by Streptavidin-Peroxidase immunohistochemistry staining. The correlation of PTTG1, MMP-2 and MMP-9 expression and their relationship with clinicopathologic factors of gastric carcinoma were analyzed.
RESULTS: The positive rates of PTTG1, MMP-2 and MMP-9 expression were significantly correlated with differentiation degree, lymph node metastasis and TNM stage (P < 0.05), but not with age, gender or pathologic type (P > 0.05). There was a positive correlation between the expression of PTTG1, MMP-2 and MMP-9 (P < 0.05).
CONCLUSION: PTTG1, MMP-2 and MMP-9 may play an important role in the occurrence, development, invasion and metastasis of gastric carcinoma. They may serve as molecular biological indexes for evaluating tumor infiltration and metastasis.
- Citation: Wen FH, Sun LM, Li HL, Yin CG. Expression of pituitary tumor-transforming gene 1, matrix metalloproteinase-2 and matrix metalloproteinase-9 in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2015; 23(19): 3147-3151
- URL: https://www.wjgnet.com/1009-3079/full/v23/i19/3147.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i19.3147
胃癌是国内最常见的恶性肿瘤之一, 其死亡的主要原因是肿瘤细胞的侵袭和转移[1]. 肿瘤的发生发展侵袭和转移是涉及癌基因的突变, 抑癌基因的丢失等多因素、多步骤的复杂的过程[2]. 到目前为止, 胃癌发生发展侵袭转移的分子机制仍不清楚. 前期研究表明胃癌患者的预后和肿瘤是否转移有密切的相关性, 即淋巴结转移率越高的患者预后越差、生存期越短.
垂体肿瘤转化基因(pituitary tumor-transforming gene, PTTG)是最近发现的癌基因, 其家族包括PTTG1、PTTG2及PTTG3 3个成员, 其中PTTG1是最广泛被研究的成员, 所以我们通常说的PTTG是指的PTTG1[3]. PTTG1可以通过多种机制影响多种肿瘤的发生发展侵袭和转移[4]. 但是PTTG1在胃癌的侵袭转移中的作用机制目前尚未见报道. 基质金属蛋白酶(matrix metalloproteinase, MMPs)在肿瘤细胞的侵袭和转移中起着关键的作用. 本研究拟采用免疫组织化学的方法检测人胃癌组织中PTTG1、MMP-2及MMP-9的表达情况, 探讨三者与胃癌生物学行为的关系和三者之间的相互关系.
收集2011-01/2013-12潍坊医学院附属医院胃癌切除组织80例. 所有病例均经2名以上病理主治医师检查证实, 术前均未接受任何放射疗法、化学疗法及免疫疗法. 其中男性58例, 女性22例. 年龄44-68岁, 平均年龄56.8岁. 腺癌68例(高分化癌18例, 中分化癌29例, 低分化癌21例), 黏液腺癌12例. 按世界卫生组织标准分为Ⅰ期11例、Ⅱ期16例、Ⅲ期35例、Ⅳ期18例. 有淋巴结转移者50例, 无淋巴结30例.
采用免疫组织化学SP法, 抗人PTTG1、MMP-2及MMP-9抗体为Santa Cruz产品, 兔抗SP、DAB显色试剂盒购自北京中杉生物技术有限公司; 用PBS代替一抗作为阴性对照. 免疫组织化学结果判定, 参照先前发表的文献[4]. 在显微镜下随机选择6个视野, 每个视野计数500个细胞, 阳性细胞占同类计数细胞的百分比为阳性细胞率. 细胞阳性率计分如下: 阳性率0%-5%计数为0分; 阳性率6%-25%计分为1分; 阳性率26%-50%计分为2分; 阳性率51%-75%计分为3分; 阳性率>75%计分为4分. 细胞染色强度计分如下: 细胞未染色为0; 染色呈淡黄色为1分; 染色呈棕黄色为2分; 染色呈棕褐色为3分. 最后以阳性细胞率和染色强度之和进行结果判定: 0-1分为阴性, 2-7分为阳性.
统计学处理 所有资料采用SPSS16.0统计软件包进行处理, PTTG1、MMP-2及MMP-9的表达与胃癌临床病理参数的关系采用χ2检验, 其相关性采用Spearman相关性分析. P<0.05为差异有统计学意义.
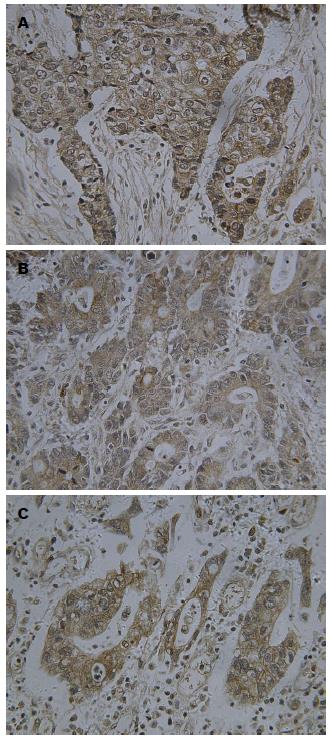
PTTG1、MMP-2及MMP-9的阳性染色均为棕褐色, 颗粒状, 主要定位于胃癌细胞的细胞浆, 细胞核也有少量的表达. 阴性对照未见棕黄色颗粒. 三者在胃癌组织中的阳性表达率与组织学分级、临床分期及淋巴结转移差异有统计学意义(均P<0.05), 而与性别、年龄、肿瘤大小及组织学分型无关(均P>0.05)(表1, 图1).
| 项目 | n | PTTG1 | χ2/P值 | MMP-2 | χ2/P值 | MMP-9 | χ2/P值 | |||
| + | - | + | - | + | - | |||||
| 性别 | 0.978/0.323 | 0.139/0.709 | 1.458/0.227 | |||||||
| 男 | 58 | 41 | 17 | 42 | 16 | 40 | 18 | |||
| 女 | 22 | 13 | 9 | 15 | 7 | 12 | 10 | |||
| 年龄(岁) | 0.001/0.981 | 0.787/0.375 | 0.812/0.368 | |||||||
| ≤57 | 46 | 31 | 15 | 31 | 15 | 28 | 18 | |||
| >57 | 34 | 23 | 11 | 26 | 8 | 24 | 10 | |||
| 肿瘤大小(cm) | 1.262/0.261 | 0.283/0.595 | 0.108/0.742 | |||||||
| ≤5 | 38 | 28 | 10 | 26 | 12 | 24 | 14 | |||
| >5 | 42 | 26 | 16 | 31 | 11 | 28 | 14 | |||
| 组织学类型 | 1.613/0.204 | 0.097/0.756 | 1.396/0.237 | |||||||
| 腺癌 | 68 | 44 | 24 | 48 | 20 | 46 | 22 | |||
| 黏液腺癌 | 12 | 10 | 2 | 9 | 3 | 6 | 6 | |||
| 分化程度 | 4.032/0.045 | 6.115/0.013 | ||||||||
| 高-中分化 | 37 | 20 | 17 | 21 | 16 | 19.092/0.000 | 19 | 18 | ||
| 低分化 | 31 | 24 | 7 | 27 | 4 | 27 | 4 | |||
| 临床分期 | 9.875/0.002 | 7.486/0.006 | 5.087/0.024 | |||||||
| Ⅰ-Ⅱ期 | 27 | 12 | 15 | 14 | 13 | 13 | 14 | |||
| Ⅲ-Ⅳ期 | 53 | 42 | 11 | 43 | 10 | 39 | 14 | |||
| 淋巴结转移 | 9.497/0.002 | 18.262/0.000 | 16.938/0.000 | |||||||
| 有 | 50 | 40 | 10 | 44 | 6 | 41 | 9 | |||
| 无 | 30 | 14 | 16 | 13 | 17 | 11 | 19 | |||
PTTG1是新发现的一种癌基因, 研究[5]表明, PTTG1可以启动细胞内外多种信号转导途径, 促进多种肿瘤的发生发展及侵袭和转移. 有研究[6]表明PTTG1在胃癌淋巴结转移中具有一定的作用, 而且其表达与胃癌病理组织学分级、临床分期有关. 刘振忠等[7]研究发现PTTG的表达与胃癌的分化程度、TNM分期及有无淋巴结转移密切相关. 但是关于PTTG1与MMP-2及MMP-9在胃癌中的表达情况及其三者的相关性目前尚未见报道.
肿瘤转移的其中一个原因就是在其迁移方向上降解细胞外基质(extracellular matrix, ECM), 而MMP负责降解ECM. MMP-2和MMP-9具有降解血管基底膜的Ⅳ型胶原的作用, 从而在肿瘤的转移中起着重要的作用[8]. 研究[9-14]发现, 在乳腺癌、直结肠癌、肺癌、胶质瘤、肝癌及头颈部鳞癌等恶性肿瘤中都有MMPs的过表达, 多种肿瘤细胞可以通过分泌MMPs降解ECM促进恶性肿瘤的侵袭和转移从而影响肿瘤患者的转归及预后. Sampieri等[15]研究结果表明在多种肿瘤的发病过程中, MMP-2和MMP-9蛋白的表达随着肿瘤TNM分期的增高和淋巴结转移的发生而逐渐增高. 本课题组先前也发现在非小细胞肺癌中PTTG的表达也与MMP-2、MMP-9的表达有密切的相关性, 而且敲除非小细胞肺癌细胞系H1299中的PTTG可以降低细胞的MMP-2和MMP-9的分泌[3].
本研究采用免疫组织化学SP法检测80例胃癌组织中PTTG1、MMP-2及MMP-9的表达情况并分析三者表达与胃癌临床病例参数的关系及三者的相关性. 结果显示PTTG1、MMP-2及MMP-9的表达均与胃癌的组织学分级、临床分期及淋巴结转移密切相关, 而与年龄、性别及组织学类型无关. 三者在胃癌中的表达强度呈显著正相关. PTTG1、MMP-2及MMP-9的表达在胃癌的发生发展侵袭和转移中起着重要的作用, 均可作为判定胃癌恶性程度, 评估其侵袭性及转移的分子生物学指标.
胃癌是国内最常见的恶性肿瘤之一, 其死亡的主要原因是肿瘤细胞的侵袭和转移. 前期研究表明胃癌患者的预后和肿瘤是否转移有密切的相关性, 即淋巴结转移率越高的患者预后越差、生存期越短. 垂体肿瘤转化基因(pituitary tumor-transforming gene, PTTG)是最近发现的癌基因, 可以通过多种机制影响多种肿瘤的发生发展侵袭和转移. 基质金属蛋白酶(matrix metalloproteinase, MMP)-2和MMP-9具在肿瘤的转移中起着重要的作用. 多种肿瘤细胞可以通过分泌MMPs降解细胞外基质(extracellular matrix)促进恶性肿瘤的侵袭和转移从而影响肿瘤患者的转归及预后.
肖恩华, 教授, 中南大学湘雅二医院放射教研室
胃癌患者死亡率的升高主要是因为肿瘤的侵袭和转移, 抑制肿瘤的侵袭和转移已成为目前研究的热点之一.
刘振忠等报道采用免疫组织化学检测胃癌组织中PTTG的表达情况, 结果发现PTTG的表达与胃癌的分化程度、TNM分期及有无淋巴结转移密切相关.
胃癌恶性程度的判断可以判断胃癌患者的预后, 而研究在肿瘤侵袭和转移中起主要作用的PTTG1、MMP-2和MMP-9在胃癌中的相关性用以判断胃癌患者的预后尚未见报道, 本文可提供数据参考.
本文初步探索了PTTG1、MMP-2、MMP-9在胃癌组织中表达的相关性, 为临床判断胃癌患者的预后提供了理论和实验基础.
本文探讨PTTG1、MMP-2及MMP-9在胃癌组织中表达的相关性, 立体依据充分, 统计方法运用正确, 结论明确, 研究结果对探索胃癌发生、发展、转移、预后的分子机制有重要意义.
编辑: 韦元涛 电编:都珍珍
| 1. | 刘 艳萍, 李 国庆, 陈 宏辉, 谢 娟, 曲 小勇, 王 正跟, 朱 理辉, 封 英娟, 张 琍. 卡培他滨治疗晚期胃癌的疗效及对患者血清MMP-2、MMP-9水平的影响. 世界华人消化杂志. 2015;23:1136-1140. |
| 2. | Yin C, Li H, Zhang B, Liu Y, Lu G, Lu S, Sun L, Qi Y, Li X, Chen W. RAGE-binding S100A8/A9 promotes the migration and invasion of human breast cancer cells through actin polymerization and epithelial-mesenchymal transition. Breast Cancer Res Treat. 2013;142:297-309. [PubMed] [DOI] |
| 3. | Salehi F, Kovacs K, Scheithauer BW, Lloyd RV, Cusimano M. Pituitary tumor-transforming gene in endocrine and other neoplasms: a review and update. Endocr Relat Cancer. 2008;15:721-743. [PubMed] [DOI] |
| 4. | Li H, Yin C, Zhang B, Sun Y, Shi L, Liu N, Liang S, Lu S, Liu Y, Zhang J. PTTG1 promotes migration and invasion of human non-small cell lung cancer cells and is modulated by miR-186. Carcinogenesis. 2013;34:2145-2155. [PubMed] [DOI] |
| 5. | Zhang J, Yang Y, Chen L, Zheng D, Ma J. Overexpression of pituitary tumor transforming gene (PTTG) is associated with tumor progression and poor prognosis in patients with esophageal squamous cell carcinoma. Acta Histochem. 2014;116:435-439. [PubMed] [DOI] |
| 6. | Wen CY, Nakayama T, Wang AP, Nakashima M, Ding YT, Ito M, Ishibashi H, Matsuu M, Shichijo K, Sekine I. Expression of pituitary tumor transforming gene in human gastric carcinoma. World J Gastroenterol. 2004;10:481-483. [PubMed] |
| 8. | Desmeules P, Trudel D, Turcotte S, Sirois J, Plante M, Grégoire J, Renaud MC, Orain M, Têtu B, Bairati I. Prognostic significance of TIMP-2, MMP-2, and MMP-9 on high-grade serous ovarian carcinoma using digital image analysis. Hum Pathol. 2015;46:739-745. [PubMed] [DOI] |
| 9. | Merdad A, Karim S, Schulten HJ, Dallol A, Buhmeida A, Al-Thubaity F, Gari MA, Chaudhary AG, Abuzenadah AM, Al-Qahtani MH. Expression of matrix metalloproteinases (MMPs) in primary human breast cancer: MMP-9 as a potential biomarker for cancer invasion and metastasis. Anticancer Res. 2014;34:1355-1366. [PubMed] |
| 10. | Yan KH, Lee LM, Yan SH, Huang HC, Li CC, Lin HT, Chen PS. Tomatidine inhibits invasion of human lung adenocarcinoma cell A549 by reducing matrix metalloproteinases expression. Chem Biol Interact. 2013;203:580-587. [PubMed] [DOI] |
| 11. | Langers AM, Verspaget HW, Hawinkels LJ, Kubben FJ, van Duijn W, van der Reijden JJ, Hardwick JC, Hommes DW, Sier CF. MMP-2 and MMP-9 in normal mucosa are independently associated with outcome of colorectal cancer patients. Br J Cancer. 2012;106:1495-1498. [PubMed] [DOI] |
| 12. | Noell S, Wolburg-Buchholz K, Mack AF, Ritz R, Tatagiba M, Beschorner R, Wolburg H, Fallier-Becker P. Dynamics of expression patterns of AQP4, dystroglycan, agrin and matrix metalloproteinases in human glioblastoma. Cell Tissue Res. 2012;347:429-441. [PubMed] [DOI] |
| 13. | Chen R, Cui J, Xu C, Xue T, Guo K, Gao D, Liu Y, Ye S, Ren Z. The significance of MMP-9 over MMP-2 in HCC invasiveness and recurrence of hepatocellular carcinoma after curative resection. Ann Surg Oncol. 2012;19 Suppl 3:S375-S384. [PubMed] [DOI] |
| 14. | Garavello W, Maggioni D, Nicolini G, Motta L, Tredici G, Gaini R. Association between metalloproteinases 2 and 9 activity and ERK1/2 phosphorylation status in head and neck cancers: an ex vivo study. Oncol Rep. 2010;24:1073-1078. [PubMed] |
| 15. | Sampieri CL, León-Córdoba K, Remes-Troche JM. Matrix metalloproteinases and their tissue inhibitors in gastric cancer as molecular markers. J Cancer Res Ther. 2013;9:356-363. [PubMed] [DOI] |