修回日期: 2015-05-03
接受日期: 2015-05-08
在线出版日期: 2015-07-08
目的: 探讨女性功能性消化不良患者与血清褪黑素和雌激素水平的关系, 初步探讨功能性消化不良发病机制, 为寻找有效治疗功能性消化不良的临床方法及诊断功能性消化不良不同类型提供依据.
方法: 取符合Roman Ⅲ诊断标准的60例女性功能性消化不良患者为实验组, 并分成两组: 35例上腹痛综合征组(epigastric pain syndrome, EPS)、25例餐后不适综合征组(postprandial distress syndrome, PDS); 30例无功能性消化不良症状及无器质性疾病体检健康者作为对照组, 分别测定血清褪黑素及雌激素水平.
结果: (1)功能性消化不良组及PDS组血清褪黑素水平均较对照组明显升高(P<0.05); PDS组较EPS组也明显升高(P<0.05); 而EPS组与对照组比较(P>0.05); (2)PDS组血清褪黑素水平症状重者较症状轻者升高(P<0.05); 其中女性EPS组血清褪黑素水平症状重者较症状轻者减低(P<0.05); (3)功能性消化不良组(围绝经期)血清雌激素水平较对照组减低(P<0.05); (4)功能性消化不良组(围绝经期)血清雌激素水平症状重者较症状轻者减低(P<0.05); (5)功能性消化不良组(围绝经期)血清褪黑素水平与雌激素水平之间不存在相关性(r = -0.03, P>0.05).
结论: (1)血清褪黑素水平的改变在功能性消化不良特别是PDS的发病中起作用, 与EPS的发病无明显关系; (2)血清褪黑素水平可能对功能性消化不良临床类型分型的诊断有一定意义; (3)血清雌激素水平改变在围绝经期功能性消化不良发病中起作用, 补充外源性雌激素可能改善围绝经期功能性消化不良患者的症状.
核心提示: 血清褪黑素水平的改变在功能性消化不良(functional dyspepsia, FD)特别是餐后不适综合征组(postprandial distress syndrome)的发病中起作用, 与上腹痛综合征组(epigastric pain syndrome)的发病无明显关系; 血清褪黑素水平可能对FD临床类型分型的诊断有一定意义; 血清雌激素水平改变在围绝经期FD发病中起作用, 补充外源性雌激素可能改善围绝经期FD患者的症状. 本实验研究得出的结论为寻找有效治疗FD的临床方法及诊断FD不同类型提供依据.
引文著录: 朱梦霞, 黄群, 王芳, 谢娟, 向琼, 张琍. 女性功能性消化不良患者血清褪黑素和雌激素水平的变化. 世界华人消化杂志 2015; 23(19): 3038-3044
Revised: May 3, 2015
Accepted: May 8, 2015
Published online: July 8, 2015
AIM: To detect the levels of serum melatonin and estrogen in women with functional dyspepsia (FD), and to evaluate the possible mechanism of FD.
METHODS: Sixty women diagnosed with FD according to Roman Ⅲ criteria were included into an experimental group, which was further divided into two subgroups: patients with epigastric pain syndrome (EPS) (n = 35) and those with postprandial distress syndrome (PDS) (n = 25). Thirty healthy person were chose as normal controls. Serum melatonin and estrogen levels were measured and analyzed in these subjects.
RESULTS: In the FD group and PDS subgroup, the levels of serum melatonin were significantly higher than that in normal controls (P < 0.05). In the PDS subgroup, the concentration of serum melatonin was significantly higher than that in the EPS subgroup (P < 0.05). There was no significant difference in the concentration of serum melatonin between the EPS subgroup and the normal control group (P > 0.05). PDS patients with severe symptoms displayed a higher melatonin concentration as compared with patients with moderate symptoms (P < 0.05). EPS patients with severe symptoms displayed a lower melatonin concentration as compared with patients with moderate symptoms (P < 0.05). In the FD subgroup (menopausal transition), the concentration of serum estrogen was significantly lower than that in normal controls (P < 0.05). FD patients (menopausal transition) with severe symptoms displayed a lower estrogen concentration as compared with patients with moderate symptoms (P < 0.05). In FD patients (menopausal transition), there was no significant correlation between the levels of serum melatonin and estrogen (r = -0.03, P > 0.05).
CONCLUSION: The alteration of serum melatonin may play a role in the pathogenesis of FD, especially PDS, but has no obvious relation with EPS. Serum melatonin level maybe have certain significance for the diagnosis of various clinical forms of FD. The alteration of serum estrogen may play a role in the development of FD. Supplementing exogenous estrogen may improve symptoms of FD patients with perimenopausal symptoms.
- Citation: Zhu MX, Huang Q, Wang F, Xie J, Xiang Q, Zhang L. Changes in serum melatonin and estrogen levels in women with functional dyspepsia. Shijie Huaren Xiaohua Zazhi 2015; 23(19): 3038-3044
- URL: https://www.wjgnet.com/1009-3079/full/v23/i19/3038.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i19.3038
功能性消化不良(functional dyspepsia, FD)指存在消化不良症状而无法用生化异常及器质性病变解释的消化功能异常性疾病, 是临床上最常见一种功能性胃肠病(functional gastrointestinal disorders, FGIDs), 严重影响患者生活质量[1,2]. 多数研究[3-5]显示, FD是由多因素和多种机制共同所致, 目前基本认为和胃肠动力障碍和内脏高敏感性、胃酸分泌、幽门螺杆菌感染、胃肠激素、心理及社会环境因素等相关. 近年来随着对褪黑素研究的深入, 发现褪黑素及其结合位点在胃肠道广发分布, 有关研究[6-9]已证实褪黑素在某些消化系疾病发病机制中扮演重要的角色, 如溃疡、胃食管反流病(gastroesophageal reflux disease, GERD)、胃肠胰腺神经内分泌肿瘤等. 褪黑素对肠道功能的影响也有一些相关的研究[10], 但与FD的关系研究甚少. FD患者多以围绝经期女性为主, 性别及年龄上的差异反应了性激素在FD的发病中起一定作用, 因此FD的症状可能与雌激素密切相关. 本研究通过检测不同组别中血清褪黑素及雌激素水平, 采用消化不良症状积分量表评估患者消化不良症状状况, 初步探讨FD可能的发病机制, 为寻求有效的临床治疗方案提供依据.
从2012-05/2012-12在南华大学附属第二医院消化内科和神经内科及其他内科住院病房中选取60例女性FD患者作为实验组, 同时符合FGIDs的Roman Ⅲ[11]诊断FD标准: (1)有以下1项或多项症状: 上腹(胃十二指肠区域)疼痛或上腹烧灼感、早饱、餐后饱胀不适感, 病程至少超过6 mo, 最近3 mo持续有以上症状; (2)经胃镜检查示正常或轻度炎症改变, 除外糜烂、溃疡、肿瘤等器质性病变; (3)经实验室(三大常规, 血生化)检查、腹部B超等检查排除肝、胆、脾、胰、肠道的器质性病变; (4)排除糖尿病及结缔组织疾病, 免疫性疾病, 无腹部手术史, 排除肠易激综合症(irritable bowel syndrome, IBS); (5)体质量指数在18.5-25.0 kg/m2. 对照组为同期在南华大学附属第二医院健康体检中心体检者30例, 入选标准: 近1年内未出现明显胃肠道症状及疾病, 实验室(三大常规, 血生化)检查均正常并排除各种器质性疾病.
60例女性FD患者, 年龄19-60岁, 平均年龄41.75岁. 并根据Roman Ⅲ中FD的诊断标准将其分成两组: 即餐后不适综合征组(postprandial distress syndrome, PDS)和上腹痛综合征组(epigastric pain syndrome, EPS), 其中PDS组25例, 平均年龄41.60岁; EPS组35例, 平均年龄41.86岁. 健康对照组共30例, 平均年龄41.90岁. 围绝经期FD患者30例, 年龄43-57岁, 平均年龄48.23岁, 围绝经期健康患者20例, 年龄39-57岁, 平均年龄47.15岁.
1.2.1 FD患者消化不良症状评估: 详细询问患者症状, 症状的严重程度: 1分-轻度, 需稍加注意方可感到症状; 2分-中度, 具有可耐受的自觉症状, 尚不影响学习、生活及睡眠; 3分-重度, 具有严重影响学习、生活和睡眠的症状.
1.2.2 检测项目: FD病例组及健康对照组均空腹10 h以上, 于早上07:30-09:30抽取静脉血5 mL, 并向试管中立即注入含10%依地酸二钠(10%EDTA-2Na)40 μg混匀抗凝, 室温下静置30 min, 3000 r/min, 离心10 min, 分离出血清2 mL, 并置于-80 ℃冰箱保存待测. 采用酶联免疫法检测褪黑素及雌激素浓度.
统计学处理 所有实验数据均在SPSS19.0统计软件上进行统计学分析. 计量资料数据均以mean±SD表示; 采用成组t检验比较两组均数; 采用LSD法两两比较多组间均数, 采用单因素方差分析比较多组间均数, 血清褪黑素水平与雌激素水平之间的相关性采用Pearson相关分析, 血清褪黑素、雌激素水平与消化不良症状程度之间的相关性采用Spearman相关分析; P<0.05为差异有统计学意义.
FD组和PDS组体质量指数、年龄较对照组比较差异无统计学意义(P>0.05); EPS组体质量指数、年龄较对照组比较差异无统计学意义(P>0.05); PDS组体质量指数、年龄较EPS组比较差异无统计学意义(P>0.05)(表1).
| 分组 | n | 体质量指数(kg/m2) | 年龄(岁) |
| 对照组 | 30 | 22.14±1.89 | 41.90±9.00 |
| FD组 | 60 | 22.39±1.97 | 41.75±10.30 |
| PDS组 | 25 | 22.58±1.93 | 41.60±10.84 |
| EPS组 | 35 | 22.26±2.03 | 41.86±10.12 |
围绝经期FD组体质量指数(22.64 kg/m2±2.08 kg/m2)、年龄(48.23岁±3.61岁)与对照组体质量指数(22.30 kg/m2±1.95 kg/m2)、年龄(47.15岁±5.18岁)比较差异无统计学意义(P>0.05).
FD组血清褪黑素水平(22.27 pg/mL±7.29 pg/mL)较对照组(16.10 pg/mL±3.94 pg/mL)升高(P<0.05); 其中PDS组血清褪黑素水平(28.95 pg/mL±3.84 pg/mL)较对照组及EPS组(17.63 pg/mL±4.92 pg/mL)均明显升高(P<0.05); 而EPS组与对照组比较血清褪黑素水平差异无统计学意义(P>0.05). 围绝经期FD组血清雌激素水平(40.55 pg/mL±14.90 pg/mL)较对照组(69.51 pg/mL±17.92 pg/mL)减低(P<0.05).
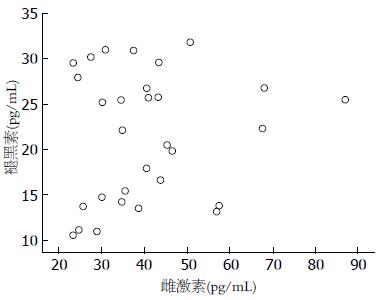
FD组(围绝经期)血清褪黑素水平与雌激素水平之间不存在相关性(r = 0.14, P>0.05)(图1).
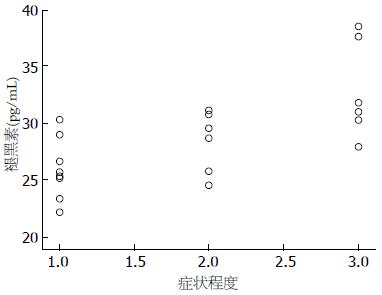
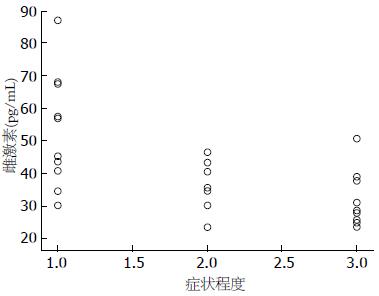
PDS组血清褪黑素水平与消化不良症状之间存在正相关(r = 0.70, P<0.01)(图2). FD组(围绝经期)血清雌激素水平与消化不良症状之间存在负相关(r = -0.62, P<0.01)(图3).
FD是临床上FGIDs中最常见的一种, 具有异质性、多发性、慢性等特点. Roman Ⅲ诊断标准将FD分为EPS及PDS, 该分型方法主要由患者的主观症状来决定, 缺乏客观指标. 因此, 如何以更加客观的指标来区分不同临床类型的FD, 不同类型FD是否有不同的发病机制, 这些都是尚待解决的问题.
褪黑素最先被发现在松果体中合成并呈周期性分泌, 后来发现胃肠道的嗜铬细胞亦能合成, 其分布量与肠道内的嗜铬细胞分布密度一致[12]. 他的生物合成受光周期的制约, 在体内的含量呈昼夜性的节律改变, 可通过自分泌或旁分泌作用于其受体的方式参与许多调节过程, 如生物节律、睡眠、情绪、抗炎、抗氧化、代谢和生殖等. 褪黑素及其代谢产物是强力的抗氧化剂[13,14], 刺激十二指肠和胰腺[15,16]的碳酸氢根分泌, 还可抑制胃酸及胃蛋白酶分泌和舒张胃肠道平滑肌[17], 增加胃黏膜血流量, 加速消化性溃疡的愈合[18], 他的抗感染和免疫调节性能对胃肠道[19,20]有一定的保护作用. 褪黑素可通过激活其受体调节肠道动力, 此过程中MT2最可能参与[21,22]. 另外, 还有实验[23]证实, 小剂量褪黑素可以加快鼠肠动力, 但大剂量则抑制其作用, 且这些作用均能为褪黑素受体阻滞剂luzindole阻断. 本实验研究发现, PDS组血清褪黑素浓度显著高于对照组及EPS组, 与相关文献[24]报道一致. 在对褪黑素进行研究中, FD患者被分为PDS组及EPS组, 其中PDS组血清褪黑素浓度显著高于对照组, 因此我们认为胃肠运动异常可能是PDS的主要病理生理机制, 由于PDS组的异常增加的血清褪黑素量抑制了胃酸及胃蛋白酶分泌, 从而导致PDS患者出现早饱, 餐后饱胀不适等症状, 且研究表明大剂量的褪黑素可以抑制肠道动力, 提示褪黑素在FD发病机制中扮演一定角色. 长期限制饮食可以增加肠道褪黑素的浓度, 这在某种程度上解释了PDS组血浆褪黑素的来源, 可能来自肠道嗜铬细胞, 因为PDS患者存在长期饮食不佳现象.
本研究发现, EPS组血清褪黑素水平较对照组比较差异无统计学意义, 我们认为血清褪黑素水平在EPS的发病中作用不大, 考虑EPS主要由于胃黏膜承受的化学刺激增加和/或内脏高敏感性增加所致, 与胃肠动力障碍无关, 而用内脏高敏感性更好解释. 结合国内外研究中十二指肠溃疡中褪黑素的浓度低于健康对照组, 我们推测褪黑素在抗溃疡机制方面是重要的, 但不足以完全抵御夜间痛及空腹痛的发生. 因此动态监测血清褪黑素的变化或许对FD不同临床类型的诊断可能有一定的意义. 实验还发现, PDS组血清褪黑素水平与消化不良症状程度正相关, 因此考虑PDS患者的早饱, 餐后饱胀不适等消化不良症状与胃酸、胃蛋白酶、胃肠道动力有关, 而褪黑素能抑制胃酸及胃蛋白酶分泌和舒张胃肠道平滑肌, 以及刺激十二指肠和胰腺碳酸氢根分泌, 大剂量的褪黑素可以抑制肠道动力, 进食L-色氨酸的食物会引起饱腹感等作用, 血清褪黑素水平的升高能使患者产生早饱, 餐后饱胀不适等症状. 由此推断血清褪黑素的升高程度或许可以作为评价PDS严重程度的临床指标之一.
雌激素是一种基本结构为雌烷核的甾体激素, 其生成与分泌受下丘脑-垂体-性腺轴的调控. 据观察, FD患者多以女性为主, 性别上的差异反应了性激素在FD的发病中起一定作用. 对于女性发病率高的解释有很多, 在生理学因素上证实性别不同, 其胃肠通过时间、内脏感知和中枢神经系统疼痛反应不同, 尤其是雌激素、睾酮激素和孕激素在消化系方面产生不同的影响. 已经有相关文献[25]表示, 消化系的动力状态与雌激素有关, 雌激素能松弛食管下段括约肌(lower esophageal sphincter, LES), 分娩后雌孕激素水平下降, 胃食管反流消失. 此外, 雌激素还可以抑制胃酸分泌, 引起FD, 其对肠动力也呈抑制作用[26]. 我们的研究发现围绝经期FD组血清雌激素水平较对照组减低, 与国内一些相关研究[27]一致. 有实验表明, 精神心理不健康可通过脑肠肽等神递质影响植物神经系统功能, 既可能使消化液的分泌发生紊乱, 也可干扰消化系统的动力, 由此出现一系列FD症状. 许多研究资料也显示焦虑、抑郁等精神心理障碍在FD患者中常见, 而更年期妇女抑郁症状发生率明显高于育龄期妇女, 并与雌激素降低有关. 雌激素和神经递质及情感障碍的关系很复杂, 可能主要是通过5-羟色胺(5-hydroxytryptamine, 5-HT)系统影响情绪. 雌激素可增加脑内5-HT受体含量, 并促进其合成; 5-HT功能不足则会出现抑郁症状, 故雌激素降低将可能导致抑郁症状出现, 增加FD的发生. 国外研究[28]证实, 绝经期妇女予以雌激素治疗后, 血清ghrelin水平显著升高, 而ghrelin可促进食欲、增强胃动力、促进胃排空和小肠转运及刺激胰腺内外分泌功能, 改善围绝经期及绝经后妇女FD症状. FD与IBS均属FGIDs, 他们的发病机制或许相同. 崔楠等[29]研究发现女性IBS患者外周血雌激素的含量低于与对照组, 而肠黏膜雌激素受体却高表达, 韩炜等[30]的研究报道, IBS患者盲肠黏膜和回肠末端雌激素受体阳性细胞数增多, 并认为雌激素增加了IBS患者和健康人的内脏感觉敏感性. 这在一定程度上均支持我们的研究. 另外, 有实验[27]证实, 接受雌激素治疗的FD女性患者, 患者的消化系症状明显改善. 本研究发现在围绝经期FD中, 血清雌激素水平与消化不良症状程度负相关. 而消化不良症状往往是抑郁症的主要甚至唯一表现, 因此考虑血清雌激素可能有抗抑郁的作用.
褪黑素通过影响胃肠动力、胃酸及胃蛋白酶分泌、保护胃黏膜、增加胃黏膜血供等, 在FD的发病机制中可能起一定作用, 测定褪黑素水平也为判定FD患者的不同亚型提供了客观的依据. 雌激素可以抑制胃酸分泌引起FD, 同时可以对情绪产生影响而干扰消化功能, 因此给予外源性雌激素有可能将有助于改善FD患者消化不良症状. 但临床上, FD患者的情况似乎更加复杂, 不同类型FD患者褪黑素水平是不一样, 这在一定程度上可能提示两者的发病机制不一样, 因此, 可能不同类型需要不同的治疗方法, 这些问题仍需作进一步探讨.
功能性消化不良(functional dyspepsia, FD)是胃肠道最常见一种功能性胃肠病, 严重影响患者生活质量, 但病因与发病机制尚未清楚. 近年来关于FD的研究日趋增多, 但分型方法主要由患者的主观症状来决定, 缺乏客观指标. 因此, 如何以更加客观的指标来区分不同临床类型的FD, 不同类型FD是否有不同的发病机制, 这些都是尚待解决的问题.
马欣, 主任医师, 甘肃省人民医院消化科
FD复杂的发病机制、针对于FD患者区别于其他器质性疾病的诊断和治疗措施, FD的客观分型指标均需要进一步研究探讨.
越来越多的实验表明, FD患者的生活质量严重下降, 尤其以难治性FD患者更为严重, 因此, 对于改善FD患者症状的诊疗措施在不断完善, 目前针对于发病机制所采取的各种治疗手段已逐步应用于临床, 并取得了较为理想的效果.
目前, 虽然针对于FD发病机制的实验很多, 但其与血清褪黑素及雌激素相关性的研究, 国内外相关报道较少. 对此做研究有助于进一步了解发病机制, 并为临床治疗提供依据.
本研究为FD的客观分型提供相关指标, 为改善FD患者的临床治疗方案提供理论依据.
餐后不适综合征(postprandial distress syndrome, PDS): 根据2006年美国消化疾病周制定的Roman Ⅲ诊断标准, PDS必须满足以下1条或2条: (1)发生在正常进食量后的餐后饱胀不适感, 并且每周发作数次; (2)早饱感阻止了进食常规量饮食, 并且每周发作数次. 诊断前症状出现至少6 mo, 近3 mo满足以上诊断标准; 上腹痛综合征(epigastric pain syndrome, EPS): 根据2006年美国消化疾病周制订的Roman Ⅲ诊断标准, 提出了EPS的概念. 必须满足以下所有条件: (1)至少1次/wk, 至少中等程度的上腹部疼痛或烧灼感; (2)疼痛为间断发作; (3)不是全腹痛、疼痛不在腹部其他部位或胸部; (4)排便或排气后不能缓解; (5)不符合胆囊或Oddi括约肌功能性疾病的诊断标准诊断前症状出现至少6 mo, 近3 mo满足以上诊断标准.
本文研究结论明确, 实验证据充足, 文章条理分明, 有系统的理论分析和有价值的科学结论. 有最新文献的引用. 文章较好地反映了我国胃肠病学临床和基础研究的先进水平.
编辑: 韦元涛 电编:都珍珍
| 1. | Varni JW, Bendo CB, Nurko S, Shulman RJ, Self MM, Franciosi JP, Saps M, Pohl JF. Health-related quality of life in pediatric patients with functional and organic gastrointestinal diseases. J Pediatr. 2015;166:85-90. [PubMed] [DOI] |
| 2. | Devanarayana NM, Rajindrajith S, Benninga MA. Quality of life and health care consultation in 13 to 18 year olds with abdominal pain predominant functional gastrointestinal diseases. BMC Gastroenterol. 2014;14:150. [PubMed] [DOI] |
| 6. | Madalinski MH. Does a melatonin supplement alter the course of gastro-esophageal reflux disease? World J Gastrointest Pharmacol Ther. 2011;2:50-51. [PubMed] [DOI] |
| 7. | Celinski K, Konturek PC, Konturek SJ, Slomka M, Cichoz-Lach H, Brzozowski T, Bielanski W. Effects of melatonin and tryptophan on healing of gastric and duodenal ulcers with Helicobacter pylori infection in humans. J Physiol Pharmacol. 2011;62:521-526. [PubMed] |
| 8. | Konturek PC, Brzozowska I, Targosz A, Pawlik M, Kania J, Hess T, Kwiecien S, Konturek SJ, Reiter RJ, Brzozowski T. Esophagoprotection mediated by exogenous and endogenous melatonin in an experimental model of reflux esophagitis. J Pineal Res. 2013;55:46-57. [PubMed] [DOI] |
| 9. | Söderquist F, Hellström PM, Cunningham JL. Human Gastroenteropancreatic Expression of Melatonin and Its Receptors MT1 and MT2. PLoS One. 2015;10:e0120195. [PubMed] [DOI] |
| 10. | Park YS, Chung SH, Lee SK, Kim JH, Kim JB, Kim TK, Kim DS, Baik HW. Melatonin improves experimental colitis with sleep deprivation. Int J Mol Med. 2015;35:979-986. [PubMed] [DOI] |
| 11. | Tack J, Talley NJ. Functional dyspepsia--symptoms, definitions and validity of the Rome III criteria. Nat Rev Gastroenterol Hepatol. 2013;10:134-141. [PubMed] [DOI] |
| 12. | Konturek SJ, Konturek PC, Brzozowska I, Pawlik M, Sliwowski Z, Cześnikiewicz-Guzik M, Kwiecień S, Brzozowski T, Bubenik GA, Pawlik WW. Localization and biological activities of melatonin in intact and diseased gastrointestinal tract (GIT). J Physiol Pharmacol. 2007;58:381-405. [PubMed] |
| 13. | Bekyarova G, Galunska B, Ivanova D, Yankova T. Effect of melatonin on burn-induced gastric mucosal injury in rats. Burns. 2009;35:863-868. [PubMed] [DOI] |
| 14. | Hardeland R, Tan DX, Reiter RJ. Kynuramines, metabolites of melatonin and other indoles: the resurrection of an almost forgotten class of biogenic amines. J Pineal Res. 2009;47:109-126. [PubMed] [DOI] |
| 15. | Sjöblom M, Flemström G. Melatonin in the duodenal lumen is a potent stimulant of mucosal bicarbonate secretion. J Pineal Res. 2003;34:288-293. [PubMed] [DOI] |
| 16. | Jaworek J, Brzozowski T, Konturek SJ. Melatonin as an organoprotector in the stomach and the pancreas. J Pineal Res. 2005;38:73-83. [PubMed] [DOI] |
| 17. | Ahmed R, Mahavadi S, Al-Shboul O, Bhattacharya S, Grider JR, Murthy KS. Characterization of signaling pathways coupled to melatonin receptors in gastrointestinal smooth muscle. Regul Pept. 2013;184:96-103. [PubMed] [DOI] |
| 18. | Celinski K, Konturek SJ, Konturek PC, Brzozowski T, Cichoz-Lach H, Slomka M, Malgorzata P, Bielanski W, Reiter RJ. Melatonin or L-tryptophan accelerates healing of gastroduodenal ulcers in patients treated with omeprazole. J Pineal Res. 2011;50:389-394. [PubMed] [DOI] |
| 19. | Carrillo-Vico A, Guerrero JM, Lardone PJ, Reiter RJ. A review of the multiple actions of melatonin on the immune system. Endocrine. 2005;27:189-200. [PubMed] [DOI] |
| 20. | Lahiri S, Singh P, Singh S, Rasheed N, Palit G, Pant KK. Melatonin protects against experimental reflux esophagitis. J Pineal Res. 2009;46:207-213. [PubMed] [DOI] |
| 21. | Stebelová K, Anttila K, Mänttäri S, Saarela S, Zeman M. Immunohistochemical definition of MT(2) receptors and melatonin in the gastrointestinal tissues of rat. Acta Histochem. 2010;112:26-33. [PubMed] [DOI] |
| 22. | Chen CQ, Fichna J, Bashashati M, Li YY, Storr M. Distribution, function and physiological role of melatonin in the lower gut. World J Gastroenterol. 2011;17:3888-3898. [PubMed] [DOI] |
| 24. | Chojnacki C, Poplawski T, Klupinska G, Blasiak J, Chojnacki J, Reiter RJ. Secretion of melatonin and 6-sulfatoxymelatonin urinary excretion in functional dyspepsia. World J Gastroenterol. 2011;17:2646-2651. [PubMed] [DOI] |
| 25. | Stec-Michalska K, Malicki S, Michalski B, Peczek L, Wisniewska-Jarosinska M, Nawrot B. Gastric ghrelin in relation to gender, stomach topography and Helicobacter pylori in dyspeptic patients. World J Gastroenterol. 2009;15:5409-5417. [PubMed] [DOI] |
| 26. | Hogan AM, Kennelly R, Collins D, Baird AW, Winter DC. Oestrogen inhibits human colonic motility by a non-genomic cell membrane receptor-dependent mechanism. Br J Surg. 2009;96:817-822. [PubMed] [DOI] |
| 29. | 崔 楠, 吴 保平, 吴 赛珠. 性激素及其受体与肠易激综合征发病机制的试验研究. 胃肠病学和肝病学杂志. 2007;16:223-225. |
| 30. | 韩 炜, 李 学会, 李 延青, 陈 建, 郭 成浩, 李 君曼. 肠黏膜雌孕激素受体表达在肠易激综合征发病机制中的作用研究. 胃肠病学和肝病学杂志. 2002;11:332-334. |