修回日期: 2015-05-14
接受日期: 2015-05-19
在线出版日期: 2015-07-08
目的: 观察表没食子儿茶素没食子酸酯[(-)-epigallocatechin-3-O-gallate, EGCG]作用下肝癌HepG2细胞自噬改变, 探讨其对肿瘤细胞增殖、死亡的影响及意义.
方法: DMEM培养基常规培养HepG2细胞, 分组给予不同浓度EGCG作用. 通过透射电镜观察细胞自噬泡形成、实时定量逆转录PCR及免疫印迹分析自噬相关基因及蛋白分子表达、MTT法测定细胞增殖率以及台盼蓝染色法检测细胞死亡数, 进一步通过自噬干预实验综合判断细胞自噬变化是否参与EGCG的肝癌治疗作用.
结果: EGCG明显抑制HepG2细胞生长, 药物浓度与细胞增殖率呈负相关(r = -0.9341, P<0.001). 在有效抑制细胞增殖的EGCG作用下, HepG2细胞自噬相关基因Beclin1和Atg5的mRNA及蛋白质表达下降, 作用底物P62表达增加, 细胞内自噬泡形成总体减少. 使用Raypamycin上调自噬水平明显削弱EGCG对HepG2细胞的杀伤作用(t = 9.95, P<0.01), 6-氨基-3-甲基嘌呤(3 methyladenine, 3MA)抑制自噬可显著增强药物的杀癌效应(t = 22.82, P<0.01).
结论: EGCG可通过下调肝癌细胞自噬有效抑制癌细胞增殖、促进癌细胞死亡, 是EGCG发挥治疗肝癌作用的重要药理机制.
核心提示: 本研究展示了表没食子儿茶素没食子酸酯可通过下调肝癌细胞自噬有效抑制癌细胞增殖、促进癌细胞死亡, 表现与传统化疗药物诱导自噬、妨碍治疗不同. 本研究所提供的药理机制新信息, 为进一步肝癌治疗研究提供了重要依据.
引文著录: 陈丽, 叶会兰, 张国, 姚文敏, 陈兴洲, 梁钢. 表没食子儿茶素没食子酸酯对肝癌HepG2细胞自噬信号的影响及意义. 世界华人消化杂志 2015; 23(19): 3022-3028
Revised: May 14, 2015
Accepted: May 19, 2015
Published online: July 8, 2015
AIM: To investigate the changes of autophagy in hepatocellular carcinoma (HCC) HepG2 cells in response to (-)-epigallocatechin-3-O-gallate (EGCG), and to explore its impact on cell proliferation and death.
METHODS: HepG2 cells were routinely cultured and re-plated in Dulbecco's modified eagle's medium (DMEM) in the presence of EGCG of different concentrations. Transmission electron microscopic technique was used to record the formation of autophagosomes in HepG2 cells. Real-time RT-PCR and Western blot were used to detect the mRNA and protein expression of autophagy-related genes, respectively. MTT and trypan blue assays were carried out to determine the cellular proliferation and death. Autophagic intervention experiment was performed to evaluate whether changes in autophagy are involved in the anti-cancer efficacy of EGCG in HCC.
RESULTS: The proliferation of HepG2 cells was significantly inhibited by EGCG and was negatively related to the concentrations of this compound (r = -0.9341, P < 0.001). Doses of EGCG that could effectively inhibit the proliferation of HepG2 cells significantly decreased the mRNA and protein expression of Beclin1 and Atg5, with increments of P62 named autophagic substrate as well as substantially reduced numbers of autophagasomes found in these cells. Moreover, up-regulating autophagy with rapamycin was found to apparently impair the effect of EGCG in killing HepG2 cells (t = 9.95, P < 0.01), while 3-MA, an autophagy inhibitor, dramatically exaggerated the anti-cancer effects of EGCG (t = 22.82, P < 0.01).
CONCLUSION: EGCG substantially inhibits cell proliferation and promotes cell death in HCC cells via down-regulation of autophagy, which indicates a novel critical pharmacological mechanism of EGCG for hepatoma therapy.
- Citation: Chen L, Ye HL, Zhang G, Yao WM, Chen XZ, Liang G. Effect of (-)-epigallocatechin-3-O-gallate on autophagic signaling in HepG2 cells. Shijie Huaren Xiaohua Zazhi 2015; 23(19): 3022-3028
- URL: https://www.wjgnet.com/1009-3079/full/v23/i19/3022.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i19.3022
自噬(autophagy)作为溶酶体依赖性降解途径广泛存在于各种真核细胞内, 是细胞进行自我保护的一种重要机制[1]. 自噬在维持细胞存活、更新、物质再利用和内环境稳定等机体生理过程中起着重要作用[2], 与肝癌发生、肝癌治疗的关系是近十年来的研究热点[3,4]. 表没食子儿茶素没食子酸酯[(-)-epigallocatechin-3-O-gallate, EGCG]是绿茶中含量最高的儿茶素, 具有多种生理和药理活性[5]. 研究[6-8]显示, 单独使用EGCG可诱导肝癌细胞发生凋亡、抑制细胞增殖, 还可通过联合用药增加多种实体癌细胞对传统化疗药物的敏感性及逆转癌细胞的多药耐药性. 新近关于EGCG作用是否涉及细胞自噬信号机制开始被学者们所关注[9,10]. 然而, 在这些不多的研究报道中, 自噬调节对EGCG的药效发挥呈现矛盾性影响[11,12], EGCG是否通过自噬调节影响其抗癌、抑癌作用尚无定论. 因此, 本研究如下报道EGCG治疗肝癌时的细胞自噬形态、自噬分子表达变化, 通过探讨与其抑制肝癌细胞增殖、促进凋亡的关系, 为EGCG的研发应用提供必要的药理实验依据.
人肝癌细胞HepG2购自中国科学院上海生命科学院细胞资源中心, EGCG、四甲基偶氮唑盐(MTT)购自美国Sigma公司; TRIzol购自美国Invitrogen公司; SYBR Premix Ex Taq™Ⅱ试剂盒购自大连宝生物工程有限公司; 抗人多克隆Beclin1、Atg5、P62分别购自美国Cell signaling和Novus公司; 抗人多克隆GADPH一抗及其他二抗均购自美国Santa Cruz公司; 高糖DMEM培养基和胎牛血清购自美国Thermo公司; 台盼蓝染色细胞死亡率检测试剂盒购自上海碧云天公司.
1.2.1 细胞培养: 人肝癌细胞HepG2培养在含10%胎牛血清的DMEM培养基(含2 mmol/L谷氨酰胺、1.0 mmol/L丙酮酸钠、0.1 mmol/L非必需氨基酸、100 U/mL的青霉素、100 U/mL链霉素)中, 于37 ℃、50 ml/L CO2、饱和湿度的培养箱内传代培养. 具体实验中按设计要求进行分组接种传代, 给药前, 给予更换无血清DMEM培养基处理.
1.2.2 透射电镜检测: 10 μg/mL、40 μg/mL EGCG作用于HepG2细胞(1×106)24 h后, 0.25%胰酶消化收集细胞, 用4%戊二醛1%锇酸固定液固定过夜, 环氧树脂包埋, 经醋酸铀及枸橼酸铅染色, 在透射电子显微镜下观察细胞内自噬泡的情况.
1.2.3 Real-time PCR检测: 5×105 HepG2细胞种于35 mm培养皿中, 5、10、20、40 μg/mL EGCG作用24 h后, 预冷PBS洗涤2次, TRIzol一步法抽提细胞mRNA并逆转录成cDNA, 采用SYBR Green法检测细胞内自噬相关基因Beclin1和Atg5的表达. 实验所用引物均由上海生工合成. Beclin1上游引物为: 5'-ACAGTGGACAGTTTGGCACA-3', 下游引物为: 5'-CGGCAGCTCCTTATTTGT-3'; Atg5上游引物为: 5'-CCAAAGCAGCATTGATGACCA-3', 下游引物为: 5'-AGCCACAGGACGAAACAGCTT-3'; GADPH上游引物为: 5'-CATGAGAAGTATGACAACAGCCT-3', 下游引物为: 5'-AGTCCTTCCACGATACCAAAGT-3'. 扩增条件为: 95 ℃预变性30 s, 1个循环; 95 ℃变性5 s, 60 ℃退火34 s, 共40个循环. 基因的mRNA相对表达量采用2-△△Ct计算.
1.2.4 免疫印迹检测: HepG2细胞经5、10、20、40 μg/mL的EGCG处理24 h后, 将其裂解于含蛋白酶抑制剂(Roche公司)的RIPA裂解液[20 mmol/L Tris-HCl(pH 8.0), 1%NP40, 150 mmol/L NaCl, 2 mmol/L EDTA(pH 8.0), 0.1%SDS]中, 冰上裂解40 min, 12000 g离心10 min后取上清, BCA法进行蛋白定量. 取20 μg蛋白与5×上样缓冲液混合, 97 ℃煮沸变性5 min. 10%的SDS-聚丙烯酰胺凝胶进行电泳分离, 电转移法转至PVDF膜上, 以含5%脱脂奶粉的TBST溶液室温封闭1 h, 再分别与相应一抗4 ℃孵育过夜, TBST溶液洗涤后和相应的二抗(HRP标记)室温孵育2 h. ECL显色, X线压片曝光30 s-3 min, 扫描胶片, Image J软件分析条带的密度值.
1.2.5 MTT实验: 取200 μL对数生长期的细胞接种于96孔板内, 9000个/孔, 以下各组每组设3个复孔. 待细胞贴壁后分别加入梯度浓度(5、10、20、40、80、160 μg/mL)的EGCG, 继续培养48 h后, 每孔加入MTT溶液(5 mg/mL)20 μL, 37 ℃孵育4 h后吸去上清, 每孔加入150 μL DMSO, 摇床上摇10 min使得紫色结晶充分溶解, 在酶标仪上测量450 nm处吸光度(A)值, 计算细胞增殖率并绘制曲线. 增殖率(%) = 实验组A值/对照组A值×100%.
1.2.6 台盼蓝染色法实验: 2×105 HepG2细胞接种于12孔板中, 待细胞贴壁培养24 h后, 单独加入10、40 μg/mL的EGCG作用, 或先分组给予2 mmol/L 3MA和100 nmol/L Raypamycin预处理细胞30 min, 再联用EGCG孵育细胞, 药物作用48 h后采用台盼蓝染色法计死亡细胞数[13].
统计学处理 应用统计学软件SPSS18.0进行统计分析, 数据以mean±SD表示, 多组间比较采用One-way ANOVA分析, 进一步两组间比较采用t检验; 计算两个变量间的相关系数采用Pearson相关分析, P<0.05为差异具有统计学意义.
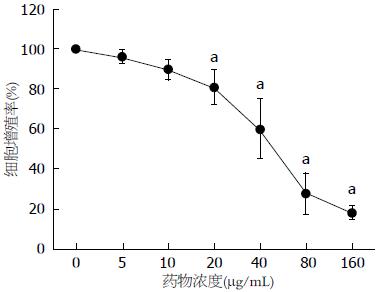
根据MTT实验结果绘制出细胞生长曲线, 如图1所示, 以5-160 μg/mL梯度浓度EGCG分别孵育HepG2细胞48 h, 随着给药浓度增加, 细胞增殖率依次下降, 表现出较典型的剂量-增殖抑制效应依赖性关系, 其中, 20、40、80、160 μg/mL药物作用下, 增殖率分别下降至80.83%±8.51%、59.88%±14.50%、27.20%±10.16%和17.97%±2.91%. HepG2细胞增殖率与EGCG作用浓度负相关(r = -0.9341, P<0.001).
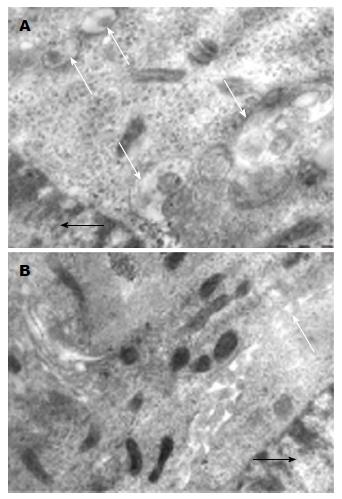
透射电镜下, 10 μg/mL低浓度EGCG孵育细胞时, 细胞超微表现与对照组无明显差异. 当用40 μg/mL EGCG作用时, 肝癌HepG2细胞发生细胞自噬现象, 细胞胞浆中可观察到典型的自噬泡存在. 典型者具有双层膜结构, 自噬泡内包含有一种或多种结构不完整的细胞质或见包绕线粒体、溶酶体等细胞器. 如图2A图中可观察到基础处理对照组中HepG2细胞内有多个自噬泡(白色箭头所指)存在; 图2B为用40 μg/mL EGCG孵育细胞24 h后的透射超微电镜观, 镜下自噬泡总体减少, 典型双层膜结构自噬体不易被找到. 在EGCG作用下, 胞质密度增加, 内质网明显脱颗粒, 易见凋亡小体.
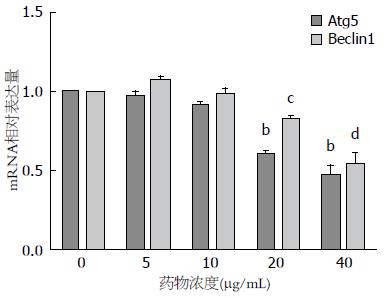
Real-time qPCR检测细胞内自噬相关基因mRNA表达, 结果显示5、10、20、40 μg/mL EGCG孵育HepG2细胞24 h后, 细胞中Beclin1 mRNA的相对表达量分别为0.97±0.07、0.92±0.01、0.61±0.04、0.47±0.12(F = 46.08, P<0.0001); Atg5 mRNA的相对表达量分别为1.08±0.04、0.99±0.07、0.83±0.04、0.54±0.13(F = 29.76, P<0.0001)(图3).
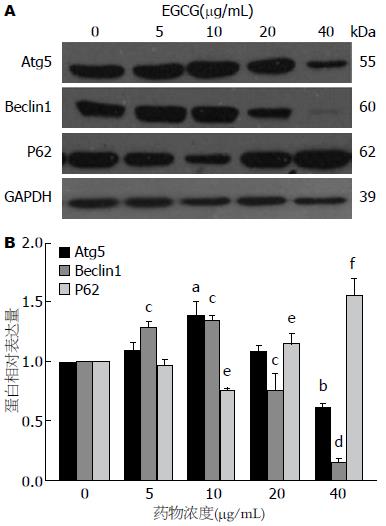
图4免疫印迹检测结果显示, 低浓度EGCG(5、10 μg/mL)作用下, HepG2细胞中Atg5、Beclin1蛋白表达不变或轻度升高; 当给药浓度增加, 细胞Atg5及Beclin1蛋白水平的表达呈现相反趋势, 给药浓度增至40 μg/mL时, Atg5及Beclin1分别下降约39%和84%. 与此同时, 检测发现, 自噬作用底物P62的表达明显增加, 平均增量达54%(F = 74.40, P<0.0001).
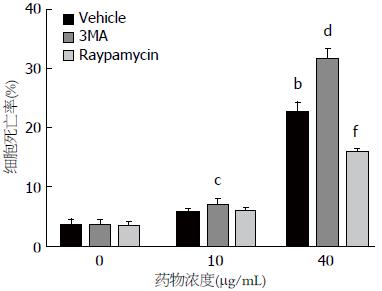
如图5所示, 给予低浓度EGCG 10 μg/mL单药作用, HepG2不受明显影响, 加入40 μg/mL EGCG作用后, 可切实杀死癌细胞, 死亡率约22.57%±2.78%(t = 15.48, P<0.01). 给予2 mmol/L 3MA预处理细胞30 min, 再加入EGCG孵育, 细胞死亡明显增加, 40 μg/mL EGCG组细胞死亡率达到31.63%±2.55%(t = 22.82, P<0.01), 较单用EGCG药效增幅约40%; 联用Raypamycin和EGCG孵育细胞48 h, 明显减弱单用EGCG的杀伤作用, HepG2存活细胞数增加(t = 9.95, P<0.01).
长期饮用绿茶具有防癌抗癌意义, 已成为人民大众生活中的一种重要行为和习惯[14,15]. 然而, 作为绿茶中最主要成分EGCG迟迟未能有效用于临床, 迫切要求从机制上重新认识和思考. 影响EGCG抑癌作用的因素较多[16,17], 概括起来, 可分为药物自身、外部环境和作用对象等. 化学结构上, 由于EGCG存在多个酚羟基基团, 极易氧化变质; 其次, EGCG在碱性或中性环境中不稳定, 导致体内生物利用度较低. 而有关肿瘤方面的影响因素也最为复杂[18]. 近年来, 由于药物化疗时常诱导肿瘤细胞自噬的发生, 导致肿瘤产生耐药、降低药物疗效, 引起学者们的普遍关注, 成为研究的热点[19-21]. 自噬机制是否参与或影响到EGCG用于肝癌治疗, 迄今仍存在争议[22,23].
本研究MTT实验显示, EGCG具有抑制肝癌HepG2细胞生长作用, 其中, 10 μg/mL以下(约20 μmol/L)低浓度EGCG对细胞增殖抑制作用轻微, 超过20 μg/mL浓度以上EGCG对HepG2细胞增殖抑制较显著. 与对照相比, 低浓度EGCG作用下细胞的超微表现改变不明显. 用40 μg/mL作用时, 透射电镜下可观察到EGCG促进肝癌细胞凋亡, 与此同时, 发现EGCG总体减少HepG2中自噬小体的形成. 这与我们之前关于EGCG可减少Hep3B细胞自噬水平的报道一致[24]. 通过Real-time PCR和免疫印迹研究, 发现EGCG显著下调自噬信号通路分子Beclin1和Atg5的基因转录及蛋白质分子表达, 作用呈浓度依赖性.
近年来, 在炎症及代谢性疾病状态下, EGCG可导致细胞自噬分子表达减少、自噬通路受阻, 与我们上述研究结果类似[10,25]. 譬如, Hashimoto等[12]研究发现EGCG诱导的巨噬细胞一氧化氮产量减少与其促进细胞凋亡、抑制细胞自噬有关, 观察到高浓度EGCG(100-400 μmol/L)显著减少饥饿条件诱导的细胞自噬体形成; Liu等[26]、Yan等[27]用EGCG对糖尿病GK大鼠灌胃给药, 明显减少肌肉组织自噬信号Beclin1、LC3Ⅱ的表达, 尤其明显逆转糖尿病大鼠LC3Ⅱ/LC3Ⅰ的转换, 最终有益于糖尿病动物模型的胰岛素抵抗治疗效果. 然而, EGCG作用于肿瘤细胞时的自噬表现复杂. 一方面有报道[9]采用60 μmol/L的EGCG作用HepG2细胞9 h, LC3Ⅱ虽然增加, 但LC3作用底物P62也同步增加, 换言之, 底物消耗减少, 提示EGCG具有明显抑制细胞自噬流作用, 支持我们的发现; 另一方面也有Satoh等[28]课题组和Zhou等[29]课题组的报道与本研究结果不同, 前者探讨EGCG体外治疗恶性间皮瘤时指出, EGCG可促进肿瘤细胞LC3Ⅱ/LC3Ⅰ的转换, 表现促进自噬; 后者研究肝脂肪代谢时显示, 20、40 μmol/L作用下, HepG2细胞LC3Ⅱ表达较对照增加分别约20%、50%; 小鼠灌胃EGCG给药后肝组织中P62明显减少, 表明EGCG上调自噬水平. 不同研究所反映的细胞自噬改变差异, 究其原因, 主要与各EGCG作用的特定研究条件及不同肿瘤病理过程有关. 其次, 研究中显示低浓度EGCG轻度上调自噬, 而具有杀癌效应的高浓度药物主要表现为抑制自噬, 提示自噬调节方向受到药物作用浓度影响. 此外, 自噬调节差异分析还应纳入药物作用时间和作用对象的细胞周期因素[30].
为了进一步了解EGCG所诱导的自噬变化与其抑癌、杀癌作用的因果关系. 本研究在使用EGCG前对肝癌细胞的自噬信号通路进行干预, 结果发现, 3MA抑制自噬, 可增强EGCG所致HepG2凋亡作用, Raypamycin促进自噬, 显著削弱EGCG的致凋亡作用. 综合文献和我们原有报道, 可判定自噬抑制至少部分参与了EGCG的抗癌作用. 这与大多数常见临床化疗用药上调自噬、妨碍疗效的表现不同[4,31].
我们也认识到, 单用EGCG尽管可以达到80%以上的癌细胞增殖抑制, 但直接诱导细胞死亡的效率偏低, 若考虑EGCG存在生物利用度不高的缺点, 在体内给药的情况下, 难以让血药浓度达到本研究中最高的体外有效水平, 因此仅通过单用EGCG治疗肝癌存在困难, 提示我们, 今后的重点研究方向可考虑通过联合用药, 抵消自噬对化疗药物的负向影响而增强共同的抑癌、杀癌效应. 无论如何, 本研究的发现, 即EGCG在抗癌、抑癌同时能下调自噬水平, 对于探讨EGCG应用于治疗肝癌提供了新的思路.
饮用绿茶具有防癌抗癌意义, 但作为绿茶最主要成分表没食子儿茶素没食子酸酯[(-)-epigallocatechin-3-O-gallate, EGCG]迟迟未能有效用于临床, 迫切要求从药理机制上对其重新认识和思考. 自噬机制是否参与或影响到EGCG用于肝癌治疗, 迄今存在争议, 也是当今研究的新热点.
邓庆, 副研究员, 博士, 上海人类基因组研究中心功能基因组部
本研究结果显示EGCG减少肝癌HepG2细胞中自噬小体的形成. 这与之前关于EGCG可减少Hep3B细胞自噬水平的报道一致, 提示EGCG治疗肝癌时涉及自噬机制的普遍性.
与大多常用化疗药诱导癌细胞自噬、妨碍治疗的表现不同, EGCG可抑制自噬发挥抑癌抗癌疗效.
该研究基于充足实验证据提出了EGCG可通过下调肝癌细胞自噬有效抑制癌细胞增殖、促进癌细胞死亡, 研究内容新颖, 研究结果提供了EGCG如何发挥治疗肝癌作用的重要药理机制信息.
编辑: 郭鹏 电编:都珍珍
| 2. | Galluzzi L, Pietrocola F, Levine B, Kroemer G. Metabolic control of autophagy. Cell. 2014;159:1263-1276. [PubMed] [DOI] |
| 3. | Carew JS, Kelly KR, Nawrocki ST. Autophagy as a target for cancer therapy: new developments. Cancer Manag Res. 2012;4:357-365. [PubMed] [DOI] |
| 4. | Amaravadi RK, Lippincott-Schwartz J, Yin XM, Weiss WA, Takebe N, Timmer W, DiPaola RS, Lotze MT, White E. Principles and current strategies for targeting autophagy for cancer treatment. Clin Cancer Res. 2011;17:654-666. [PubMed] [DOI] |
| 5. | Pan MH, Chiou YS, Wang YJ, Ho CT, Lin JK. Multistage carcinogenesis process as molecular targets in cancer chemoprevention by epicatechin-3-gallate. Food Funct. 2011;2:101-110. [PubMed] [DOI] |
| 6. | Wang S, Chen R, Zhong Z, Shi Z, Chen M, Wang Y. Epigallocatechin-3-gallate potentiates the effect of curcumin in inducing growth inhibition and apoptosis of resistant breast cancer cells. Am J Chin Med. 2014;42:1279-1300. [PubMed] [DOI] |
| 7. | Zhao H, Zhu W, Xie P, Li H, Zhang X, Sun X, Yu J, Xing L. A phase I study of concurrent chemotherapy and thoracic radiotherapy with oral epigallocatechin-3-gallate protection in patients with locally advanced stage III non-small-cell lung cancer. Radiother Oncol. 2014;110:132-136. [PubMed] [DOI] |
| 8. | Chen TC, Wang W, Golden EB, Thomas S, Sivakumar W, Hofman FM, Louie SG, Schönthal AH. Green tea epigallocatechin gallate enhances therapeutic efficacy of temozolomide in orthotopic mouse glioblastoma models. Cancer Lett. 2011;302:100-108. [PubMed] [DOI] |
| 9. | Zhang Y, Yang ND, Zhou F, Shen T, Duan T, Zhou J, Shi Y, Zhu XQ, Shen HM. (-)-Epigallocatechin-3-gallate induces non-apoptotic cell death in human cancer cells via ROS-mediated lysosomal membrane permeabilization. PLoS One. 2012;7:e46749. [PubMed] [DOI] |
| 10. | Liu J, Tang Y, Feng Z, Hou C, Wang H, Yan J, Liu J, Shen W, Zang W, Liu J. Acetylated FoxO1 mediates high-glucose induced autophagy in H9c2 cardiomyoblasts: regulation by a polyphenol -(-)-epigallocatechin-3-gallate. Metabolism. 2014;63:1314-1323. [PubMed] [DOI] |
| 11. | Li W, Zhu S, Li J, Assa A, Jundoria A, Xu J, Fan S, Eissa NT, Tracey KJ, Sama AE. EGCG stimulates autophagy and reduces cytoplasmic HMGB1 levels in endotoxin-stimulated macrophages. Biochem Pharmacol. 2011;81:1152-1163. [PubMed] [DOI] |
| 12. | Hashimoto K, Sakagami H. Induction of apoptosis by epigallocatechin gallate and autophagy inhibitors in a mouse macrophage-like cell line. Anticancer Res. 2008;28:1713-1718. [PubMed] |
| 13. | Elkady AI, Hussein RA, Abu-Zinadah OA. Differential control of growth, apoptotic activity and gene expression in human colon cancer cells by extracts derived from medicinal herbs, Rhazya stricta and Zingiber officinale and their combination. World J Gastroenterol. 2014;20:15275-15288. [PubMed] [DOI] |
| 14. | Tang N, Wu Y, Zhou B, Wang B, Yu R. Green tea, black tea consumption and risk of lung cancer: a meta-analysis. Lung Cancer. 2009;65:274-283. [PubMed] [DOI] |
| 15. | Wang L, Zhang X, Liu J, Shen L, Li Z. Tea consumption and lung cancer risk: a meta-analysis of case-control and cohort studies. Nutrition. 2014;30:1122-1127. [PubMed] [DOI] |
| 16. | Liang G, Tang A, Lin X, Li L, Zhang S, Huang Z, Tang H, Li QQ. Green tea catechins augment the antitumor activity of doxorubicin in an in vivo mouse model for chemoresistant liver cancer. Int J Oncol. 2010;37:111-123. [PubMed] |
| 17. | Yang CS, Wang X. Green tea and cancer prevention. Nutr Cancer. 2010;62:931-937. [PubMed] [DOI] |
| 18. | Lecumberri E, Dupertuis YM, Miralbell R, Pichard C. Green tea polyphenol epigallocatechin-3-gallate (EGCG) as adjuvant in cancer therapy. Clin Nutr. 2013;32:894-903. [PubMed] [DOI] |
| 19. | Sui X, Chen R, Wang Z, Huang Z, Kong N, Zhang M, Han W, Lou F, Yang J, Zhang Q. Autophagy and chemotherapy resistance: a promising therapeutic target for cancer treatment. Cell Death Dis. 2013;4:e838. [PubMed] [DOI] |
| 20. | Műzes G, Sipos F. Anti-tumor immunity, autophagy and chemotherapy. World J Gastroenterol. 2012;18:6537-6540. [PubMed] [DOI] |
| 21. | Yuan H, Li AJ, Ma SL, Cui LJ, Wu B, Yin L, Wu MC. Inhibition of autophagy significantly enhances combination therapy with sorafenib and HDAC inhibitors for human hepatoma cells. World J Gastroenterol. 2014;20:4953-4962. [PubMed] [DOI] |
| 22. | Pallauf K, Rimbach G. Autophagy, polyphenols and healthy ageing. Ageing Res Rev. 2013;12:237-252. [PubMed] [DOI] |
| 23. | Bareford MD, Park MA, Yacoub A, Hamed HA, Tang Y, Cruickshanks N, Eulitt P, Hubbard N, Tye G, Burow ME. Sorafenib enhances pemetrexed cytotoxicity through an autophagy-dependent mechanism in cancer cells. Cancer Res. 2011;71:4955-4967. [PubMed] [DOI] |
| 24. | Chen L, Ye HL, Zhang G, Yao WM, Chen XZ, Zhang FC, Liang G. Autophagy inhibition contributes to the synergistic interaction between EGCG and doxorubicin to kill the hepatoma Hep3B cells. PLoS One. 2014;9:e85771. [PubMed] [DOI] |
| 25. | Li CP, Yao J, Tao ZF, Li XM, Jiang Q, Yan B. Epigallocatechin-gallate (EGCG) regulates autophagy in human retinal pigment epithelial cells: a potential role for reducing UVB light-induced retinal damage. Biochem Biophys Res Commun. 2013;438:739-745. [PubMed] [DOI] |
| 26. | Liu J, Tang Y, Feng Z, Liu J, Liu J, Long J. (-)-Epigallocatechin-3-gallate attenuated myocardial mitochondrial dysfunction and autophagy in diabetic Goto-Kakizaki rats. Free Radic Res. 2014;48:898-906. [PubMed] [DOI] |
| 27. | Yan J, Feng Z, Liu J, Shen W, Wang Y, Wertz K, Weber P, Long J, Liu J. Enhanced autophagy plays a cardinal role in mitochondrial dysfunction in type 2 diabetic Goto-Kakizaki (GK) rats: ameliorating effects of (-)-epigallocatechin-3-gallate. J Nutr Biochem. 2012;23:716-724. [PubMed] [DOI] |
| 28. | Satoh M, Takemura Y, Hamada H, Sekido Y, Kubota S. EGCG induces human mesothelioma cell death by inducing reactive oxygen species and autophagy. Cancer Cell Int. 2013;13:19. [PubMed] [DOI] |
| 29. | Zhou J, Farah BL, Sinha RA, Wu Y, Singh BK, Bay BH, Yang CS, Yen PM. Epigallocatechin-3-gallate (EGCG), a green tea polyphenol, stimulates hepatic autophagy and lipid clearance. PLoS One. 2014;9:e87161. [PubMed] [DOI] |
| 30. | Neufeld TP. Autophagy and cell growth--the yin and yang of nutrient responses. J Cell Sci. 2012;125:2359-2368. [PubMed] [DOI] |
| 31. | Gauthier A, Ho M. Role of sorafenib in the treatment of advanced hepatocellular carcinoma: An update. Hepatol Res. 2013;43:147-154. [PubMed] [DOI] |