修回日期: 2015-05-05
接受日期: 2015-05-08
在线出版日期: 2015-06-28
目的: 检测Hedgehog信号通路基因Sonic Hedgehog(Shh)、Patched1(Ptch1)、Smoothened(Smo)及神经胶质瘤相关癌基因同源蛋白1(glioma-associated oncogene homolog 1, Gli1)在胰腺癌组织中的表达及其生物学意义.
方法: 采用反转录-聚合酶链反应(RT-PCR)分别检测48例胰腺癌组织和配对的癌旁组织中Shh、Ptch1、Smo及Gli1 mRNA的表达情况.
结果: RT-PCR检测结果显示: Shh、Ptch1、Smo及Gli1 mRNA在胰腺癌组织中的相对表达量分别是0.652±0.036、0.604±0.063、0.493±0.011、0.512±0.052, 在胰腺癌旁组织中为0.312±0.013、0.319±0.053、0.214±0.046、0.247±0.059(P<0.05). 与正常胰腺组织相比, 胰腺癌组织中Shh、Ptch1、Smo及Gli1 mRNA表达量显著升高(P<0.05), 胰腺癌组织中Shh、Ptch1、Smo及Gli1 mRNA表达与胰腺癌的分化程度有显著性差异(P<0.05), 与患者年龄、性别、肿瘤直径、TNM分期、淋巴结转移、糖链抗原(CA19-9)无显著性差异(P>0.05).
结论: Hedgehog信号通路基因Shh、Ptch1、Smo及Gli1在胰腺癌组织中表达增高, Hedgehog信号通路的异常激活可能与胰腺癌发生发展过程相关.
核心提示: 本研究通过检测正常胰腺癌组织和癌旁组织中Hedgehog(Hh)信号通路基因Sonic Hedgehog(Shh)、Patched1(Ptch1)、Smoothened(Smo)及神经胶质瘤相关癌基因同源蛋白1(glioma-associated oncogene homolog 1, Gli1)的mRNA的表达量, 初步探讨Shh、Ptch1、Smo及Gli1在胰腺癌中的异常表达与肿瘤发生的关系.
引文著录: 依马木买买提江•阿布拉, 李东伟, 易超, 李海军. Hedgehog信号通路基因Shh、Ptch1、Smo及Gli1在胰腺癌中的表达及意义. 世界华人消化杂志 2015; 23(18): 2894-2900
Revised: May 5, 2015
Accepted: May 8, 2015
Published online: June 28, 2015
AIM: To detect the expression of Hedgehog pathway components Sonic Hedgehog (Shh), Patched1 (Ptch1), Smoothened (Smo) and glioma-associated oncogene homolog 1 (Gli1) genes in pancreatic cancer, and to discuss their biological significance.
METHODS: Expression of Shh, Ptch1, Smo and Gli1 mRNAs was evaluated by RT-PCR in 48 cases of pancreatic cancer and matched tumor adjacent tissue.
RESULTS: The relative expression levels of Shh, Ptch1, Smo and Gli1 mRNAs in pancreatic cancer were 0.652 ± 0.036, 0.604 ± 0.063, 0.493 ± 0.011 and 0.512 ± 0.052, respectively, significantly higher than those in tumor adjacent tissue (0.312 ± 0.013, 0.319 ± 0.053, 0.214 ± 0.046 and 0.247 ± 0.059) (P < 0.05). Overexpression of these genes was associated with tumor differentiation (P < 0.05), but not with age, gender, tumorous size, TNM stage, lymph node metastasis, or CA19-9 (P > 0.05).
CONCLUSION: The expression of Shh, Ptch1, Smo and Gli1 is increased in human pancreatic cancer. The genesis and development of pancreatic cancer may be associated with the abnormal activation of Hedgehog signaling pathway.
- Citation: Yimamumaimaitijiang•Abula, Li DW, Yi C, Li HJ. Functional significance of expression of Hedgehog pathway components Shh, Ptch1, Smo and Gli1 in human pancreatic cancer. Shijie Huaren Xiaohua Zazhi 2015; 23(18): 2894-2900
- URL: https://www.wjgnet.com/1009-3079/full/v23/i18/2894.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i18.2894
胰腺癌是一种较常见、恶性程度极高的消化系肿瘤. 因此, 深入探讨胰腺癌发生发展的机制, 寻求新的治疗方法, 具有重要意义. Hedgehog(Hh)信号通路在细胞生长分化、脊椎动物胚胎发育中起重要作用[1-4]. Hh信号通路各组成部分的突变或异常激活会导致发育缺陷或肿瘤, 包括小细胞肺癌[5]、食管癌[6,7]、胃癌[8]、大肠癌[9]、胰腺癌[10,11]和前列腺癌[12]等. Hh信号通路主要由Hh配体蛋白、两个跨膜蛋白受体Patched(Ptch)和Smoothened(Smo)以及下游转录因子神经胶质瘤相关癌基因同源蛋白(glioma-associated oncogene homolog, Gli)组成. 在哺乳动物中存在3种Hh成员, 即Sonic Hedgehog(Shh)、Indian Hedgehog(Ihh)及Desert Hedgehog(Dhh)[13]. 当不存在Hh蛋白时, Ptch1抑制Smo的活性, 进而抑制下游基因的转录表达. 当Hh蛋白与Ptch1结合时, Ptch1对Smo的抑制作用被解除, Smo被激活, 进入胞质, 将信号下传, 激活转录因子(Gli1、Gli2、Gli3), 后者进入细胞核, 直接启动Ptch、Gli1、Wnt、EGF等目的基因的表达[14]. 基于Hh信号通路基因Shh、Ptch1、Smo及Gli1在Hh信号通路中的重要作用[15,16], 本研究初步探讨Shh、Ptch1、Smo及Gli1在胰腺癌中的异常表达与肿瘤发生的关系, 并探索Hh信号通路在胰腺癌发生中的作用机制, 以期寻找胰腺癌早期诊断和治疗的生物标志物.
在患者知情同意的原则下, 48例胰腺癌组织取自新疆医科大学附属肿瘤医院2011-01/2014-01住院患者, 所有组织均经病理确诊为胰腺导管腺癌, 手术后即刻切取胰腺癌组织和配对的癌旁组织(癌旁3 cm组织), 置液氮贮存. 48例患者术前均无急性或慢性胰腺炎等疾病, 术前未接受化疗或放疗, 年龄46-73岁, 平均59.5岁, 其中男35例, 女13例. 病理检查: 高中分化18例, 低分化30例; 肿瘤直径≤2 cm 19例,>2 cm 29例; 按国际抗癌联盟2002年肿瘤-淋巴结-转移(tumor-node-metastasis, TNM)分期标准进行分期, Ⅰ期10例, Ⅱ期16例, Ⅲ期22例; 无淋巴转移27例, 有淋巴转移21例; 有糖链抗原(CA19-9)增高的25例, 无糖链抗原(CA19-9)增高23例.
RNA提取试剂TRIzol(美国Invitrogen公司), 水平琼脂糖凝胶电泳仪、槽(北京六一仪器厂), 96孔梯度PCR仪(ABI公司), 两步法逆转录聚合酶链式反应(RT-PCR)试剂盒[宝生物工程(大连)有限公司]、Bio-vision凝胶成像系统(美国Bio-vison公司).
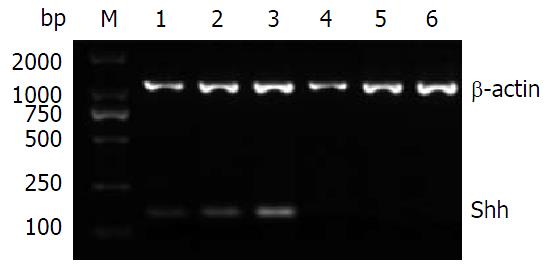
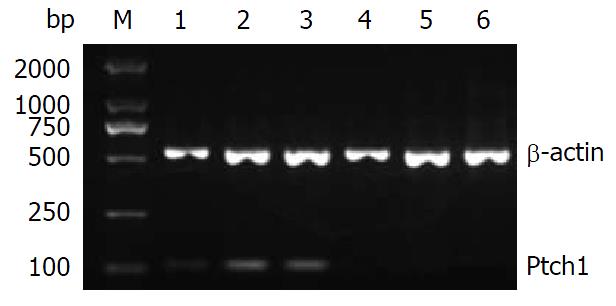
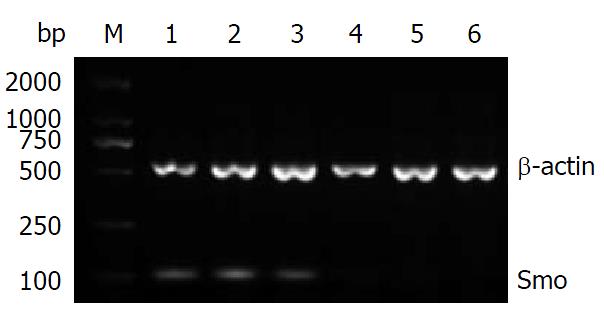
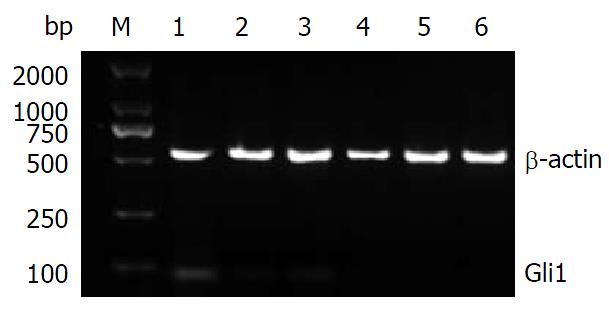
反转录-聚合酶链反应(RT-PCR)检测Shh、Ptch1、Smo及Gli1 mRNA表达: 将-80 ℃冰箱保存的胰腺组织标本取出, 按30-40 mg胰腺组织样品中加入1 mL的TRIzol试剂装于匀浆管中, 将匀浆管置于冰盒上用匀浆器匀浆组织, 匀浆两次, 6 s/次. RNA的提取按TRIzol说明书进行. 用紫外分光光度计检测总RNA样品在260 nm和280 nm处的吸光度(A)值, 样品A260/280值在1.8-2.0为纯度良好, 同时检测出总RNA样品RNA浓度的值. 取2.5 μg总RNA按M-MLV说明书进行逆转录, 合成的cDNA置于-20 ℃保存备用. 扩增引物根据GeneBank序列设计并合成引物, 委托上海生工生物工程公司定量检测. Shh引物序列, 上游: 5'-GTCTCCTCGCTGCTGGTATG-3', 下游: 5'-TTGGGGATAAACTGCTTGTAGG-3', 扩增片段150 bp; Ptch1引物序列, 上游: 5'-CTCCTTTGCGGTGGACAA-3', 下游: 5'-CCTCAGCCTTATTCAGCATTTC-3', 扩增片段109 bp; Smo引物序列, 上游: 5'-CTCCTACTTCCACCTGCTCAC-3', 下游: 5'-CAAAACAAATCCCACTCACAGA-3', 扩增片段104 bp; Gli1引物序列, 上游: 5'-ATCCTTACCTCCCAACCTCTGT-3', 下游: 5'-AACTTCTGGCTCTTCCTGTAGC-3', 扩增片段84 bp; β-肌动蛋白(β-actin)引物序列, 上游: 5'-GGGACCTGACTGACTACCTC-3', 下游: 5'-CGTCATACTCCTGCTTGCTG-3', 扩增片段543 bp. Shh、Ptch1、Smo、Gli1和β-actin cDNA扩增反应条件: 94 ℃ 2 min, 94 ℃ 30 s, 退火40 s, 72 ℃ 30 s, 循环30次, 再72 ℃ 2 min. 退火温度分别是56 ℃、54 ℃、57 ℃、55 ℃、56 ℃. 反应结束后2%琼脂糖凝胶电泳鉴定其大小是否为目的基因片段, 用BIO-RAD Gel Doc XR凝胶成像系统拍照, 并用软件Image Lab 4.0软件对条带进行灰度、面积扫描, 测量灰度值, mRNA表达的相对值 = 目的基因灰度值/β-actin灰度值(T/N). 以条带灰度值代表mRNA的表达量, 分别比较两组的差异.
统计学处理 应用SPSSl7.0统计软件分析. 计量资料用mean±SD表示, 配对的癌组织和癌旁组织mRNA表达的比较采用配对样本t检验, 所有检验均为双侧检验, P<0.05为差异具有统计学意义.
胰腺癌组织和癌旁组织中Shh mRNA的相对表达量分别为0.652±0.036、0.312±0.013, 胰腺癌组织和癌旁组织中Ptch1 mRNA的相对表达量分别为0.604±0.063、0.319±0.053, 胰腺癌组织和癌旁组织中Smo mRNA的相对表达量分别为0.493±0.011、0.214±0.046, 胰腺癌组织和癌旁组织中Gli1 mRNA的相对表达量分别为0.512±0.052、0.247±0.059. 胰腺癌组织中Shh、Ptch1、Smo及Gli1 mRNA的表达量分别是胰腺癌旁组织的(2.090倍±0.132倍)、(1.893倍±0.327倍)、(2.304倍±0.213倍)、(2.073倍±0.438倍)(P = 0.020、0.032、0.014、0.025). 胰腺癌组织中Shh、Ptch1、Smo及Gli1 mRNA表达明显高于癌旁组织(P<0.05)(表1, 图1, 图2, 图3和图4).
| 分组 | Shh/β-actinmRNA的表达 | Ptch1/β-actinmRNA的表达 | Smo/β-actinmRNA的表达 | Gli1/β-actinmRNA的表达 |
| 胰腺癌组织 | 0.652±0.036 | 0.604±0.063 | 0.493±0.011 | 0.512±0.052 |
| 胰腺癌旁组织 | 0.312±0.013 | 0.319±0.053 | 0.214±0.046 | 0.247±0.059 |
低分化胰腺癌Shh、Ptch1、Smo及Gli1 mRNA平均表达水平(0.846±0.052、0.833±0.042、0.725±0.063、0.712±0.058)高于中高分化胰腺癌(0.457±0.021、0.372±0.035、0.262±0.046、0.310±0.037), 差异具有统计学意义(P<0.05)(表 2, 3). Shh、Ptch1、Smo及Gli1 mRNA表达水平与患者年龄、性别、肿瘤直径、TNM分期、淋巴结转移、糖链抗原(CA19-9)无显著性差异(P>0.05)(表2, 表3).
| 临床特征 | n | Shh mRNA | Ptch1 mRNA | ||
| 相对表达量 | P值 | 相对表达量 | P值 | ||
| 年龄(岁) | 0.854 | 0.521 | |||
| ≤60 | 27 | 0.671±0.027 | 0.651±0.057 | ||
| >60 | 21 | 0.636±0.048 | 0.558±0.048 | ||
| 性别 | 0.652 | 0.742 | |||
| 男 | 35 | 0.685±0.042 | 0.638±0.049 | ||
| 女 | 13 | 0.628±0.061 | 0.572±0.036 | ||
| 分化程度 | 0.036 | 0.018 | |||
| 中高分化 | 18 | 0.457±0.021 | 0.372±0.035 | ||
| 低分化 | 30 | 0.846±0.052 | 0.833±0.042 | ||
| 肿瘤直径(cm) | 0.739 | 0.843 | |||
| ≤2 | 19 | 0.645±0.029 | 0.617±0.038 | ||
| >2 | 29 | 0.661±0.057 | 0.593±0.026 | ||
| TNM分期 | 0.572 | 0.642 | |||
| Ⅰ-Ⅱ | 26 | 0.692±0.046 | 0.585±0.018 | ||
| Ⅲ | 22 | 0.613±0.039 | 0.629±0.037 | ||
| 淋巴结转移 | 0.631 | 0.857 | |||
| 无 | 27 | 0.626±0.011 | 0.595±0.024 | ||
| 有 | 21 | 0.684±0.056 | 0.618±0.046 | ||
| CA19-9 | 0.773 | 0.763 | |||
| 无 | 25 | 0.646±0.026 | 0.576±0.039 | ||
| 有 | 23 | 0.668±0.033 | 0.635±0.042 | ||
| 临床特征 | n | Smo mRNA | Gli1 mRNA | ||
| 相对表达量 | P值 | 相对表达量 | P值 | ||
| 年龄(岁) | 0.658 | 0.658 | |||
| ≤60 | 27 | 0.452±0.025 | 0.536±0.053 | ||
| >60 | 21 | 0.531±0.037 | 0.493±0.029 | ||
| 性别 | 0.742 | 0.731 | |||
| 男 | 35 | 0.516±0.043 | 0.503±0.052 | ||
| 女 | 13 | 0.478±0.052 | 0.526±0.052 | ||
| 分化程度 | 0.010 | 0.015 | |||
| 中高分化 | 18 | 0.262±0.046 | 0.310±0.037 | ||
| 低分化 | 30 | 0.725±0.063 | 0.712±0.058 | ||
| 肿瘤直径(cm) | 0.844 | 0.535 | |||
| ≤2 | 19 | 0.465±0.011 | 0.482±0.018 | ||
| >2 | 29 | 0.529±0.011 | 0.548±0.037 | ||
| TNM分期 | 0.562 | 0.643 | |||
| Ⅰ-Ⅱ | 26 | 0.447±0.048 | 0.531±0.032 | ||
| Ⅲ | 22 | 0.548±0.039 | 0.498±0.047 | ||
| 淋巴结转移 | 0.831 | 0.748 | |||
| 无 | 27 | 0.521±0.011 | 0.523±0.052 | ||
| 有 | 21 | 0.468±0.011 | 0.506±0.052 | ||
| CA19-9 | 0.728 | 0.468 | |||
| 无 | 25 | 0.472±0.011 | 0.475±0.052 | ||
| 有 | 23 | 0.519±0.011 | 0.553±0.052 | ||
胰腺癌因其病程隐匿、易发生早期转移、对放化疗不敏感、进展迅速、手术切除率低及预后差等特有的生物学特性, 已被西方国家列为恶性肿瘤导致死亡的第四大原因[17-19]. 在我国, 胰腺癌近20年来发病率增长约6倍, 死亡率位居恶性肿瘤第5位[20]. 近几十年来, 围绕胰腺癌的治疗手段问题虽已做了多年的努力, 临床手术和综合治疗技术也有了长足的进步, 但在过去的20年里, 胰腺癌的总手术切除率和5年存活率却并无显著提高[21]. 因此, 深入探讨胰腺癌发生发展的机制, 寻求新的治疗方法, 具有重要的意义.
Hh信号通路在人胰腺癌的发生发展和恶性生物学特性的维持起着至关重要的作用[22-25]. Hh信号主要由Hh配体蛋白、Ptch和Smo两个跨膜蛋白受体、costal-2(cos2)(一种具有动力素样功能的蛋白)、融合蛋白Fused、融合阻抑蛋白Su(Fu)(suppressor of fused), 以及下游转录因子Ci基因同源体相关产物-Gli组成[26-28]. 感受器蛋白Ptch是膜受体, 包括Ptch1和Ptch2两种亚型[29,30].
本研究RT-PCR检测结果显示: 胰腺癌组织中Shh、Ptch1、Smo及Gli1 mRNA表达高于癌旁组织(P<0.05). 说明胰腺癌组织中存在Hh信号通路成员Shh、Ptch1、Smo及Gli1的表达, 也即存在Hh信号通路的活化, 而癌旁正常胰腺组织不表达或弱表达Hh信号通路成员Shh、Ptch1、Smo及Gli1, 也说明了在癌旁正常胰腺组织Hh信号通路是关闭的. 胰腺癌组织中Shh、Ptch1、Smo及Gli1 mRNA表达与胰腺癌的分化程度有显著性差异(P<0.05), 与患者年龄、性别、肿瘤直径、TNM分期、淋巴结转移、糖链抗原(CA19-9)无显著性差异(P>0.05). 说明在有Hh信号通路活化参与发生的癌较无Hh信号通路参与发生的胰腺癌其恶性程度高、分化增殖快. 总之, Hh信号通路基因Shh、Ptch1、Smo及Gli1在胰腺癌组织中表达上调, 且该基因表达量与胰腺癌的分化程度有关, 表明Hh信号通路参与了胰腺癌的发生发展. 进一步研究Shh、Ptch1、Smo及Gli1在胰腺癌中如何表达调控, 将有助于阐明胰腺癌发生发展的分子机制.
胰腺癌是一种较常见、恶性程度极高的消化系肿瘤, Hedgehog(Hh)信号通路在人胰腺癌的发生发展和恶性生物学特性的维持起着至关重要的作用, 本研究初步探讨Sonic Hedgehog(Shh)、Patched(Ptch)1、Smoothened(Smo)及神经胶质瘤相关癌基因同源蛋白(glioma-associated oncogene homolog, Gli)在胰腺癌中的异常表达与肿瘤发生的关系, 并探索Hh信号通路在胰腺癌发生中的作用机制, 以期寻找胰腺癌早期诊断和治疗的生物标志物.
陈光, 教授, 吉林大学第一医院消化器官外科
Hh信号通路主要由Hh配体蛋白、两个跨膜蛋白受体Ptc、Smo以及Gli组成. 当不存在Hh蛋白时, Ptch1抑制Smo的活性, 进而抑制下游基因的转录表达. 当Hh蛋白与Ptch1结合时, Ptch1对Smo的抑制作用被解除, Smo被激活, 进入胞质, 将信号下传, 激活转录因子(Gli1、Gli2、Gli3), 后者进入细胞核, 直接启动Ptch、Gli1、Wnt、EGF等目的基因的表达.
Berman等报道, 在来源于食管、胃、胆道、胰腺和结肠肿瘤的38个细胞系中有37个检测到Shh的mRNA表达, 而且Shh分子可以维持肿瘤细胞的生长和增殖.
Hh信号通路基因Shh、Ptch1、Smo及Gli1 mRNA在胰腺癌组织中表达上调, 且基因表达量与胰腺癌的分化程度有关, 表明Hh信号通路参与了胰腺癌的发生发展. 进一步研究Shh、Ptch1、Smo及Gli1在胰腺癌中如何表达调控, 将有助于阐明胰腺癌发生发展的分子机制.
Hh信号通路: 主要由Hh配体蛋白、Ptch和Smo两个跨膜蛋白受体、costal-2(cos2)(一种具有动力素样功能的蛋白)、融合蛋白Fused、融合阻抑蛋白Su(Fu)(suppressor of fused), 以及下游转录因子Ci基因同源体相关产物-Gli组成.
本文课题设计合理, 方法科学, 数据分析可靠, 结论可信, 为进一步研究Hh信号通路在胰腺癌发生、发展中的作用及胰腺癌的生物学治疗提供了理论依据.
编辑: 韦元涛 电编:闫晋利
| 1. | Xie K, Abbruzzese JL. Developmental biology informs cancer: the emerging role of the hedgehog signaling pathway in upper gastrointestinal cancers. Cancer Cell. 2003;4:245-247. [PubMed] [DOI] |
| 2. | Echelard Y, Epstein DJ, St-Jacques B, Shen L, Mohler J, McMahon JA, McMahon AP. Sonic hedgehog, a member of a family of putative signaling molecules, is implicated in the regulation of CNS polarity. Cell. 1993;75:1417-1430. [PubMed] [DOI] |
| 3. | Marigo V, Roberts DJ, Lee SM, Tsukurov O, Levi T, Gastier JM, Epstein DJ, Gilbert DJ, Copeland NG, Seidman CE. Cloning, expression, and chromosomal location of SHH and IHH: two human homologues of the Drosophila segment polarity gene hedgehog. Genomics. 1995;28:44-51. [PubMed] [DOI] |
| 4. | Pepinsky RB, Zeng C, Wen D, Rayhorn P, Baker DP, Williams KP, Bixler SA, Ambrose CM, Garber EA, Miatkowski K. Identification of a palmitic acid-modified form of human Sonic hedgehog. J Biol Chem. 1998;273:14037-14045. [PubMed] |
| 5. | Watkins DN, Berman DM, Burkholder SG, Wang B, Beachy PA, Baylin SB. Hedgehog signalling within airway epithelial progenitors and in small-cell lung cancer. Nature. 2003;422:313-317. [PubMed] [DOI] |
| 6. | 孙 波, 张 蕾, 李 颖霞, 符 仲标, 卲 惠杰, 温 洪涛. Smo和Gli1蛋白在食管鳞状细胞癌组织中的表达及临床意义. 世界华人消化杂志. 2011;19:483-487. [DOI] |
| 9. | Oniscu A, James RM, Morris RG, Bader S, Malcomson RD, Harrison DJ. Expression of Sonic hedgehog pathway genes is altered in colonic neoplasia. J Pathol. 2004;203:909-917. [PubMed] [DOI] |
| 10. | Berman DM, Karhadkar SS, Maitra A, Montes De Oca R, Gerstenblith MR, Briggs K, Parker AR, Shimada Y, Eshleman JR, Watkins DN. Widespread requirement for Hedgehog ligand stimulation in growth of digestive tract tumours. Nature. 2003;425:846-851. [PubMed] [DOI] |
| 11. | Thayer SP, di Magliano MP, Heiser PW, Nielsen CM, Roberts DJ, Lauwers GY, Qi YP, Gysin S, Fernández-del Castillo C, Yajnik V. Hedgehog is an early and late mediator of pancreatic cancer tumorigenesis. Nature. 2003;425:851-856. [PubMed] [DOI] |
| 12. | Chen G, Goto Y, Sakamoto R, Tanaka K, Matsubara E, Nakamura M, Zheng H, Lu J, Takayanagi R, Nomura M. GLI1, a crucial mediator of sonic hedgehog signaling in prostate cancer, functions as a negative modulator for androgen receptor. Biochem Biophys Res Commun. 2011;404:809-815. [PubMed] [DOI] |
| 13. | McMahon AP. More surprises in the Hedgehog signaling pathway. Cell. 2000;100:185-188. [PubMed] [DOI] |
| 14. | Cohen MM. Hedgehog signaling update. Am J Med Genet A. 2010;152A:1875-1914. [PubMed] [DOI] |
| 15. | 陈 志荣, 李 兆申, 屠 振兴, 高 军, 龚 燕芳, 金 晶, 满 晓华. 胰腺癌组织中PTCH mRNA的表达及其临床意义. 世界华人消化杂志. 2005;13:1147-1150. [DOI] |
| 17. | Untch BR, Allen PJ. Pancreatic metastasectomy: the Memorial Sloan-Kettering experience and a review of the literature. J Surg Oncol. 2014;109:28-30. [PubMed] [DOI] |
| 18. | 孙 诚谊, 张 宏. 胰腺癌的外科治疗-现状与思考. 中华普通外科学文献(电子版). 2014;8:92-94. |
| 20. | Luo J, Xiao L, Wu C, Zheng Y, Zhao N. The incidence and survival rate of population-based pancreatic cancer patients: Shanghai Cancer Registry 2004-2009. PLoS One. 2013;8:e76052. [PubMed] [DOI] |
| 21. | Jemal A, Murray T, Ward E, Samuels A, Tiwari RC, Ghafoor A, Feuer EJ, Thun MJ. Cancer statistics, 2005. CA Cancer J Clin. 2005;55:10-30. [PubMed] [DOI] |
| 22. | Onishi H, Morifuji Y, Kai M, Suyama K, Iwasaki H, Katano M. Hedgehog inhibitor decreases chemosensitivity to 5-fluorouracil and gemcitabine under hypoxic conditions in pancreatic cancer. Cancer Sci. 2012;103:1272-1279. [PubMed] [DOI] |
| 23. | Hao K, Tian XD, Qin CF, Xie XH, Yang YM. Hedgehog signaling pathway regulates human pancreatic cancer cell proliferation and metastasis. Oncol Rep. 2013;29:1124-1132. [PubMed] [DOI] |
| 26. | Choi KS, Harfe BD. Hedgehog signaling is required for formation of the notochord sheath and patterning of nuclei pulposi within the intervertebral discs. Proc Natl Acad Sci USA. 2011;108:9484-9489. [PubMed] [DOI] |
| 27. | Ghanbari A, Khazaei M, Hashemi-Tabar M, Rabzia A, Fathi F, Bayat PD. Sonic hedgehog inhibition induces mouse embryonic stem cells to differentiate toward definitive endoderm. Indian J Exp Biol. 2013;51:201-207. [PubMed] |
| 29. | Nakamura M, Tanaka H, Nagayoshi Y, Nakashima H, Tsutsumi K, Ohtsuka T, Takahata S, Tanaka M, Okada H. Targeting the hedgehog signaling pathway with interacting peptides to Patched-1. J Gastroenterol. 2012;47:452-460. [PubMed] [DOI] |
| 30. | Lee Y, Miller HL, Russell HR, Boyd K, Curran T, McKinnon PJ. Patched2 modulates tumorigenesis in patched1 heterozygous mice. Cancer Res. 2006;66:6964-6971. [PubMed] [DOI] |