修回日期: 2014-12-04
接受日期: 2015-01-09
在线出版日期: 2015-06-28
目的: 克隆幽门螺杆菌(Helicobacter pylori, H. pylori) γ-谷氨酰转肽酶(γ-glutamyl transpeptidase, GGT)基因, 实现GGT基因在人胃癌上皮细胞SGC-7901中的表达和定位.
方法: 本实验从胃癌患者胃黏膜组织中分离培养获得H. pylori, 提取其基因组DNA, 对GGT基因进行PCR扩增, 将利用绿色荧光蛋白(green fluorescent protein, GFP)融合GGT基因全长序列和成熟肽序列, 克隆进pcDNA3质粒中, 观察GGT基因表达后在人胃癌上皮细胞SGC-7901中的定位, 观察SGC-7901细胞形态、生长以及运动性的变化. 推测其可能诱导细胞凋亡的途径.
结果: pcDNA3-GGT-EGFP质粒转染SGC-7901细胞后, 在SGC-7901细胞中表达外源基因, 在显微镜下可见转染的细胞产生明显的病变, 细胞由梭形变成圆形、变大、胞核扩大. 转染60 h后, 在共聚焦显微镜下观察, 发现荧光信号主要集中在细胞质中.
结论: 成功克隆了GGT基因, 经酶切和测序验证正确, 成功构建了pcDNA3-GGT-EGFP质粒.
核心提示: γ-谷氨酰转肽酶(γ-glutamyl transpeptidase, GGT)是一种催化肽基转移作用的酶, 这种酶广泛存在于动植物体内, 在谷光苷肽的新陈代谢中起到了重要的作用. 幽门螺杆菌(Helicobacter pylori, H. pylori)GGT也具有相似的特点. 但是H. pylori GGT的成熟过程不十分清楚. 我们利用GFP融合GGT基因全长序列和成熟肽序列, 克隆进pcDNA3质粒中, 在显微镜下可见转染的细胞产生明显的病变, 细胞由梭形变成圆形、变大、胞核扩大, GGT基因表达后主要集中在人胃癌上皮细胞的细胞质中. 结合相关报道, GGT基因表达的蛋白可能主要定位在线粒体上发挥作用, 参与程序性细胞死亡, 与胃癌的发生具有相关性, 为进一步研究GGT基因与胃癌发生的具体信号通路提供好的基础.
引文著录: 唐炜, 尹江涛, 张尤历. 幽门螺杆菌GGT基因在胃癌上皮细胞中的表达和定位. 世界华人消化杂志 2015; 23(18): 2880-2885
Revised: December 4, 2014
Accepted: January 9, 2015
Published online: June 28, 2015
AIM: To investigate the expression and subcellular localization of Helicobacter pylori (H. pylori) γ-glutamyl transpeptidase (GGT) gene in SGC-7901 cells.
METHODS: H. pylori strains were isolated from the gastric mucosa of patients with gastric cancer, and cultured on solid agar medium. The GGT gene was amplified from the chromosomal DNA of H. pylori by PCR, and was cloned into T vector. The recombinant plasmids were confirmed by enzyme digestion and sequence analysis. H. pylori GGT was then expressed and localized in SGC-7901 cells.
RESULTS: The GGT gene was obtained and its sequence was proved to be correct by sequencing identification. SDS-PAGE and Western blot analysis showed that the GGT product could be expressed in SGC-7901 cells.
CONCLUSION: The GGT gene has been successfully expressed in SGC-7901 cells and localized in the cytoplasm. This lays a foundation for studying the relationship between GGT and mitochondria-mediated apoptosis.
- Citation: Tang W, Yin JT, Zhang YL. Expression and subcellular localization of Helicobacter pylori GGT gene in SGC-7901 cells. Shijie Huaren Xiaohua Zazhi 2015; 23(18): 2880-2885
- URL: https://www.wjgnet.com/1009-3079/full/v23/i18/2880.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i18.2880
澳大利亚学者罗宾•沃伦(Robin JW)和巴里•马歇尔(Marshall B)在1983年从人胃黏膜分离获得幽门螺杆菌(Helicobacter pylori, H. pylori)[1], 越来越多的研究指出H. pylori感染是导致胃溃疡(gastric ulcer, GU)、十二指肠溃疡(duodenal ulcer, DU)以及慢性胃炎的一个主要原因[2], 并且与胃癌(gastric cancer, GC)等胃相关性疾病的发生有着密切的关系[3], 国际癌症机构已将H. pylori列为Ⅰ级致癌因子[4]. H. pylori致病力的强弱与菌株的毒力相关, 主要与毒力因子的基因型有关[5]. H. pylori γ-谷氨酰转肽酶(γ-glutamyl transpeptidase, GGT)是一种催化肽基转移作用的酶, 在分泌和成熟后, 通过与细胞膜结合进入细胞内[6], 抑制CD4+T细胞的增殖, 从而抑制了CD4+T细胞对H. pylori的清除作用, 对H. pylori的定植有一定的作用, 参与H. pylori诱导的线粒体介导的程序性细胞死亡, 是一个抗肿瘤因子[7], 但程序性细胞死亡的持续发生, 破坏了新细胞生成和细胞消亡之间的平衡产生病理作用, 凋亡调节基因的转变和突变频繁的发生, 反而增加了胃癌发生的危险性[8]. 为研究GGT蛋白在胃癌细胞中的表达, 进一步研究该蛋白的功能以及与线粒体之间的作用机制, 我们克隆H. pyloriGGT基因, 实现GGT基因在人胃癌上皮细胞SGC-7901中的表达和定位.
H. pylori从江苏大学附属医院内镜室活检标本(距幽门5 cm内)分离培养获得, 尿素酶试验阳性, 行常规病理检查明确为GC. H. pylori基础培养基、微需氧环境发生袋、选择性抗生素及厌氧培养罐购自德国Merck公司; 改良布氏肉汤培养基由上海腹泻疾病控制中心提供; 无菌羊全血购自金坛欣迪公司; pcDNA3-GFP(HindⅢ+KpnⅠ)和pBacPAK-EGFP(KpnⅠ+EcoRⅠ)质粒由本实验室构建; DMEM为Gibco公司产品; 胎牛血清FBS购自Hyclone公司; Lipofectin购自GIBCO公司, 其他生化试剂为国家AP级试剂; 试验中所用的限制性内切酶和配套的缓冲液、T4 DNA ligase、Taq酶、dNTPs、DL2000标准分子量核酸、λ-HindⅢ标准分子量核酸、质粒抽提试剂盒为TaKaRa公司产品; TRIzol购自Invitrogen公司; X-gal、IPTG为GIBCO公司产品; 酵母提取物、蛋白胨为OXOID公司产品. 其他常规试剂为市售分析纯.
1.2.1 H. pylori培养: 将活检新鲜组织用接种环均匀涂于固体琼脂培养基, 在微需氧环境, 37 ℃培养, 约96 h后收集细菌.
1.2.2 H. pylori基因组DNA提取: 刮取菌落, 提取其基因组DNA, 保存于-20 ℃备用.
1.2.3 引物设计与合成: 根据GenBank中H. pylori 26695标准株(GenBank登录号: NC_000915)预测成熟肽序列, 设计PCR引物: Forward: P1: 5'-GGC AAGCTTATGGCGAGTTACCC-3'; Reverse: P2: 5'-GCAGGTACCAAATTCTTTCCTTGGAT-3'. 在上游引物5'端加HindⅢ酶切位点; 在下游引物5'端加KpnⅠ酶切位点. 引物由上海生工基因有限公司合成.
1.2.4 PCR扩增: 以来源胃癌的H. pylori菌株DNA为模板, 分别扩增出GGT基因全长序列和成熟肽序列, 用LA-Taq聚合酶进行PCR扩增.
1.2.5 构建pcDNA3-GGT-EGFP重组质粒: 将GGT基因全长序列和成熟肽序列克隆到pMD-simple-T载体上, 以构建pMD-simple-T-GGT. 将pBacPAK-EGFP用KpnⅠ和EcoRⅠ酶切后, 回收EGFP片段, 与同样酶切的pcDNA3进行连接, 以构建pcDNA3-EGFP; 用HindⅢ、KpnⅠ酶切pMD-simple-T-GGT, 回收GGT片段, 与同样酶切的pcDNA3-EGFP进行连接, 以构建pcDNA3-GGT-EGFP.
1.2.6 细胞培养: 人胃癌上皮细胞SGC-7901用含10%FBS的DMEM培养, 并放置在50 mL/L CO2、饱和湿度、37 ℃二氧化碳培养箱培养. 培养液每隔2-3 d更换1次, 细胞传代时用0.25%胰酶消化. 每次转染的前2 d将细胞消化接种到培养皿或培养板中, 细胞接种的数量应保证第2天转染时能达到50%的密度.
1.2.7 重组质粒: pcDNA3-GGT-GFP转染细胞准备质粒DNA/脂质体复合物, 溶液A: 取重组质粒pcDNA3-GGT-GFP(5-10 μg), 加入无血清细胞培养基补充体积至100 μL; 溶液B: 取脂质体10 μL, 加入90 μL无血清DMEM细胞培养基补充体积至100 μL. 将溶液A和溶液B混匀, 室温静置15 min. 取生长良好的人胃癌上皮细胞SGC-7901, 用无血清DMEM培养基培养基洗2-3次, 加入800 μL无血清的DMEM细胞培养基后, 再加入准备好的质粒DNA/脂质体复合物200 μL. 28 ℃继续培养3-5 h后, 加1 mL含有20%血清的DMEM细胞培养基继续培养. 28 ℃继续培养60 h后, 在荧光显微镜下观察SGC-7901细胞是否发绿色荧光.
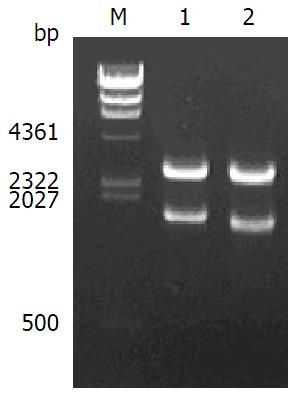
以来源于胃癌的菌株基因组DNA为模板, 分别扩增出GGT全长序列和成熟肽序列, 大小分别为1704、1629 bp(图1).
用HindⅢ和KpnⅠ酶切pMD-simple-T-GGT, 切出一条1700 bp左右的外源片段(图2, 泳道1), 与GGT全长大小一致. 另一条1600 bp左右的外源片段(图2, 泳道2)与GGT成熟肽大小一致, 这些酶切结果验证了pMD-simple-T-GGT的正确构建.
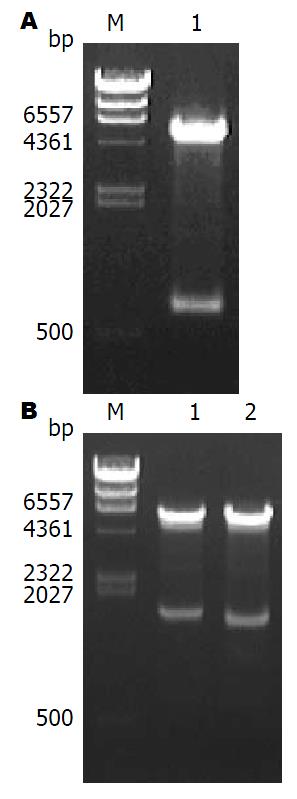
用KpnⅠ和EcoRⅠ酶切pcDNA3-EGFP, 切出一条750 bp左右的外源片段, 与 EGFP大小一致. 另一条为 6.1 kb左右的载体片段pcDNA3-GFP(HindⅢ+KpnⅠ). pcDNA3(5.4 kb), GFP(750 bp)其大小应该为5400 bp+750 bp, 即6.15 kb左右. 酶切结果验证了pcDNA3-EGFP的正确构建(图3A).
用HindⅢ和KpnⅠ酶切pcDNA3-GGT-EGFP, 切出一条1700 bp左右的条带(图3B, 泳道1), 与GGT全长序列大小一致. 另一条1600 bp左右大小(图3B, 泳道2), 与GGT成熟肽序列大小一致. 由于pcDNA3-GFP(HindⅢ+KpnⅠ)被同样酶切位点的GGT序列代替, 所以载体大小为pcDNA3(5.4 kb), EGFP(750 bp)即6.15 kb左右. 酶切结果验证了pcDNA3-GGT-EGFP的正确构建.
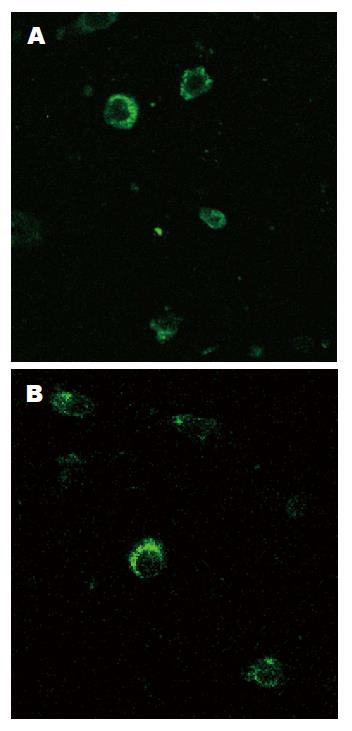
重组pcDNA3-GGT-EGFP DNA转染SGC-7901细胞后, 在SGC-7901细胞中表达外源基因, 在显微镜下可见转染的细胞产生明显的病变, 细胞由梭形变成圆形、变大、胞核扩大. 转染60 h后, 在共聚焦显微镜下观察, 发现荧光信号主要集中在细胞质中(图4).
GGT是谷氨酰循环中的关键酶, 这种酶被发现广泛存在于动植物体内[9], 可特异性催化γ-谷氨酰基的转移反应, H. pyloriGGT被发现也具有相似的特点, 目前大量哺乳动物细胞的GGT已经被纯化, 他们的性质和功能也被确定. 很多细菌的GGT也已经被鉴定和调查, 但是H. pylori GGT的成熟过程仍然不十分清楚. 在过去的研究中我们发现H. pylori GGT由单个基因编码, 可以被翻译成61个多肽, 进一步被分别加工成38和21 kDa的多肽. 这个结果证实了在原核细胞中很少发生翻译后的成熟过程.
和其他的病原体相比, H. pylori的感染是终身性的, 但是这种终身感染的原因仍然不清楚. H. pylori GGT对于H. pylori在小鼠模型胃部的定植非常重要. 免疫细胞的凋亡在H. pylori持续感染中起到了重要的作用[10]. CD4+T细胞对于细菌的清除十分重要, 但却受到H. pylori的抑制. 研究[11]发现H. pylori分泌的GGT能够抑制T细胞的增殖, GGT是一个新发现的H. pylori的免疫抑制因素, 通过诱导细胞周期停滞在G1时相抑制T细胞的增殖. 但是GGT与CD4+T细胞作用的具体机制还不十分清楚. H. pylori定植引起胃上皮细胞损伤的确切机制还不太清楚, 目前, 已经对H. pylori的凋亡诱导因素做了一些研究[12-14], 目前有很多假设指向线粒体在凋亡的调节中的作用和氧化应激[15]. 线粒体介导的程序性细胞死亡, 主要是由线粒体释放细胞色素C进入细胞质和半胱天冬酶家族成员的激活[16,17].
氧化应激主要是吞噬细胞在胃上皮下黏膜固有层浸润的结果, 这些吞噬细胞主要包括中性粒细胞和巨噬细胞, 这些细胞产生大量的活性氧自由基(reactive oxygen species, ROS)引起宿主防御反应. 细菌在胃黏膜上引起氧化应激反应, 线粒体是可能存在的目标之一, 是细胞质中自由基的主要来源, 据估计由线粒体消耗的氧通过电子传递链转变为O2-[18]. 线粒体中主要的ROS是O2-, 增加的O2-对邻近的分子诸如一些蛋白质、脂类甚至线粒体DNA都有损伤作用. 在生理条件下, 线粒体有很多酶诸如锰离子依赖的超氧化物歧化酶, 谷胱甘肽过氧化物酶, 还有一些非酶系统诸如NADPH, 维生素C和E, 这些物质能够保持O2-浓度在非常低的水平[19]. 总之, 过氧化物在H. pylori感染的AGS细胞中能够能够作用于线粒体启动细胞凋亡途径. 这些变化能够引起线粒体去极化, 导致其形态学和功能学的改变. 因此, 对于临床上感染H. pylori的患者需要给予抗氧化治疗[20].
很多体外实验和体内试验初步阐述了在胃上皮细胞中H. pylori感染和细胞凋亡之间的关系[21]. 细胞凋亡主要在调节细胞生长、免疫应答的发生以及正常细胞的清除方面起作用. 但是细胞凋亡也是对抗细菌和病毒的防御机制. H. pylori感染促进上皮细胞增生, 通过细胞凋亡保持了细胞的稳定性. 初步研究表明H. pylori感染引起的细胞凋亡通过Fas/FasL系统, 线粒体途径[22]介导的. 线粒体被认为是大部分细胞死亡途径的中枢细胞器[23]. 释放一些促凋亡物质诸如细胞色素C[24].
H. pylori GGT在分泌和成熟后通过离子键与细胞膜结合, 将细菌和宿主细胞直接连接起来. H. pylori GGT在胃癌细胞中诱导线粒体介导的程序性细胞死亡, 主要是细胞色素C[25]由线粒体释放进入细胞质和半胱天冬酶(Caspase)家族成员的激活[26]. 半胱天冬酶被分为两类, 上游区半胱天冬酶, 包括Caspase2、8、9和10, 下游区半胱天冬酶, 包括Caspase3、6和7[27]. 所有的半胱天冬酶在细胞内催化无活性的酶原, 在细胞凋亡的过程中必须经历蛋白水解的过程. 此外, 细胞凋亡除了导致AGS细胞核形态学改变以外, 还会引起Bax易位和Bcl-2、Bcl-xL表达量的减少[28]. 在Bcl-2蛋白家族中, Bcl-2是一种抗凋亡蛋白, Bax能够通过在线粒体外膜形成寡聚体和建立细胞色素C以及其他凋亡物质释放的通道促进凋亡. 程序性细胞死亡通过破坏新细胞生成和细胞消亡之间的平衡产生病理作用. 程序性细胞死亡持续发生和调节这种死亡的基因发生转变和突变增加胃癌发生的风险. 因此H. pylori在致胃癌过程中起到了关键作用[29].
尽管H. pylori GGT是一种诱导凋亡的因素, 可能是一种好的抗肿瘤因素. 但是其诱导的程序性细胞死亡的信号通路的细胞和分子机制仍需阐明, 有关GGT的生物学机制和在体内的效应还需要进一步研究.
为了进一步弄清楚H. pylori GGT在线粒体介导的细胞凋亡中的作用及临床上如何根治H. pylori, 我们利用GFP[30]融合GGT基因全长序列和成熟肽序列, 克隆进pcDNA3质粒中, 观察GGT基因表达后在人胃癌上皮细胞SGC-7901中的定位, 观察SGC-7901细胞形态、生长以及运动性的变化, 推测其可能诱导细胞凋亡的途径. 在显微镜下可见转染的细胞产生明显的病变, 细胞由梭形变成圆形、变大、胞核扩大. 转染60 h后, 在共聚焦显微镜下观察, 发现荧光信号主要集中在细胞的细胞质中. 结合相关报道, GGT基因表达的蛋白可能主要定位在线粒体上发挥作用, 参与程序性细胞死亡, 与胃癌的发生具有相关性, 为进一步研究GGT基因与胃癌发生的具体信号通路提供好的基础.
幽门螺杆菌(Helicobacter pylori, H. pylori)是一种革兰染色阴性的微需氧菌, H. pylori感染是导致胃溃疡、十二指肠溃疡以及慢性胃炎的一个主要原因, 并且与胃癌等胃相关性疾病的发生有着密切的关系, γ-谷氨酰转肽酶(γ-glutamyl transpeptidase, GGT)是一种催化肽基转移作用的酶, 在H. pylori诱导的线粒体介导的程序性细胞死亡中, 主要是通过诱导线粒体释放细胞色素C进入细胞质和激活Caspase家族成员起作用.
陈国忠, 主任医师, 广西中医学院第一附属医院消化内科
H. pylori的感染与消化系统疾病密切相关, 尤其是与胃癌的相关性一直是研究的焦点, GGT已经被证实与细胞凋亡途径有关, 但是其具体作用机制还有待进一步研究.
H. pylori GGT在胃癌细胞中诱导线粒体介导的程序性细胞死亡, 主要是细胞色素C由线粒体释放进入细胞质和半胱天冬酶(Caspase)家族成员的激活.
本文为研究GGT蛋白在胃癌细胞中的表达, 进一步研究该蛋白的功能以及与线粒体之间的作用机制奠定基础.
本研究成功克隆H. pylori GGT基因, 实现GGT基因在人胃癌上皮细胞SGC-7901中的表达和定位, 为进一步研究GGT蛋白的功能以及GGT基因与胃癌发生的具体信号通路提供好的基础.
编辑: 郭鹏 电编:闫晋利
| 1. | 1 Unidentified curved bacilli on gastric epithelium in active chronic gastritis. Lancet. 1983;1:1273-1275. [PubMed] [DOI] |
| 2. | Cover TL, Blaser MJ. Helicobacter pylori in health and disease. Gastroenterology. 2009;136:1863-1873. [PubMed] |
| 3. | Kraft C, Suerbaum S. Mutation and recombination in Helicobacter pylori: mechanisms and role in generating strain diversity. Int J Med Microbiol. 2005;295:299-305. [PubMed] [DOI] |
| 4. | Höcker M, Hohenberger P. Helicobacter pylori virulence factors--one part of a big picture. Lancet. 2003;362:1231-1233. [PubMed] |
| 5. | Panayotopoulou EG, Sgouras DN, Papadakos KS, Petraki K, Breurec S, Michopoulos S, Mantzaris G, Papatheodoridis G, Mentis A, Archimandritis A. CagA and VacA polymorphisms are associated with distinct pathological features in Helicobacter pylori-infected adults with peptic ulcer and non-peptic ulcer disease. J Clin Microbiol. 2010;48:2237-2239. [PubMed] [DOI] |
| 6. | Shibayama K, Doi Y, Shibata N, Yagi T, Nada T, Iinuma Y, Arakawa Y. Apoptotic signaling pathway activated by Helicobacter pylori infection and increase of apoptosis-inducing activity under serum-starved conditions. Infect Immun. 2001;69:3181-3189. [PubMed] |
| 7. | Kim KM, Lee SG, Park MG, Song JY, Kang HL, Lee WK, Cho MJ, Rhee KH, Youn HS, Baik SC. Gamma-glutamyltranspeptidase of Helicobacter pylori induces mitochondria-mediated apoptosis in AGS cells. Biochem Biophys Res Commun. 2007;355:562-567. [PubMed] [DOI] |
| 8. | Xia HH, Talley NJ. Apoptosis in gastric epithelium induced by Helicobacter pylori infection: implications in gastric carcinogenesis. Am J Gastroenterol. 2001;96:16-26. [PubMed] [DOI] |
| 9. | Barnes IH, Bagnall MC, Browning DD, Thompson SA, Manning G, Newell DG. Gamma-glutamyl transpeptidase has a role in the persistent colonization of the avian gut by Campylobacter jejuni. Microb Pathog. 2007;43:198-207. [PubMed] |
| 10. | Singh M, Prasad KN, Saxena A, Yachha SK. Helicobacter pylori induces apoptosis of T- and B-cell lines and translocates mitochondrial apoptosis-inducing factor to nucleus. Curr Microbiol. 2006;52:254-260. [PubMed] [DOI] |
| 11. | Schmees C, Prinz C, Treptau T, Rad R, Hengst L, Voland P, Bauer S, Brenner L, Schmid RM, Gerhard M. Inhibition of T-cell proliferation by Helicobacter pylori gamma-glutamyl transpeptidase. Gastroenterology. 2007;132:1820-1833. [PubMed] |
| 12. | Kuck D, Kolmerer B, Iking-Konert C, Krammer PH, Stremmel W, Rudi J. Vacuolating cytotoxin of Helicobacter pylori induces apoptosis in the human gastric epithelial cell line AGS. Infect Immun. 2001;69:5080-5087. [PubMed] [DOI] |
| 13. | Le'Negrate G, Ricci V, Hofman V, Mograbi B, Hofman P, Rossi B. Epithelial intestinal cell apoptosis induced by Helicobacter pylori depends on expression of the cag pathogenicity island phenotype. Infect Immun. 2001;69:5001-5009. [PubMed] [DOI] |
| 14. | Pompella A, De Tata V, Paolicchi A, Zunino F. Expression of gamma-glutamyltransferase in cancer cells and its significance in drug resistance. Biochem Pharmacol. 2006;71:231-238. [PubMed] |
| 15. | Orrenius S. Mitochondrial regulation of apoptotic cell death. Toxicol Lett. 2004;149:19-23. [PubMed] [DOI] |
| 16. | Gogvadze V, Orrenius S, Zhivotovsky B. Multiple pathways of cytochrome c release from mitochondria in apoptosis. Biochim Biophys Acta. 2006;1757:639-647. [PubMed] [DOI] |
| 17. | Sung JJ, Leung WK, Go MY, To KF, Cheng AS, Ng EK, Chan FK. Cyclooxygenase-2 expression in Helicobacter pylori-associated premalignant and malignant gastric lesions. Am J Pathol. 2000;157:729-735. [PubMed] [DOI] |
| 18. | Desouki MM, Kulawiec M, Bansal S, Das GM, Singh KK. Cross talk between mitochondria and superoxide generating NADPH oxidase in breast and ovarian tumors. Cancer Biol Ther. 2005;4:1367-1373. [PubMed] [DOI] |
| 19. | Zhang DX, Gutterman DD. Mitochondrial reactive oxygen species-mediated signaling in endothelial cells. Am J Physiol Heart Circ Physiol. 2007;292:H2023-H2031. [PubMed] [DOI] |
| 20. | Calvino-Fernández M, Benito-Martínez S, Parra-Cid T. Oxidative stress by Helicobacter pylori causes apoptosis through mitochondrial pathway in gastric epithelial cells. Apoptosis. 2008;13:1267-1280. [PubMed] |
| 21. | Ding SZ, Minohara Y, Fan XJ, Wang J, Reyes VE, Patel J, Dirden-Kramer B, Boldogh I, Ernst PB, Crowe SE. Helicobacter pylori infection induces oxidative stress and programmed cell death in human gastric epithelial cells. Infect Immun. 2007;75:4030-4039. [PubMed] [DOI] |
| 22. | Zhang H, Fang DC, Lan CH, Luo YH. Helicobacter pylori infection induces apoptosis in gastric cancer cells through the mitochondrial pathway. J Gastroenterol Hepatol. 2007;22:1051-1056. [PubMed] [DOI] |
| 23. | Rajalingam K, Oswald M, Gottschalk K, Rudel T. Smac/DIABLO is required for effector caspase activation during apoptosis in human cells. Apoptosis. 2007;12:1503-1510. [PubMed] |
| 24. | Yamasaki E, Wada A, Kumatori A, Nakagawa I, Funao J, Nakayama M, Hisatsune J, Kimura M, Moss J, Hirayama T. Helicobacter pylori vacuolating cytotoxin induces activation of the proapoptotic proteins Bax and Bak, leading to cytochrome c release and cell death, independent of vacuolation. J Biol Chem. 2006;281:11250-11259. [PubMed] [DOI] |
| 25. | Eskes R, Desagher S, Antonsson B, Martinou JC. Bid induces the oligomerization and insertion of Bax into the outer mitochondrial membrane. Mol Cell Biol. 2000;20:929-935. [PubMed] |
| 26. | Borner C. The Bcl-2 protein family: sensors and checkpoints for life-or-death decisions. Mol Immunol. 2003;39:615-647. [PubMed] [DOI] |
| 27. | Robertson JD, Orrenius S, Zhivotovsky B. Review: nuclear events in apoptosis. J Struct Biol. 2000;129:346-358. [PubMed] [DOI] |
| 28. | Chipuk JE, Kuwana T, Bouchier-Hayes L, Droin NM, Newmeyer DD, Schuler M, Green DR. Direct activation of Bax by p53 mediates mitochondrial membrane permeabilization and apoptosis. Science. 2004;303:1010-1014. [PubMed] |
| 29. | Shibayama K, Kamachi K, Nagata N, Yagi T, Nada T, Doi Y, Shibata N, Yokoyama K, Yamane K, Kato H. A novel apoptosis-inducing protein from Helicobacter pylori. Mol Microbiol. 2003;47:443-451. [PubMed] |
| 30. | Misteli T, Spector DL. Applications of the green fluorescent protein in cell biology and biotechnology. Nat Biotechnol. 1997;15:961-964. [PubMed] |