修回日期: 2015-04-30
接受日期: 2015-05-15
在线出版日期: 2015-06-28
目的: 观察舒芬太尼预处理对脑死亡大鼠导致的肝细胞凋亡的影响.
方法: 将18只SD大鼠随机分为假手术组(Sham组)、脑死亡组(BD组)、舒芬太尼预处理组(SUF组). 采用缓慢颅内加压法建立大鼠脑死亡模型, 诱导脑死亡前1 h皮下给予舒芬太尼10 μg/kg. 利用免疫组织化学及Western blot检测细胞色素c(cytochrome c, Cyt-c)及Caspase3的表达, 并且利用TUNEL检测肝细胞的凋亡.
结果: 通过实验发现: BD组与Sham组相比, Cyt-c与Caspase3表达明显增加, 肝细胞凋亡增加, 差异具有统计学意义(P<0.05); SUF组与BD组相比, Cyt-c与Caspase3表达明显降低, 肝细胞凋亡减少(P<0.05).
结论: 舒芬太尼的预处理能显著减轻脑死亡大鼠肝细胞的凋亡.
核心提示: 本研究首次发现舒芬太尼预处理能通过线粒体途径减轻脑死亡状态下的肝细胞凋亡.
引文著录: 李兰兰, 陈淼, 韩雪萍. 舒芬太尼预处理对脑死亡大鼠肝细胞凋亡的影响. 世界华人消化杂志 2015; 23(18): 2874-2879
Revised: April 30, 2015
Accepted: May 15, 2015
Published online: June 28, 2015
AIM: To investigate the effect of sufentanil against liver apoptosis induced by brain death in rats.
METHODS: Eighteen SD rats were randomly divided into three groups: a sham operation group, a brain death group and a sufentanil group. Activation of cytochrome c (Cyt-c) and Caspase3 was examined by the immunohistochemical staining (IHC) and Western blot. Apoptosis was assessed by terminal deoxynucleotide transferase-mediated dUTP nick-end nick-end labeling assay (TUNEL). Brain death was induced by gradually increasing intracranial pressure (ICP). Sufentanil (10 μg/kg) was injected 1 h before induction of brain death.
RESULTS: Liver tissue samples harvested after brain death showed increased activation of Cyt-c and Caspase3 (P < 0.05). Consistent with this, TUNEL analysis confirmed apoptosis in the liver following brain death. Sufentanil significantly decreases levels of Cyt-c and Caspase3 compared to the brain death group (P < 0.05).
CONCLUSION: Sufentanil preconditioning has a protective effect in reducing liver apoptosis induced by brain death in rats.
- Citation: Li LL, Chen M, Han XP. Effect of sufentanil preconditioning on liver apoptosis induced by brain death in rats. Shijie Huaren Xiaohua Zazhi 2015; 23(18): 2874-2879
- URL: https://www.wjgnet.com/1009-3079/full/v23/i18/2874.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i18.2874
脑死亡是包括脑干在内的全脑功能不可逆的丧失[1-4]. 脑死亡供体是器官移植的主要来源. 实验及临床研究[5-7]表明, 脑死亡来源的供体较活体供体移植术后并发症多、生存率低. 因此, 脑死亡被认为是造成供体器官损伤的一个独立危险因素[8-15]. 脑死亡可以导致血流动力学、神经内分泌、免疫学及其他方面的改变[16,17]. 肝细胞的凋亡是造成肝损伤的最基本中心环节.
舒芬太尼是一种强效类阿片类镇痛药, 具有起效快, 镇痛效果强及作用时间长, 并且有较好的血流动力学稳定性. 已经广泛的应用于临床麻醉及术后、重症监护室的镇痛. 研究[18-21]表明, 舒芬太尼对缺血再灌注损伤有很好的保护作用, 并且在减轻细胞凋亡中发挥重要的作用. 尚未见其对脑死亡状态下肝细胞的凋亡的报道, 本研究拟观察舒芬太尼预处理对脑死亡状态下肝细胞凋亡的影响.
SPF级健康♂SD大鼠18只, 体质量250-350 g, 购自河南省动物中心. 大鼠随机分为3组: 假手术组(Sham组): 除不进行脑死亡的诱导外, 其他操作均同脑死亡组; 脑死亡组(BD组): 采用传统的渐进性颅内加压法诱导脑死亡的发生; 舒芬太尼(批号060337, 德国Impfstoffwerk Dessau-Tornau GmbH公司)预处理组(SUF组): 诱导脑死亡前1 h皮下给予舒芬太尼10 μg/kg, 之后同脑死亡组. 一抗细胞色素c(cytochrome c, Cyt-c)、Caspase3(Cell signaling technology公司兔抗单克隆抗体); 二抗(中杉金桥山羊抗兔lgG-HRP); 一抗(中杉金桥兔抗大鼠内参β-actin一抗); TUNEL试剂盒(In Situ cell Death Detection Kit, Fluorescein; Roche).
1.2.1 脑死亡模型的建立: 术前不禁食水. 称质量后, 利用3%戊巴比妥钠按照60 mg/kg的体质量腹腔注射进行麻醉. 麻醉成功后, 于左下肢股动静脉置管, 分别连接压力传感器和静脉输液管道. 在颅顶正中做矢状切口, 剥离皮下组织及颅骨外组织, 在冠状线与矢状线的左前方钻一直径为2 mm的孔, 将3F的Fogarty导管放置在硬脑膜外腔. 颅内加压采用缓慢的渐进的颅内加压法加压, 直至脑死亡的发生. 本实验的脑死亡判定标准为[22-24]: (1)深昏迷, 排除麻醉、低体温等可逆性昏迷的原因; (2)脑干发射消失; (3)脑电图成一平直的直线.
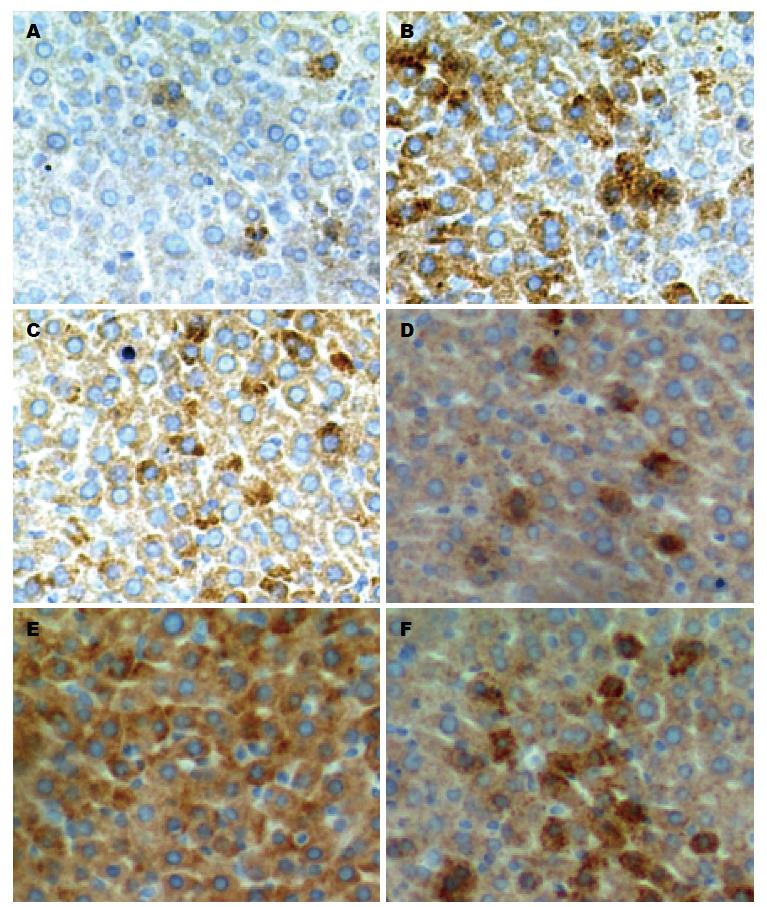
1.2.2 免疫组织化学检测Cyt-c及Caspase3蛋白的表达: 所有标本均经中性甲醛固定、常规脱水、包埋, 连续4 μm切片, 作SP染色. 3%H2O2-甲醇阻断内源性过氧化物酶, 微波(750 W, 95 ℃, 5 min×2次)抗原修复, DAB显色, 苏木素复染. 严格按SP试剂盒的说明进行染色. 染色判断标准: (1)按细胞显色有无及深浅计分: 0分为细胞无显色; 1分为浅黄色; 2分为棕黄色; 3分为棕褐色; (2)按细胞的显色比例计分: 0分, 显色细胞<10%; 1分, 10%-30%显色; 2分, 31%-60%显色; 3分, 60%以上显色. 每例积分 = (1)×(2). 按积分高低分为: 阴性(-), 计分为0分; 弱阳性(+), 积分1-4分; 强阳性(++ ), 积分>4分.
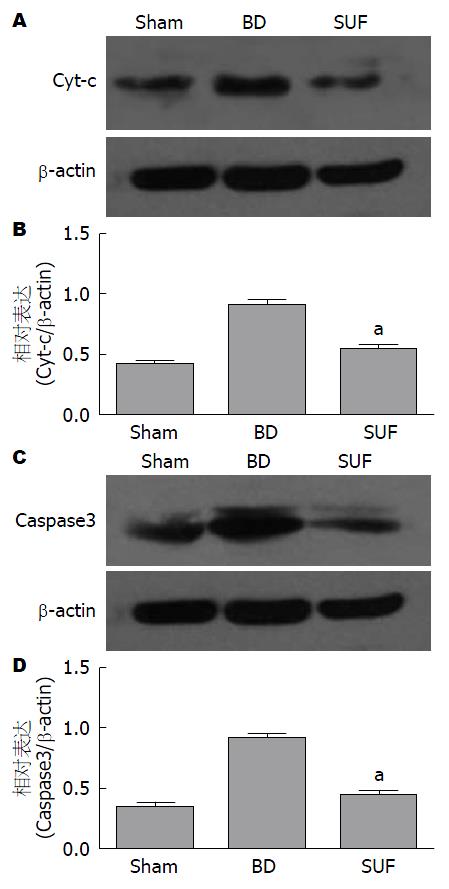
1.2.3 Western blot检测Cyt-c及Caspase3蛋白的表达: 取100 mg大鼠肝脏组织及1 mL的RIPA和10 μL的PMSF放入EP管并置于超声组织破碎仪中, 之后按照RIPA裂解液说明书提取组织蛋白. BCA法测蛋白浓度. 取40 μg的组织总蛋白, SDS-PAGE凝胶电泳80 V, 待蛋白至分离胶后100 V. 湿转220 mA, 1.5 h将凝胶上的蛋白转移至硝酸纤维素膜上. 5%的脱脂奶粉封闭1 h. 加入1︰1000的1×TBS稀释的一抗Cyt-c及1︰1000的1×TBS稀释的一抗Caspase3, 4 ℃过夜. 1×TBST洗膜3次×10 min. 加入1︰3000的1×TBS稀释的二抗, 室温1 h. 1×TBST洗膜3次×10 min. 加入1︰1000的1×TBS稀释的一抗, 4 ℃过夜. 1×TBST洗膜3次×10 min. 加入1︰3000的1×TBS稀释的二抗, 室温1 h. 1×TBST洗膜3次×10 min. 待暗室加入ECL发光剂曝光, 显影. 使用Quantity-one软件计算各个样本蛋白表达水平.
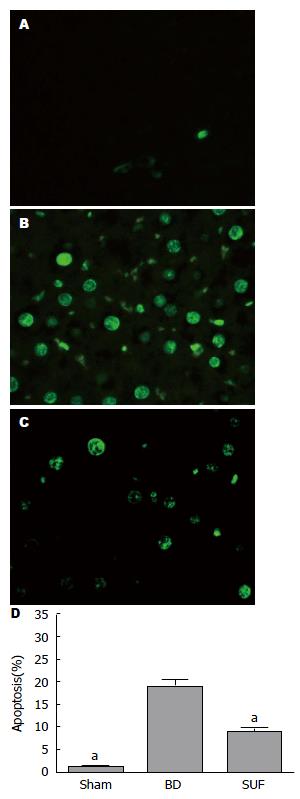
1.2.4 TUNEL检测肝细胞的凋亡: 所有标本经甲醛固定, 常规脱水、包埋, 连续4 μm切片, 经二甲苯脱蜡, 梯度乙醇水化, 严格按照TUNEL凋亡试剂盒说明书, 滴加TUNEL反应液, 温箱孵育, 滴加抗荧光淬灭剂, 进行封片.
统计学处理 采用SPSS18.0统计软件包进行统计学处理数据, 蛋白表达量及细胞凋亡率利用t检验, P<0.05为差异有统计学意义.
通过免疫组织化学检测发现, 大鼠脑死亡组与假手术组相比, Cyt-c与Caspase3的蛋白在细胞质中表达增加; 舒芬太尼预处理组与脑死亡组相比, Cyt-c与Caspase3的蛋白在细胞质中表达减少(图1). 为进一步验证这以结果, 我们通过Western blot进行检测Cyt-c及Caspase3的蛋白表达, 我们发现, Cyt-c及Caspase3的蛋白表达同免疫组织化学检测的结果相似, 大鼠脑死亡后Cyt-c及Caspase3的表达增加, 舒芬太尼预处理后表达降低, 差异具有统计学意义(P<0.05)(图2).
大鼠脑死亡组与假手术组相比, 肝细胞的凋亡率增加, 差异具有统计学意义(P<0.05); 舒芬太尼预处理后, 大鼠肝细胞的凋亡率明显降低, 差异具有统计学意义(P<0.05)(图3).
细胞凋亡, 又称为程序性细胞死亡, 是基因调控下的细胞主动性的死亡过程[25-28]. 研究[4,29,30]表明, 凋亡在脑死亡状态下的肝损伤中占据重要的部分. 各种刺激信号如氧自由基、钙超载、内质网通路等信号通路传至细胞内, 由Cyt-c及Caspase等参与调控执行. 因而, 了解细胞凋亡的机制, 采取相应的措施, 对于减轻脑死亡状态下的肝细胞凋亡具有重要的意义.
围手术期的肝脏保护是临床麻醉研究的焦点之一, 尤其临床麻醉药物的使用对肝脏是否有保护作用是人们关注的重点. 舒芬太尼是临床常用的静脉镇痛药物, 具有良好的镇痛效果. 本研究旨在观察舒芬太尼对脑死亡状态下肝损伤有无保护作用.
本研究通过免疫组织化学研究发现, 大鼠脑死亡后肝脏中Cyt-c及Caspase3的表达增加, 并且在细胞质中呈棕黄色颗粒, 为胞质表达, 舒芬太尼预处理后, 细胞质中的Cyt-c及Caspase3的表达明显减轻. 为进一步验证其结果, 我们通过Western blot检测发现, 脑死亡组与假手术组相比, Cyt-c及Caspase3表达增加, 差异具有统计学意义; 在舒芬太尼预处理后, 凋亡相关蛋白明显降低. 另外, 我们通过TUNEL检测肝细胞的凋亡情况发现: 大鼠脑死亡后肝细胞凋亡率明显增加, 在舒芬太尼预处理后, 肝细胞的凋亡率明显下降, 差异具有统计学意义.
总之, 舒芬太尼的预处理可以减轻脑死亡状态下肝细胞的凋亡, 其可能的机制是通过减轻线粒体凋亡途径来实现的.
脑死亡来源的供体较活体供体移植术后并发症多、生存率低. 因此, 脑死亡被认为是造成供体器官损伤的一个独立危险因素, 舒芬太尼对缺血再灌注损伤有很好的保护作用, 并且在减轻细胞凋亡中发挥重要的作用, 本研究探讨是否在脑死亡下肝细胞损伤中起到保护作用.
姚鹏, 主任医师, 首都医科大学附属北京朝阳医院西区肝病科
舒芬太尼对缺血再灌注损伤有很好的保护作用, 并且在减轻细胞凋亡中发挥重要的作用. 尚未见其对脑死亡状态下肝细胞的凋亡的报道.
在麻醉的过程中利用舒芬太尼预处理减轻脑死亡状态下的肝细胞凋亡, 提高移植的供体存活率.
脑死亡: 是包括脑干在内的全脑功能不可逆的丧失.
本文通过细胞色素c及Caspase3的表达, 检测肝细胞的凋亡, 分析舒芬太尼预处理对脑死亡大鼠肝细胞凋亡的影响, 具有一定科学性、可读性.
编辑: 韦元涛 电编:闫晋利
| 1. | Cohen J, Steinberg A, Singer P, Ashkenazi T. The implementation of a protocol promoting the safe practice of brain death determination. J Crit Care. 2015;30:107-110. [PubMed] [DOI] |
| 2. | Rady MY, Verheijde JL. Brain death and the moral code of islam. Chest. 2015;147:e69. [PubMed] [DOI] |
| 3. | Szurhaj W, Lamblin MD, Kaminska A, Sediri H. EEG guidelines in the diagnosis of brain death. Neurophysiol Clin. 2015;45:97-104. [PubMed] [DOI] |
| 4. | Denny JT, Burr A, Tse J, Denny JE, Chyu D, Cohen S, Patel AN. A new technique for avoiding barotrauma-induced complications in apnea testing for brain death. J Clin Neurosci. 2015;22:1021-1024. [PubMed] |
| 5. | Kusaka M, Pratschke J, Wilhelm MJ, Ziai F, Zandi-Nejad K, Mackenzie HS, Hancock WW, Tilney NL. Activation of inflammatory mediators in rat renal isografts by donor brain death. Transplantation. 2000;69:405-410. [PubMed] [DOI] |
| 6. | Pratschke J, Wilhelm MJ, Laskowski I, Kusaka M, Beato F, Tullius SG, Neuhaus P, Hancock WW, Tilney NL. Influence of donor brain death on chronic rejection of renal transplants in rats. J Am Soc Nephrol. 2001;12:2474-2481. [PubMed] |
| 7. | Zweers N, Petersen AH, van der Hoeven JA, de Haan A, Ploeg RJ, de Leij LF, Prop J. Donor brain death aggravates chronic rejection after lung transplantation in rats. Transplantation. 2004;78:1251-1258. [PubMed] [DOI] |
| 8. | van der Hoeven JA, Molema G, Ter Horst GJ, Freund RL, Wiersema J, van Schilfgaarde R, Leuvenink HG, Ploeg RJ. Relationship between duration of brain death and hemodynamic (in)stability on progressive dysfunction and increased immunologic activation of donor kidneys. Kidney Int. 2003;64:1874-1882. [PubMed] [DOI] |
| 9. | Van Der Hoeven JA, Moshage H, Schuurs T, Nijboer M, Van Schilfgaarde R, Ploeg RJ. Brain death induces apoptosis in donor liver of the rat. Transplantation. 2003;76:1150-1154. [PubMed] [DOI] |
| 10. | Gasser M, Waaga AM, Laskowski IA, Tilney NL. The influence of donor brain death on short and long-term outcome of solid organ allografts. Ann Transplant. 2000;5:61-67. [PubMed] |
| 11. | Krishnamoorthy V, Borbely X, Rowhani-Rahbar A, Souter MJ, Gibbons E, Vavilala MS. Cardiac dysfunction following brain death in children: prevalence, normalization, and transplantation. Pediatr Crit Care Med. 2015;16:e107-e112. [PubMed] |
| 12. | Dhanani S, Shemie SD. Advancing the science of organ donor management. Crit Care. 2014;18:612. [PubMed] [DOI] |
| 13. | Eremenko AA, Minbolatova NM, Kaabak MM, Babenko NN. [Neutrophil gelatinase-associated lipocalin (u-NGAL) in the assessment of renal function in patients after kidney allotransplantation]. Anesteziol Reanimatol. 2014;59:10-15. [PubMed] |
| 14. | Kosmoliaptsis V, Salji M, Bardsley V, Chen Y, Thiru S, Griffiths MH, Copley HC, Saeb-Parsy K, Bradley JA, Torpey N. Baseline donor chronic renal injury confers the same transplant survival disadvantage for DCD and DBD kidneys. Am J Transplant. 2015;15:754-763. [PubMed] [DOI] |
| 15. | Branchereau J, Barrou B. Pharmacological strategy designed to limit ischemia-reperfusion injury in brain dead donor kidneys. Prog Urol. 2014;24 Suppl 1:S26-S30. [PubMed] [DOI] |
| 16. | Wilhelm MJ, Pratschke J, Laskowski IA, Paz DM, Tilney NL. Brain death and its impact on the donor heart-lessons from animal models. J Heart Lung Transplant. 2000;19:414-418. [PubMed] [DOI] |
| 17. | Bugge JF. Brain death and its implications for management of the potential organ donor. Acta Anaesthesiol Scand. 2009;53:1239-1250. [PubMed] [DOI] |
| 21. | Wu QL, Shen T, Ma H, Wang JK. Sufentanil postconditioning protects the myocardium from ischemia-reperfusion via PI3K/Akt-GSK-3β pathway. J Surg Res. 2012;178:563-570. [PubMed] [DOI] |
| 22. | Steen PA, Milde JH, Michenfelder JD. No barbiturate protection in a dog model of complete cerebral ischemia. Ann Neurol. 1979;5:343-349. [PubMed] |
| 23. | Pomper G, Trescher K, Santer D, Hasun M, Baumgartner A, Adelmann K, Inci M, Dietl W, Zuckermann AO, Podesser BK. Introducing a mouse model of brain death. J Neurosci Methods. 2010;192:70-74. [PubMed] |
| 24. | Sereinigg M, Stiegler P, Puntschart A, Seifert-Held T, Zmugg G, Wiederstein-Grasser I, Marte W, Marko T, Bradatsch A, Tscheliessnigg K. Establishing a brain-death donor model in pigs. Transplant Proc. 2012;44:2185-2189. [PubMed] [DOI] |
| 25. | Rahman HS, Rasedee A, Chartrand MS, Othman HH, Yeap SK, Namvar F. Zerumbone induces G2/M cell cycle arrest and apoptosis via mitochondrial pathway in Jurkat cell line. Nat Prod Commun. 2014;9:1237-1242. [PubMed] |
| 26. | Stehle A, Hugle M, Fulda S. Eribulin synergizes with Polo-like kinase 1 inhibitors to induce apoptosis in rhabdomyosarcoma. Cancer Lett. 2015;365:37-46. [PubMed] [DOI] |
| 27. | Hsieh YH, Lee CH, Chen HY, Hsieh SC, Lin CL, Tsai JP. Induction of cell cycle arrest, DNA damage, and apoptosis by nimbolide in human renal cell carcinoma cells. Tumour Biol. 2015;36:7539-7547. [PubMed] |
| 28. | Lalaoui N, Lindqvist LM, Sandow JJ, Ekert PG. The molecular relationships between apoptosis, autophagy and necroptosis. Semin Cell Dev Biol. 2015;39:63-69. [PubMed] [DOI] |