修回日期: 2015-04-27
接受日期: 2015-05-15
在线出版日期: 2015-06-28
目的: 探讨甘草甜素抑制胃癌细胞BGC-823增殖及其相关机制.
方法: 不同浓度甘草甜素培养后, 采用MTT法检测细胞增殖率; 流式细胞术检测细胞周期; 黏附实验和Transwell小室实验检测细胞的黏附百分比和迁移的变化; 免疫印迹法检测β-catenin、Bcl-2、CyclinD1和Survivin的蛋白表达水平.
结果: 甘草甜素呈浓度依赖性抑制BGC-823细胞增殖, 并且抑制细胞从G1期向S期的转变(P<0.05). 给予40 μmol/L甘草甜素处理BGC-823细胞后, 细胞黏附和迁移的能力减弱, 且β-catenin、Bcl-2、CyclinD1和Survivin的蛋白表达水平明显降低(P<0.05).
结论: 甘草甜素通过调控细胞周期抑制BGC-823细胞的增殖、黏附、迁移, 其作用机制可能与Wnt/β-catenin信号通路有关.
核心提示: 本研究结果显示, 甘草甜素可抑制胃癌细胞BGC-823细胞的增殖、黏附和迁移能力, 其作用机制可能与Wnt/β-catenin信号通路有关.
引文著录: 王惠枫, 禇志凤, 高远, 黄美红. 甘草甜素对胃癌细胞BGC-823增殖作用的影响. 世界华人消化杂志 2015; 23(18): 2868-2873
Revised: April 27, 2015
Accepted: May 15, 2015
Published online: June 28, 2015
AIM: To investigate the effect of glycyrrhizin on the proliferation of gastric cancer cell line BGC-823 and the underlying mechanism.
METHODS: BGC-823 cells were incubated with different concentrations of glycyrrhizin, and cell proliferation was examined by MTT assay. BGC-823 cells were then treated with 40 μmol/L glycyrrhizin, and cell cycle, adhesive capacity and migration were determined by flow cytometry, adhesion assay and transwell assay, respectively. The expression of β-catenin, Bcl-2, CyclinD1 and survivin was detected by Western blot.
RESULTS: Glycyrrhizin decreased BGC-823 cell proliferation in a dose-dependent manner, and inhibited cell cycle progression from G1 phase to S phase (P < 0.05). After treatment with 40 μmol/L glycyrrhizin, cell adhesion and migration were inhibited (P < 0.05). Furthermore, the expression of β-catenin, Bcl-2, CyclinD1 and survivin was significantly decreased (P < 0.05).
CONCLUSION: Glycyrrhizin inhibits BGC-823 proliferation, adhesion and migration via the regulation of cell cycle, which may be related to the Wnt/β-catenin signaling pathway.
- Citation: Wang HF, Zhu ZF, Gao Y, Huang MH. Effect of glycyrrhizin on gastric cancer BGC-823 cell proliferation. Shijie Huaren Xiaohua Zazhi 2015; 23(18): 2868-2873
- URL: https://www.wjgnet.com/1009-3079/full/v23/i18/2868.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i18.2868
胃癌是全球发病率处于第4位的恶性肿瘤, 在肿瘤致死率中居第2位[1]. 亚洲日本、韩国和中国是胃癌高发国家[2], 其中男性是胃癌发病的高危人群, 具有早期诊断率低, 误诊率高, 治疗效果不理想的特点[3], 其发病与饮食不规律、酗酒等不良生活习惯有关. 胃癌位于中国恶性肿瘤发病率的第2位, 每年新增病例占全球的42%[4,5]. 因此, 胃癌是当前危害我国人民身体健康的重大疾病之一[6]. 目前手术是胃癌最有效的手段, 但复发率仍达到60%左右[7]. 随着多种化学药物联合治疗, 对胃癌的治疗取得阶段性的临床进展, 但由于化疗药物长时间使用易出现耐药性, 导致治疗难以继续, 寻找新的抗癌药物迫在眉睫.
甘草甜素(Glycyrrhizin)也称甘草酸, 是豆科植物甘草(Glycyrrhiza uralensis Fisch)根茎的有效成分之一, 甘草甜味的来源, 具有安全无毒性及良好的医疗保健的特点[8]. 除了作为甜味剂外, 甘草甜素还具有抗病毒、抗肿瘤、免疫调节和抗炎等多种药理作用[9-13]. 本实验将探讨甘草甜素抑制胃癌细胞BGC-823增殖及其可能的作用机制.
人胃癌细胞BGC-823细胞购自上海生博生物医药科技有限公司; 甘草甜素购自南京泽朗医药科技有限公司; DMEM、Opti-MEM培养基购自Gibco公司; 胎牛血清购自Hyclone公司; CCK-8试剂盒购自碧云天生物技术有限公司; Transwell小室购自Costar公司; β-catenin、Bcl-2、CyclinD1和Survivin抗体均购自Cell Signaling Technology公司; 其余试剂均为国产分析纯.
1.2.1 细胞培养与分组: 将BGC-823细胞株置于含10%胎牛血清的DMEM培养基中, 于37 ℃、50 mL/L CO2培养箱中培养, 每2-3 d换液1次. 将甘草甜素溶于DMSO中, 分别配制为10、20、40和80 mmol/L的工作液. 设空白对照组(Control), 细胞不给药处理; 溶剂对照组(Vehicle), 细胞中加入DMSO; 给药组A-D, 分别于2 mL培养基中加入2 μL甘草甜素工作液(比例1:1000), 使其总浓度为10、20、40和80 μmol/L.
1.2.2 MTT法测定细胞增殖率: 收集各组对数期细胞, 并调整细胞悬液浓度, 取96孔板, 加入细胞悬液使密度为4000-5000个/孔. 给药后, 分别于12、24、36和48 h加入MTT溶液, 继续培养4 h, 吸去孔内培养液, 每孔加入DMSO 100 μL, 摇床震荡15 min, 在酶联免疫检测仪488 nm处, 以空白孔调零(不加细胞, 仅加入等量的DMEM培养基), 测量每孔的吸光度(A)值.
1.2.3 流式细胞术检测细胞周期: 将处于生长对数期的各组细胞消化处理后, 800 r/min离心5 min, PBS洗涤2次, 800 r/min离心5 min, PBS重悬, 加入70 mL/L预冷无水乙醇, 4 ℃避光过夜. 1000 r/min离心7 min洗去乙醇, 加入碘化丙啶(PI), 避光孵育30 min, 记录于激发波长488 nm处荧光强度, 实验重复3次.
1.2.4 黏附实验: 取96孔板, 以无菌PBS配制30 μg/mL纤连蛋白(fibronectin, Fn), 每孔加入50 μL, 置于37 ℃、50 mL/L CO2的培养箱包被1 h, 无菌PBS洗涤2次, 每孔加入1%BSA, 置于培养箱封闭2 h. PBS清洗3次, 晾干. 收集处于生长对数期的各组细胞, 调整细胞浓度为5×105/mL, 以每孔100 μL加入预包被的培养板, 置于细胞培养箱分别静置20、40和60 min后, 吸取未黏附的细胞, 以无菌PBS清洗2次, 收集黏附细胞, 计算黏附百分率(黏附百分比 = 黏附细胞总数/接种细胞总数×100%).
1.2.5 Transwell迁移实验: 经相应处理后, 将各组细胞培养于无血清DMEM培养基中, 稀释, 消化细胞, 计数, 调整细胞浓度为2×104/100 μL; 将细胞悬液加入至Transwell小室的上室, 下室加入完全培养基, 培养24 h. 0.9%NaCl溶液漂洗, 用4%甲醛固定15 min, 结晶紫染色, 将上室有细胞的面贴玻璃, 倒置显微镜下观察并拍照, 计数.
1.2.6 免疫印迹法检测相关蛋白表达: 各组细胞经相应处理后, 离心收集细胞, 提取细胞总蛋白. 12%SDS-PAGE电泳, 电转至硝酸纤维素(NC)膜上, 封闭液封闭, 加入一抗4 ℃孵育过夜, TBST漂洗后加入相应二抗室温孵育2 h, TBST洗涤; 化学发光法显色, 胶片用凝胶成像系统扫描灰度值分析.
统计学处理 数据处理采用SPSS16.0统计软件, 实验结果采用mean±SD表示, 组间差异采用t检验或方差分析(One-way ANOVA), P<0.05为差异具有统计学意义.
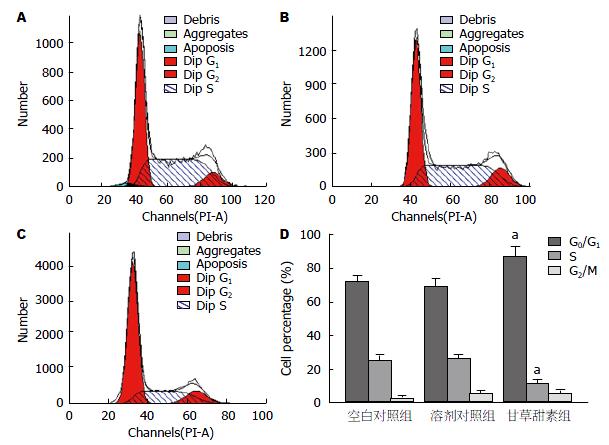
MTT法分别检测各组细胞的增殖率, 结果显示, 与空白对照组相比, 给予甘草甜素培养后的BGC-823细胞增殖率明显降低(P<0.05); 在相同时间点处, 细胞增殖率随着甘草甜素浓度的增大而减少, 20、40和80 μmol/L甘草甜素组与10 μmol/L甘草甜素组间差异有统计学意义(P<0.05); 40和80 μmol/L甘草甜素组与20 μmol/L甘草甜素组间差异亦有统计学意义(P<0.05). 空白对照组与溶剂对照组间差异无统计学意义(P>0.05)(表1). 同时, 40 μmol/L甘草甜素和80 μmol/L甘草甜素组间差异无统计学意义(P>0.05), 因此采用40 μmol/L进行后续实验.
| 分组 | 12 h | 24 h | 36 h | 48 h |
| 空白对照组 | 25.43±1.28 | 50.37±3.76 | 89.84±4.36 | 113.25±6.54 |
| 溶剂对照组 | 24.47±2.01 | 51.84±3.42 | 90.27±6.41 | 111.38±8.25 |
| 给药组A | 20.01±1.02a | 39.54±2.57a | 64.58±4.37a | 83.96±5.37a |
| 给药组B | 18.01±1.01ac | 33.28±2.47ac | 53.37±3.67ac | 76.37±5.47ac |
| 给药组C | 14.63±1.03ace | 24.13±2.54ace | 36.37±3.21ace | 45.43±4.32ace |
| 给药组D | 13.78±1.04ace | 25.57±2.01ace | 34.92±2.38ace | 47.48±5.21ace |
流式细胞术结果显示, 与空白对照组相比, 给予40 μmol/L甘草甜素培养后, BGC-823细胞G0/G1期的细胞数占百分比明显增加, S期细胞数所占百分比明显减少(P<0.05), 表明甘草甜素能延缓BGC-823细胞的周期由G0/G1期向S期转换(图1).
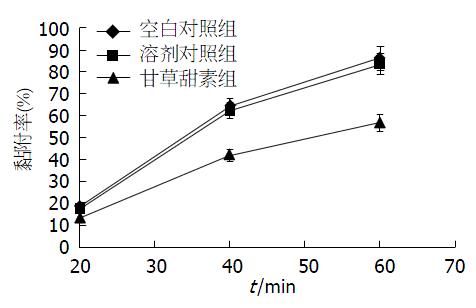
分别于20、40和60 min后计数各组细胞黏附于LN基质的数量, 计算细胞的黏附百分比. 结果显示, 与空白对照组相比, 给予40 μmol/L甘草甜素培养后的细胞黏附百分比显著降低(P<0.05), 而空白对照组与溶剂对照组间无统计学差异(P>0.05)(图2).
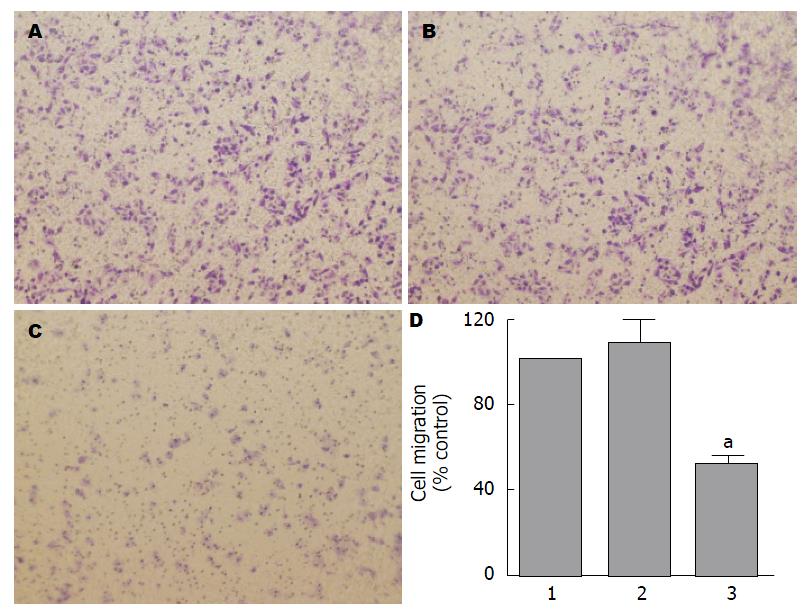
Transwell迁移实验结果显示, 40 μmol/L甘草甜素培养后, BGC-823细胞培养24 h后的细胞迁移数显著低于空白对照组(P<0.05), 而空白对照组和溶剂对照组间的细胞迁移数无统计学差异(P>0.05)(图3).
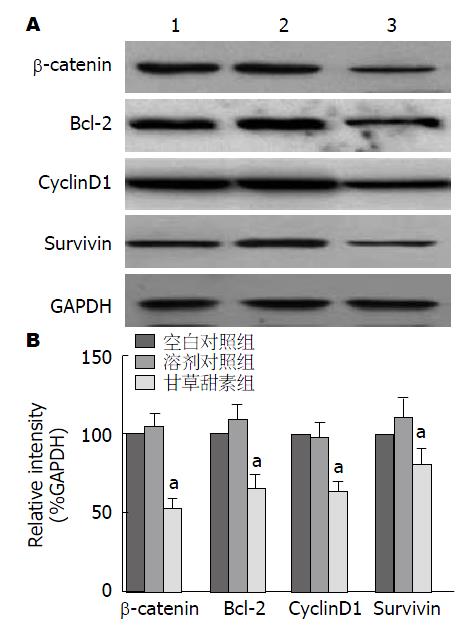
免疫印迹法结果显示, 40 μmol/L甘草甜素培养后的BGC-823细胞中β-catenin、Bcl-2、CyclinD1和Survivin的蛋白表达显著低于空白对照组(P<0.05), 而空白对照组和溶剂对照组间无统计学差异(P>0.05)(图4).
甘草是中国中医里最常用和沿用历史最悠久的中草药之一. 通过现代分析技术发现, 甘草是有多种化学成分组成, 主要有甘草甜素、甘草次酸、甘草苷、新甘草苷、异甘草苷、新异甘草苷和黄酮等[14]. 其中甘草甜素是从甘草根茎提取的三萜皂苷, 由一个甘草次酸分子作为苷元连接两个葡萄糖醛酸组成[15].
本实验采用MTT法检测结果发现甘草甜素可抑制BGC-823细胞的增殖, 且与浓度呈正相关. 40和80 μmol/L的甘草甜素对细胞增殖的抑制作用无显著性差异, 因此采用40 μmol/L进行后续实验. 再者, 流式细胞仪检测结果同样表明了甘草甜素对BGC-823细胞的增殖具有抑制作用. Fn黏附和迁移实验结果表明, 与空白对照组相比, 给药组的细胞黏附力明显减弱, 迁移能力也明显降低(P<0.05), 提示甘草甜素具有降低BGC-823细胞黏附和迁移能力的功效.
Wnt信号通路参与了调控细胞增殖及凋亡等过程[16], Wnt信号转导途径的失调与多种已知的高发性癌变有关[17-20]. 由细胞外配体Wnt蛋白发起, β-catenin是Wnt的活性调控信号通路的关键成员[21]. 研究[22-24]发现, Wnt信号通路异常激活常通过APC或β-catenin基因突变导致, 进而参与了多种肿瘤的发生发展. Wnt经典信号通路调节由胞质β-链接蛋白的磷酸化/降解引起. 当Wnt通路被激活后, β-catenin不断积聚形成复合物[25], 从而激活其下游基因β-catenin、Bcl-2、c-myc、Fral、CyclinD1、Survivin和基质金属蛋白酶(matrix metalloproteinases, MMPs)等的表达产生变化, 从而引起生物活性的变化[26]. 有报道[27]指出Wnt通路的异常激活, 导致β-catenin表达失常, 导致结肠直肠癌等的发生. 研究[16]认为Wnt通路的异常激活通过调控CyclinD和c-myc基因表达, 导致细胞一直处于不断增殖的状态, 产生突变. 已有学者研究山荷素通过抑制Wnt信号通路中的LRP6, β-catenin进而抑制c-myc和CyclinD1来抑制癌细胞增殖[28]. 前列腺癌、乳腺癌、胰腺癌等中均存在Wnt经典通路[29]. 本实验中免疫印迹法结果表明, 甘草甜素能使BGC-823细胞的Wnt信号通路中β-catenin、Bcl-2、CyclinD1和Survivin的蛋白表达显著低于空白对照组, 提示甘草甜素抑制胃癌细胞增殖的机制可能与Wnt/β-catenin信号通路有关.
总之, 甘草甜素具有抑制BGC-823胃癌细胞增殖的作用, 其机制可能与降低Wnt信号通路中β-catenin等相关蛋白有关, 为甘草甜素用于治疗胃癌的临床应用提供了实验依据, 且甘草的来源广泛, 可大量栽培, 适用于临床上大量使用.
我国是胃癌的高发地区, 与现代社会中的不良饮食规律和生活习惯有关, 每年新增病例占全球42%. 手术治疗胃癌的复发率较高, 而长期使用化学药物联合治疗容易出现耐药性, 在临床治疗中造成了一定的困难. 甘草中的有效成分之一甘草甜素具有抗肿瘤的功效, 本文对甘草甜素对胃癌细胞BGC-823的增殖作用及其初步作用机制进行研究.
杨秋蒙, 副主任医师, 上海交通大学医学院附属瑞金医院
中草药用于治疗肿瘤是近来研究的热点, 甘草来源广泛, 甘草甜素对于肿瘤具有良好的效果, 但其对于胃癌BGC-823细胞增殖作用机制尚不明确, 还需进一步研究.
已有报道甘草甜素具有广泛的抗瘤活性, 能抑制乳腺癌、肝癌、前列腺癌和膀胱癌等细胞的生长, 并对其作用机制进行了研究, 其作用机制与甘草甜素诱导肿瘤细胞凋亡或抑制细胞增殖、侵袭迁移有关.
甘草甜素对胃癌细胞有良好的抑制作用. 因此探讨其作用机制能对临床上胃癌的治疗提供了新的治疗药物, 尤其是对手术后复发以及产生化疗耐药性的患者.
本文用现代分子生物学方法探讨了生物提取物治疗胃癌的作用机制, 视角独特, 具有一定的科学价值, 可能为新药研发提供思路.
编辑: 郭鹏 电编:闫晋利
| 1. | Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-2917. [PubMed] [DOI] |
| 12. | Cherng JM, Tsai KD, Yu YW, Lin JC. Molecular mechanisms underlying chemopreventive activities of glycyrrhizic acid against UVB-radiation-induced carcinogenesis in SKH-1 hairless mouse epidermis. Radiat Res. 2011;176:177-186. [PubMed] |
| 13. | Kim KJ, Choi JS, Kim KW, Jeong JW. The anti-angiogenic activities of glycyrrhizic acid in tumor progression. Phytother Res. 2013;27:841-846. [PubMed] [DOI] |
| 15. | Chang CZ, Wu SC, Kwan AL. Glycyrrhizin Attenuates Proinflammatory Cytokines through a Peroxisome Proliferator-Activated Receptor-γ-Dependent Mechanism and Experimental Vasospasm in a Rat Model. J Vasc Res. 2015;52:12-21. [PubMed] |
| 17. | Lie DC, Colamarino SA, Song HJ, Désiré L, Mira H, Consiglio A, Lein ES, Jessberger S, Lansford H, Dearie AR. Wnt signalling regulates adult hippocampal neurogenesis. Nature. 2005;437:1370-1375. [PubMed] |
| 20. | 刘 宣, 王 炎, 李 丹光, 周 利红, 殷 佩浩, 隋 华, 范 忠泽, 李 琦. 丹参酮IIA对COX-2激活β-catenin信号通路介导的人结肠癌细胞VEGF表达的调控作用. 中华中医药杂志. 2013;28:108-112. |
| 21. | Carre AL, James AW, MacLeod L, Kong W, Kawai K, Longaker MT, Lorenz HP. Interaction of wingless protein (Wnt), transforming growth factor-beta1, and hyaluronan production in fetal and postnatal fibroblasts. Plast Reconstr Surg. 2010;125:74-88. [PubMed] [DOI] |
| 23. | Mosimann C, Hausmann G, Basler K. Parafibromin/Hyrax activates Wnt/Wg target gene transcription by direct association with beta-catenin/Armadillo. Cell. 2006;125:327-341. [PubMed] |
| 24. | Castellone MD, Teramoto H, Williams BO, Druey KM, Gutkind JS. Prostaglandin E2 promotes colon cancer cell growth through a Gs-axin-beta-catenin signaling axis. Science. 2005;310:1504-1510. [PubMed] |
| 25. | Zerlin M, Julius MA, Kitajewski J. Wnt/Frizzled signaling in angiogenesis. Angiogenesis. 2008;11:63-69. [PubMed] [DOI] |
| 26. | Sato M. Upregulation of the Wnt/beta-catenin pathway induced by transforming growth factor-beta in hypertrophic scars and keloids. Acta Derm Venereol. 2006;86:300-307. [PubMed] |
| 28. | Shen W, Zou X, Chen M, Liu P, Shen Y, Huang S, Guo H, Zhang L. Effects of diphyllin as a novel V-ATPase inhibitor on gastric adenocarcinoma. Eur J Pharmacol. 2011;667:330-338. [PubMed] [DOI] |