修回日期: 2015-04-27
接受日期: 2015-05-08
在线出版日期: 2015-06-28
目的: 本研究探讨重组人乳铁蛋白(recombinant human lactoferrin, rhLF)联合三联疗法是否能够提高小鼠胃幽门螺旋杆菌(Helicobacter pylori, H. pylori)根除率, 能否降低小鼠胃黏膜炎症反应, 初步揭示rhLF对H. pylori感染小鼠胃黏膜炎症的作用特点及相关机制.
方法: 192只Babl/c小鼠用H. pylori ATCC43504感染建立胃炎模型, 随机分为A组(标准三联+rhLF)、B组(rhLF)、C组(标准三联)、D组(生理盐水), 小鼠胃黏膜采用特殊银染评定H. pylori定植情况、HE染色镜检炎症积分值, 采用ELISA试剂盒测定胃组织匀浆肿瘤坏死因子(tumor necrosis factor, TNF)-α含量. 并通过RT-PCR方法检测各组药物对H. pylori ATCC43504的主要致病因子空泡毒素蛋白(vacuolating cytotoxin, VacA) mRNA表达水平. 数据均有SPSS17.0软件分析.
结果: 与D组比较, A、B、C组小鼠胃黏膜特殊银染色镜检H. pylori定植率、HE染色镜检胃黏膜炎症积分明显降低(P<0.05); 与B、C组比较, A组小鼠胃黏膜特殊银染色镜检H. pylori定植、HE染色镜检胃黏膜炎症积分明显降低(P<0.05); A、B、C、D组胃组织匀浆中体内TNF-α含量分别为28.64 pg/mL±12.07 pg/mL、300.16 pg/mL±59.10 pg/mL、54.96 pg/mL±15.02 pg/mL、503.25 pg/mL±1.35 pg/mL; rhLF联合三联疗法可降低胃组织匀浆液中TNF-α含量(P<0.01), 与生理盐水组、标准三联组、rhLF组比较差异有统计意义. rhLF联合三联疗法可降低胃组织匀浆液中VacA mRNA表达水平(P<0.01), 与生理盐水组、标准三联组、rhLF组比较差异有统计意义.
结论: RhLF联合三联疗法能够提高H. pylori根除率; 降低胃黏膜炎症反应, 此作用可能与rhLF联合三联疗法能够降低促炎症因子释放有关. rhLF可有效抑制VacA mRNA表达, 提示rhLF具有下调H. pylori毒性的潜在作用.
核心提示: 本研究从空泡毒素蛋白(vacuolating cytotoxin, VacA)入手探讨人乳铁蛋白(recombinant human lactoferrin, rhLF)联合标准三联疗法能否提高幽门螺旋杆菌(Helicobacter pylori, H. pylori)根除率及干预H. pylori所致胃黏膜炎性损伤, 能否通过抑制VacA mRNA表达、肿瘤坏死因子α分泌影响H. pylori定植及对胃黏膜的炎性损伤, 从而为rhLF治疗H. pylori胃炎提供理论依据.
引文著录: 刘雪芳, 成国祥, 袁渝萍, 张爱民, 罗娟, 刘思国, 陈建泉, 董向前, 张磊, 马岚青. 重组人乳铁蛋白对幽门螺旋杆菌胃炎小鼠空泡毒素蛋白A、肿瘤坏死因子α含量的影响. 世界华人消化杂志 2015; 23(18): 2860-2867
Revised: April 27, 2015
Accepted: May 8, 2015
Published online: June 28, 2015
AIM: To explore whether recombinant human lactoferrin (rhLF) plus triple therapy can increase the rate of Helicobacter pylori(H. pylori) eradication, reduce gastric mucosal inflammation, and inhibit vacuolating cytotoxin (VacA) mRNA expression.
METHODS: One hundred and ninety-two H. pylori ATCC43504 infected Babl/c mice with gastritis were randomly divided into four groups: A (rhLF+standard triple therapy), B (rhLF alone), C (standard triple therapy alone), and D (saline). H. pyloricolonization of the gastric mucosa was assessed by silver staining. Gastric mucosal inflammation was assessed by HE staining. Tumor necrosis factor (TNF)-α content was determined by ELISA. VacA mRNA expression was detected by RT-PCR.
RESULTS: Compared with group D, the rate of H. pylori colonization and gastric mucosal inflammation score decreased significantly in groups A, B, and C (P < 0.05). Compared with groups B and C, the rate of H. pylori colonization and gastric mucosal inflammation score decreased significantly in group A (P < 0.05). rhLF plus standard triple therapy significantly decreased gastric TNF-α content (28.64 pg/mL ± 12.07 pg/mL vs 300.16 pg/mL ± 59.1 pg/mL, 54.96 pg/mL ± 15.02 pg/mL, 503.25 pg/mL ± 1.35 pg/mL, P < 0.01) and VacA mRNA expression (P < 0.01) compared with groups B, C and D.
CONCLUSION: rhLF combined with triple therapy can improve H. pylori eradication rate, reduce gastric mucosal inflammation possibly by inhibiting proinflammatory factor release, and effectively inhibit VacA mRNA expression.
- Citation: Liu XF, Cheng GX, Yuan YP, Zhang AM, Luo J, Liu SG, Chen JQ, Dong XQ, Zhang L, Ma LQ. Effect of recombinant human lactoferrin treatment on mRNA expression of vacuolating cytotoxin A and content of tumor necrosis factor-α in gastric tissue of mice with Helicobacter pylori-associated gastritis. Shijie Huaren Xiaohua Zazhi 2015; 23(18): 2860-2867
- URL: https://www.wjgnet.com/1009-3079/full/v23/i18/2860.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i18.2860
根除幽门螺旋杆菌(Helicobacter pylori, H. pylori)依赖于抗生素. 传统的三联疗法[两种抗生素+质子泵抑制剂(proton pump inhibitor, PPI)]在出现H. pylori耐药的情况下不能达到≥80%的根除率, 即使针对H. pylori对克拉霉素高耐药率而使用氟喹诺酮类药物(左氧氟沙星), 并没有因此提高根除率. 而寻找一种能够协同抗生素提高H. pylori根除率的非抗生素类药物或许能为提高H. pylori根除率提供新的思路.
H. pylori的致病性与其分泌的多种毒力因子有关, 包括: 细胞毒素相关蛋白A(cytotoxin-associated gene A, CagA)、尿素酶(urease, Ure)、空泡毒素蛋白(vacuolating cytotoxin, VacA)等. 其中VacA是一种单独作用即可引起靶细胞发生空泡化、凋亡、骨架重排等病理改变, 最终导致宿主细胞死亡的毒性蛋白, 与胃、十二指肠的炎症性疾病密切相关. 选择重组人乳铁蛋白(recombinant human lactoferrin, rhLF)与H. pylori VacA作为研究对象, 在体内实验予以验证rhLF可联合标准三联疗法提高H. pylori根除率及可以抑制VacA的表达.
健康♂Babl/c小鼠, SPF级, 体质量20 g±2 g, 共192只, 由昆明医科大学实验动物中心提供. 饲养于昆明医科大学实验动物中心. 室温控制在20 ℃-22 ℃, 相对湿度为65%-70%, 小鼠在自然光暗周期中饲养, 所用颗粒饲料和垫料均有昆明医科大学试验动物中心提供; rhLF由上海杰隆生物工程公司提供; H. pylori菌株(国际标准菌株ATCC43504, 上海交通大学附属仁济医院消化科陆红教授赠); H. pylori快速尿素酶试验试纸(广州贝思奇诊断试剂有限公司); 电子分析天平、低温离心机、VacA抗体(Santa sc-25790)、Actin(Santa, sc-1615)、Mouse肿瘤坏死因子(tumor necrosis factor, TNF)-α ELISA(欣博盛生物科技有限公司); PrimeScript™ RT reagent Kit with gDNA Eraser(Perfect Real Time)(TAKARA, RR047A), SYBR®Premix Ex Taq™ Ⅱ(Tli RNaseH Plus)(TAKARA, RR820A).
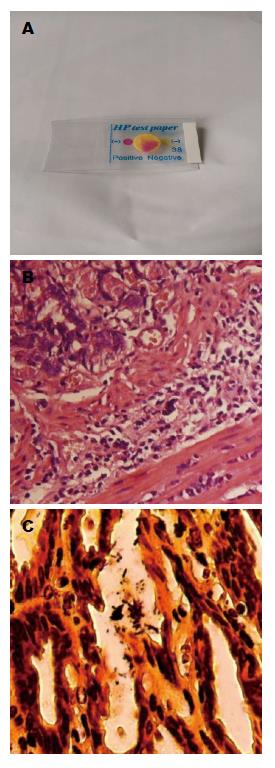
1.2.1 小鼠建模: (1)H. pylori胃炎建模: 氨苄青霉素+庆大霉素+阿奇霉素, 每天给予抗生素混合液0.5 mL/只灌胃, 1次/d, 连续5 d. 第5天, 小鼠禁食24 h, 禁饮4 h, 给予2%NaHCO3 0.2 mL灌胃, 1 h后给予H. pylori(含量109 cfu/mL)新鲜悬菌液1 mL灌胃, 禁食禁水2 h后给予营养液1 mL灌胃, 之后正常饮食. 隔天禁食12 h, 禁水4 h, 后给予2%NaHCO3 0.2 mL灌胃, 1 h后给予H. pylori(含量109 cfu/mL)新鲜悬菌液1 mL灌胃. 禁食禁水2 h, 给予营养液1 mL灌胃, 之后正常饮食. 如此重复4次; (2)造模成功指标: 快速尿素酶试验阳性, 胃黏膜组织HE染色镜检显示胃黏膜上皮细胞脱落并有炎性细胞浸润, 胃黏膜组织特殊银染色镜检显示H. pylori.
1.2.2 胃炎模型小鼠分组给药及标本提取: 所有H. pylori感染胃炎小鼠随机分为4组, 每组48只, A组联合治疗组: 每只小鼠给予阿莫西林(5.07 mg)+克拉霉素(2.54 mg)+奥美拉唑(0.10 mg)+rhLF(11 mg); B组rhLF组: 每只小鼠给予rhLF(11 mg); C组标准三联组: 每只小鼠给予给予阿莫西林(5.07 mg)+克拉霉素(2.54 mg)+奥美拉唑(0.10 mg); D组生理盐水组: 每只小鼠给予生理盐水; 给药2次/d, 连续7 d. 于最后1次灌胃后7 d, 小鼠禁食12 h, 采用颈椎脱臼法处死小鼠, 迅速取完整的胃组织(包括十二指肠、胃窦、胃体等), 用冷生理盐水冲洗胃内残留物; 一半胃黏膜组织用40 g/L甲醛溶液固定行HE染色和银染; 另一半组织装入EP管中, 放入液氮中, 迅速转至-80 ℃冰箱中.
1.2.3 标本处理: (1)胃组织匀浆液的处理: 准确称取组织质量, 按质量体积比加入9倍的生理盐水制成10%的组织匀浆, 2500 r/min, 离心10 min. 取上清液, EP管分装, -80 ℃保存备用待测; (2)石蜡切片制作: 组织在4%多聚甲醛固定24 h以上; 梯度乙醇脱水及二甲苯透明; 浸蜡包埋、自然冷却后修整蜡块置低温保存备用; 切片; 切片厚4-5 μm, 铺片, 60 ℃温箱中烤片.
1.2.4 观察指标: 一位病理学专家对每一张病理切片进行诊断评估. (1)胃黏膜组织HE染色镜检炎症程度评分积分值, 根据参考文献[1]. 从3个方面对胃炎组织损伤进行评分: 炎性细胞浸润: 无(0分), 炎性细胞较少(1分), 炎性细胞较多(2分), 炎性细胞密集(3分); 浸润深度: 炎性细胞局限于黏膜浅层不超过黏膜层1/3(1分), 炎性细胞浸润黏膜下层黏膜全层的2/3(2分), 炎性细胞浸润黏膜全层或肌层(3分); 破损程度: 无(0分), 上皮细胞层(1分), 黏膜固有层(2分), 黏膜肌层(3分); 将3方面分值相加作为炎性损伤总分值进行统计学分析; (2)胃黏膜组织特殊银染色镜检H. pylori定植: 阴性: 染色后组织内无H. pylori; 阳性: 染色后组织内可见胃黏膜表面及小凹内H. pylori; 轻度: 偶见H. pylori; 中度: 散在的H. pylori, 未聚集成簇; 重度: 大量H. pylori, 聚集成簇或片; (3)胃黏膜组织匀浆TNF-α含量测定: 采用酶联免疫法(ELISA)按照试剂盒操作方法进行. 测定前将试剂盒放置室温20 min, 所有试剂使用前轻轻摇匀. 稀释标准品为1000、500、250、125、62.5、31.25、15.6 pg/mL; 空白孔加标准品&标本通用稀释液, 其余各孔中加标准品或者标本(100 μL/孔), 封板, 36 ℃孵箱孵育90 min; 准备生物素化抗体工作液; 洗板5次; 空白孔加生物素化抗体稀释液, 其余孔加生物素化抗体工作液(100 μL/孔), 封板, 36 ℃孵箱孵育60 min; 准备酶结合物工作液; 洗板5次; 空白孔加酶结合物稀释液, 其余孔加酶结合物工作液(100 μL/孔), 封板, 36 ℃孵箱避光孵育30 min; 洗板5次; 加入显色底物100 μL/孔, 36 ℃孵箱, 避光孵育15 min, 加入终止液100 μL/孔, 混匀后即可测量A450值.
1.2.5 RT-PCR实验: 使用TRIzol试剂提取各组胃黏膜总RNA, 测定各样本的A260 nm和A280 nm, 选取A260/280>1.8, RNA采用primeScript TMRT reagent kit with gDNA Eraser试剂盒, 进行反转录反应, 体系及方法具体参照试剂盒说明书进行. 按照SYBR:emoji:Premix Ex Taq™ Ⅱ试剂盒说明, 以cDNA为模板, 16S rRNA为内参, 分析VacA表达水平, VacA引物为: F: 5'-CCAACTTACCCACAAACACC-3', R: 5'-TAGCCAATTCAAACACGCTC-3', 产物长度265 bp, 应用ROCHE lightcycle 480ⅡPCR反应程序, 获得扩增曲线取溶解曲线单峰所得cp值, 根据cp值, 并利用其△cp值进行定量, 得到处理组相对对照组PCR产物的浓度比值.
统计学处理 所有资料进行正态性检验, 符合正态分布的数据mean±SD表示, 多组计量资料采用单因素方差分析(One-way ANOVA), 方差齐者LSD法和SNK法, 方差不齐者Tamhane's T2法: 非正态分布数据用中位数与四分位数间距[M(Q)]表示, 采用秩和检验. 所有数据使用SPSS17.0软件进行处理, P<0.05为差异有统计学意义.
胃黏膜组织快速尿素酶试验阳性, 胃黏膜组织HE染色镜检显示胃黏膜上皮细胞脱落并有炎性细胞浸润, 胃黏膜组织特殊银染色镜检显示有H. pylori(图1).
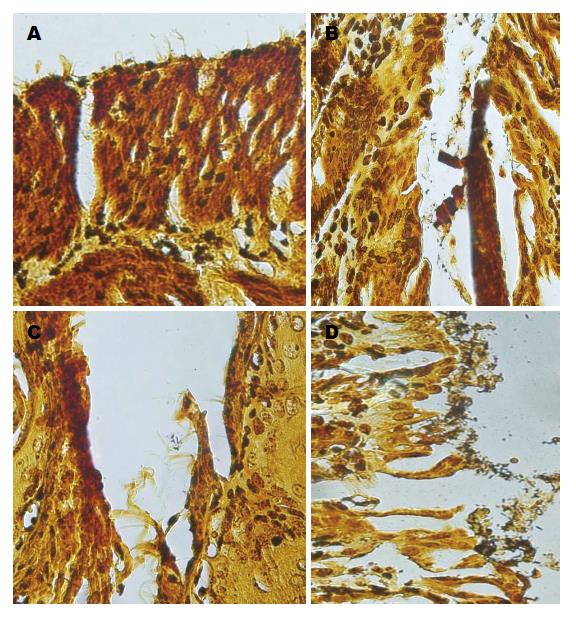
与D组比较, A、B、C 3组H. pylori定植率明显降低(P<0.05). 与B、C组比较, A组H. pylori定植率降低(P<0.05). 与B组比较, C组H. pylori定植率降低(P<0.05), 以上结果显示, rhLF联合标准三联疗法可以提高H. pylori根除率(表1, 图2).
| 定植情况 | 联合治疗 | rhLF | 标准三联疗法 | 生理盐水 |
| 阴性 | 37 | 37 | 20 | 0 |
| 轻度 | 8 | 8 | 8 | 5 |
| 中度 | 3 | 3 | 12 | 13 |
| 重度 | 0 | 0 | 8 | 30 |
| 合计 | 48 | 48 | 48 | 48 |
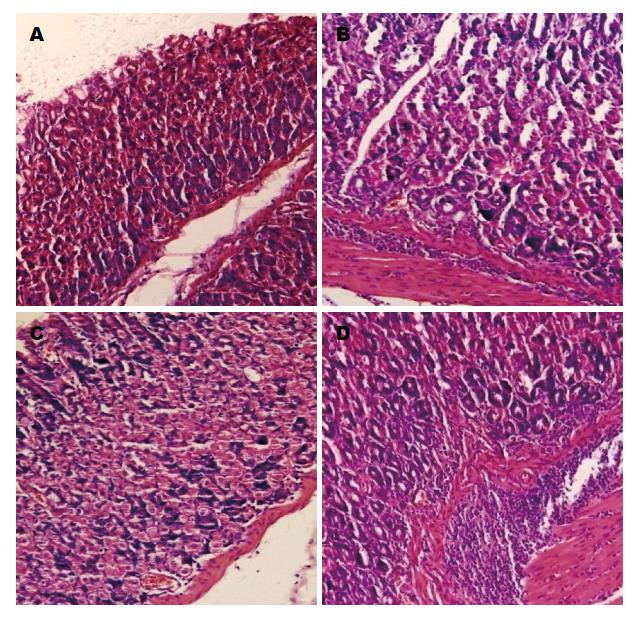
与A、B、C组比较, D组小鼠胃黏膜上皮出现明显的破损、脱落, 黏膜固有层腺体浅层被破坏, 有炎症细胞浸润, 胃黏膜炎症较重: 与B、C组比较, A组胃黏膜上皮细胞破损、脱落较少, 炎性细胞浸润较少. rhLF联合标准三联可以明显减小H. pylori对胃黏膜炎性损伤(图3).
与D组比较, A、B、C 3组炎症程度积分明显降低[6(2) vs 0(0)、4(4)、2(4)](P<0.05); 与B组比较, A、C组炎症积分明显降低(P<0.05); 与C组比较, A组炎症积分明显降低(P<0.05). H. pylori灌胃建立模型, 胃黏膜炎性损伤重; rhLF联合标准三联疗法可以降低小鼠胃黏膜HE染色炎症程度的积分, 减轻胃黏膜炎性损伤程度, 且减轻胃黏膜炎性损伤作用优于单独使用rhLF和标准三联疗法.
D组小鼠胃组织匀浆液TNF-α含量明显高于A、B、C组(503.25±1.35 vs 28.64±12.07、300.16±59.1、54.96±15.02)(P<0.01); A组小鼠胃组织匀浆液中TNF-α含量低于B、C组(P<0.01); B组小鼠胃组织匀浆液中TNF-α高于C组(P<0.01). rhLF联合标准三联疗法可以降低H. pylori感染小鼠胃组织匀浆TNF-α含量, 作用强于单独使用rhLF和标准三联疗法.
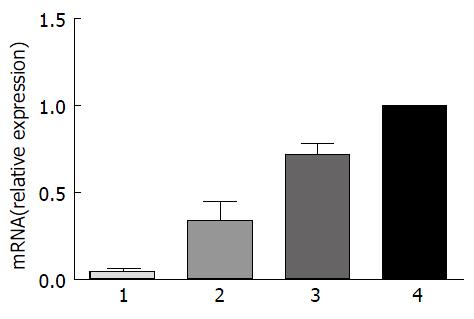
rhLF联合三联疗法可降低胃组织匀浆液中VacA mRNA表达水平(P<0.01), 与B、C、D组相比差异有统计学意义(图4).
目前有多种抗H. pylori的三联或四联方案, 但H. pylori的根除率仍逐年下降, 传统标准三联疗法的根除率已低于或远低于80%[2,3]. 即使标准三联疗法的疗程从7 d延长至10 d或14 d, 根除率仅能提高约5%[4]. 随着根除失败, H. pylori对抗生素的耐药率逐年增加[5], H. pylori对抗生素的耐药已成为根除失败的主要原因[6,7]. 乳铁蛋白(lactoferrin, LF)属转铁蛋白家族成员, 具抗炎症反应、免疫调节和铁离子结合功能, LF被认为是一种天然免疫因子和广谱抗菌剂[8]. 国外有少数研究观察了牛乳铁蛋白(bovine lactoferrin, bLF)抗H. pylori的效果, bLF除了能改善H. pylori感染所致的上消化系症状外, 还能提高三联疗法的根除率[9-11]. 在人乳铁蛋白抗H. pylori的研究方面, Miehlke等[12]的体外实验发现rhLF对13株临床分离H. pylori中的8株具有时间-剂量依赖性抑制作用, 但未进行体内试验. 而我们的研究通过建立H. pylori感染小鼠模型进行关于rhLF的体内试验, 试验表明rhLF联合标准三联疗法对减少H. pylori定植效果优于单独使用标准三联疗法, 而单独使用rhLF对H. pylori的定植也有一定的影响, 同时发现rhLF联合标准三联疗法较单独使用三联疗法对VacA mRNA抑制作用强, 而单独使用rhLF对VacA mRNA抑制作用虽弱于rhLF联合标准三联疗法、标准三联疗法, 但是较未使用任何药物处理的模型组有一定的抑制作用. H. pylori感染胃炎小鼠胃组织时通过毒力作用使黏液层不完整形成特征性的空泡, 破坏胃组织第一道保护屏障. 胃黏膜上皮细胞通过紧密连接和其他细胞间结构形成的经上皮阻力防御H. pylori侵袭[13]. 而H. pylori的主要毒力因子VacA在酸性环境下被激活和顶端插入, 胃上皮细胞的经上皮阻力迅速降低并在几天内维持这种状态[14]. 同样, 胃黏膜上皮细胞旁的通透力增加, 小的有机物及Fe3+、Ni2+等离子增加[15]. 为H. pylori在胃黏膜生长提供必要的营养物质[14,16]. rhLF联合标准三联疗法可能通过较强的抑制H. pylori VacA mRNA表达, 而提高H. pylori根除.
H. pylori感染时嗜中性粒细胞及单核炎性细胞浸润胃黏膜[17-19], 同时H. pylori的蛋白质成分能够牵引并激活嗜中性粒细胞及其他炎性细胞[20]. 而H. pylori相关的炎症主要有辅助性T细胞1亚型(T helper 1 type, TH1)介导, TH1强烈介导TNF-α[21,22]. TNF-α通过上调中性粒细胞及内皮细胞上黏附分子的表达引起中性粒细胞移动, 诱导中性粒细胞黏附和白细胞穿出血管壁. 造成胃黏膜内皮细胞损伤使胃黏膜血流减少, 造成胃黏膜损伤[23]. 有研究[24,25]证明, VacA能上调巨噬细胞(MΦ)分泌TNF-α. MΦ活化后能产生TNF-α等前炎症细胞因子, 增强其吞噬、杀伤等活性, 促进他释放炎性蛋白和炎症介质, 直接参与炎性反应. 加重胃黏膜炎症, H. pylori感染时可以诱导胃上皮细胞增生[26], 使局部细胞因子TNF-α产生增加[27]; 体内外试验中均已证实在H. pylori感染时TNF-α作为一种对增生与凋亡不平衡免疫应答信号, 可以引起胃上皮细胞过度凋亡[28,29]. 另外, H. pylori感染后能激活B淋巴细胞中的细胞核因子-κB(nuclear factor kappa B, NF-κB)[30], NF-κB的激活能诱导其炎症相关因子如TNF-α等的过度表达, 而TNF-α又能激活NF-κB, 导致持续放大的炎症反应. Kim等[31]发现VacA能通过激活NF-κB促进嗜酸性细胞释放趋化因子. 本研究发现rhLF联合标准三联疗法可以明显减轻胃黏膜炎性细胞的浸润, 其作用效果优于单独使用标准三联疗法, 而单独使用rhLF虽效果不如联合治疗组及标准三联疗法组, 但较未经治疗的小鼠胃黏膜炎性细胞浸润明显减少. 证明rhLF可以减轻胃黏膜的炎症程度, 而rhLF联合标准三联疗法可显著减轻胃黏膜炎症程度. 同时我们的研究显示rhLF联合标准三联疗法有效地降低H. pylori感染时胃黏膜TNF-α含量, 其作用效果强于标准三联疗法, 这有可能是rhLF联合标准三联疗法减少TNF-α含量, 减少了TNF-α激活NF-κB, 从而减轻小鼠胃黏膜炎症反应.
总之, 我们的研究证明了rhLF联合标准三联疗法可以有效抑制H. pylori在小鼠胃黏膜的定植, 同时减轻小鼠胃黏膜炎症反应, 但由于小鼠体积小, 标本量少, 我们的试验并未完全阐述rhLF联合标准三联疗法能够提高H. pylori根除率及减轻胃黏膜炎症反应的机制, 对此需进一步展开研究, rhLF在治疗H. pylori感染相关消化系统疾病方面具有一定的临床价值, 值得进一步研究.
国外有少数研究观察了牛乳铁蛋白(bovine lactoferrin, bLF)抗幽门螺旋杆菌(Helicobacter pylori, H. pylori)的效果发现bLF能改善H. pylori感染所致的上消化系症状外, 还能提高三联疗法的根除率, 但针对人乳铁蛋白(recombinant human lactoferrin, rhLF)抗H. pylori的研究方面相关研究少, rhLF是否也具有协同抗生素提高H. pylori根除率有待进一步研究.
王小众, 教授, 福建医科大学附属协和医院消化内科
空泡毒素蛋白(vacuolating cytotoxin, VacA)、肿瘤坏死因子(tumor necrosis factor, TNF)-α与H. pylori定植及感染所致胃黏膜炎性损伤密切相关. 研究报道rhLF对H. pylori有抑制作用. RhlF联合标准三联疗法是否能够提高H. pylori的根除率、保护胃黏膜, 及其作用是否与VacA、TNF-α是否有关, 是本研究的主要目的.
研究发现乳铁蛋白具备特殊的抗菌及抗炎调节免疫的功能, 而重组乳铁蛋白与天然蛋白去N端糖基与铁饱和度不同外, 功能无太大差别. 服用后无任何不良作用, 现已广泛应用于食品、医疗领域.
我们的研究证明rhLF联合标准三联疗法可以有效抑制H. pylori在小鼠胃黏膜的定植, 同时减轻小鼠胃黏膜炎症反应rhLF在治疗H. pylori感染相关消化系疾病方面具有一定的临床价值, 值得进一步研究.
空泡毒素蛋白(VacA): 被认为是H. pylori主要毒力因子之一, 是一种单独作用即可引起靶细胞发生空泡化、凋亡、骨架重排等病理改变, 最终导致宿主细胞死亡的毒性蛋白.
本研究通过H. pylori感染Babl/c小鼠, 建立H. pylori感染胃黏膜炎症模型, 采用rhLF干预, 探讨并证实乳铁蛋白体内抗炎抗H. pylori的作用, 具有潜在的临床价值.
编辑: 韦元涛 电编:闫晋利
| 1. | Nagahata Y, Kawakita N, Azumi Y, Numata N, Yano M, Saitoh Y. Etiological involvement of Helicobacter pylori in "reflux" gastritis after gastrectomy. Am J Gastroenterol. 1996;91:2130-2134. [PubMed] |
| 2. | Zheng Q, Chen WJ, Lu H, Sun QJ, Xiao SD. Comparison of the efficacy of triple versus quadruple therapy on the eradication of Helicobacter pylori and antibiotic resistance. J Dig Dis. 2010;11:313-318. [PubMed] [DOI] |
| 3. | Malfertheiner P, Bazzoli F, Delchier JC, Celiñski K, Giguère M, Rivière M, Mégraud F. Helicobacter pylori eradication with a capsule containing bismuth subcitrate potassium, metronidazole, and tetracycline given with omeprazole versus clarithromycin-based triple therapy: a randomised, open-label, non-inferiority, phase 3 trial. Lancet. 2011;377:905-913. [PubMed] [DOI] |
| 4. | Malfertheiner P, Megraud F, O'Morain CA, Atherton J, Axon AT, Bazzoli F, Gensini GF, Gisbert JP, Graham DY, Rokkas T. Management of Helicobacter pylori infection--the Maastricht IV/ Florence Consensus Report. Gut. 2012;61:646-664. [PubMed] [DOI] |
| 5. | 胡 伏莲. 中国幽门螺杆菌耐药研究现状. 胃肠病学和肝病学杂志. 2008;17:517-518. |
| 6. | Gu Q, Xia HH, Wang JD, Wong WM, Chan AO, Lai KC, Chan CK, Yuen MF, Fung FM, Wong KW. Update on clarithromycin resistance in Helicobacter pylori in Hong Kong and its effect on clarithromycin-based triple therapy. Digestion. 2006;73:101-106. [PubMed] [DOI] |
| 7. | Mégraud F, Lehours P. Helicobacter pylori detection and antimicrobial susceptibility testing. Clin Microbiol Rev. 2007;20:280-322. [PubMed] [DOI] |
| 8. | Jenssen H, Hancock RE. Antimicrobial properties of lactoferrin. Biochimie. 2009;91:19-29. [PubMed] [DOI] |
| 9. | Di Mario F, Aragona G, Bò ND, Ingegnoli A, Cavestro GM, Moussa AM, Iori V, Leandro G, Pilotto A, Franzè A. Use of lactoferrin for Helicobacter pylori eradication. Preliminary results. J Clin Gastroenterol. 2003;36:396-398. [PubMed] [DOI] |
| 10. | Okuda M, Nakazawa T, Yamauchi K, Miyashiro E, Koizumi R, Booka M, Teraguchi S, Tamura Y, Yoshikawa N, Adachi Y. Bovine lactoferrin is effective to suppress Helicobacter pylori colonization in the human stomach: a randomized, double-blind, placebo-controlled study. J Infect Chemother. 2005;11:265-269. [PubMed] [DOI] |
| 11. | Di Mario F, Aragona G, Dal Bó N, Cavallaro L, Marcon V, Olivieri P, Benedetti E, Orzès N, Marin R, Tafner G. Bovine lactoferrin for Helicobacter pylori eradication: an open, randomized, multicentre study. Aliment Pharmacol Ther. 2006;23:1235-1240. [PubMed] [DOI] |
| 12. | Miehlke S, Reddy R, Osato MS, Ward PP, Conneely OM, Graham DY. Direct activity of recombinant human lactoferrin against Helicobacter pylori. J Clin Microbiol. 1996;34:2593-2594. [PubMed] |
| 13. | Kraehenbuhl JP, Neutra MR. Molecular and cellular basis of immune protection of mucosal surfaces. Physiol Rev. 1992;72:853-879. [PubMed] |
| 14. | Papini E, Satin B, Norais N, de Bernard M, Telford JL, Rappuoli R, Montecucco C. Selective increase of the permeability of polarized epithelial cell monolayers by Helicobacter pylori vacuolating toxin. J Clin Invest. 1998;102:813-820. [PubMed] [DOI] |
| 15. | Pelicic V, Reyrat JM, Sartori L, Pagliaccia C, Rappuoli R, Telford JL, Montecucco C, Papini E. Helicobacter pylori VacA cytotoxin associated with the bacteria increases epithelial permeability independently of its vacuolating activity. Microbiology. 1999;145:2043-2050. [PubMed] [DOI] |
| 16. | Montecucco C, Papini E, de Bernard M, Zoratti M. Molecular and cellular activities of Helicobacter pylori pathogenic factors. FEBS Lett. 1999;452:16-21. [PubMed] [DOI] |
| 17. | Fiocca R, Luinetti O, Villani L, Chiaravalli AM, Capella C, Solcia E. Epithelial cytotoxicity, immune responses, and inflammatory components of Helicobacter pylori gastritis. Scand J Gastroenterol. 1994;205 Suppl:11-21. [PubMed] [DOI] |
| 18. | Goodwin CS. Helicobacter pylori gastritis, peptic ulcer, and gastric cancer: clinical and molecular aspects. Clin Infect Dis. 1997;25:1017-1019. [PubMed] [DOI] |
| 19. | Yahiro K, Niidome T, Kimura M, Hatakeyama T, Aoyagi H, Kurazono H, Imagawa Ki, Wada A, Moss J, Hirayama T. Activation of Helicobacter pylori VacA toxin by alkaline or acid conditions increases its binding to a 250-kDa receptor protein-tyrosine phosphatase beta. J Biol Chem. 1999;274:36693-36699. [PubMed] [DOI] |
| 20. | Marchetti M, Aricò B, Burroni D, Figura N, Rappuoli R, Ghiara P. Development of a mouse model of Helicobacter pylori infection that mimics human disease. Science. 1995;267:1655-1658. [PubMed] [DOI] |
| 21. | Mattapallil JJ, Dandekar S, Canfield DR, Solnick JV. A predominant Th1 type of immune response is induced early during acute Helicobacter pylori infection in rhesus macaques. Gastroenterology. 2000;118:307-315. [PubMed] [DOI] |
| 22. | Russo F, Jirillo E, Clemente C, Messa C, Chiloiro M, Riezzo G, Amati L, Caradonna L, Di Leo A. Circulating cytokines and gastrin levels in asymptomatic subjects infected by Helicobacter pylori (H. pylori). Immunopharmacol Immunotoxicol. 2001;23:13-24. [PubMed] [DOI] |
| 23. | Moorchung N, Srivastava AN, Gupta NK, Malaviya AK, Achyut BR, Mittal B. The role of mast cells and eosinophils in chronic gastritis. Clin Exp Med. 2006;6:107-114. [PubMed] [DOI] |
| 24. | 黎 村艳, 张 艳, 余 敏君, 刘 志杰, 于 文. 幽门螺杆菌VacA通过激活NF-kB诱导巨噬细胞分泌及凋亡. 中华微生物学和免疫学杂志. 2009;29:454-459. |
| 26. | Fan XG, Kelleher D, Fan XJ, Xia HX, Keeling PW. Helicobacter pylori increases proliferation of gastric epithelial cells. Gut. 1996;38:19-22. [PubMed] [DOI] |
| 27. | Lindholm C, Quiding-Järbrink M, Lönroth H, Hamlet A, Svennerholm AM. Local cytokine response in Helicobacter pylori-infected subjects. Infect Immun. 1998;66:5964-5971. [PubMed] |
| 28. | Ierardi E, Di Leo A, Barone M, Marangi S, Burattini O, Panarese A, Margiotta M, Francavilla R, Panella C, Francavilla A. Tumor necrosis factor alpha and apoptosis in Helicobacter pylori related progressive gastric damage: a possible mechanism of immune system involvement in epithelial turnover regulation. Immunopharmacol Immunotoxicol. 2003;25:203-211. [PubMed] [DOI] |
| 29. | Kim JM, Kim JS, Jung HC, Song IS, Kim CY. Apoptosis of human gastric epithelial cells via caspase-3 activation in response to Helicobacter pylori infection: possible involvement of neutrophils through tumor necrosis factor alpha and soluble Fas ligands. Scand J Gastroenterol. 2000;35:40-48. [PubMed] [DOI] |
| 30. | Ohmae T, Hirata Y, Maeda S, Shibata W, Yanai A, Ogura K, Yoshida H, Kawabe T, Omata M. Helicobacter pylori activates NF-kappaB via the alternative pathway in B lymphocytes. J Immunol. 2005;175:7162-7169. [PubMed] [DOI] |
| 31. | Kim JM, Kim JS, Lee JY, Kim YJ, Youn HJ, Kim IY, Chee YJ, Oh YK, Kim N, Jung HC. Vacuolating cytotoxin in Helicobacter pylori water-soluble proteins upregulates chemokine expression in human eosinophils via Ca2+ influx, mitochondrial reactive oxygen intermediates, and NF-kappaB activation. Infect Immun. 2007;75:3373-3381. [PubMed] [DOI] |