修回日期: 2015-05-11
接受日期: 2015-05-15
在线出版日期: 2015-06-18
应用转基因动物构建的胃癌模型具有高度特异性和与人类肿瘤相似的特点, 目前胃癌转基因动物模型的研究及应用非常广泛, 已经建立开发了多个模型, 能够自发发生原发胃癌. 转基因胃癌动物模型的广泛应用对胃癌发生发展的机制研究、胃癌的临床诊疗研究有着重要的意义. 为了系统地了解几种常见的转基因胃癌动物模型, 我们分别对不同种类的转基因动物模型进行了归纳, 包括转基因模型构建的分子机制以及胃黏膜病变的病理学特点. 本文就胃癌转基因动物研究应用作一综述.
核心提示: 本文系统地概括了几种广泛应用的转基因胃癌小鼠模型, 详细介绍了每种小鼠模型的构建机制和病理特征, 对转基因小鼠模型进行了较为系统描述.
引文著录: 尤丽丽, 曹东慧, 姜晶, 侯振, 索岳尔, 王世栋, 曹雪源. 原发胃癌转基因小鼠模型的病理特征及应用新进展. 世界华人消化杂志 2015; 23(17): 2754-2760
Revised: May 11, 2015
Accepted: May 15, 2015
Published online: June 18, 2015
Transgenic animal models of gastric cancer have high specificity and similar tumor characteristics to human gastric cancer. Current research and application of transgenic animal models of gastric cancer are wide, and several models have been developed. In transgenic animal models of gastric cancer, primary gastric carcinoma can develop spontaneously. These transgenic animal models have been widely used to study the mechanism of gastric cancer development, and have great significance for clinical diagnosis and treatment of gastric cancer. This paper systematically summarizes several different kinds of transgenic animal models and describes the molecular pathogenic mechanisms and pathological characteristics of gastric mucosal lesions in these models as well as their applications.
- Citation: You LL, Cao DH, Jiang J, Hou Z, Suo YE, Wang SD, Cao XY. Transgenic mouse models of gastric cancer: Pathological characteristic and applications. Shijie Huaren Xiaohua Zazhi 2015; 23(17): 2754-2760
- URL: https://www.wjgnet.com/1009-3079/full/v23/i17/2754.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i17.2754
胃癌(gastric cancer, GC)严重影响人类健康, 2012年世界卫生组织的数据显示, 全球GC死亡人数为70万例, 占恶性肿瘤总死亡人数的8.8%[1]. 因此, 探索GC早期诊疗方法, 降低GC发病率是当务之急. 由于转基因动物形成的肿瘤形态与人类自然发生的肿瘤相似, 且肿瘤只发生在特定组织[2], 所以, 转基因动物在GC研究中有独特优势, 建立相应的转基因动物模型成为GC新研究方法之一.
转基因动物(transgenic animals)是指通过基因工程技术将目的基因导入受精卵或早期胚胎干细胞, 并整合到受体细胞的基因组中, 受体细胞通过各种发育途径形成所有的细胞都包含有目的基因的个体, 并能够将目的基因稳定遗传给后代的一类动物[3]. GC转基因动物模型是将调控GC形成的相关基因转染到动物胚胎中形成胃肿瘤[4]. 目前国内外研究中经常应用的外源基因导入方法有: 显微原核注射法、逆转录病毒感染法、胚胎干细胞介导法、精子载体法、体细胞核移植转基因法、电脉冲介导法、磷酸介导法、细胞融合法和人工酵母染色法等[5-9].
SV40(simian virus 40)是猿猴肾细胞病毒, 具有转化动物细胞和诱发肿瘤的特性[10]. SV40病毒编码两种转化蛋白, 即大T抗原和小t抗原. 大T抗原可以活化宿主细胞核糖体基因, 诱导DNA合成, 修饰蛋白合成起始因子等作用, 在细胞转化中起决定性作用. 小t抗原可以加强细胞转化[11]. SV40小鼠GC模型是应用酚-氯仿从昆明小鼠肝细胞提取基因组DNA为模板, 设计引物扩增H+-K+-ATPase β亚基因启动子片段, 应用聚合酶链式反应(PCR)体外扩增, 将PCR产物回收与PMT18-T载体相连, 并将其克隆至真核表达载体pcDNA3.1(-), 构建pcDNA3.1(-)/HK, 进而与pcDNA3.1(-)/HK相连, 构建完成胃壁细胞特异性表达载体pcDNA3.1(-)/HKSV. 采用显微注射法将3.8 kb的H+-K+-ATPase β/SV40T基因片段注射小鼠受精卵的雄原核中, 并将形态良好的受精卵移植假孕母鼠输卵管中使其生长. 剪取F1子代小鼠尾部提取DNA, 经过PCR电泳鉴定. SV40T抗原仅在F1代转基因阳性鼠胃组织中表达, 而在其他器官组织中均不表达[12-16]. SV40T基因在胃壁细胞中的特异性表达, 可观察到胃壁细胞增生, 胃黏膜发生癌前病变, 癌变等一系列病理性改变. 包括: (1)胃黏膜明显增厚以及胃小凹与胃底腺拉长, 胃底腺中成熟细胞与未成熟细胞比例明显下降; (2)胃黏膜明显增厚; (3)细胞体积缩小, 胞内线粒体数目减少, 以及管泡系统不发达甚至缺如; (4)胃液酸度pH值显著降低; (5)胃黏膜腺上皮增生, 萎缩性胃炎, 局部囊性扩张, 腺体数目减少, 坏死以及炎性渗出等[17-20].
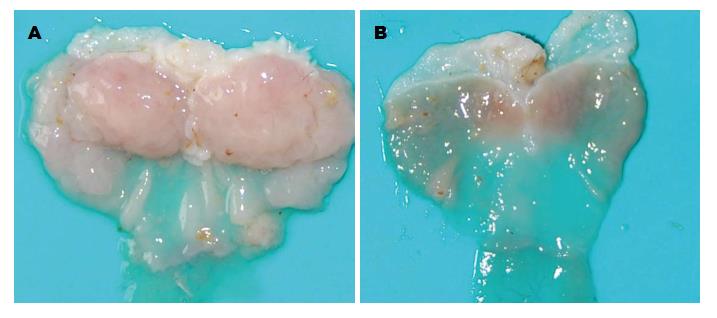
K19-C2mE转基因小鼠的建立是通过对基因组进行PCR将一个2.1 kb的启动子片段细胞角蛋白19(K19)扩增, 同时再将一个1.0 kb SV40聚合A以及一个合成内含子从PCI中提取出来将两者克隆到pBluescript载体. 环氧化酶-2(cyclooxygenase-2, COX-2)和微粒体前列腺素合成酶-1(microsomal prostaglandin E2 synthase-1, mPGES-1)全长cDNA通过反转录聚合酶链式反应(RT-PCR)进行扩增[21-29]. 基因序列被确认后, cDNA片段被分别亚克隆到K19, 成功构建pK19-COX-2和pK19-mPGES. 两个表达的载体通过显微注射方法将目的片段导入C3H与C57BL/6交配所得的F1代受精卵中, 筛选出成功表达目的基因的雌性转基因鼠, 再将转基因小鼠与C57BL/6雄鼠进行杂交. 转基因小鼠成年后, 在胃近端自发出现隆起型肿瘤, 发生率接近100%[21-26]. 吉林大学第一医院临床流行病学研究中心研究并应用了K19-Wnt1/C2mE转基因小鼠, 小鼠解剖后肉眼可观察胃部肿瘤大体形态如图1A, 野生小鼠胃部解剖大体形态如图1B. 产生胃炎和肿瘤的机制主要是通过K19启动子调控胃黏膜条件性过表达COX-2以及mPGES-1. 研究[27-29]显示, 通过抑制COX-2和PGE2的信号表达, 在许多动物模型中可以达到抑制肿瘤发展的目的. 我们将转基因小鼠各40只分别作为实验组和对照组, 对照组进行常规饲养, 实验组则给予含0.1%菜籽多酚(Canolol), 52 wk后发现菜籽多酚显著抑制了胃肿瘤的发生[30]. K19-Wnt1转基因小鼠是将Wnt1相关的cDNA从pUSE-amp-Wnt1中提取出, 这些基因片段被克隆到pBIuescript上构建pK19-Wnt1转基因载体, 表达的载体显微注射导入C3H和C57BL/6杂交的F1代中, 成功存活并表达目的基因的转基因雌性小鼠再与C57BL/6的野生雄性小鼠交配,通过RT-PCR确认Wnt1在胃黏膜上的表达[24,26,28,30-32]. Gan小鼠模型是通过将K19-C2mE与K19-Wnt1转基因小鼠交配建立的动物型, K19-Wnt1/C2mE转基因小鼠黏膜同时表达Wnt1、Ptgs2和Ptges导致小鼠体内的COX-2/PGES2信号通路和Wnt信号通路同时激活构建成了Gan小鼠[30]. Gan小鼠模型的生理特点包括: (1)癌症形态均为腺样结构; (2)同时伴有Ki-67标志指数明显升高, 并且有大量单核细胞浸润; (3)机体促炎因子大量升高.
TFF1是三叶子家族成员之一, 具有胃肠道黏膜保护与修复作用. 主要在胃黏膜腺体细胞质中表达, 核周聚集明显, 文献表明TFF1在癌旁及不典型增生胃黏膜中表达降低[33,34]. TFF1基因敲除小鼠在1 wk时发生胃体和胃幽门部特异性增生, 有1/3的TFF1基因敲除小鼠在20 wk发展为不典型增生性上皮内癌. TFF1基因敲除所致肿瘤有两个表型, 第一个位于胃远端, 其提示TFF1是特殊肿瘤抑制基因; 第二个表型表现在增加淋巴细胞浸润相关的小肠绒毛的长度和促使胃上皮细胞表面的中性糖蛋白丢失, 提示TFF1有调节组织分化的作用. TFF1在癌组织中表达降低, 且表达量与分化程度呈正比, 分化程度越低, 表达越低[35-38].
敲除白介素-6(interleukin-6, IL-6)家族辅助受体gp130上的SHP2/SOCS3结合位点, 构建GP130757F757F基因突变小鼠模型[39]. 将细胞内gp130区域757位置上的酪氨酸残基的两个等位基因置换成苯丙氨酸残基, 在基因水平上剖析基因转导下游两蛋白的独立作用[5,40-43]. GP130757F757F基因敲除突变体小鼠模型主要用于模拟人类肠道发生胃腺癌病理改变. 此类型肿瘤的发生与幽门螺旋杆菌感染、高胃泌素血症和连续的表皮生长因子受体连续性激活都是独立的. 在所建立的该小鼠模型中肿瘤发生的时间以及肿瘤发生的位置具有一致性, 且肿瘤发展迅速, 在基因突变构建培育小鼠4 wk左右即可观察到胃炎引发的胃窦肿瘤, 肿瘤沿着胃小弯快速进展, 小鼠生长到20 wk左右可观察到肿瘤环绕整个胃黏膜[41,43-45].
胃泌素是由胃窦和十二指肠近端黏膜的G细胞及散在于胰腺和胃肠道的某些内分泌细胞产生的多肽激素, 是胃黏膜的重要调节激素, 同时具有能够在转录水平上调节细胞分裂、入侵、血管生成和抗细胞凋亡活性[46-48]. 应用较成熟的胃泌素突变模型主要有3种亚型: (1)胰岛素-胃泌素转基因鼠(insulin-gastrin transgenic mice, INS-GAS): 在胃泌素过量表达的一周岁INS-GAS小鼠模型中, 可以观察到胃黏膜基底增厚以及胃部多灶性增生, 同时这类小鼠会在两周岁的时候发展为胃黏膜萎缩和GC. INS-GAS小鼠模型合并幽门螺旋杆菌感染, 小鼠在生长7 mo时胃部会发生病理性改变, 包括萎缩、肠上皮化生、不典型增生, 最后可发展成胃部腺癌; (2)肌动蛋白-胃泌素转基因鼠(actin-gastrin transgenic mice, Act-Gas): Act-Gas转基因鼠模型是通过利用肌动蛋白启动子调控胃泌素的表达构建的. 转基因后构建的模型能够达到使胃泌素基因在非内分泌细胞中可以完成胃泌素的表达. 与TFF1-/-模型相似, Act-Gas转基因鼠模型培养16 wk时发展为以黏膜肥大为主的胃小凹增生, 同时伴有胃壁细胞萎缩; (3)胃泌素基因敲除小鼠模型(gastrin-knockout mice): 胃泌素基因敲除小鼠表性特点是胃泌素缺乏导致机体胃酸分泌不足, 因此在该小鼠模型胃内, 低胃酸环境给细菌生长提供良好的条件, 使细菌能够在动物模型胃内过度生长, 这种导致细菌过度生长导致的炎症能够通过抗生素治疗得到缓解. 在该动物模型生长到12 mo时会发展成慢性胃炎、胃萎缩、胃部组织化生、不典型增生和胃窦部黏膜内GC[33,49-55].
壁细胞丢失或是壁细胞胃酸合成功能障碍都可能导致胃酸浓度下降继而导致胃腔内细菌繁殖, 引发机体炎症反应, 诱发细胞病理学改变包括GC的发生[56,57]. 因此, 通过修改一系列的基因构成来观察壁细胞胃酸分泌的变化, 以便能够增加我们对于在动物模型中诱发组织化生和癌症的机体机制的进一步理解. 目前应用较为广泛的胃壁细胞突变模型主要有以下3种: (1)H+-K+-ATPase敲除小鼠: H+-K+-ATPase由胃基底部壁细胞分泌, 对于酸化胃内容物有着重要的作用. H+-K+-ATPase敲除小鼠在生长20 mo时病理表现为机体胃部肥大细胞向透明细胞转化、纤毛上皮化生和慢性胃炎, 此表现特别是在雌性小鼠模型中更加明显; (2)Na+/H+离子交换蛋白敲除小鼠模型: Na+/H+离子交换蛋白位于胃上皮细胞基底膜, 特别是在壁细胞膜分布更加广泛, 主要的功能是调节胃酸分泌和维持上皮细胞正常功能. 敲除该蛋白可以导致胃基底萎缩、胃壁细胞坏死、胃酸缺乏、高胃泌素血症和腺体增生; (3)钾通道敲除小鼠模型, 由于在胃壁细胞内具有较高的H+/K+酶活性, 钾离子通道在维持离子平衡中有重要的作用. 该类型小鼠模型基体黏膜形态上类似于H+-K+-ATPase敲除小鼠模型, 该模型也发展为胃酸缺乏、高胃泌素血症、增生[58-65].
转基因GC动物模型是对GC发生机制深入了解的有力工具. 将外源基因导入动物细胞中, 或者对特定基因进行基因敲除, 并最终导致转基因动物产生胃肿瘤, 以达到发病机制研究目的. 其优点是可以分别从动物个体水平和分子水平全方位的探究GC发生发展的机制. 然而, 转基因GC动物模型也存在一些问题, 包括成功率和成活率较低, 外源基因在目的基因中整合率低和效果不稳定, 转基因在宿主基因中难以控制, 对转基因过程中的精细理论及其过程不甚清楚. 另外, 模型动物黏膜所发生的肿瘤多为隆起型病变, 还未能达到完全模拟人GC的各种分型. 随着科学技术的发展, GC转基因动物模型的开发和应用会有长足进步.
胃癌(gastric cancer, GC)是威胁全人类的恶性肿瘤, 因此, GC的机制及诊疗研究是当务之急. GC转基因动物模型能够解决人体试验的伦理学问题, 又能以与人类GC肿瘤发生最大相似度构建GC模型, 且小鼠模型具有饲养方便, 繁殖速度快等优势.
葛海燕, 教授, 同济大学附属第十人民医院普通外科; 陈洪, 副教授, 主任医师, 硕士研究生导师, 医学博士, 东南大学附属中大医院消化科
GC的高恶性特征对医务工作者研发其临床诊疗方法提出更紧迫的要求. 构建小鼠模型模拟人类胃肿瘤发生发展过程, 是肿瘤研究方法学的经典也是热点. 在今后的科研工作中要求研究者能够构建出更加接近人类肿瘤特征的小鼠模型.
Yu等总结了以化学法、幽门螺旋杆菌感染及遗传法诱导产生胃癌模型, 内容较系统、丰富.
本文主要是针对几种广泛应用的转基因小鼠模型进行介绍, 并且对各类转基因鼠的构建机制以及病理特点进行了系统阐述, 相对于就某一类转基因鼠进行介绍的文章更加系统化, 对了解不同种类的转基因鼠增加了对比性.
本文对几类转基因GC小鼠模型进行介绍, 能够使科研工作者系统了解几种广泛应用转基因GC小鼠模型的研究应用情况, 指导科研工作.
转基因动物: 通过基因工程技术, 将目的基因导入动物体内, 目的基因在动物体内能够成功表达, 并且能够将目地基因稳定遗传给后代的一类动物.
该文介绍了相关领域的最新进展情况, 文章结构清晰、语言流畅、综述了近年来裸鼠转基因GC模型的研究状况, 对读者了解相关内容有一定帮助.
编辑: 郭鹏 电编:都珍珍
| 1. | Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-2917. [PubMed] [DOI] |
| 2. | Schwartz M, Meyer B, Wirnitzer B, Hopf C. Standardized processing of MALDI imaging raw data for enhancement of weak analyte signals in mouse models of gastric cancer and Alzheimer's disease. Anal Bioanal Chem. 2015;407:2255-2264. [PubMed] [DOI] |
| 3. | Melief EJ, Cudaback E, Jorstad NL, Sherfield E, Postupna N, Wilson A, Darvas M, Montine KS, Keene CD, Montine TJ. Partial depletion of striatal dopamine enhances penetrance of cognitive deficits in a transgenic mouse model of Alzheimer's disease. J Neurosci Res. 2015;93:1413-1422. [PubMed] [DOI] |
| 4. | Yu S, Yang M, Nam KT. Mouse models of gastric carcinogenesis. J Gastric Cancer. 2014;14:67-86. [PubMed] [DOI] |
| 5. | Rinis N, Küster A, Schmitz-Van de Leur H, Mohr A, Müller-Newen G. Intracellular signaling prevents effective blockade of oncogenic gp130 mutants by neutralizing antibodies. Cell Commun Signal. 2014;12:14. [PubMed] [DOI] |
| 6. | Yan Y, Hsu Y, He X, Lu N, Wei W, Zhang Z, Zhu L. Evidence of cell fusion in carcinogen-induced mice gastric carcinoma. Tumour Biol. 2015;36:5089-5094. [PubMed] [DOI] |
| 7. | Kim MJ, Hong JH, Park ES, Byun JH. Gastric metastasis from primary lung adenocarcinoma mimicking primary gastric cancer. World J Gastrointest Oncol. 2015;7:12-16. [PubMed] [DOI] |
| 8. | Wang X, Shen L. [Current status of the study on hereditary diffuse gastric cancer]. Zhonghua Weichang Waike Zazhi. 2015;18:295-297. [PubMed] |
| 9. | Sun Q, Feng J, Wei XL, Zhang R, Dong SZ, Shen Q, Dong J, Li HD, Hu YH. Generation and characterization of a transgenic mouse model for pancreatic cancer. World J Gastroenterol. 2006;12:2785-2788. [PubMed] |
| 10. | Zheng HC, Noguchi A, Kikuchi K, Ando T, Nakamura T, Takano Y. Gene expression profiling of lens tumors, liver and spleen in α-crystallin/SV40 T antigen transgenic mice treated with Juzen-taiho-to. Mol Med Rep. 2014;9:547-552. [PubMed] [DOI] |
| 11. | Wadhwa L, Bond WS, Perlaky L, Overbeek PA, Hurwitz MY, Chévez-Barrios P, Hurwitz RL. Embryonic retinal tumors in SV40 T-Ag transgenic mice contain CD133+ tumor-initiating cells. Invest Ophthalmol Vis Sci. 2012;53:3454-3462. [PubMed] [DOI] |
| 12. | Shen Q, Sun Q, Wei X, Dong J, Zhang R, Wu P, Jin Y, Feng J, Li H, Hu Y. Generation and characterization of islet cell tumor in pTet-on/pTRE-SV40Tag double-transgenic mice model. J Biosci Bioeng. 2007;104:14-21. [PubMed] [DOI] |
| 13. | Meyer-Losic F, Newman SP, Day JM, Reed MJ, Kasprzyk PG, Purohit A, Foster PA. STX140, but not paclitaxel, inhibits mammary tumour initiation and progression in C3(1)/SV40 T/t-antigen transgenic mice. PLoS One. 2013;8:e80305. [PubMed] [DOI] |
| 14. | Lawrence MD, Blyth BJ, Ormsby RJ, Tilley WD, Sykes PJ. False-positive TUNEL staining observed in SV40 based transgenic murine prostate cancer models. Transgenic Res. 2013;22:1037-1047. [PubMed] [DOI] |
| 15. | Kroy DC, Hebing L, Sander LE, Gassler N, Erschfeld S, Sackett S, Galm O, Trautwein C, Streetz KL. Differential role of gp130-dependent STAT and Ras signalling for haematopoiesis following bone-marrow transplantation. PLoS One. 2012;7:e39728. [PubMed] [DOI] |
| 16. | Kim SH, Kim MO, Lee SR, Kim KS, Lee TH, Lee HT, Ha JH, Kim TY, Ryoo ZY. Characterization of a brain tumor cell line established from transgenic mice expressing the vasopressin SV-40 T antigen. Exp Mol Med. 2006;38:196-202. [PubMed] [DOI] |
| 17. | Kawano M, Morikawa K, Suda T, Ohno N, Matsushita S, Akatsuka T, Handa H, Matsui M. Chimeric SV40 virus-like particles induce specific cytotoxicity and protective immunity against influenza A virus without the need of adjuvants. Virology. 2014;448:159-167. [PubMed] [DOI] |
| 18. | Goodwin EM, Zhong Q, Abendroth CS, Ward-Kavanagh LK, Schell TD, Cooper TK. Anaplastic renal carcinoma expressing SV40 T antigen in a female TRAMP mouse. Comp Med. 2013;63:338-341. [PubMed] |
| 19. | Colvin EK, Weir C, Ikin RJ, Hudson AL. SV40 TAg mouse models of cancer. Semin Cell Dev Biol. 2014;27:61-73. [PubMed] [DOI] |
| 20. | Chen J, Liu X, Jiao H, Peng L, Huo Z, Yang W, Shen Q, Li T, Liu Q. Prognostic and clinical significance of STAT3 and MMP9 in patients with gastric cancer: a meta-analysis of a Chinese cohort. Int J Clin Exp Med. 2015;8:546-557. [PubMed] |
| 21. | Kawai T, Yasuchika K, Ishii T, Katayama H, Yoshitoshi EY, Ogiso S, Kita S, Yasuda K, Fukumitsu K, Mizumoto M. Keratin 19, a Cancer Stem Cell Marker in Human Hepatocellular Carcinoma. Clin Cancer Res. 2015;21:3081-3091. [PubMed] [DOI] |
| 22. | Dudek AM, Martin S, Garg AD, Agostinis P. Immature, Semi-Mature, and Fully Mature Dendritic Cells: Toward a DC-Cancer Cells Interface That Augments Anticancer Immunity. Front Immunol. 2013;4:438. [PubMed] [DOI] |
| 23. | Oshima M, Oshima H, Matsunaga A, Taketo MM. Hyperplastic gastric tumors with spasmolytic polypeptide-expressing metaplasia caused by tumor necrosis factor-alpha-dependent inflammation in cyclooxygenase-2/microsomal prostaglandin E synthase-1 transgenic mice. Cancer Res. 2005;65:9147-9151. [PubMed] [DOI] |
| 24. | Brembeck FH, Moffett J, Wang TC, Rustgi AK. The keratin 19 promoter is potent for cell-specific targeting of genes in transgenic mice. Gastroenterology. 2001;120:1720-1728. [PubMed] |
| 25. | Tamai Y, Ishikawa T, Bösl MR, Mori M, Nozaki M, Baribault H, Oshima RG, Taketo MM. Cytokeratins 8 and 19 in the mouse placental development. J Cell Biol. 2000;151:563-572. [PubMed] |
| 26. | Oshima H, Itadani H, Kotani H, Taketo MM, Oshima M. Induction of prostaglandin E2 pathway promotes gastric hamartoma development with suppression of bone morphogenetic protein signaling. Cancer Res. 2009;69:2729-2733. [PubMed] [DOI] |
| 27. | Oshima H, Oshima M. The role of PGE2-associated inflammatory responses in gastric cancer development. Semin Immunopathol. 2013;35:139-150. [PubMed] [DOI] |
| 28. | Oshima H, Matsunaga A, Fujimura T, Tsukamoto T, Taketo MM, Oshima M. Carcinogenesis in mouse stomach by simultaneous activation of the Wnt signaling and prostaglandin E2 pathway. Gastroenterology. 2006;131:1086-1095. [PubMed] [DOI] |
| 29. | Oshima H, Oshima M. Mouse models of gastric tumors: Wnt activation and PGE2 induction. Pathol Int. 2010;60:599-607. [PubMed] [DOI] |
| 30. | Cao D, Jiang J, Tsukamoto T, Liu R, Ma L, Jia Z, Kong F, Oshima M, Cao X. Canolol inhibits gastric tumors initiation and progression through COX-2/PGE2 pathway in K19-C2mE transgenic mice. PLoS One. 2015;10:e0120938. [PubMed] [DOI] |
| 31. | Kitase Y, Barragan L, Qing H, Kondoh S, Jiang JX, Johnson ML, Bonewald LF. Mechanical induction of PGE2 in osteocytes blocks glucocorticoid-induced apoptosis through both the β-catenin and PKA pathways. J Bone Miner Res. 2010;25:2657-2668. [PubMed] [DOI] |
| 32. | Deng ZB, Zhuang X, Ju S, Xiang X, Mu J, Wang Q, Jiang H, Zhang L, Kronenberg M, Yan J. Intestinal mucus-derived nanoparticle-mediated activation of Wnt/β-catenin signaling plays a role in induction of liver natural killer T cell anergy in mice. Hepatology. 2013;57:1250-1261. [PubMed] [DOI] |
| 33. | Tomita H, Takaishi S, Menheniott TR, Yang X, Shibata W, Jin G, Betz KS, Kawakami K, Minamoto T, Tomasetto C. Inhibition of gastric carcinogenesis by the hormone gastrin is mediated by suppression of TFF1 epigenetic silencing. Gastroenterology. 2011;140:879-891. [PubMed] [DOI] |
| 34. | Soutto M, Chen Z, Saleh MA, Katsha A, Zhu S, Zaika A, Belkhiri A, El-Rifai W. TFF1 activates p53 through down-regulation of miR-504 in gastric cancer. Oncotarget. 2014;5:5663-5673. [PubMed] |
| 35. | Viby NE, Nexø E, Kissow H, Andreassen H, Clementsen P, Thim L, Poulsen SS. Trefoil factors (TFFs) are increased in bronchioalveolar lavage fluid from patients with chronic obstructive lung disease (COPD). Peptides. 2015;63:90-95. [PubMed] [DOI] |
| 36. | Tu S, Chi AL, Lim S, Cui G, Dubeykovskaya Z, Ai W, Fleming JV, Takaishi S, Wang TC. Gastrin regulates the TFF2 promoter through gastrin-responsive cis-acting elements and multiple signaling pathways. Am J Physiol Gastrointest Liver Physiol. 2007;292:G1726-G1737. [PubMed] [DOI] |
| 37. | Shi Y, Chen GB, Huang QW, Chen X, Liu JJ, Xu W, Huang XX, Liu YP, Xiao CX, Wu DC. miR218-5p regulates the proliferation of gastric cancer cells by targeting TFF1 in an Erk1/2-dependent manner. Biochim Biophys Acta. 2015;1852:970-979. [PubMed] [DOI] |
| 38. | Soutto M, Peng D, Katsha A, Chen Z, Piazuelo MB, Washington MK, Belkhiri A, Correa P, El-Rifai W. Activation of β-catenin signalling by TFF1 loss promotes cell proliferation and gastric tumorigenesis. Gut. 2015;64:1028-1039. [PubMed] [DOI] |
| 39. | Hayakawa Y, Fox JG, Gonda T, Worthley DL, Muthupalani S, Wang TC. Mouse models of gastric cancer. Cancers (Basel). 2013;5:92-130. [PubMed] [DOI] |
| 40. | Poussin K, Pilati C, Couchy G, Calderaro J, Bioulac-Sage P, Bacq Y, Paradis V, Leteurtre E, Sturm N, Ramos J. Biochemical and functional analyses of gp130 mutants unveil JAK1 as a novel therapeutic target in human inflammatory hepatocellular adenoma. Oncoimmunology. 2013;2:e27090. [PubMed] [DOI] |
| 41. | Ernst M, Thiem S, Nguyen PM, Eissmann M, Putoczki TL. Epithelial gp130/Stat3 functions: an intestinal signaling node in health and disease. Semin Immunol. 2014;26:29-37. [PubMed] [DOI] |
| 42. | Padró M, Mejías-Luque R, Cobler L, Garrido M, Pérez-Garay M, Puig S, Peracaula R, de Bolós C. Regulation of glycosyltransferases and Lewis antigens expression by IL-1β and IL-6 in human gastric cancer cells. Glycoconj J. 2011;28:99-110. [PubMed] [DOI] |
| 43. | Lee IO, Kim JH, Choi YJ, Pillinger MH, Kim SY, Blaser MJ, Lee YC. Helicobacter pylori CagA phosphorylation status determines the gp130-activated SHP2/ERK and JAK/STAT signal transduction pathways in gastric epithelial cells. J Biol Chem. 2010;285:16042-16050. [PubMed] [DOI] |
| 44. | Krueger S, Roessner A, Kuester D. Murine models of H. pylori-induced gastritis and gastric adenocarcinoma. Pathol Res Pract. 2011;207:599-607. [PubMed] [DOI] |
| 45. | Giraud AS, Menheniott TR, Judd LM. Targeting STAT3 in gastric cancer. Expert Opin Ther Targets. 2012;16:889-901. [PubMed] [DOI] |
| 46. | Terry NA, Walp ER, Lee RA, Kaestner KH, May CL. Impaired enteroendocrine development in intestinal-specific Islet1 mouse mutants causes impaired glucose homeostasis. Am J Physiol Gastrointest Liver Physiol. 2014;307:G979-G991. [PubMed] [DOI] |
| 47. | Solorzano C, Villafuerte D, Meda K, Cevikbas F, Bráz J, Sharif-Naeini R, Juarez-Salinas D, Llewellyn-Smith IJ, Guan Z, Basbaum AI. Primary afferent and spinal cord expression of gastrin-releasing peptide: message, protein, and antibody concerns. J Neurosci. 2015;35:648-657. [PubMed] [DOI] |
| 48. | Feng R, Aihara E, Kenny S, Yang L, Li J, Varro A, Montrose MH, Shroyer NF, Wang TC, Shivdasani RA. Indian Hedgehog mediates gastrin-induced proliferation in stomach of adult mice. Gastroenterology. 2014;147:655-666.e9. [PubMed] [DOI] |
| 49. | Walker AK, Park WM, Chuang JC, Perello M, Sakata I, Osborne-Lawrence S, Zigman JM. Characterization of gastric and neuronal histaminergic populations using a transgenic mouse model. PLoS One. 2013;8:e60276. [PubMed] [DOI] |
| 50. | Kupari J, Rossi J, Herzig KH, Airaksinen MS. Lack of cholinergic innervation in gastric mucosa does not affect gastrin secretion or basal acid output in neurturin receptor GFRα2 deficient mice. J Physiol. 2013;591:2175-2188. [PubMed] [DOI] |
| 51. | Cayrol C, Bertrand C, Kowalski-Chauvel A, Daulhac L, Cohen-Jonathan-Moyal E, Ferrand A, Seva C. αv integrin: a new gastrin target in human pancreatic cancer cells. World J Gastroenterol. 2011;17:4488-4495. [PubMed] [DOI] |
| 52. | Ferrand A, Lachal S, Bramante G, Kovac S, Shulkes A, Baldwin GS. Stimulation of proliferation in the colorectal mucosa by gastrin precursors is blocked by desferrioxamine. Am J Physiol Gastrointest Liver Physiol. 2010;299:G220-G227. [PubMed] [DOI] |
| 53. | Drouyer E, LeSauter J, Hernandez AL, Silver R. Specializations of gastrin-releasing peptide cells of the mouse suprachiasmatic nucleus. J Comp Neurol. 2010;518:1249-1263. [PubMed] [DOI] |
| 54. | Takaishi S, Tu S, Dubeykovskaya ZA, Whary MT, Muthupalani S, Rickman BH, Rogers AB, Lertkowit N, Varro A, Fox JG. Gastrin is an essential cofactor for helicobacter-associated gastric corpus carcinogenesis in C57BL/6 mice. Am J Pathol. 2009;175:365-375. [PubMed] [DOI] |
| 55. | Sakamoto H, Saito K, Marie-Luce C, Raskin K, Oti T, Satoh K, Tamura K, Sakamoto T, Mhaouty-Kodja S. Androgen regulates development of the sexually dimorphic gastrin-releasing peptide neuron system in the lumbar spinal cord: evidence from a mouse line lacking androgen receptor in the nervous system. Neurosci Lett. 2014;558:109-114. [PubMed] [DOI] |
| 56. | Arapis K, Cavin JB, Gillard L, Cluzeaud F, Lettéron P, Ducroc R, Le Beyec J, Hourseau M, Couvelard A, Marmuse JP. Remodeling of the residual gastric mucosa after roux-en-y gastric bypass or vertical sleeve gastrectomy in diet-induced obese rats. PLoS One. 2015;10:e0121414. [PubMed] [DOI] |
| 57. | Petersen CP, Weis VG, Nam KT, Sousa JF, Fingleton B, Goldenring JR. Macrophages promote progression of spasmolytic polypeptide-expressing metaplasia after acute loss of parietal cells. Gastroenterology. 2014;146:1727-1738.e8. [PubMed] [DOI] |
| 58. | Yamamura H, Cole WC, Kita S, Hotta S, Murata H, Suzuki Y, Ohya S, Iwamoto T, Imaizumi Y. Overactive bladder mediated by accelerated Ca2+ influx mode of Na+/Ca2+ exchanger in smooth muscle. Am J Physiol Cell Physiol. 2013;305:C299-C308. [PubMed] [DOI] |
| 59. | Schultheis PJ, Clarke LL, Meneton P, Harline M, Boivin GP, Stemmermann G, Duffy JJ, Doetschman T, Miller ML, Shull GE. Targeted disruption of the murine Na+/H+ exchanger isoform 2 gene causes reduced viability of gastric parietal cells and loss of net acid secretion. J Clin Invest. 1998;101:1243-1253. [PubMed] [DOI] |
| 60. | Nguyen N, Kozer-Gorevich N, Gliddon BL, Smolka AJ, Clayton AH, Gleeson PA, van Driel IR. Independent trafficking of the KCNQ1 K+ channel and H+-K+-ATPase in gastric parietal cells from mice. Am J Physiol Gastrointest Liver Physiol. 2013;304:G157-G166. [PubMed] [DOI] |
| 61. | Rotte A, Pasham V, Mack AF, Bhandaru M, Qadri SM, Eichenmüller M, Ruth P, Lang F. Ca2+ activated K+ channel Kca3.1 as a determinant of gastric acid secretion. Cell Physiol Biochem. 2011;27:597-604. [PubMed] [DOI] |
| 62. | Chandra M, Zhou H, Li Q, Muallem S, Hofmann SL, Soyombo AA. A role for the Ca2+ channel TRPML1 in gastric acid secretion, based on analysis of knockout mice. Gastroenterology. 2011;140:857-867. [PubMed] [DOI] |
| 63. | Karam SM. Mouse models demonstrating the role of stem/progenitor cells in gastric carcinogenesis. Front Biosci (Landmark Ed). 2010;15:595-603. [PubMed] |
| 64. | Zavros Y, Waghray M, Tessier A, Bai L, Todisco A, L Gumucio D, Samuelson LC, Dlugosz A, Merchant JL. Reduced pepsin A processing of sonic hedgehog in parietal cells precedes gastric atrophy and transformation. J Biol Chem. 2007;282:33265-33274. [PubMed] [DOI] |
| 65. | Syu LJ, El-Zaatari M, Eaton KA, Liu Z, Tetarbe M, Keeley TM, Pero J, Ferris J, Wilbert D, Kaatz A. Transgenic expression of interferon-γ in mouse stomach leads to inflammation, metaplasia, and dysplasia. Am J Pathol. 2012;181:2114-2125. [PubMed] [DOI] |