修回日期: 2015-04-17
接受日期: 2015-04-24
在线出版日期: 2015-06-18
目的: 探讨腹腔感染早期, 调控腹膜淋巴孔对内毒素肺损伤的影响.
方法: 将54只Wister大鼠随机分为3组: 对照组(n = 18), 开腹后翻动盲肠注射生理盐水; 试验组(n = 18), 开腹后行盲肠结扎穿孔手术(cecum ligation perforation, CLP); 干预组(n = 18), CLP手术术前1.0 h及术后(0.5、2.0 h)腹腔注射氯沙坦钾溶液. 检测3组大鼠腹膜淋巴孔孔径大小和分布密度、淋巴浆内毒素浓度, 肺组织核因子-κB(nuclear factor κB, NF-κB) P65免疫组织化学平均光密度值、Caspase3酶相对活性.
结果: (1)试验组随时间延长, 腹膜淋巴孔孔径、分布密度及淋巴浆内毒素浓度逐渐增加(P<0.05); 干预组淋巴孔和内毒素指标: 术后2.0 h高于术后0.5 h(P<0.05)、术后高于术前(P<0.05); (2)干预组肺组织NF-κB P65及Caspase3的水平: 术前低于术后(P<0.05), 术后2.0 h高于术后0.5 h(P<0.05).
结论: (1)腹腔感染早期, 血管紧张素Ⅱ受体抑制剂可以调控腹膜淋巴孔, 减轻内毒素导致的肺损伤; (2)干预时间越早, 肺损伤程度越轻.
核心提示: 腹膜淋巴孔作为腹膜腔淋巴回流系统的一部分, 在腹腔感染早期内毒素肺损伤中扮演重要角色. 而血管紧张素Ⅱ受体抑制剂可减小腹膜淋巴孔孔径和分布密度, 减轻内毒素所致的肺损伤.
引文著录: 刘洪恩, 王海龙, 蒋志伟, 朱永强, 王科, 张高峰, 汤礼军, 汪涛. 调控腹膜淋巴孔在大鼠腹腔感染早期对内毒素肺损伤的影响. 世界华人消化杂志 2015; 23(17): 2707-2713
Revised: April 17, 2015
Accepted: April 24, 2015
Published online: June 18, 2015
AIM: To investigate the effect of regulation of peritoneal lymphatic stomata on endotoxin induced lung injury in early abdominal infection.
METHODS: Fifty-four Wister rats were randomly divided into three groups: a control group (n = 18) to receive sham operation and intraperitoneal injection of saline solution, an experimental group (n = 18) to receive intraperitoneal ligation perforation (CLP) and cecum injection of saline solution, and an intervention group (n = 18) to receive CLP and intraperitoneal injection of losartan potassium 1.0 h before and 0.5 and 2.0 h after surgery. The aperture size and density of peritoneal lymphatic stomata, lymph endotoxin concentration, immunohistochemical average optical density of nuclear factor κB (NF-κB) P65 in lung tissue, and relative Caspase3 protease activity in lung tissue were measured and compared for the three groups.
RESULTS: As time went by, peritoneal lymphatic stomata aperture and density and lymph endotoxin concentration gradually increased in the experimental group (P < 0.05). In the intervention group, lymphatic stomata and endotoxin indexes were significantly higher after operation than before operation, and at 2.0 h after operation than at 0.5 h (P < 0.05). NF-κB P65 expression and Caspase3 activity in lung tissue were also significantly higher after operation than before operation, and at 2.0 h after operation than at 0.5 h (P < 0.05).
CONCLUSION: In early abdominal infection, angiotensin Ⅱ receptor (AngⅡ-R) inhibitor can regulate the peritoneal lymphatic stomata and reduce lung injury caused by endotoxin. Earlier intervention is associated with milder lung injury. s
- Citation: Liu HE, Wang HL, Jiang ZW, Zhu YQ, Wang K, Zhang GF, Tang LJ, Wang T. Effect of regulation of peritoneal lymphatic stomata on endotoxin induced lung injury in rats with early abdominal infection. Shijie Huaren Xiaohua Zazhi 2015; 23(17): 2707-2713
- URL: https://www.wjgnet.com/1009-3079/full/v23/i17/2707.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i17.2707
腹腔感染, 内毒素作为其重要的致病物质, 肺部往往是重要受损的靶器官之一[1]. 最近的研究[2]发现淋巴回流途径在腹腔感染中扮演者重要的作用. 李继承等[3]认为, 腹膜淋巴孔、膜膜下小管、淋巴引流单位(lymphatic drainage unit, LDU)、淋巴陷窝形成了一个从腹膜腔到淋巴管的快速直捷通道, 即腹膜腔淋巴引流系统(lymphatic drainage system in the peritoneal cavity). 腹膜腔的物质吸收路径为: 从腹膜淋巴孔吸收, 经腹膜下小管和LDU调控, 进入淋巴陷窝, 再经中心腱和肌性部的淋巴管网回流到脉管系统[4]. 而血管紧张素Ⅱ受体(angiotensin Ⅱ receptor, AngⅡ-R)抑制剂氯沙坦可使腹膜淋巴孔孔径减小, 开放数目减少[5]. 在内毒素肺损伤时, 核因子-κB(nuclear factor κB, NF-κB) P65蛋白表达水平显著增高[6], 而Caspase3又是细胞凋亡中一个重要的中心蛋白酶[7]. 因此, 本研究通过药物对腹膜淋巴孔进行调控, 观察内毒素的转运及肺损伤的情况, 从而解决腹腔感染早期导致的肺损伤新的治疗方案问题.
成年健康清洁级♂Wister大鼠54只, 体质量280 g(280 g±20 g), 购自成都达硕实验动物研究所. 将大鼠54只随机分为3组: 对照组(n = 18)、试验组(n = 18)及干预组(n = 18). 适应性饲养1 wk, 实验前12 h禁食, 自由饮水. 前两组分别在时相点1.0、2.5、4.0 h取材, 干预组在腹腔注射氯沙坦钾后2.0 h取材. 其中, 干预组时相点(术前1.0 h、术后0.5 h、术后2.0 h)分别与对照组、试验组(1.0 h、2.5 h、4.0 h)相对应. 显色基质鲎试剂试剂盒购自厦门市鲎试剂实验厂有限公司; NF-κB P65一抗购自武汉博士德生物工程有限公司; 羊抗兔Ⅱ抗HRP购自北京中杉生物技术公司; 凋亡蛋白酶Caspase3活性检测试剂盒购自碧云天生物技术公司.
1.2.1 模型制备和处理: 试验组: 选用经典的盲肠结扎穿孔实验(cecum ligation perforation, CLP)造腹腔感染模型[8], 常规麻醉、固定、消毒、腹正中约2-3 cm开腹, 找到盲肠部位, 以3-0号丝线结扎盲肠远端部位, 结扎2/3宽度, 并用18号针头穿刺肠壁2次, 挤出适量肠内容物, 将肠内容物及盲肠按原位放回腹腔, 逐层关腹, 分别缝合结扎. 对照组: 仅开腹, 于盲肠下边穿人3-0号丝线, 注射适量生理盐水, 然后逐层关腹. 干预组: 应用氯沙坦钾片(由默沙东公司提供)溶于0.9%氯化钠溶液后63 mg/kg腹腔内注射; 术前干预组: 注射氯沙坦溶液后1 h行CLP手术. 术后0.5、2.0 h干预组: 分别在CLP手术后0.5、2.0 h注射氯沙坦溶液.
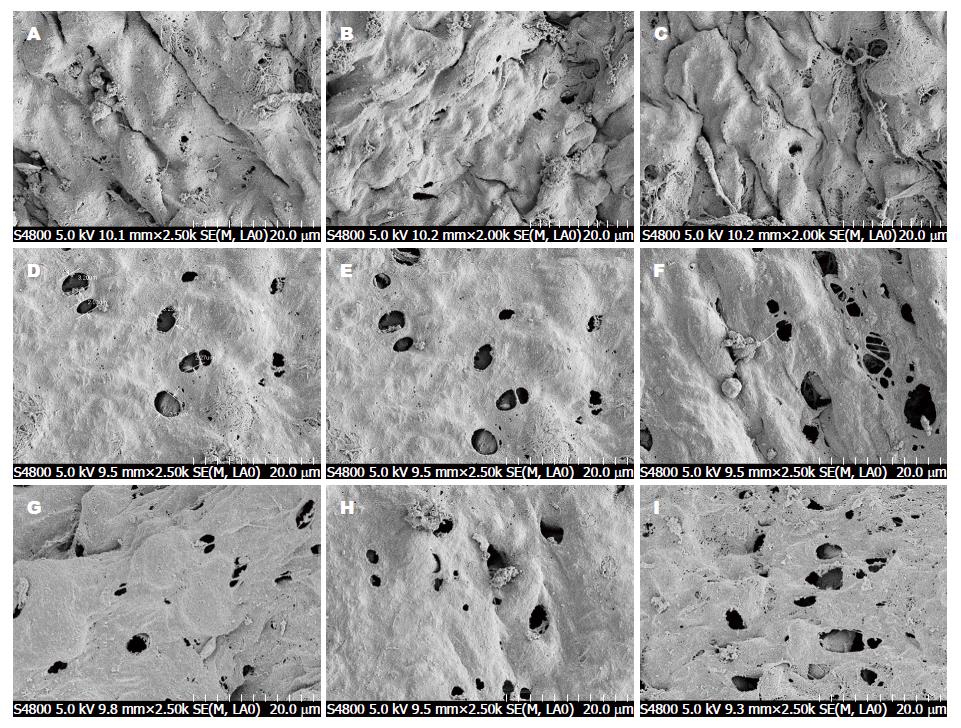
1.2.2 标本采集及检测: 腹膜淋巴孔孔径和密度: 扫描电镜制样膈腹膜以2.5%戊二醛和l%锇酸双固定, 2%单宁酸液导电处理, 梯度乙醇脱水, 醋酸异戊酯置换. HCP-2型C02临界点干燥仪处理, E-1020型离子溅射仪喷金. CAMBRIDGE Stereoscan260型扫描电镜观察腹膜淋巴孔, 加速电压20 kV. 每组随机摄取10个视野, 以Elescope计算机图像处理软件对视野内的腹膜淋巴孔孔径和分布密度进行计算[5].
胸导管淋巴液: 正中切口开腹后在显微外科镜下, 于腹主动脉左后方找到淡乳白色的乳糜池及胸导管, 插人留置针, 收集0.5 mL淋巴液, 3000 r/min 4 ℃低温离心2 min, 取上清液冻存于-20 ℃. 应用显色基质鲎试剂试剂盒微板法检测内毒素浓度.
取右肺下叶、中叶迅速放液氮中冻存, 冻存于-70 ℃. 应用Caspase3活性试剂盒检测酶相对活性.
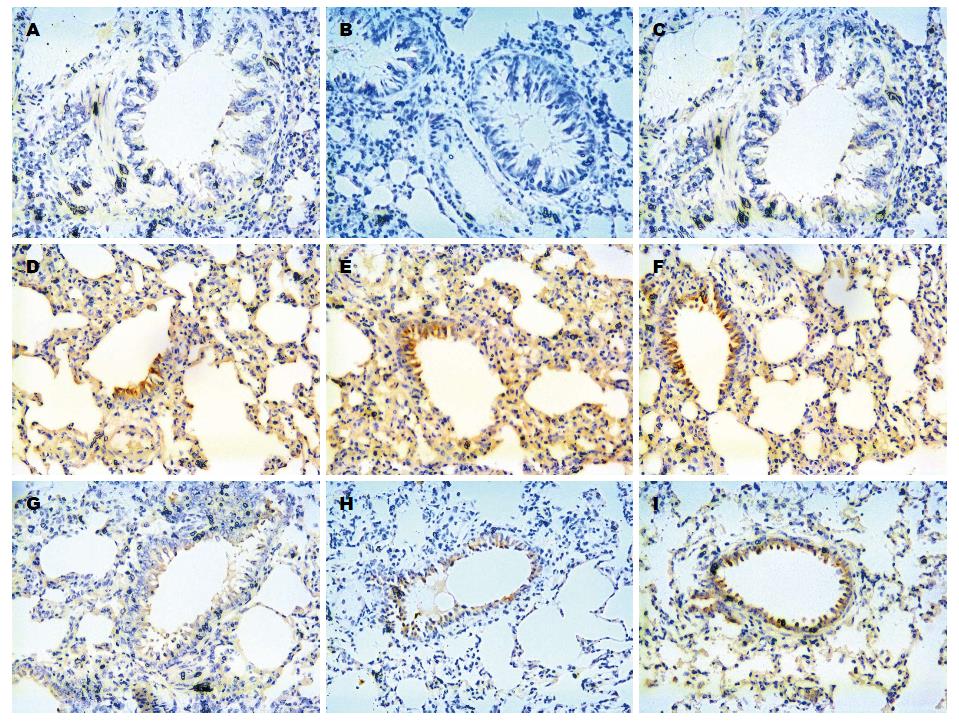
取左肺下叶用40 g/L甲醛溶液固定, 石蜡包埋, 5 μm厚度连续切片, 应用免疫组织化学SABC法, 在光镜下观察肺组织NF-κB P65的病理改变. 通过Image pus6.0分析其病理灰度值.
统计学处理 计量数据以mean±SD表示. 应用SPSS13.0统计软件单因素方差分析(One-way ANOVA)检验各组间差异. P<0.05为差异有统计学意义.
试验组随时间的延长、腹膜淋巴孔的孔径及分布密度逐渐增加(P<0.05), 明显高于对照组(P<0.01); 干预组腹膜淋巴孔的指标均低于试验组(P<0.05)(表1, 表2), 且术前干预组淋巴孔的孔径及分布密度比术后(0.5、2.0 h)减小(P<0.05), 术后2.0 h干预组高于术后0.5 h的水平(P<0.05)(图1).
干预组: 术前干预组淋巴液内毒素的浓度低于术后干预组(P<0.05), 而术后0.5 h干预组低于术后2.0 h的水平(P<0.05); 但干预组均高于对应时相点对照组的水平(P<0.05)、而低于试验组(P<0.05)(表3).
术前干预组肺组织NF-κB P65的平均光密度值及凋亡蛋白酶Caspase3的活性低于术后干预组(P<0.05), 而术后2.0 h高于术后0.5 h的水平(P<0.05); 而干预组高于对应时相点对照组的水平(P<0.05)、而低于试验组(P<0.05)(表4, 表5, 图2).
腹腔感染作为腹部外科一种常见疾病, 常常由穿孔性腹膜炎、急性重症胰腺炎(severe acute pancreatitis, SAP)、胆道感染、腹膜内脓肿等基础疾病引起, 而这些疾病又频发败血症和多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS). 这可能是由于肠功能紊乱导致持续性肠道细菌移位和内毒素血症, 诱导全身炎症反应(systemic inflammatory response syndrome, SIRS)过度激活和失控以及远隔器官损伤. 因此, 肠屏障功能的损伤以及内毒素易位可能是MODS的主要原因. 虽然肠道发病起始阶段发挥关键作用, 与疾病的发展、SIRS、MODS及预后相关, 但其机制仍然知之甚少[9-12]. 之前一致认为细菌和内毒素易位通过门静脉途径, 然而这个理论不能很好解释临床上观察到发生MODS的患者肺是最先受累的器官[13]. 另外临床研究[14]也没有观察到门静脉血中出现"易位"细菌或内毒素, 而在淋巴液中却被发现.
最近研究[15,16]表明, 淋巴回流途径参与了SIRS/MODS的发展. Deitch等[17]发现: 在腹腔感染早期, 内毒素和炎性介质等吸收流至胸导管乳糜池, 然后通过胸导管进入全身循环. Baigrie等[18]认为乳糜池淋巴液能快速运输炎症介质和细胞毒性物质. 他们推测在外伤性腹腔感染中, 肠道的反应是产生一系列的炎症介质和细胞因子; 然而运输炎症介质、细胞因子和其他细胞毒性物质进入胸导管和循环系统是由淋巴系统介导而非经典的门静脉系统.
此外, 他们通过给大鼠腹腔注射大肠杆菌制造腹腔感染模型, 发现淋巴浆和支气管肺泡灌洗液(bronchial alveolar lavage fluid, BALF)的内毒素水平明显升高. 而阻断淋巴回流途径和淋巴液引流, BALF中内毒素水平下降明显, 这暗示淋巴途径在腹腔感染中有毒物质的转运中扮演重要作用[19]. 对大鼠腹腔感染肺损伤潜在的机制研究[20-22]中, 我们发现Toll样受体-4(Toll-like receptor-4, TLR-4)、自介素-1受体相关激酶4(interleukin-1 receptor-associated kinase 4, IRAK-4)和NF-κB的水平在肺部增加, 而引流淋巴液可以抑制这些因素的升高[23-25]. 通过给成年小鼠气管内注射脂多糖(lipopolysaccharide, LPS)结果NF-κB p65的活性增加并诱导炎症反应及细胞凋亡[26].
然而, 腹膜淋巴孔从最初在光镜下发现, 到Li等[27]首次报道人的腹膜淋巴孔, 并认为他作为淋巴回流途径的一部分, 有完整的运输通路; 而AngⅡ-R抑制剂可对腹膜淋巴孔调控; 那么调控腹膜淋巴孔或许能减少内毒素的淋巴转运途径引起的肺损伤.
本实验研究发现在腹腔感染早期, 随着时相点的延长, 腹膜淋巴孔的孔径和密度逐渐增大, 内毒素的转运也增加, 肺损伤相关指标也不同程度的受损; 而通过药物氯沙坦钾的干预, 可以观察到腹膜淋巴孔的孔径大小和分布密度明显减小, 腹膜淋巴途径中内毒素的浓度也明显下降, 肺损伤的相关指标的严重程度也较试验组对应时相点减轻; 此外, 干预组干预的时间越早, 肺损伤程度越轻. 这样可能为临床上治疗腹腔感染导致的肺损伤提供新的药物靶向治疗的理念.
腹腔感染的治疗理念目前不再单单局限于外科手术的治疗范畴; 在腹腔感染早期, 或许我们可以通过药物的干预, 抑制内毒素在淋巴回流途径的转运, 从而减轻内毒素导致的肺损伤及SIRS/MODS; 另外, 随着各种新药的不断涌现, 可能对于腹腔感染的早期治疗提供一个新的台阶. 腹膜淋巴孔淋巴回流途径在机体内作为一个完整的转运通路, 对腹腔内物质有主动吸收功能: Marco等[28]将细菌和印度墨水分别注入小鼠腹腔内, 发现这些物质都通过腹膜淋巴孔, 在肺部、胸导管均发现墨汁, 胸导管的淋巴结中检查出腹腔细菌; Leak等[29]把药物颗粒及细菌注入家兔腹腔, Li[30]用台盼蓝及红细胞分别注入小鼠的腹腔; 发现这些颗粒可以迅速通过腹膜淋巴孔, 被他吸收, 还有学者[31]发现腹腔肿瘤细胞也可以经腹膜淋巴孔转移, 那么这对于未来肿瘤的研究及治疗也可能存在潜在的价值.
总之, 随着该途径及其发病机制的深入研究, 无论对于腹腔感染内毒素的转运, 还是肿瘤的扩散以及其他物质的吸收等都可能有着重要的理论及临床价值.
最近研究发现腹膜淋巴孔作为腹膜腔淋巴回流系统的一部分, 而淋巴途径在腹腔感染内毒素肺损伤中扮演重要角色; 血管紧张素Ⅱ受体(angiotensin Ⅱ receptor, AngⅡ-R)抑制剂可调控腹膜淋巴孔. 那么, 通过药物对腹膜淋巴孔调控, 或许能抑制内毒素的淋巴转运, 进而减轻肺损伤.
康春博, 副主任医师, 北京大学航天临床医院普通外科
淋巴回流途径在腹腔感染肺损伤中有重要作用, 内毒素可经淋巴途径转运导致肺损伤, 而药物对腹膜淋巴孔的干预可减轻肺损伤; 而腹腔肿瘤细胞也可以经腹膜淋巴孔转移, 那么这对于未来肿瘤的研究和治疗也可能存在潜在的价值. 那么其他物质的吸收是否也通过该途径起作用, 值得进一步研究.
腹膜淋巴孔从最初在光镜下发现, 到李继承等首次报道人的腹膜淋巴孔, 并认为他作为淋巴回流途径的一部分, 有完整的运输通路; 李继承后来又报道了AngⅡ-R抑制剂可减小腹膜淋巴孔的孔径和分布密度; 这些文献对淋巴回流系统进行了全面详细的阐述.
有以下两点为本文独具的特点: 一是建模采用经典的盲肠结扎穿孔制造腹腔感染而未采用腹腔注射内毒素, 这样更贴近临床; 二是将腹膜淋巴回流途径内毒素肺损伤及腹膜淋巴孔的调控紧密的联系在一起, 这样对于腹腔感染可有针对性地提出拮抗措施. 同时, 也为腹腔肿瘤的淋巴途径的转移提供新的思路.
本研究表明AngⅡ-R抑制剂可以调控腹膜淋巴孔, 抑制内毒素的淋巴途径转运而减轻肺损伤. 从而为腹腔感染内毒素肺损伤的早期非手术干预提供一个新的治疗阶梯. 同时, 也为腹腔肿瘤其他部位转移及治疗提供重要的理论参考.
腹膜淋巴孔: 由腹膜间皮细胞的胞质突起与相邻的细胞胞质突起连接, 直径为2.12-8.53 µm; 腹膜下小管: 淋巴陷窝内皮细胞的胞质突起和腹膜间皮细胞相互靠拢形成的通道, 他与腹膜淋巴孔和淋巴陷窝相沟通; 淋巴引流单位: 在腹膜淋巴孔和淋巴陷窝之间隔有一薄层的结缔组织, 并与腹膜间皮细胞和淋巴陷窝内皮细胞共同形成; 腹膜腔淋巴引流系统: 腹膜淋巴孔、膜膜下小管、淋巴引流单位、淋巴陷窝形成的一个快速直捷通道.
本研究对"调控腹膜淋巴孔对内毒素肺损伤的影响"的疗效判断和"治疗预后的分析"方面的研究很有必要; 采用前瞻性的研究方法对大鼠进行了相应的治疗与研究, 并提供了科学的、有意义的医疗信息; 具有一定的创新性与开拓性.
编辑: 韦元涛 电编:都珍珍
| 2. | 王 科, 汪 涛. 腹腔感染时淋巴回流作用的研究进展. 中国普外基础与临床杂志. 2014;21:778-781. |
| 4. | Wang ZB, Li M, Li JC. Recent advances in the research of lymphatic stomata. Anat Rec (Hoboken). 2010;293:754-761. [PubMed] [DOI] |
| 5. | 李 慧, 李 继承, 徐 坚. 血管紧张素Ⅱ和氯沙坦对小鼠腹膜淋巴孔的调控作用. 2002;24:467-470. |
| 6. | Matsuda N, Hattori Y, Jesmin S, Gando S. Nuclear factor-kappaB decoy oligodeoxynucleotides prevent acute lung injury in mice with cecal ligation and puncture-induced sepsis. Mol Pharmacol. 2005;67:1018-1025. [PubMed] [DOI] |
| 7. | Lu Q, Harrington EO, Rounds S. Apoptosis and lung injury. Keio J Med. 2005;54:184-189. [PubMed] |
| 8. | Rittirsch D, Huber-Lang MS, Flierl MA, Ward PA. Immunodesign of experimental sepsis by cecal ligation and puncture. Nat Protoc. 2009;4:31-36. [PubMed] [DOI] |
| 9. | Goris RJ. MODS/SIRS: result of an overwhelming inflammatory response? World J Surg. 1996;20:418-421. [PubMed] [DOI] |
| 10. | Deitch EA. Multiple organ failure. Pathophysiology and potential future therapy. Ann Surg. 1992;216:117-134. [PubMed] [DOI] |
| 11. | Bone RC. Immunologic dissonance: a continuing evolution in our understanding of the systemic inflammatory response syndrome (SIRS) and the multiple organ dysfunction syndrome (MODS). Ann Intern Med. 1996;125:680-687. [PubMed] [DOI] |
| 12. | Volman TJ, Goris RJ, van der Meer JW, Hendriks T. Tissue- and time-dependent upregulation of cytokine mRNA in a murine model for the multiple organ dysfunction syndrome. Ann Surg. 2004;240:142-150. [PubMed] [DOI] |
| 13. | Giroir BP. Mediators of septic shock: new approaches for interrupting the endogenous inflammatory cascade. Crit Care Med. 1993;21:780-789. [PubMed] [DOI] |
| 14. | Givner LB, Gray L, O'Shea TM. Antibodies to tumor necrosis factor-alpha: use as adjunctive therapy in established group B streptococcal disease in newborn rats. Pediatr Res. 1995;38:551-554. [PubMed] [DOI] |
| 15. | Schrader J, Rennekamp W, Niebergall U, Schoppet M, Jahr H, Brendel MD, Hörsch D, Hofbauer LC. Cytokine-induced osteoprotegerin expression protects pancreatic beta cells through p38 mitogen-activated protein kinase signalling against cell death. Diabetologia. 2007;50:1243-1247. [PubMed] [DOI] |
| 16. | Martinon F, Tschopp J. Inflammatory caspases and inflammasomes: master switches of inflammation. Cell Death Differ. 2007;14:10-22. [PubMed] [DOI] |
| 17. | Deitch EA. Role of the gut lymphatic system in multiple organ failure. Curr Opin Crit Care. 2001;7:92-98. [PubMed] [DOI] |
| 18. | Baigrie RJ, Lamont PM, Dallman M, Morris PJ. The release of interleukin-1 beta (IL-1) precedes that of interleukin 6 (IL-6) in patients undergoing major surgery. Lymphokine Cytokine Res. 1991;10:253-256. [PubMed] |
| 19. | Zhang Y, Zhang S, Tsui N. Mesenteric lymph duct drainage attenuates acute lung injury in rats with severe intraperitoneal infection. Inflammation. 2015;38:1239-1249. [PubMed] [DOI] |
| 20. | Németh ZH, Csóka B, Wilmanski J, Xu D, Lu Q, Ledent C, Deitch EA, Pacher P, Spolarics Z, Haskó G. Adenosine A2A receptor inactivation increases survival in polymicrobial sepsis. J Immunol. 2006;176:5616-5626. [PubMed] |
| 21. | Csóka B, Németh ZH, Rosenberger P, Eltzschig HK, Spolarics Z, Pacher P, Selmeczy Z, Koscsó B, Himer L, Vizi ES. A2B adenosine receptors protect against sepsis-induced mortality by dampening excessive inflammation. J Immunol. 2010;185:542-550. [PubMed] [DOI] |
| 22. | Csóka B, Németh ZH, Mukhopadhyay P, Spolarics Z, Rajesh M, Federici S, Deitch EA, Bátkai S, Pacher P, Haskó G. CB2 cannabinoid receptors contribute to bacterial invasion and mortality in polymicrobial sepsis. PLoS One. 2009;4:e6409. [PubMed] [DOI] |
| 23. | Akira S, Takeda K, Kaisho T. Toll-like receptors: critical proteins linking innate and acquired immunity. Nat Immunol. 2001;2:675-680. [PubMed] [DOI] |
| 24. | Kaisho T, Akira S. Toll-like receptors and their signaling mechanism in innate immunity. Acta Odontol Scand. 2001;59:124-130. [PubMed] [DOI] |
| 25. | O'Neill LA, Dinarello CA. The IL-1 receptor/toll-like receptor superfamily: crucial receptors for inflammation and host defense. Immunol Today. 2000;21:206-209. [PubMed] [DOI] |
| 26. | Lopez B, Maisonet TM, Londhe VA. Alveolar NF-κB signaling regulates endotoxin-induced lung inflammation. Exp Lung Res. 2015;41:103-114. [PubMed] [DOI] |
| 27. | Li H, Li J. [Advances in the research of the peritoneal lymphatic stomata in human]. Zhongguo Yixue Kexueyuan Xuebao. 2000;22:585-588. [PubMed] |
| 28. | Marco AJ, Domingo M, Ruberte J, Carretero A, Briones V, Dominguez L. Lymphatic drainage of Listeria monocytogenes and Indian ink inoculated in the peritoneal cavity of the mouse. Lab Anim. 1992;26:200-205. [PubMed] [DOI] |
| 29. | Leak LV, Rahil K. Permeability of the diaphragmatic mesothelium: the ultrastructural basis for "stomata". Am J Anat. 1978;151:557-593. [PubMed] |
| 30. | Li J. [Study on the peritoneal stomata and absorptive mechanism of ascites]. Zhongguo Yixue Kexueyuan Xuebao. 1992;14:328-333. [PubMed] |