修回日期: 2015-03-29
接受日期: 2015-04-08
在线出版日期: 2015-05-28
目的: 探讨新疆地区维吾尔族与汉族结直肠癌(colorectal cancer, CRC)临床病理特征及hMLH1和hMSH2蛋白表达差异.
方法: 回顾性分析284例CRC患者(维吾尔族133例, 汉族151例)临床病理资料, 采用免疫组织化学方法对207例(维吾尔族98例, 汉族109例)CRC组织中hMLH1和hMSH2蛋白的表达进行检测.
结果: (1)新疆地区维吾尔族CRC患者与汉族CRC患者在发病年龄、肿瘤大小、病理分型、淋巴结转移、TNM分期间的差异均具有统计学意义(P<0.05); (2)维吾尔族CRC患者中hMLH1蛋白表达缺失率为9.2%(9/98), hMSH2蛋白表达缺失率为3.1%(3/98); (3)hMLH1蛋白在肿瘤最大径>5.0 cm的CRC组织中的缺失率(17.1%)明显高于肿瘤最大径≤5.0 cm的CRC组织(3.5%, P<0.05), 在有淋巴结转移的CRC组织中的缺失率(15.1%)明显高于无淋巴结转移的CRC组织(2.2%, P<0.05); (4)维吾尔族CRC患者中hMSH2蛋白缺失率(3.1%)明显低于汉族CRC患者(10.1%, P<0.05).
结论: 新疆地区维吾尔族CRC患者较汉族患者有发病年龄较轻, 肿瘤直径较大, 黏液腺癌及印戒细胞癌所占比例较高, TNM分期较晚等临床病理特点; 且hMSH2蛋白在维吾尔族与汉族CRC患者中的表达具有种族差异性.
核心提示: 新疆地区维吾尔族结直肠癌(colorectal carcinoma, CRC)患者与汉族患者在发病年龄、肿瘤大小、病理分型、TNM分期等方面存在显著差异, 并且维吾尔族CRC患者中hMSH2蛋白缺失率较汉族CRC患者低. 了解维吾尔族及汉族CRC患者临床病理及遗传背景的差异性, 可以为不同民族CRC患者的早期诊断和个性化治疗, 提供强有力的证据.
引文著录: 肉克彦•库达来提, 岳娜, 梁莉萍, 赵峰. 维吾尔族与汉族大肠癌临床病理特征及hMLH1、hMSH2的表达差异. 世界华人消化杂志 2015; 23(15): 2382-2388
Revised: March 29, 2015
Accepted: April 8, 2015
Published online: May 28, 2015
AIM: To compare the differences in clinicopathological features and expression of hMLH1 and hMSH2 between Uygur and Han patients with colorectal carcinoma.
METHODS: The clinical data for 133 Uygur and 151 Han patients with colorectal carcinoma were analyzed retrospectively. The expression of hMLH1 and hMSH2 proteins was detected in 207 colorectal carcinoma samples, including 98 from Uygur and 109 from Han patients, by immunohistochemical staining.
RESULTS: There were significant differences in onset age, tumor size, pathological differentiation, lymphatic metastasis and tumor stage between the Uygur group and Han group (P < 0.05). In Uygur patients, the loss rate of hMLH1 expression was 9.2% (9/98) in colorectal cancer tissue, and the loss rate of hMSH2 expression was 3.3% (3/98). The loss rate of hMLH1 expression in patients with tumor size > 5 cm was significantly higher than that in patients with tumor size ≤ 5 cm (17.1% vs 3.5%, P < 0.05). The loss rate of hMLH1 expression in patients with lymph node metastasis was 15.1%, significantly higher than that (2.2%) in patients without lymph node metastasis (P < 0.05). The loss rate of hMSH2 in colorectal cancer tissue of Uygur patients (3.1%) was significantly lower than that (10.1%) in Han patients (P < 0.05).
CONCLUSION: There are differences in clinicopathologic features and expression of hMSH2 between Uygur and Han patients with colorectal carcinoma in Xinjiang.
- Citation: Roukeyan•Kudalaiti, Yue N, Liang LP, Zhao F. Clinicopathological features and expression of hMLH1 and hMSH2 in Uygur and Han patients with colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2015; 23(15): 2382-2388
- URL: https://www.wjgnet.com/1009-3079/full/v23/i15/2382.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i15.2382
结直肠癌(colorectal carcinoma, CRC)已成为第三大引起死亡的恶性肿瘤, 在欧美等西方国家发病率较高, 而亚洲、非洲及南美洲发病率较低, 却在逐年上升中[1,2]. 新疆是多民族聚居的地区, 以维吾尔族和汉族为主, 维吾尔族属于高加索人种, 而汉族是属于蒙古人种[3]. 两民族除种族不同外, 在宗教信仰、生活习惯、社会文化、居住地域等各个方面均存在差异. 新疆地区恶性肿瘤分布中, 汉族结肠癌占第7位, 而维吾尔族结肠癌发病率低于汉族[4]. 其原因可能与种族因素有关, 又或者与维吾尔族CRC患者就诊率低有关. 错配修复(mismatch repair, MMR)作为DNA复制后的碱基修复系统, 对维持DNA高保真性起重要作用[5,6]. MMR基因缺陷会引起微卫星不稳定性(microsatellite instability, MSI), 从而导致CRC及其他恶性肿瘤的发生[7,8]. 本研究中, 我们回顾性分析了近十年新疆医科大学附属肿瘤医院收治的133例维吾尔族CRC患者临床病理资料, 并采用免疫组织化学法检测98例维吾尔族CRC组织中hMLH1和hMSH2蛋白的表达, 以探讨维吾尔族CRC临床病理特征及MMR基因在维吾尔族与汉族CRC组织中的表达差异.
收集新疆医科大学附属肿瘤医院自2003-01/2013-12病历完整的维吾尔族CRC患者133例(中位年龄54岁), 回顾性分析维吾尔族CRC的临床和病理特点. 151例(中位年龄66岁)汉族CRC患者作为对照. 剔除术前有放疗及化疗史的病例后, 选取经手术切除治疗的98例维吾尔族CRC患者标本(男性51例, 女性47例, 中位年龄54岁), 用免疫组织化学法对CRC组织中hMLH1和hMSH2蛋白的表达进行检测. 109例汉族CRC患者标本(男性61例, 女性48例, 中位年龄66岁)作为对照. 鼠抗人hMLH1和hMSH2免疫组织化学单克隆抗体为福州迈新生物技术开发有限公司产品. hMLH1抗体(克隆号G168-15)为即用型, hMSH2抗体(克隆号25D12)为浓缩型, 免疫组织化学染色PV6000试剂盒购自北京中杉金桥生物有限公司.
1.2.1 临床病理资料分析: 根据2010版世界卫生组织(World Health Organization, WHO)结肠与直肠肿瘤TNM分期标准对肿瘤进行分期, 从发病年龄、病变部位、肿瘤大小、病理分型、TNM分期等方面对维汉两组病例进行比较分析. CRC的病理类型分为高-中分化腺癌、低分化腺癌、黏液及印戒细胞癌、其他(鳞癌、类癌). 病变部位分为右半结肠(回盲部、升结肠、肝曲、横结肠), 左半结肠(脾曲、降结肠、乙状结肠), 直肠.
1.2.2 免疫组织化学染色: 采用PV6000二步法, 抗原修复采用EDTA抗原修复液(pH 9.0)高压锅热修复, 免疫组织化学染色具体步骤按试剂盒说明书进行. 用已知阳性标本切片做阳性对照, PBS代替一抗做阴性对照.
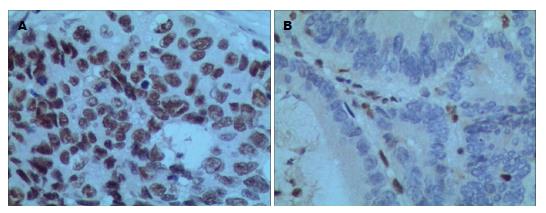
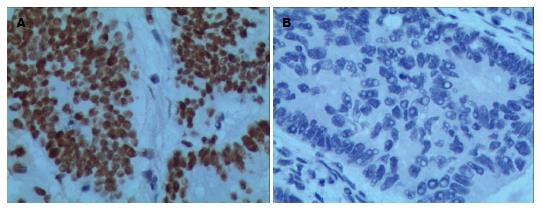
1.2.3 结果判定: hMLH1和hMSH2抗体染色定位于细胞核, 参照Fromowitz等[9]的方法, 从细胞内的染色反应及阳性细胞百分比两方面综合评分. 染色反应: 无着色计0分, 淡黄色计1分, 棕黄色计2分, 棕褐色计3分; 阳性细胞所占百分比: <5%计0分, 5%-25%计1分, 26%-50%计2分, 51%-75%计3分, >75%计4分. 两项评分结果相加<2分定义为阴性表达(-), 2-7分定义为阳性表达(+).
统计学处理 采用SPSS17.0统计学软件进行统计学处理, 组间比较采用χ2检验和秩和检验, 以P<0.05为差异有统计学意义.
新疆地区维吾尔族CRC患者发病年龄≤60岁94例(70.7%), 汉族发病年龄≤60岁60例(39.7%), 维吾尔族CRC患者年龄较汉族患者年轻, 差异有统计学意义(P<0.05); 维吾尔族CRC肿瘤最大径>5 cm 60例(45.1%), 汉族46例(30.5%), 维吾尔族CRC组肿瘤大小较汉族CRC组更大, 二者差异具有统计学意义(P<0.05); 维吾尔族高-中分化腺癌91例(68.4%), 汉族128例(84.8%), 维吾尔族低分化腺癌17例(12.8%), 汉族14例(9.3%), 维吾尔族黏液腺癌及印戒细胞癌23例(17.3%), 汉族9例(6.0%), 维吾尔族其他类型2例(1.5%), 汉族0例(0%), 维吾尔族CRC组中黏液腺癌及印戒细胞癌比率较汉族CRC组高, 差异有统计学意义(P<0.05); 维吾尔族CRC淋巴结有转移为73例(54.9%), 汉族62例(41.1%), 维吾尔族CRC组淋巴结转移率较汉族组高, 差异有统计学意义(P<0.05); 维吾尔族TNM分期Ⅰ期14例(10.5%)、Ⅱ期46例(34.6%)、Ⅲ期65例(48.9%)、Ⅳ期8例(6%), 汉族患者分别为28(18.5%)、61(40.4%)、60(39.7%)、2例(1.3%), 维吾尔族CRC组晚期患者比率较汉族组高, 差异有统计学意义(P<0.05). 维吾尔族CRC组与汉族CRC组在性别、部位方面差异无统计学意义(表1, 2).
| 临床特征 | n | 维吾尔族 | 汉族 | P值 |
| n | 133 | 151 | ||
| 年龄(岁) | 0.000 | |||
| ≤60 | 154 | 94(70.7) | 60(39.7) | |
| >60 | 130 | 39(29.3) | 91(60.3) | |
| 性别 | 0.137 | |||
| 男 | 150 | 64(48.1) | 86(57.0) | |
| 女 | 134 | 69(51.9) | 65(43.0) | |
| 部位 | 0.574 | |||
| 右半结肠 | 27 | 15(11.3) | 12(7.9) | |
| 左半结肠 | 71 | 31(23.3) | 40(26.5) | |
| 直肠 | 186 | 87(65.4) | 99(65.6) |
| 病理特征 | n | 维吾尔族 | 汉族 | P值 |
| n | 133 | 151 | ||
| 大小(cm) | 0.011 | |||
| ≤5 | 178 | 73(54.9) | 105(69.5) | |
| >5 | 106 | 60(45.1) | 46(30.5) | |
| 病理分型 | 0.004 | |||
| 高-中分化 | 219 | 91(68.4) | 128(84.8) | |
| 低分化 | 31 | 17(12.8) | 14(9.3) | |
| 黏液及印戒细胞癌 | 32 | 23(17.3) | 9(6.0) | |
| 其他 | 2 | 2(1.5) | 0(0.0) | |
| 淋巴结转移 | 0.020 | |||
| 有 | 135 | 73(54.9) | 62(41.1) | |
| 无 | 149 | 60(45.1) | 89(58.9) | |
| TNM分期 | 0.024 | |||
| Ⅰ期 | 42 | 14(10.5) | 28(18.5) | |
| Ⅱ期 | 107 | 46(34.6) | 61(40.4) | |
| Ⅲ期 | 125 | 65(48.9) | 60(39.7) | |
| Ⅳ期 | 10 | 8(6.0) | 2(1.3) |
在98例维吾尔族CRC组织中, hMLH1蛋白缺失率为9.2%(图1), hMSH2蛋白缺失率为3.1%(图2). hMLH1蛋白在肿瘤最大径>5.0 cm的CRC组织中的缺失率(17.1%)明显高于肿瘤最大径≤5.0 cm的CRC组织(3.5%, P<0.05), 在有淋巴结转移的CRC组织中的缺失率(15.1%)明显高于无淋巴结转移的CRC组织(2.2%, P<0.05). hMLH1蛋白缺失率在不同年龄、不同性别、不同肿瘤部位、不同分化程度、不同浸润深度的CRC组织中的表达差异无统计学意义. hMSH2蛋白缺失率在各个不同临床病理指标间的差异均无统计学意义(表3).
| 临床病理特征 | n | hMLH1蛋白表达 | P值 | hMSH2蛋白表达 | P值 | ||
| 缺失例数(n) | 缺失率(%) | 缺失例数(n) | 缺失率(%) | ||||
| 年龄(岁) | 0.147 | 0.549 | |||||
| ≤60 | 66 | 4 | 6.1 | 3 | 4.5 | ||
| >60 | 32 | 5 | 15.6 | 0 | 0.0 | ||
| 性别 | 0.734 | 1.000 | |||||
| 男 | 51 | 4 | 7.8 | 2 | 3.9 | ||
| 女 | 47 | 5 | 10.6 | 1 | 2.1 | ||
| 部位 | 0.402 | 0.774 | |||||
| 右半结肠 | 12 | 2 | 16.7 | 0 | 0.0 | ||
| 左半结肠 | 23 | 3 | 13.0 | 1 | 4.3 | ||
| 直肠 | 63 | 4 | 6.3 | 2 | 3.1 | ||
| 肿瘤最大径(cm) | 0.022 | 0.763 | |||||
| ≤5 | 57 | 2 | 3.5 | 2 | 3.5 | ||
| >5 | 41 | 7 | 17.1 | 1 | 2.4 | ||
| 分化程度 | 0.460 | 0.265 | |||||
| 高分化 | 38 | 5 | 13.2 | 1 | 2.6 | ||
| 中分化 | 52 | 3 | 5.8 | 1 | 1.9 | ||
| 低分化 | 8 | 1 | 12.5 | 1 | 12.5 | ||
| TNM分期 | 0.884 | 0.446 | |||||
| Ⅰ期 | 11 | 1 | 9.1 | 1 | 9.1 | ||
| Ⅱ期 | 31 | 3 | 9.7 | 0 | 0.0 | ||
| Ⅲ期 | 50 | 5 | 10.0 | 2 | 4.0 | ||
| Ⅳ期 | 6 | 0 | 0.0 | 0 | 0.0 | ||
| 淋巴结转移 | 0.036 | 0.592 | |||||
| 有 | 45 | 1 | 15.1 | 2 | 4.4 | ||
| 无 | 53 | 8 | 2.2 | 1 | 1.9 | ||
由于肠镜的普及及癌症筛查技术的提高, 欧美等发达国家CRC发病率基本保持稳定甚至有所下降, 但是我国CRC发病率却逐年上升, 已跃居恶性肿瘤第3位[10]. 有相当多的证据表明, 种族差异在肿瘤生物学和遗传学中起到一定的作用, 世界各地不同种族人群社会文化、生活方式、饮食习惯均有所不同, CRC的发病率也各不相同. 一般来说, CRC在欧美白种人中的发病率要高于亚洲国家的黄种人. 在美国, CRC在非裔美国人中的发病率和死亡率均高于美国白种人及其他种族[11]. 新疆是多民族聚居的地区, 其中以维吾尔族和汉族为主, 两民族在种族、社会文化、生活习惯以及居住地域等方面均存在差异. 故我们总结分析了近十年间的维、汉族CRC临床病理资料, 并对其分子遗传背景进行初步检测分析.
自20世纪60-90年代, 我国CRC发病中位年龄由原来的48岁上升至55岁, 且近年来的研究[12]显示, 其发病中位年龄已上升至58岁. 本组资料显示, 新疆地区维吾尔族CRC患者中位发病年龄为54岁, 较汉族患者年轻了近10岁, 且低于国家平均水平, 并以51-60岁患者多见, 而汉族CRC组高发年龄在71-80岁. 其差异原因一方面可能是种族差异导致; 另一方面可能由于维吾尔族饮食结构与汉族有着显著的不同, 维吾尔族人喜食肉食, 以牛羊肉为主, 且新鲜蔬菜及水果摄入量也较汉族少. 有调查显示, 喀什地区维吾尔族人群中各种维生素和微量元素, 如钙和维生素A的人均摄入量均未达到营养素供给量(recommended dietary allowance, RDA)的标准[13]. 高脂高蛋白的西方化饮食是CRC的危险因素, 而钙和维生素是CRC的保护因素[14]. 维吾尔族高脂高蛋白及低维生素和微量元素的饮食结构, 可能导致发病年龄的提前.
国内外研究[15-18]显示, 大肠黏液腺癌及印戒细胞癌具有组织分化程度差, 恶性程度高, 病变进展快, 往往在呈增生性生长前就先有肠壁内浸润和脉管侵犯的特点, 是影响预后的重要因素之一, 而且在年轻患者中更为多见. 本组资料中, 维吾尔族与汉族CRC均以高-中分化腺癌多见, 但维吾尔族CRC组中黏液及印戒细胞癌比例显著高于汉族患者, 除种族因素外, 可能与维吾尔族CRC组中年轻患者比例较高有关, 同时说明维吾尔族CRC较汉族CRC恶性程度更高、更具侵袭性, 发现时多已为晚期, 分化程度更差.
我们发现维吾尔族CRC组晚期患者比例高于汉族CRC组. 其原因可能有以下几方面, 首先维吾尔族患者多生活在南疆医疗水平较低的地区, 早期诊断率低; 其次维吾尔族患者由于对CRC认识不足及经济原因, 诊疗依从性较差, 使病情拖延, 导致维吾尔族CRC组晚期患者较多; 再次维吾尔族患者中黏液及印戒细胞癌所占比例较高, 易发生腹膜转移及淋巴结转移, 恶性程度高, 病变进展快, 这也是维吾尔族CRC组中晚期患者较多的原因. 我们还发现维吾尔族CRC组肿瘤直径较大, 可能是由于维吾尔族CRC组晚期患者较多, 肿瘤生长时间较长, 而导致肿瘤体积增大.
MMR基因功能缺陷是引起MSI的重要原因, 并会导致遗传性非息肉病性结直肠癌(hereditary nonpolyposis colorectal cancer, HNPCC)及部分散发性CRC的发生[19,20]. MMR包括hMLH1、hMSH2、hMSH6、hMSH3、hPMSl及hPMS2等多个家族成员, 而MMR基因突变的90%主要是hMLH1和hMSH2基因的突变, 其余家族成员功能的表达主要依赖于这两个基因[21]. 大多数研究显示hMLH1蛋白缺失率较hMSH2蛋白缺失率高, hMLH1表达缺陷一方面是由于hMLH1基因本身的种系突变; 另一方面是由于hMLH1启动子区甲基化导致转录翻译的障碍, 从而使hMLH1比hMSH2更易发生功能缺陷[22,23]. 本研究中, 维吾尔族CRC组织中hMLH1蛋白缺失率(9.2%)高于hMSH2蛋白缺失率(3.1%), 结果与大多文献结果相一致. 郑建云等[24]检测了63例散发性CRC组织中hMLH1及hMSH2蛋白表达情况后发现hMLH1在有淋巴结转移的CRC组织中的缺失率明显高于无淋巴结转移的CRC组织, 且hMLH1、hMSH2蛋白的表达与患者年龄、肿瘤浸润深度有关. 本研究结果也显示hMLH1蛋白缺失率在有淋巴结转移的CRC组织中显著增加, 表明hMLH1蛋白缺失可能在判断肿瘤的转移方面有一定意义. Khoo等[25]用免疫组织化学法检测298例CRC组织中MMR蛋白表达后, 发现体积较大及外生性生长的肿瘤更易有MMR基因的缺陷. 本研究中, 维吾尔族CRC组织中, 肿瘤直径越大, hMLH1蛋白缺失率越高, 与以上研究结果较一致.
相当多的证据表明, MMR蛋白表达存在种族差异性[26-28]. 本研究中, 维吾尔族CRC患者中hMSH2蛋白缺失率明显少于汉族CRC患者. 有研究显示MMR蛋白在高龄CRC患者组织中的缺失率明显高于低龄CRC患者组织, 提示高龄患者更易有MMR基因的缺失[29]. Kenney等[30]的研究显示hMSH2蛋白缺失率在年轻CRC患者中更高. 可以推测除种族差异因素以外, 维吾尔族CRC患者中hMSH2蛋白较低的缺失率或许与其较轻的发病年龄有关.
总之, 新疆地区维吾尔族CRC患者较汉族患者有发病年龄较轻, 肿瘤直径较大, 黏液腺癌及印戒细胞癌所占比例较高, TNM分期较晚等临床病理特点; 并且hMSH2蛋白在维吾尔族CRC组织中的表达与汉族CRC患者具有差异性. CRC的发生发展是多步骤、多基因参与的结果, 维汉之间是否有其他基因的表达差异, 还需要我们进一步深入研究证实.
结直肠癌(colorectal carcinoma, CRC)是常见的恶性肿瘤, 不同国家地区CRC发病率相差较大, 不同种族间CRC的临床病理特征也各不相同. DNA错配修复(mismatch repair, MMR)系统是人体细胞中一类能修复DNA碱基错配的安全保障体系, 对保持遗传物质的完整稳定性具有重要作用. 包括多个基因, 起主要作用的是hMLH1和hMSH2. 其功能的缺失可导致卵巢癌、子宫内膜癌、胃癌和CRC等恶性肿瘤.
李革, 副教授, 延边大学附属医院
hMLH1和hMSH2基因在CRC中的研究虽可见报道, 但是国内外对于不同种族间hMLH1和hMSH2表达差异的研究报道很少, 对于其在维吾尔族与汉族CRC患者中的表达差异更是尚未见报道. CRC的发生发展是多步骤、多基因参与的结果, 维汉之间是否有其他基因的表达差异, 还需要我们进一步深入研究证实.
郑建云等研究发现hMLH1和hMSH2蛋白在散发性大肠癌组织中的表达与患者的年龄、淋巴结转移和癌组织浸润的范围有关. Kenney等的研究表明年轻的大肠癌患者倾向于较高的肿瘤分级, 黏液性分化、易有淋巴及神经浸润, 且hMSH2的缺失在年轻患者中更加突出.
本文首次探讨了新疆地区维吾尔族与汉族CRC患者临床病理特征的差异, 并检测了hMLH1和hMSH2蛋白在维汉两民族CRC组织间的表达差异. 提示维吾尔族CRC患者具有不同于汉族患者的临床病理特征, 且hMSH2蛋白缺失率较低.
了解维吾尔族及汉族CRC患者临床病理及遗传背景的差异性, 可以指导不同民族的CRC患者的早期诊断和个性化治疗.
微卫星不稳定(microsatellite instability, MSI): 微卫星是一段在DNA复制阶段形成插入/删除环的寡核苷酸重复序列, MMR主要负责修复DNA复制过程中所形成的错配碱基和插入/缺失环, 使微卫星长度保持在胚系水平. 如果MMR系统发生缺陷, 则插入/删除环不能被纠正, 形成额外的复制叉, 从而使微卫星长度改变, 而形成MSI. MSI分为高度微卫星不稳定性、低度微卫星不稳定性和微卫星稳定性.
本论文有一定的科学性和创新性, 实验设计合理, 论文撰写清晰, 论据可靠, 结论可信, 对临床有价值, 是一篇具有可读性的论文.
编辑: 郭鹏 电编:都珍珍
| 1. | Pourhoseingholi MA. Increased burden of colorectal cancer in Asia. World J Gastrointest Oncol. 2012;4:68-70. [PubMed] [DOI] |
| 2. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 5. | Stojic L, Brun R, Jiricny J. Mismatch repair and DNA damage signalling. DNA Repair (Amst). 2004;3:1091-1101. [PubMed] |
| 7. | Buecher B, Cacheux W, Rouleau E, Dieumegard B, Mitry E, Lièvre A. Role of microsatellite instability in the management of colorectal cancers. Dig Liver Dis. 2013;45:441-449. [PubMed] [DOI] |
| 8. | Marra G, Boland CR. Hereditary nonpolyposis colorectal cancer: the syndrome, the genes, and historical perspectives. J Natl Cancer Inst. 1995;87:1114-1125. [PubMed] |
| 9. | Fromowitz FB, Viola MV, Chao S, Oravez S, Mishriki Y, Finkel G, Grimson R, Lundy J. ras p21 expression in the progression of breast cancer. Hum Pathol. 1987;18:1268-1275. [PubMed] |
| 10. | Chen W, Zheng R, Zhang S, Zhao P, Zeng H, Zou X, He J. Annual report on status of cancer in China, 2010. Chin J Cancer Res. 2014;26:48-58. [PubMed] [DOI] |
| 11. | Lieberman DA, Holub JL, Moravec MD, Eisen GM, Peters D, Morris CD. Prevalence of colon polyps detected by colonoscopy screening in asymptomatic black and white patients. JAMA. 2008;300:1417-1422. [PubMed] [DOI] |
| 13. | 樊勇, 邓晓龙, 阿不力克木, 谢白敬, 木合塔尔, 阿地力, 段风梅, 肖艳, 张 玲, 张明琛. 新疆喀什市及周边县乡维吾尔族422人膳食调查. 中国组织工程研究与临床康复. 2009;11:2174-2177. |
| 16. | Benedix F, Kuester D, Meyer F, Lippert H. [Influence of mucinous and signet-ring cell differentiation on epidemiological, histological, molecular biological features, and outcome in patients with colorectal carcinoma]. Zentralbl Chir. 2013;138:427-433. [PubMed] [DOI] |
| 18. | Thota R, Fang X, Subbiah S. Clinicopathological features and survival outcomes of primary signet ring cell and mucinous adenocarcinoma of colon: retrospective analysis of VACCR database. J Gastrointest Oncol. 2014;5:18-24. [PubMed] [DOI] |
| 19. | Vasen HF, Blanco I, Aktan-Collan K, Gopie JP, Alonso A, Aretz S, Bernstein I, Bertario L, Burn J, Capella G. Revised guidelines for the clinical management of Lynch syndrome (HNPCC): recommendations by a group of European experts. Gut. 2013;62:812-823. [PubMed] [DOI] |
| 20. | Sinicrope FA, Sargent DJ. Molecular pathways: microsatellite instability in colorectal cancer: prognostic, predictive, and therapeutic implications. Clin Cancer Res. 2012;18:1506-1512. [PubMed] [DOI] |
| 21. | Lynch HT, Lynch PM, Lanspa SJ, Snyder CL, Lynch JF, Boland CR. Review of the Lynch syndrome: history, molecular genetics, screening, differential diagnosis, and medicolegal ramifications. Clin Genet. 2009;76:1-18. [PubMed] [DOI] |
| 22. | Sun Z, Yu X, Wang H, Zhang S, Zhao Z, Xu R. Clinical significance of mismatch repair gene expression in sporadic colorectal cancer. Exp Ther Med. 2014;8:1416-1422. [PubMed] |
| 23. | Musulén E, Sanz C, Muñoz-Mármol AM, Ariza A. Mismatch repair protein immunohistochemistry: a useful population screening strategy for Lynch syndrome. Hum Pathol. 2014;45:1388-1396. [PubMed] [DOI] |
| 25. | Khoo JJ, Gunn A, Peh SC. Pattern of hMLH1, hMSH2 and hMSH6 expression and clinical characteristics in a sample of Malaysian colorectal carcinoma cases. Malays J Pathol. 2013;35:45-57. [PubMed] |
| 26. | De Jesus-Monge WE, Gonzalez-Keelan C, Zhao R, Hamilton SR, Rodriguez-Bigas M, Cruz-Correa M. Mismatch repair protein expression and colorectal cancer in Hispanics from Puerto Rico. Fam Cancer. 2010;9:155-166. [PubMed] [DOI] |
| 27. | Molaei M, Mansoori BK, Ghiasi S, Khatami F, Attarian H, Zali M. Colorectal cancer in Iran: immunohistochemical profiles of four mismatch repair proteins. Int J Colorectal Dis. 2010;25:63-69. [PubMed] [DOI] |
| 28. | Zahary MN, Kaur G, Hassan MR, Sidek AS, Singh H, Yeh LY, Ankathil R. Germline mutation and protein expression analysis of mismatch repair genes MSH6 and PMS2 in Malaysian Lynch syndrome patients. Int J Colorectal Dis. 2014;29:261-262. [PubMed] [DOI] |
| 30. | Kenney B, Deng Y, Mitchell K. Expression of p27, COX-2, MLH1, and MSH2 in young patients with colon carcinoma and correlation with morphologic findings. Hum Pathol. 2013;44:591-597. [PubMed] [DOI] |