修回日期: 2015-03-10
接受日期: 2015-03-18
在线出版日期: 2015-05-28
目的: 探讨中国汉族人群T、B淋巴细胞弱化因子(B and T lymphocyte attenuator, BTLA)基因单核苷酸多态性(single nucleotide polymorphism, SNP)与慢性乙型肝炎病毒(hepatitis B virus, HBV)感染家系的遗传易感性.
方法: 采用SNaPshot技术检测核心家系中慢性HBV感染者及其家庭成员BTLA基因rs2633562和rs2952323 SNP位点的多态性, 采用家系内关联性分析(family-based association test, FBAT)基因型、等位基因及单体型分布频率.
结果: 单位点SNP遗传关联性分析显示, BTLA基因rs2952323位点多态性与慢性HBV感染的遗传易感有显著的相关性, G/G基因型Z = 2.731, P = 0.006308, G等位基因在附加遗传模型中Z = 2.689, P = 0.0007174, 隐性遗传模型中Z = 2.731, P = 0.006308. 传统的传递不平衡检验(transmission/disequilibrium test, TDT)和同胞对传递不平衡检验(siblings disequilibrium test, SDT)分析显示无主要的优势等位基因A、C或G从杂合的父母传递给患病子女, P = 1.000000, P = 0.151590. FBAT单倍型分析结果显示rs2633562-A/rs2952323-G(70.0%)存在优势单倍型传递给患病子女或者患病同胞, 在附加遗传模型Z = 3.093, P = 0.001979, 隐性遗传模型中Z = 2.825, P = 0.004721.
结论: BTLA基因位点多态性可能与家族聚集性慢性HBV感染的遗传易感性相关.
核心提示: 中国汉族人群T、B淋巴细胞弱化因子(B and T lymphocyte attenuator)基因rs2952323位点的G/G基因型与慢性乙型肝炎病毒(hepatitis B virus, HBV)感染有关联, 存在优势的G等位基因从杂合的父母传递给患病子女, 单倍型分析显示存在优势单倍型rs2633562-A/rs2952323-G传递给患病子女或者患病同胞, 该基因可能对慢性HBV感染的遗传易感性发挥作用.
引文著录: 张唯, 吕峰, 郜玉峰, 邹桂舟, 潘发明, 李旭. BTLA基因多态性与慢性HBV感染家系的遗传易感性. 世界华人消化杂志 2015; 23(15): 2373-2381
Revised: March 10, 2015
Accepted: March 18, 2015
Published online: May 28, 2015
AIM: To investigate the association between BTLA polymorphisms and genetic susceptibility to chronic hepatitis B virus (HBV) infection in a Chinese Han population.
METHODS: The rs2633562 and rs2952323 single nucleotide polymorphisms (SNPs) of the BTLA gene were genotyped by Multiplex SNaPshot technique in patients with chronic HBV infection and other family members (HBsAg negative). Genotype and allele frequencies were calculated and analyzed. The association between the gene polymorphisms of BTLA and genetic susceptibility to chronic HBV infection was analyzed by a family-based association method.
RESULTS: Association or linkage was detected among 431 patients. Univariate family-based association tests (FBATs) demonstrated that the G/G genotype in rs2952323 of the BTLA gene was associated with chronic HBV infection, and the variant allele G at rs2952323 was significantly associated with genetic susceptibility to chronic HBV infection in additive model (Z = 2.689, P = 0.0007174) and recessive model (Z = 2.731, P = 0.006308). Transmission/disequilibrium test (TDT) and sibship disequilibuium test (SDT) analysis showed no increased transmission for the major alleles (A, C or G) from heterozygous parents to affected offspring (P = 1.000000, P = 0.151590, respectively). Furthermore, haplotype-specific FBATs showed that AG haplotype (70.0%) was more frequently transmitted in chronic HBV infection than other haplotypes in additive model (Z = 3.093, P = 0.001979) and recessive model (Z = 2.825, P = 0.004721).
CONCLUSION: The gene polymorphisms of BTLA may participate in chronicity of HBV infection in the Chinese Han population.
- Citation: Zhang W, Lv F, Gao YF, Zou GZ, Pan FM, Li X. Association between BTLA polymorphisms and genetic susceptibility to chronic HBV infection. Shijie Huaren Xiaohua Zazhi 2015; 23(15): 2373-2381
- URL: https://www.wjgnet.com/1009-3079/full/v23/i15/2373.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i15.2373
慢性乙型肝炎病毒(hepatitis B virus, HBV)感染是一种多因素和多基因参与的复杂性疾病, HBV持续感染和疾病的进展与多种因素有关, 如宿主的年龄、性别、HBV基因型、遗传、环境和免疫等因素[1-3]. 同时, 种族分析和同卵双胞胎研究证实了宿主的遗传因素不仅影响对感染的易感性, 而且影响感染个体的临床进展[4-6]. 基因关联分析已经证实了人类白细胞抗原与非人类白细胞抗原基因, 包括细胞程序性死亡受体-1(programmed death-1, PD-1)[7-9], 细胞毒T淋巴细胞抗原-4(cytotoxic T lymphocyte-associated antigen-4, CTLA-4)[10]、干扰素-γ(interferon γ, IFN-γ)[11]、雌激素受体-1[12], α-肿瘤坏死因子[13], Ⅰ-型IFN受体[14]等, 与慢性HBV感染的发生和病原体的清除密切相关. T、B淋巴细胞弱化因子(B and T lymphocyte attenuator, BTLA)是新近发现的一个CD28超家族共刺激分子, 他与CTLA-4、PD-1有相似的结构和功能, 慢性HBV感染者外周血CD4+ T细胞及肝组织的炎症浸润细胞上存在BTLA的表达, 已经证实对T细胞活化起负性调控作用[15-18]. 同时有许多研究报道BTLA基因中一些调控性的多态性位点与乳腺癌[19]、系统性红斑狼疮[20]、1型糖尿病[20]、亚急性硬化性全脑炎[21]和类风湿性关节炎[22,23]有着密切关联或者无关联, 他们已经成为免疫相关疾病研究的主要候选基因, 但是目前BTLA基因多态性在大样本人群中与慢性HBV感染易感性的研究尚未见报道. 因此, 本研究通过采用家系遗传关联分析方法探讨BTLA基因多态性与慢性HBV感染的遗传易感性.
研究对象来自安徽省内7家三级医院(安徽医科大学第二附属医院、六安市人民医院、阜阳市第二人民医院、淮北市人民医院、界首市人民医院、太和县中医院、太和县医院)就诊的慢性HBV感染先证者(先证者: 指一个家庭中第一个被发现并被诊断为患者的个体)及其家庭成员. 慢性HBV感染者经副主任医师以上的专家确诊, 诊断依据2010年《慢性乙型肝炎防治指南》[24]的诊断标准, 并且所有病例均未合并其他嗜肝病毒感染或其他慢性肝病, 排除了重叠艾滋病病毒(human immunodeficiency virus, HIV)、甲型肝炎病毒(hepatitis A virus, HAV)、丙型肝炎病毒(hepatitis C virus, HCV)、戊型肝炎病毒(hepatitis E virus, HEV)感染、自身抗体阳性. 由患者本人或其合法的监护人签订知情同意书后, 由经过专门培训的流行病学调查员记录患者的信息资料及家系资料. 以先证者为基础, 共收集核心家系188个, 总计668例, 其中431例HBV慢性感染者, 平均年龄40.5岁±14.6岁, 237例家系成员(非感染者), 平均年龄44.1岁±15.5岁. 有双方父母入选的家系84个(44.68%), 只有其中一方父母的家系73个(38.83%), 另外父母均未入选的家系31个(16.49%). 此次遗传流行病学研究中, 采用以下家系标准进行定义: (1)先证者加父母; (2)假如父母有一方不能入选(如死亡或不愿意参加或其他原因不能参加等), 则至少有一个同胞; (3)如果父母双方均未入选(如均死亡或者不愿意参加或其他原因不能参加等), 则除先证者外, 至少有另外两个同胞.
1.2.1 基因组DNA提取: 所有入选家系成员采外周静脉血5 mL于EDTA-2K抗凝管中, 采用中量全血基因组DNA提取试剂盒提取外周血DNA(天津原平皓生物技术有限公司产品, 规格HF202-02), 紫外分光光度计和0.8%琼脂糖凝胶电泳检测DNA浓度和纯度后于-80 ℃超低温冰箱保存.
1.2.2 多态性位点的选择: 选取的BTLA基因单核苷酸多态性(single nucleotide polymorphism, SNP)位点的信息来自美国国立生物技术信息中心(NCBI) dbSNP, 以LD相关系数r2>0.8, 等位基因频率(minor allele frequency, MAF)>0.1为选择标准, 以及综合评估SNP在功能上的重要性, 或与免疫疾病相关的文献报道作为依据, 同时参考hapmap数据库(http://www.hapmap.org)中汉族人BTLA基因信息, 选择出BTLA基因rs2633562和rs2952323两个标签SNP位点.
1.2.3 多态性位点的引物设计与合成: 参考NCBI公共数据库信息(http://www.ncbi.nlm.nih.gov), 采用Primier3软件设计引物及延伸引物(http://frodo.wi. mit.edu/cgi-bin/primer3/primer3_http://www.cgi). BTLA基因, rs2633562位点PCR扩增引物序列: F: ACGTTGGATGGGTTGCCAGTCTATTTGTTG; R: ACGTTGGATGCCAAAAATAGATAAATTGGAC; SNaPshot的延伸引物序列为: GAAATTGGACTTCATAAAAATTAAACG; rs2952323位点PCR扩增引物序列: F : ACGTTGGATGCAGAGTGAGACTCTGTCTCC; R: ACGTTGGATGCAACCGCATCAAAAAGTGGG, SNaPshot的延伸引物序列为: CTATGAACACACAGTTCTCTCTG, 引物均由上海生工生物工程有限公司合成.
1.2.4 多重PCR反应体系及反应条件: (1)采用Qiagen公司的HotStarTaq进行多重PCR反应, PCR扩增反应体系(10 μL)包括1×HotStarTaq缓冲液(大连Takara生物工程有限公司)1.5 μL, HotstarR Taq DNA聚合酶(德国Qiagen公司)0.1 μL, dNTP混合物(上海Generay Biotech有限公司, 10 mmol/L)0.3 μL, MgCl2(大连Takara生物工程有限公司, 25 mmol/L)0.9 μL, 多重PCR引物(10 pmol/L)各0.5 µL, 样本DNA模板(20 mg/L)1 μL和去离子水5.2 μL. 多重PCR反应采用Touch-down PCR反应程序: 95 ℃预变性2 min, 94 ℃变性20 s, 65 ℃退火40 s, 每个循环下降0.5 ℃, 72 ℃延伸1 min 30 s, 共11个循环. 然后94 ℃变性20 s, 59 ℃退火30 s, 72 ℃延伸1 min 30 s, 24个循环. 最后72 ℃延伸2 min, 结束后4 ℃保存. PCR扩增后, 取1.5 μL反应产物进行琼脂糖凝胶电泳检测, 有片段的表明PCR扩增反应成功; (2)PCR产物的纯化: 取10 μL PCR产物中加入1 U虾碱酶(SAP, 北京Promega生物技术有限公司)和1 U外切酶Ⅰ(Exonuclease Ⅰ酶, 美国Epicentre公司)震荡混匀后, 37 ℃温浴1 h, 然后75 ℃保温15 min来灭活SAP和Exonuclease Ⅰ酶. 纯化好的模板可以在4 ℃保存24 h内进入下一反应程序; (3)SNaPshot多重单碱基延伸反应体系(10 μL)包括5 μL SNaPshot Multiplex Kit(ABI), 2 μL纯化后多重PCR产物, 1 μL延伸引物混合物(0.8 μmol/L), 2 μL去离子水. SNaPshot荧光混合物中含AmpliTaq DNA多聚酶和不同荧光标记的ddNTP. SNaPshot的反应程序: 96 ℃预变性1 min, 然后96 ℃变性10 s, 52 ℃退火5 s, 60 ℃延伸30 s, 28个循环后, 60 ℃延伸30 s, 反应结束后4 ℃保存; (4)延伸产物的纯化和测序: 取10 μL SNaPshot PCR产物加入1 U SAP, 震荡混匀, 37 ℃温浴1 h, 75 ℃保温15 min以灭活酶. 取0.5 μL纯化后的延伸产物, 加0.5 μL GeneScan-120 LIZ Size Standard和9 μL Hi-Di Formamide(高纯甲酰胺)混匀, 95 ℃变性5 min后上样于ABI3130XL测序仪进行电泳, 利用GeneMapper 4.0(AppliedBiosystems Co., Ltd., USA)进行基因型的判定和数据的收集. 为确保试验结果的准确性, 随机抽取5%样本进行直接测序验证SNaPshot方法的准确性.
统计学处理 采用基于家系为基础的关联性检验(family-based association test, FBAT)[25]和传递不平衡检验(transmission/disequilibrium test, TDT), 同时使用FBAT软件中单倍型程序进行易感单倍型分析[26,27]. 观察每个模型下某等位基因所对应的Z值及P值, 如果Z为正值, 其对应的P<0.05, 说明某等位基因与某病存在遗传学关联(只适合双等位基因); 如果Z为负值, 则说明某等位基因与某疾病不存在遗传学上的关联. 同时拟合优度χ2检验用于分析基因型频率分布是否符合Hardy-Weinberg平衡定律.
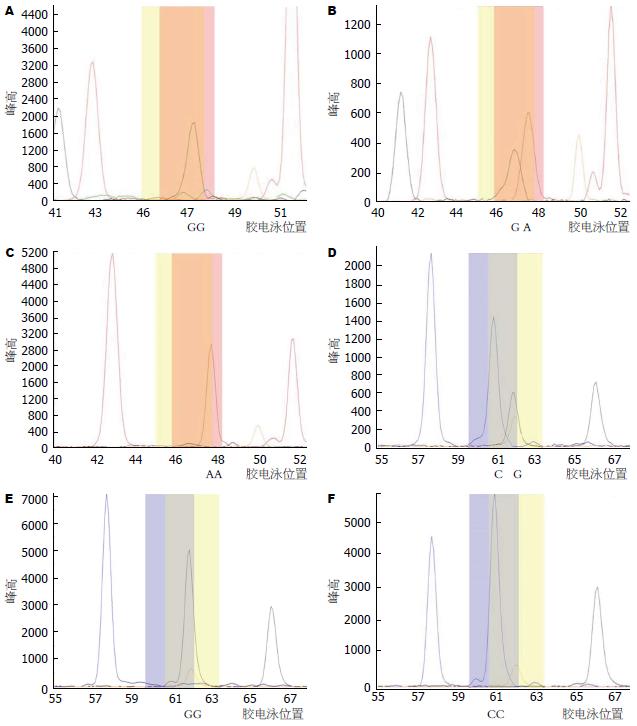
采用SNaPshot技术对BTLA基因中rs2633562和rs2952323位点的多态性进行检测, 根据电泳峰型图中碱基峰值的位置判断基因型(图1), 结果显示: rs2633562 A/G, AA、AG和GG基因型的频率分别是50.9%、48.0%和1.1%, A和G等位基因的频率分别是74.9%和25.1%. rs2952323 C/G, CC、CG和GG基因型的频率分别是8.3%、48.9%和42.8%, C和G等位基因的频率分别是32.8%和67.2%, 并且两个位点的基因频率分布经过χ2检验均符合Hardy-Weinberg平衡定律. 经单个位点家系关联性分析结果显示: BTLA基因rs2952323单位点多态性G/G基因型与慢性HBV感染的遗传易感有显著的相关性(Z = 2.731, P = 0.006308)(表1).
| 多态位点 | 基因型 | 频率 | 家系数1 | 检验统计量 | 预测值 | 方差 | Z值2 | P值 |
| rs2633562 | A/A | 0.509 | 59 | 46.000 | 39.639 | 16.841 | 1.550 | 0.121108 |
| A/G | 0.480 | 65 | 39.000 | 45.873 | 19.238 | -1.567 | 0.117126 | |
| G/G | 0.011 | 15 | 11.000 | 10.489 | 4.106 | 0.252 | 0.800750 | |
| rs2952323 | C/C | 0.083 | 28 | 11.000 | 13.370 | 6.858 | -0.905 | 0.365423 |
| C/G | 0.489 | 85 | 48.000 | 58.393 | 25.706 | -2.050 | 0.040381 | |
| G/G | 0.428 | 75 | 60.000 | 47.237 | 21.835 | 2.731 | 0.006308 |
BTLA基因中, rs2633562 A/G和rs2952323 C/G两位点, 经单个位点家系关联性分析结果显示: rs2952323位点有优势的G等位基因从杂合的父母传递给患病子女, 在附加遗传模型(Z = 2.689, P = 0.007174)和隐性遗传模型(Z = 2.731, P = 0.006308)中的P值均<0.05(表2).
| 多态位点 | 等位基因 | 附加遗传模型 | 显性遗传模型 | 隐性遗传模型 | ||||||
| 家系数1 | Z值2 | P值 | 家系数1 | Z值2 | P值 | 家系数1 | Z值2 | P值 | ||
| rs2633562 | A | 65 | 1.229 | 0.219050 | 15 | -0.252 | 0.800750 | 59 | 1.550 | 0.121108 |
| G | 65 | -1.229 | 0.219050 | 59 | -1.550 | 0.121108 | 15 | 0.252 | 0.800750 | |
| rs2952323 | C | 85 | -2.689 | 0.007174 | 75 | -2.731 | 0.006308 | 28 | -0.905 | 0.365423 |
| G | 85 | 2.689 | 0.007174 | 28 | 0.905 | 0.365423 | 75 | 2.731 | 0.006308 | |
分析结果显示BTLA基因中, rs2633562 A/G和rs2952323 C/G两位点无主要的优势等位基因A、C或G从杂合的父母传递给患病子女(P = 1.000000, P = 0.151590), 具体如表3.
| SNP位点 | 频率 | 等位基因 | Trio TDT (n probands with allele) | ||
| 传递 | 未传递 | P值 | |||
| rs2633562 | 0.749 | A | 11 | 11 | 1.000000 |
| 0.251 | G | 11 | 11 | 1.000000 | |
| rs2952323 | 0.328 | C | 8 | 16 | 0.151590 |
| 0.672 | G | 16 | 8 | 0.151590 | |
188个核心家系单倍型分析结果显示: 在中国汉族人群中存在以下4种单倍型型结构: rs2633562/rs2952323: A/G(70.0%), G/C(15.4%), A/C(13.4%)和G/G(1.1%). rs2633562-A/rs2952323-G存在优势单倍型传递给患病子女或者患病同胞, 传递的单倍型与慢性HBV感染的遗传易感有显著的相关性, 在附加遗传模型(Z = 3.093, P = 0.001979)和隐性遗传模型(Z = 2.825, P = 0.004721)中的P值均<0.05(表4).
人的BTLA基因位于人染色体3q13.2, 含有5个外显子和4个内含子[28], 具有传递抑制信号来阻止淋巴细胞活化的能力. 遗传流行病学研究显示, 在相同的环境暴露条件下, 不同的个体对疾病的易感性存在差异, 而基因多态性在个体对疾病的易感性方面起着重要的作用. 因此, 探讨基因多态性与慢性HBV感染遗传易感性之间的关系, 有助于阐明慢性HBV感染的发病机制、临床表现和预后, 对指导临床诊断和治疗具有重要意义. 到目前为止, 关于BTLA基因SNP的研究, 已经确认与乳腺癌[19], 类风湿性关节炎[22,23]的发病有关联. 这些研究SNP位点的选择涉及基因的内含子、外显子和启动子区. 众所所知, 内含子在基因的翻译、转录和保持RNA稳定性中发挥着重要的作用[29], 因此, 位于基因内含子区域的位点是研究的热点, 早先报道的关联研究中, Fu等[19]发现, BTLA位于内含子区的SNP与中国妇女的乳腺癌发生和预后有密切关联, 并且有5种基因型与肿瘤大小、雌激素受体、黄体酮、C-erbB-2及P53状态高度相关. 而Inuo等[20]报道了BTLA两个SNP(rs2705534和rs9288953)位于基因内含子1, 没有发现其基因型、等位基因和单倍型与系统性红斑狼疮的发病有关联, 这些研究中, 有阳性结果也有阴性结果, 可能与BTLA基因功能在不同疾病中的致病机制不同有关.
在慢性HBV感染的发病机制中, 机体HBV特异性CD4+和CD8+ T细胞的数量及应答功能的不足是造成病毒持续感染的主要因素, 这与提供T细胞活化的第二类共刺激信号的负性共刺激分子对免疫细胞活化和增殖的负向调节, 造成T细胞的耗竭息息相关. 部分研究已经初步揭示了BTLA信号通路在T细胞耗竭中可能起到了重要的作用. Cai等[17]研究发现在慢性乙型肝炎患者的肝内和外周血CD4+和CD8+细胞上, BTLA分子的表达是显著增高的, 介导了免疫抑制, 当阻断了BTLA信号通路, 则表现出T细胞的增殖及细胞因子的分泌, 免疫功能的增强. 反映出BTLA信号通路可能通过影响了Th1/Th2细胞的平衡以及CD8+细胞的细胞毒作用, 进而影响了机体的获得性免疫的效能. 并且Iwata等[18]认为BTLA也是NKT细胞的抑制性受体, 能够抑制NKT细胞介导的肝脏损伤, 在剔除BTLA的小鼠试验中发现能大量分泌IL-4和IFN-γ, 验证了BTLA分子的免疫调节还涉及机体的固有免疫. 总之, BTLA在慢性HBV感染的免疫反应中作为一种负性共刺激分子, 很可能直接或者与其他分子协同向效应细胞传到了负性信号, 抑制他们的功能, 影响了机体的免疫状态, 促进了病毒的持续感染. 那么, BTLA在基因层面, 是否与慢性HBV感染的基因易感性有关联尚未见报道. 本研究就探讨了位于BTLA基因内含子的两个SNPs, rs2633562和rs2952323的SNP与慢性HBV感染的遗传易感性, 从结果可以看出, BTLA基因中的rs2952323位点的G/G基因型与慢性HBV感染有关联(Z = 2.731, P = 0.006308), 存在G优势等位基因优先从杂和的父母传递给患病子女, 在附加遗传模型(Z = 2.689, P = 0.007174)和隐性遗传模型(Z = 2.731, P = 0.006308)中的P值均<0.05, 说明他们与慢性HBV感染遗传易感性有关. 同时对BTLA基因内含子区两位点等位基因进行了单倍型分析, 我们发现有统计学意义的易感单倍型rs2633562-A/rs2952323-G的存在. 而通常所指的单倍型是在一条染色体上紧密连锁的多个等位基因的线性排列, SNP单倍型就是这样不同的SNPs位点上核苷酸碱基的线性排列, 每一种线性的排列都称为一种SNP单倍型. 从理论上来讲, 单倍型出现的频率应该是各个基因频率的乘积, 但是实际情况并非如此, 连锁的单倍型并不是随机组合而成的, 而是某些基因更多或更少的连锁在一起, 称之为"连锁不平衡". 因此在探讨基因遗传与疾病相关性时, 单倍型的分析能够提供相对多的遗传信息, 使得分析疾病的遗传易感性更具有准确性和客观性. 本次研究发现易感单倍型rs2633562-A/rs2952323-G中包含一个易感等位基因G, 进一步验证rs2952323位点等位基因G可能是慢性HBV感染的易感等位基因, 所以我们有理由推测BTLA基因在慢性HBV感染的遗传易感性方面可能发挥了作用, 但其BTLA基因多态性的确切生物学功能机制尚不清楚, 可能的反应机制是因为SNPs引起了BTLA信号转导的失调, 或者通过改变转录因子结合位点或其他调节区域, 启动子区等位基因的变异影响到免疫性受体的定性或定量表达, 以及结构和功能的改变, 进而增加了感染的易感性.
在众多的SNP的研究设计中, Zhang等[30]提出了SNP的选择, 不同疾病的研究模型和检验统计学的方法是决定基因关联研究效能的3个因素. 本次研究选择的SNP为标签位点, 采用了以家系为基础的遗传关联性分析, 避免了环境因素对结果的影响[31,32], 同时样本量大, 统计结果P值小, 提示关联显著, 使得研究的结果更加准确、可信, 但是本研究也存在一定的局限性, 研究结果尚需在其他的种族中得到进一步证实和拓展, 对于基因功能SNP的生物学产物是否确实影响BTLA的表达和功能, 并进而影响了BTLA分子在HBV感染中的调控还有待于进一步研究.
慢性乙型肝炎病毒(hepatitis B virus, HBV)感染和疾病进展除了与病毒感染有关外, 和宿主因子也密切相关, 特别是免疫相关分子的基因多态性的研究是阐明疾病发病机制的重要途径之一.
白浪, 副教授, 四川大学华西医院感染性疾病中心
慢性HBV感染遗传易感性的研究为人类提供了一个很好的探讨基因与环境相互作用导致不同疾病结局的机会, 综合考虑病毒、环境、宿主等因素的共同作用, 探讨慢性HBV感染的机制是目前研究的热点.
T、B淋巴细胞弱化因子(B and T lymphocyte attenuator, BTLA)基因中一些调控性的多态性位点与乳腺癌、系统性红斑狼疮、1型糖尿病、亚急性硬化性全脑炎和类风湿性关节炎有着密切关联或者无关联, 但是目前BTLA基因多态性在大样本人群中与慢性HBV感染易感性的研究尚未见报道.
本研究采用多重单碱基延伸SNP分型技术(SNaPshot)首次对BTLA基因两个标签SNP位点多态性与慢性HBV感染家系的遗传易感性进行研究, 研究人群是以家系为基础, 具有创新性.
BTLA基因可能对慢性HBV感染的遗传易感性发挥作用, 对于基因功能SNP的生物学产物的表达和功能还有待于进一步研究.
SNaPshot SNP分型技术: 是一种以单碱基延伸原理为基础, 同时利用多重PCR对多个已知SNP位点进行遗传分型的方法.
本文从宿主的角度对BTLA基因多态性和慢性HBV感染的遗传易感性的关系进行了分析. 研究设计合理, 实验数据真实可信, 结论可靠.
编辑: 郭鹏 电编:都珍珍
| 2. | Chu CJ, Lok AS. Clinical significance of hepatitis B virus genotypes. Hepatology. 2002;35:1274-1276. [PubMed] [DOI] |
| 3. | Thursz M. Genetic susceptibility in chronic viral hepatitis. Antiviral Res. 2001;52:113-116. [PubMed] [DOI] |
| 4. | Frodsham AJ. Host genetics and the outcome of hepatitis B viral infection. Transpl Immunol. 2005;14:183-186. [PubMed] [DOI] |
| 5. | Chang JJ, Lewin SR. Immunopathogenesis of hepatitis B virus infection. Immunol Cell Biol. 2007;85:16-23. [PubMed] |
| 6. | Ramezani A, Hasanjani Roshan MR, Kalantar E, Eslamifar A, Banifazl M, Taeb J, Aghakhani A, Gachkar L, Velayati AA. Association of human leukocyte antigen polymorphism with outcomes of hepatitis B virus infection. J Gastroenterol Hepatol. 2008;23:1716-1721. [PubMed] [DOI] |
| 7. | Zhang G, Li N, Zhang P, Li F, Yang C, Zhu Q, Han Q, Lv Y, Zhou Z, Liu Z. PD-1 mRNA expression is associated with clinical and viral profile and PD1 3'-untranslated region polymorphism in patients with chronic HBV infection. Immunol Lett. 2014;162:212-216. [PubMed] [DOI] |
| 8. | Zheng L, Li D, Wang F, Wu H, Li X, Fu J, Chen X, Wang L, Liu Y, Wang S. Association between hepatitis B viral burden in chronic infection and a functional single nucleotide polymorphism of the PDCD1 gene. J Clin Immunol. 2010;30:855-860. [PubMed] [DOI] |
| 9. | Lv F, Gao YF, Zhang ZH, Zhang TC, Pan FM, Cui MF, Xia SL, Li X, Yin HF. Polymorphisms in programmed death-1 gene are not associated with chronic HBV infection in Chinese patients. World J Hepatol. 2011;3:72-78. [PubMed] [DOI] |
| 10. | Thio CL, Mosbruger TL, Kaslow RA, Karp CL, Strathdee SA, Vlahov D, O'Brien SJ, Astemborski J, Thomas DL. Cytotoxic T-lymphocyte antigen 4 gene and recovery from hepatitis B virus infection. J Virol. 2004;78:11258-11262. [PubMed] [DOI] |
| 11. | Gao QJ, Liu DW, Zhang SY, Jia M, Wu LH. [Association between IFN-gamma+874 polymorphisms and the clinical outcomes of hepatitis B and/or hepatitis C virus infection]. Zhonghua Liu Xing Bing Xue Za Zhi. 2010;31:324-328. [PubMed] |
| 12. | Deng G, Zhou G, Zhai Y, Li S, Li X, Li Y, Zhang R, Yao Z, Shen Y, Qiang B. Association of estrogen receptor alpha polymorphisms with susceptibility to chronic hepatitis B virus infection. Hepatology. 2004;40:318-326. [PubMed] [DOI] |
| 13. | Kummee P, Tangkijvanich P, Poovorawan Y, Hirankarn N. Association of HLA-DRB1*13 and TNF-alpha gene polymorphisms with clearance of chronic hepatitis B infection and risk of hepatocellular carcinoma in Thai population. J Viral Hepat. 2007;14:841-848. [PubMed] [DOI] |
| 14. | Zhou J, Lu L, Yuen MF, Lam TW, Chung CP, Lam CL, Zhang B, Wang S, Chen Y, Wu SH. Polymorphisms of type I interferon receptor 1 promoter and their effects on chronic hepatitis B virus infection. J Hepatol. 2007;46:198-205. [PubMed] [DOI] |
| 15. | Nan XP, Zhang Y, Yu HT, Li Y, Sun RL, Wang JP, Bai XF. Circulating CD4+CD25high regulatory T cells and expression of PD-1 and BTLA on CD4+ T cells in patients with chronic hepatitis B virus infection. Viral Immunol. 2010;23:63-70. [PubMed] [DOI] |
| 16. | Xu H, Cao D, Guo G, Ruan Z, Wu Y, Chen Y. The intrahepatic expression and distribution of BTLA and its ligand HVEM in patients with HBV-related acute-on-chronic liver failure. Diagn Pathol. 2012;7:142. [PubMed] [DOI] |
| 17. | Cai G, Nie X, Li L, Hu L, Wu B, Lin J, Jiang C, Wang H, Wang X, Shen Q. B and T lymphocyte attenuator is highly expressed on intrahepatic T cells during chronic HBV infection and regulates their function. J Gastroenterol. 2013;48:1362-1372. [PubMed] [DOI] |
| 18. | Iwata A, Watanabe N, Oya Y, Owada T, Ikeda K, Suto A, Kagami S, Hirose K, Kanari H, Kawashima S. Protective roles of B and T lymphocyte attenuator in NKT cell-mediated experimental hepatitis. J Immunol. 2010;184:127-133. [PubMed] [DOI] |
| 19. | Fu Z, Li D, Jiang W, Wang L, Zhang J, Xu F, Pang D, Li D. Association of BTLA gene polymorphisms with the risk of malignant breast cancer in Chinese women of Heilongjiang Province. Breast Cancer Res Treat. 2010;120:195-202. [PubMed] [DOI] |
| 20. | Inuo M, Ihara K, Matsuo T, Kohno H, Hara T. Association study between B- and T-lymphocyte attenuator gene and type 1 diabetes mellitus or systemic lupus erythematosus in the Japanese population. Int J Immunogenet. 2009;36:65-68. [PubMed] [DOI] |
| 21. | Ishizaki Y, Yukaya N, Kusuhara K, Kira R, Torisu H, Ihara K, Sakai Y, Sanefuji M, Pipo-Deveza JR, Silao CL. PD1 as a common candidate susceptibility gene of subacute sclerosing panencephalitis. Hum Genet. 2010;127:411-419. [PubMed] [DOI] |
| 22. | Lin SC, Kuo CC, Chan CH. Association of a BTLA gene polymorphism with the risk of rheumatoid arthritis. J Biomed Sci. 2006;13:853-860. [PubMed] [DOI] |
| 23. | Oki M, Watanabe N, Owada T, Oya Y, Ikeda K, Saito Y, Matsumura R, Seto Y, Iwamoto I, Nakajima H. A functional polymorphism in B and T lymphocyte attenuator is associated with susceptibility to rheumatoid arthritis. Clin Dev Immunol. 2011;2011:305656. [PubMed] [DOI] |
| 24. | Chinese Society of Hepatology and Chinese Society of Infectious Diseases, Chinese Medical Association. [The guideline of prevention and treatment for chronic hepatitis B (2010 version)]. Zhonghua Gan Zang Bing Za Zhi. 2011;19:13-24. [PubMed] |
| 25. | Rabinowitz D, Laird N. A unified approach to adjusting association tests for population admixture with arbitrary pedigree structure and arbitrary missing marker information. Hum Hered. 2000;50:211-223. [PubMed] |
| 26. | Horvath S, Xu X, Lake SL, Silverman EK, Weiss ST, Laird NM. Family-based tests for associating haplotypes with general phenotype data: application to asthma genetics. Genet Epidemiol. 2004;26:61-69. [PubMed] [DOI] |
| 27. | Excoffier L, Slatkin M. Maximum-likelihood estimation of molecular haplotype frequencies in a diploid population. Mol Biol Evol. 1995;12:921-927. [PubMed] |
| 28. | Watanabe N, Gavrieli M, Sedy JR, Yang J, Fallarino F, Loftin SK, Hurchla MA, Zimmerman N, Sim J, Zang X. BTLA is a lymphocyte inhibitory receptor with similarities to CTLA-4 and PD-1. Nat Immunol. 2003;4:670-679. [PubMed] [DOI] |
| 29. | Jonsson JJ, Foresman MD, Wilson N, McIvor RS. Intron requirement for expression of the human purine nucleoside phosphorylase gene. Nucleic Acids Res. 1992;20:3191-3198. [PubMed] |
| 30. | Zhang K, Calabrese P, Nordborg M, Sun F. Haplotype block structure and its applications to association studies: power and study designs. Am J Hum Genet. 2002;71:1386-1394. [PubMed] |
| 31. | Glaser B, Holmans P. Comparison of methods for combining case-control and family-based association studies. Hum Hered. 2009;68:106-116. [PubMed] [DOI] |
| 32. | Reich DE, Goldstein DB. Detecting association in a case-control study while correcting for population stratification. Genet Epidemiol. 2001;20:4-16. [PubMed] [DOI] |