修回日期: 2015-03-26
接受日期: 2015-04-01
在线出版日期: 2015-05-18
目的: 研究JZL184对结直肠癌细胞系细胞凋亡的影响及其可能的机制.
方法: 分别用JZL184, JZL184联合不同浓度5-氟尿嘧啶(5-fluorouracil, 5-Fu)及单用5-Fu干预SW480和Lovo 48 h, 流式细胞仪检测结直肠癌细胞系SW480和Lovo细胞凋亡率变化. Western blot检测JZL184干预SW480及Lovo 48 h后p-AKT、p-mTOR、pro-Caspase3和pro-Caspase8蛋白水平的变化.
结果: 在结直肠癌细胞系SW480及Lovo中, JZL184联合5-Fu与单用5-Fu组相比细胞凋亡不同程度增加(在SW480中凋亡率提升分别为: JZL184+500 μmol/L 5-Fu 13.91%±9.13%, JZL184+200 μmol/L 5-Fu 26.34%±13.32%, JZL184+100 μmol/L 5-Fu 43.32%±8.04%, JZL184+10 μmol/L 5-Fu 31.4%±5.82%; 在Lovo中凋亡率提升分别为: JZL184+500 μmol/L 5-Fu 17.56%±8.14%, JZL184+200 μmol/L 5-Fu 33.04%±9.49%, JZL184+100 μmol/L 5-Fu 36.91%±16.63%, JZL184+10 μmol/L 5-Fu 21.26%±11.03%. 与对照组相比, 10 μmol/L JZL184可不同程度抑制结直肠癌细胞系SW480及Lovo p-AKT、p-mTOR、pro-Caspase3、pro-Caspase8蛋白水平(P<0.05).
结论: JZL184抑制AKT-mTOR通路及促进pro-Caspase8和pro-Caspase3裂解活化从而增强5-Fu诱导结直肠癌细胞系SW480, Lovo细胞凋亡, 提高结直肠癌细胞系对5-Fu敏感性.
核心提示: 单酰基甘油脂肪酶脂肪酶抑制剂JZL184可通过活化pro-Caspase8和pro-Caspase 3及抑制AKT-mTOR通路促进5-氟尿嘧啶(5-fluorouracil)诱导结直肠癌细胞系细胞凋亡增多, 提高结直肠癌细胞系对化疗药物敏感性, 因此单酰基甘油脂肪酶脂肪酶是治疗结直肠癌潜在靶点而JZL184可能成为结直肠癌新的治疗手段.
引文著录: 马牧原, 白洁, 常伟龙, 陶凯雄. 单酰基甘油脂肪酶抑制剂JZL184对结直肠癌细胞系凋亡的影响及其机制. 世界华人消化杂志 2015; 23(14): 2256-2263
Revised: March 26, 2015
Accepted: April 1, 2015
Published online: May 18, 2015
AIM: To investigate whether JZL184, a monoacylglycerol lipase inhibitor, induces apoptosis of colorectal cancer cells and to explore the possible mechanism.
METHODS: SW480 and Lovo cells were treated with JZL184, JZL184 + 5-fluorouracil (5-Fu) or 5-Fu alone for 48 h. Apoptosis was assessed by flow cytometry. The protein levels of p-AKT, p-mTOR, pro-Caspase3 and pro-Caspase8 were assessed by Western blot.
RESULTS: Treatment with JZL184 + 5-Fu increased SW480 and Lovo cell apoptosis more significantly than 5-Fu alone (apoptosis increase in SW480 cells: JZL184 + 500 μmol/L 5-Fu 13.91% ± 9.13%, JZL184 + 200 μmol/L 5-Fu 26.34% ± 13.32%, JZL184 + 100 μmol 5-Fu 43.32% ± 8.04%, JZL184 + 10 μmol 5-Fu 31.4% ± 5.82%; Lovo cells: JZL184 + 500 μmol/L 5-Fu 17.56% ± 8.14%, JZL184 + 200 μmol/L 5-Fu 33.04% ± 9.49%, JZL184 + 100 μmol/L 5-Fu 36.91% ± 16.63%, JZL184 + 10 μmol/L 5-Fu 21.26% ± 11.03%). Treatment with JZL184 significantly decreased the protein levels of p-AKT, p-mTOR, pro-Caspase3 and pro-Caspase8 in colorectal cancer SW480 and Lovo cells (P < 0.05).
CONCLUSION: JZL184 can inhibit the AKT-mTOR pathway and promote pro-Caspase8 and pro-Caspase3 activation to increase the apoptosis of SW480 and Lovo cells treated with 5-Fu.
- Citation: Ma MY, Bai J, Chang WL, Tao KX. Effect of monoacylglycerol lipase inhibitor JZL184 on apoptosis of colorectal cancer cells. Shijie Huaren Xiaohua Zazhi 2015; 23(14): 2256-2263
- URL: https://www.wjgnet.com/1009-3079/full/v23/i14/2256.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i14.2256
单酰基甘油脂肪酶(monoacylglycerol lipase, MAGL)是一种将三酰甘油分解为游离脂肪酸和甘油的丝氨酸水解酶[1]. 在神经系统中, MAGL是2-花生四烯酸(2-arachidonylglycerol, 2-AG)水解的关键酶[2]. 而2-AG是内源性大麻素系统组成部分, 之前研究[3,4]发现内源性大麻素与机体脑损伤保护, 免疫应答, 炎症反应等有关. JZL184是MAGL高选择性抑制剂, 已有研究[5]证明, JZL184可有效抑制MAGL活性, 并且有效地升高颅内2-AG水平. 基于此, 对于MAGL的研究主要集中在水解2-AG及其对内大麻素系统影响[6]. 2010年, Nomura等[7]研究发现, MAGL在一些高侵袭性肿瘤中高表达, 并且MAGL可以通过调控脂肪酸代谢网络影响肿瘤侵袭及转移. 本科室之前的研究[8]发现MAGL在大肠癌中高表达, 而且MAGL表达水平与患者BMI相关. 利用siRNA及JZL184干扰大肠癌细胞系中MAGL表达, 肿瘤细胞系凋亡增多, Cyclin D1和Bcl-2表达量降低, 但是抑制MAGL活性与肿瘤凋亡的关系尚不清楚. 本研究使用JZL184抑制MAGL活性, 检测JZL184联合5-氟尿嘧啶(5-fluorouracil, 5-Fu)对结直肠癌细胞系凋亡影响, 探讨JZL184对结直肠癌凋亡的作用及与相关凋亡蛋白之间的关系, 以寻找结直肠癌治疗新的靶点及措施.
DMEM高糖培养基购自美国Hyclone公司; 10%胎牛血清购自美国Gibco公司; 二甲基亚砜(dimethyl sulphoxide, DMSO); 5-Fu及GAPDH一抗购自美国Sigma公司; Annexin-V FITC/PI试剂盒购自南京凯基公司; p-AKT(Ser473)、p-mTOR(Ser2448)、pro-Caspase3及pro-Caspase8一抗购自美国Cell Signal Technology公司; 过氧化物酶标记羊抗兔二抗购自武汉博士德公司.
1.2.1 细胞培养: 结直肠癌细胞系SW480及Lovo由武汉协和医院胃肠外科实验室存放, 培养条件10%胎牛血清, DMEM培养基, 在37 ℃, 50 mL/L CO2培养箱中培养.
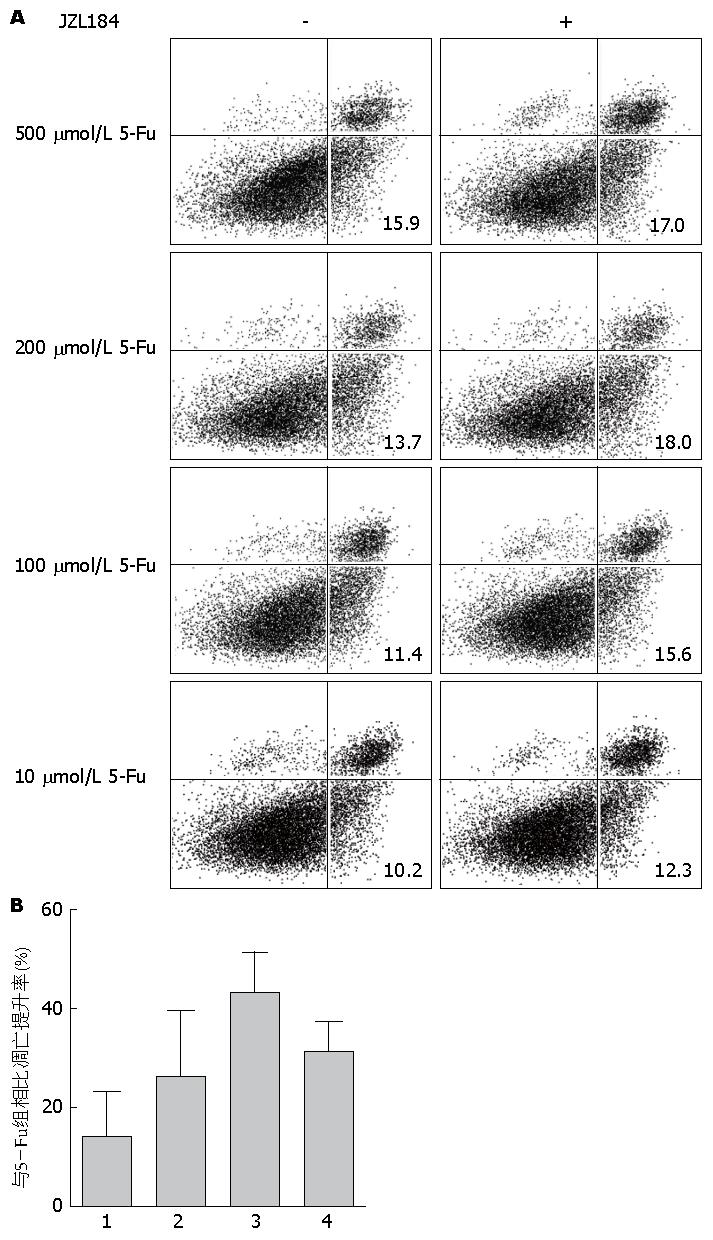
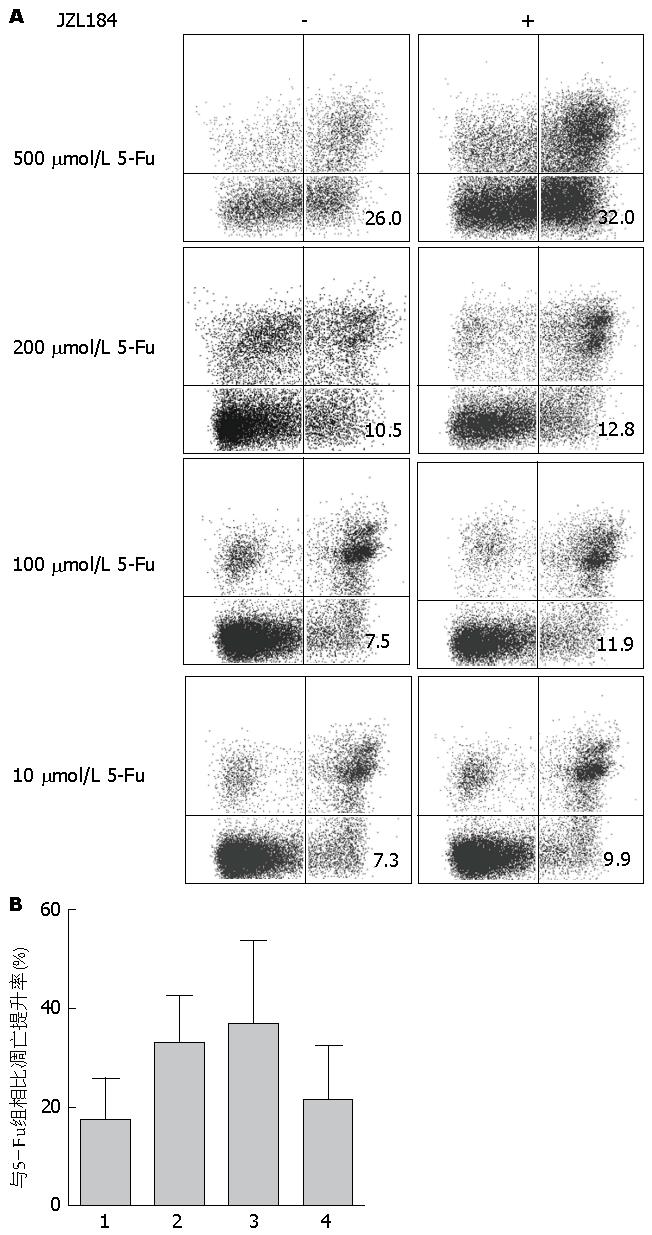
1.2.2 AnnexinV-FITC/PI双标法检测细胞凋亡: JZL184溶解在DMSO中, 使用10 μmol/L JZL184分别联合500、200、100、10 μmol/L的5-Fu处理结直肠癌细胞系SW480, Lovo, 对照组为单用不同浓度5-Fu. 干预48 h后, 胰酶消化收集各组细胞后, 按照AnnexinV-FITC/PI试剂盒说明书加入相应试剂. 凋亡率 = 右下象限细胞数量/上机总细胞数量. 实验重复3次. 凋亡提升率(%) = (实验组凋亡率-对照组凋亡率)/对照组凋亡率.
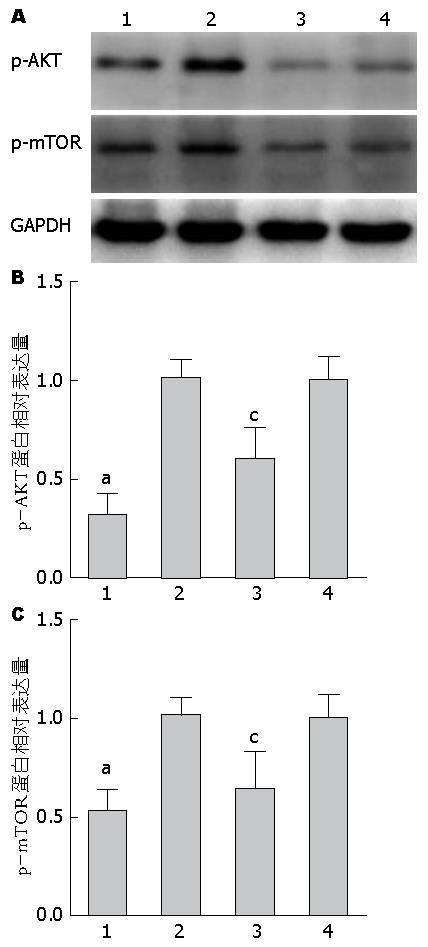
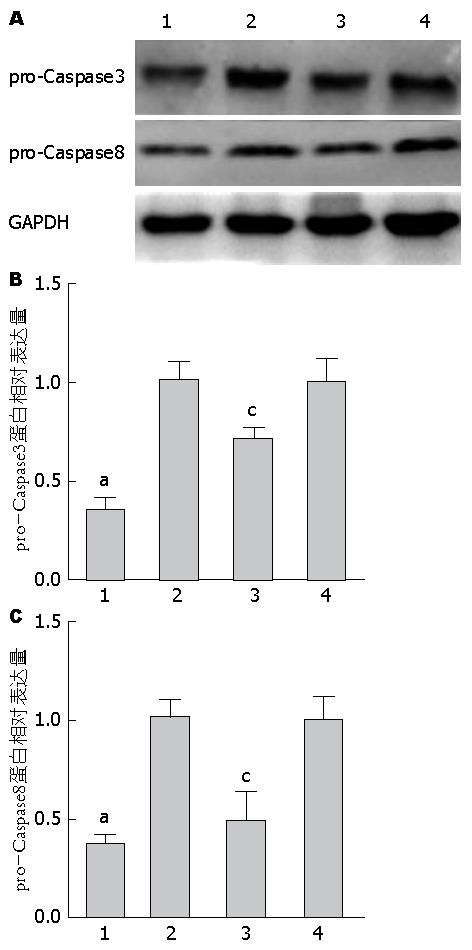
1.2.3 Western blot检测p-AKT、p-mTOR、pro-Caspase3、pro-Caspase8蛋白水平: 10 μmol/L JZL184干预结直肠癌细胞系SW480及Lovo, 48 h后提取蛋白, BCA法测定蛋白浓度. 取等量蛋白样品, 依据蛋白质分子量大小分别选用6%及10%SDS-PAGE分离, 电泳后转膜, 室温封闭2 h后, 分别加入p-AKT/p-mTOR/pro-Caspase3/pro-Caspase8一抗4 ℃孵育过夜, 二抗室温孵育1 h, ECL发光剂发光, Bio-Red凝胶成像分析仪器扫描图像, 并利用Image Lab分析图片条带灰度. 结果以GAPDH作为内参, 采用相对于对照组蛋白表达量的倍数表示.
统计学处理 所有实验重复3次, 采用SPSS18.0软件进行统计学分析, 计量资料用mean±SD表示, 组间均数比较采用单因素方差分析及t检验, P<0.05为差异有统计学意义.
与单用5-Fu组相比, JZL184联合用药组细胞凋亡率不同程度的提升. 在SW480中凋亡率提升分别为: JZL184+500 μmol/L 5-Fu 13.91%±9.13%, JZL184+200 μmol/L 5-Fu 26.34%±13.32%, JZL184+100 μmol 5-Fu 43.32%±8.04%, JZL184+10 μmol 5-Fu 31.4%±5.82%; 在Lovo中凋亡率提升分别为: JZL184+500 μmol/L 5-Fu 17.56%±8.14%, JZL184+200 μmol/L 5-Fu 33.04%±9.49%, JZL184+100 μmol/L 5-Fu 36.91%±16.63%, JZL184+10 μmol/L 5-Fu 21.26%±11.03%(图1, 图2).
10 μmol/L JZL184干预结直肠癌细胞系SW480和Lovo, 与对照组相比, p-AKT蛋白相对表达量在SW480及Lovo细胞系均明显下降(P<0.05), p-mTOR蛋白相对表达量SW480及Lovo细胞系均明显下降(P<0.05)(图3).
10 μmol/L JZL184干预结直肠癌细胞系SW480和Lovo, 与对照组相比, pro-Caspase3蛋白相对表达量在SW480及Lovo细胞系均明显下降(P<0.05), pro-Caspase8蛋白相对表达量SW480及Lovo细胞系均明显下降(P<0.05)(图4).
MAGL作为2-AG水解关键酶, 通过影响内大麻素系统从而在外周组织及中枢神经系统发挥重要作用. 最新的研究[9-11]表明, 内大麻素系统在部分肿瘤中可以抑制癌细胞增殖, 诱导肿瘤细胞凋亡, 在肿瘤生长中影响肿瘤血管生成. Nomura等[7]发现MAGL通过MAGL-FFA通路影响脂肪酸代谢, 从而导致一系列的脂质信号分子改变, 如溶血磷脂酰胆碱(lysoph-osphatidylcholine, LPC), 溶血磷脂酸乙醇胺(lysophosphatidylethanolamine, LPE), 溶血磷脂酸(lysophosphatidic, LPA)和前列腺素E2(prostaglandin E2, PGE2), 特别是PGE2和LPA在已有的研究[12]中发现与肿瘤增殖和转移密切相关. 并且Nomura等[13]还发现在雄激素依赖的前列腺癌中, MAGL通过大麻素系统和脂肪酸网络同时影响肿瘤细胞增殖和转移.
AKT-mTOR分子通路是细胞信号分子通路的重要部分, AKT属于PI3K下游[14], 具有两个磷酸化位点丝氨酸蛋白(Ser473)及苏氨酸蛋白(Thr308)[15]. AKT在肿瘤细胞中作用广泛, 大肠癌中磷酸化AKT激活下游靶蛋白, 从而抑制大肠癌凋亡及促进血管生成等[16], 并且抑制AKT磷酸化可增加结肠癌对化疗药物敏感性[17]. mTOR与AKT同样属于丝氨酸苏氨酸蛋白家族激酶, 调控细胞生长及增殖[18]. AKT-mTOR通路异常激活可以减少大肠癌细胞凋亡, 促进肿瘤细胞转移和侵袭[19,20], 并且大肠癌组织中, p-AKT及mTOR过表达与肿瘤分期及预后有着密切的关系[21,22].
肿瘤发生发展与细胞凋亡之间的关系密不可分, 而Caspase家族在细胞凋亡中发挥重要作用. 这其中Caspase3作为重要凋亡执行因子, 处在凋亡级联反应下游, 他的活化可以导致细胞凋亡不可逆转[23]. 研究[24]表明Caspase3活化异常与大肠癌分化程度等密切相关, 除此之外, 有研究[25]表明在耐药细胞中Caspase3活性降低与肿瘤耐药有重要作用. 非活化形式pro-Caspase3存在于细胞中, 上游凋亡蛋白如非活化形式的pro-Caspase8自我活化后会激活其下游Caspase3, 使得pro-Caspase3裂解为有催化活性的功能体, 导致细胞凋亡[24].
本科室之前的研究[8]表明, siRNA及JZL184干扰MAGL表达或活性会导致结直肠癌细胞系凋亡增多, 细胞增殖能力下降. 在本研究中, 我们发现, 10 μmol/L JZL184联合不同浓度5-Fu相对于单用5-Fu组, 可以导致结直肠癌细胞系肿瘤凋亡率的不同程度提高, 这提示JZL184亦可增加结直肠癌细胞系对5-Fu的敏感性. 此外, 我们首次发现10 μmol/L JZL184干预后的结直肠癌细胞系, 其p-AKT及p-mTOR蛋白水平下降, 表明JZL184可能通过AKT-mTOR通路影响肿瘤生长及细胞凋亡并提高结直肠癌细胞对化疗药物敏感性. 并且与细胞凋亡密切相关的pro-Caspase3和pro-Caspase8蛋白水平下降, 表明JZL184可诱导pro-Caspase8活化从而分解为活性片段, 导致pro-Caspase8蛋白水平下降; pro-Caspase8裂解后进一步激活pro-Caspase3裂解活化, 使得pro-Caspase3蛋白水平下降, pro-Caspase3裂解后的活性片段最终导致细胞凋亡. 而有研究[25-29]报道证实AKT磷酸化过程可以影响Caspase8活化, 并且AKT通路可以调控与Caspase8密切相关的Fas介导细胞凋亡途径, 因此JZL184可能通过AKT磷酸化水平影响pro-Caspase8活化从而调控pro-Caspase3裂解活化来影响结直肠癌细胞系细胞凋亡及肿瘤耐药性.
MAGL对于肿瘤生长的影响, 一方面可通过MAGL-FFA通路调控下游与肿瘤发生发展密切相关的脂质信号分子表达; 另外也可以通过水解2-AG来调控内大麻素系统从而影响肿瘤生长及侵袭等. JZL184是否通过上述两种调控机制来抑制肿瘤生长目前仍不清楚, 并且AKT/mTOR及pro-Caspase8/pro-Caspase3与MAGL-FFA及内大麻素系统之间关系尚不明确, 这些都是我们下一步研究需要解决的问题.
总之, 本研究证明JZL184联合5-Fu可诱导结直肠癌细胞系细胞凋亡增多, 提高肿瘤细胞系对5-Fu敏感性, JZL184可能通过抑制AKT-mTOR通路及活化pro-Caspase8和pro-Caspase3进而诱导结直肠癌细胞系细胞凋亡及抑制肿瘤耐药性. 这些结果表明JZL184可能会成为治疗结直肠癌新的治疗药物, 并且MAGL可能成为结直肠癌治疗的潜在靶点.
JZL184是单酰基甘油酯脂肪酶(monoacylglycerol lipase, MAGL)选择性抑制剂. MAGL是甘油三酯代谢中关键酶, 可将甘油三酯分解为游离脂肪酸并且MAGL是内大麻素系统中2-花生四烯酸水解关键酶. MAGL通过调控脂肪酸网络或内大麻素系统影响多种肿瘤的恶性行为.
杜雅菊, 教授, 哈尔滨医科大学附属第二医院消化内科
MAGL除了参与脂代谢及内大麻素系统调控外, 近年来研究发现MAGL与多种恶性肿瘤的细胞增殖、细胞凋亡及侵袭能力等密切相关. AKT-mTOR通路是体内重要的信号通路, 而Caspase家族是细胞凋亡过程重要组成部分, 上述两者一直是肿瘤研究的热点.
Nomura等发现MAGL调控脂肪酸网络增加多种恶性肿瘤侵袭性, Ye等研究发现MAGL在结直肠癌中高表达, 抑制MAGL基因表达可降低结直肠癌细胞系增殖能力、促使细胞周期阻滞及诱导肿瘤细胞凋亡.
本实验中JZL184可提高结直肠癌细胞系对5-氟尿嘧啶(5-fluorouracil, 5-Fu)敏感性, 提高5-Fu诱导肿瘤细胞凋亡的能力, 并发现JZL184抑制AKT-mTOR通路并活化pro-Caspase8及pro-Caspase3, 揭示MAGL与结直肠癌凋亡及肿瘤耐药间的相关机制.
目前MAGL与多种肿瘤相关但其机制仍缺乏详细的研究. 本研究发现JZL184与结直肠癌化疗药物敏感性的关系及其中可能机制, 为MAGL与结直肠癌关系提供新的思路, 并为MAGL及JZL184成为结直肠癌化疗耐药性治疗的分子靶点及治疗药物提供了一定的理论基础.
Caspase8: 在体内以无活性的酶原形式(pro-Caspase8)存在于成人及除胎儿脑组织外的各种组织中, 能启动死亡受体介导的凋亡; Caspase3: 是细胞凋亡重要的执行分子, 在上游凋亡信号作用下, Caspase3由非活化形式的pro-Caspase3裂解为活性片段, 作用于下游底物从而导致细胞凋亡.
本文探讨JZL184联合常规化疗药物5-Fu对结直肠癌细胞的影响及机制, 为结直肠癌的联合治疗方案提供理论基础, 故本文的完成具有一定的临床意义.
编辑: 郭鹏 电编: 闫晋利
| 1. | King AR, Lodola A, Carmi C, Fu J, Mor M, Piomelli D. A critical cysteine residue in monoacylglycerol lipase is targeted by a new class of isothiazolinone-based enzyme inhibitors. Br J Pharmacol. 2009;157:974-983. [PubMed] [DOI] |
| 2. | Blankman JL, Simon GM, Cravatt BF. A comprehensive profile of brain enzymes that hydrolyze the endocannabinoid 2-arachidonoylglycerol. Chem Biol. 2007;14:1347-1356. [PubMed] [DOI] |
| 3. | Hermanson DJ, Marnett LJ. Cannabinoids, endocannabinoids, and cancer. Cancer Metastasis Rev. 2011;30:599-612. [PubMed] [DOI] |
| 4. | Panikashvili D, Simeonidou C, Ben-Shabat S, Hanus L, Breuer A, Mechoulam R, Shohami E. An endogenous cannabinoid (2-AG) is neuroprotective after brain injury. Nature. 2001;413:527-531. [PubMed] [DOI] |
| 5. | Long JZ, Li W, Booker L, Burston JJ, Kinsey SG, Schlosburg JE, Pavón FJ, Serrano AM, Selley DE, Parsons LH. Selective blockade of 2-arachidonoylglycerol hydrolysis produces cannabinoid behavioral effects. Nat Chem Biol. 2009;5:37-44. [PubMed] [DOI] |
| 6. | Pisanti S, Picardi P, D'Alessandro A, Laezza C, Bifulco M. The endocannabinoid signaling system in cancer. Trends Pharmacol Sci. 2013;34:273-282. [PubMed] [DOI] |
| 7. | Nomura DK, Long JZ, Niessen S, Hoover HS, Ng SW, Cravatt BF. Monoacylglycerol lipase regulates a fatty acid network that promotes cancer pathogenesis. Cell. 2010;140:49-61. [PubMed] [DOI] |
| 8. | Ye L, Zhang B, Seviour EG, Tao KX, Liu XH, Ling Y, Chen JY, Wang GB. Monoacylglycerol lipase (MAGL) knockdown inhibits tumor cells growth in colorectal cancer. Cancer Lett. 2011;307:6-17. [PubMed] [DOI] |
| 9. | Gustafsson SB, Palmqvist R, Henriksson ML, Dahlin AM, Edin S, Jacobsson SO, Öberg Å, Fowler CJ. High tumour cannabinoid CB1 receptor immunoreactivity negatively impacts disease-specific survival in stage II microsatellite stable colorectal cancer. PLoS One. 2011;6:e23003. [PubMed] [DOI] |
| 10. | Guzmán M. Cannabinoids: potential anticancer agents. Nat Rev Cancer. 2003;3:745-755. [PubMed] [DOI] |
| 11. | Zeestraten EC, Benard A, Reimers MS, Schouten PC, Liefers GJ, van de Velde CJ, Kuppen PJ. The prognostic value of the apoptosis pathway in colorectal cancer: a review of the literature on biomarkers identified by immunohistochemistry. Biomark Cancer. 2013;5:13-29. [PubMed] [DOI] |
| 12. | Yamada T, Sato K, Komachi M, Malchinkhuu E, Tobo M, Kimura T, Kuwabara A, Yanagita Y, Ikeya T, Tanahashi Y. Lysophosphatidic acid (LPA) in malignant ascites stimulates motility of human pancreatic cancer cells through LPA1. J Biol Chem. 2004;279:6595-6605. [PubMed] [DOI] |
| 13. | Nomura DK, Lombardi DP, Chang JW, Niessen S, Ward AM, Long JZ, Hoover HH, Cravatt BF. Monoacylglycerol lipase exerts dual control over endocannabinoid and fatty acid pathways to support prostate cancer. Chem Biol. 2011;18:846-856. [PubMed] [DOI] |
| 14. | Katso R, Okkenhaug K, Ahmadi K, White S, Timms J, Waterfield MD. Cellular function of phosphoinositide 3-kinases: implications for development, homeostasis, and cancer. Annu Rev Cell Dev Biol. 2001;17:615-675. [PubMed] [DOI] |
| 15. | Hill MM, Hemmings BA. Inhibition of protein kinase B/Akt. implications for cancer therapy. Pharmacol Ther. 2002;93:243-251. [PubMed] |
| 17. | Abdul-Ghani R, Serra V, Györffy B, Jürchott K, Solf A, Dietel M, Schäfer R. The PI3K inhibitor LY294002 blocks drug export from resistant colon carcinoma cells overexpressing MRP1. Oncogene. 2006;25:1743-1752. [PubMed] [DOI] |
| 18. | 常 立功, 黄 培林. mTOR信号通路与大肠癌演进相关性的研究进展. 东南大学学报(医学版). 2013;32:243-247. |
| 19. | López-Knowles E, O'Toole SA, McNeil CM, Millar EK, Qiu MR, Crea P, Daly RJ, Musgrove EA, Sutherland RL. PI3K pathway activation in breast cancer is associated with the basal-like phenotype and cancer-specific mortality. Int J Cancer. 2010;126:1121-1131. [PubMed] [DOI] |
| 20. | Huynh H. Molecularly targeted therapy in hepatocellular carcinoma. Biochem Pharmacol. 2010;80:550-560. [PubMed] [DOI] |
| 22. | 汪 砥, 陈 健, 陈 辉, 段 智, 许 奇美, 韦 妹艳, 王 亮华, 钟 美佐. 瘦素与p-mTOR在大肠癌中的表达及临床意义. 中南大学学报(医学版). 2012;37:233-237. |
| 23. | Adrain C, Brumatti G, Martin SJ. Apoptosomes: protease activation platforms to die from. Trends Biochem Sci. 2006;31:243-247. [PubMed] [DOI] |
| 25. | Eicher C, Dewerth A, Kirchner B, Warmann SW, Fuchs J, Armeanu-Ebinger S. Development of a drug resistance model for hepatoblastoma. Int J Oncol. 2011;38:447-454. [PubMed] [DOI] |
| 27. | Cardone MH, Roy N, Stennicke HR, Salvesen GS, Franke TF, Stanbridge E, Frisch S, Reed JC. Regulation of cell death protease caspase-9 by phosphorylation. Science. 1998;282:1318-1321. [PubMed] |
| 28. | Shim D, Kang HY, Jeon BW, Kang SS, Chang SI, Kim HY. Protein kinase B inhibits apoptosis induced by actinomycin D in ECV304 cells through phosphorylation of caspase 8. Arch Biochem Biophys. 2004;425:214-220. [PubMed] [DOI] |
| 29. | Li Y, Song YH, Mohler J, Delafontaine P. ANG II induces apoptosis of human vascular smooth muscle via extrinsic pathway involving inhibition of Akt phosphorylation and increased FasL expression. Am J Physiol Heart Circ Physiol. 2006;290:H2116-H2123. [PubMed] [DOI] |