修回日期: 2015-03-20
接受日期: 2015-03-25
在线出版日期: 2015-05-08
目的: 探讨新生期母婴分离对成年大鼠血浆nesfatin-1的影响及其与大鼠内脏敏感性的关系.
方法: 新生♂SD大鼠随机分为母婴分离组和正常组. 母婴分离组大鼠自出生后第2-15天, 每天上午8:00-11:00将幼鼠与母鼠分开, 其余时间与母鼠共笼饲养, 正常组幼鼠不做处理. 第8周时, 大鼠接受结直肠扩张(colorectal distension, CRD), 检测腹壁撤退反射(abdominal withdrawal reflex, AWR)和腹外斜肌放电活动(electromyographic, EMG), ELISA法检测血浆nesfatin-1和糖皮质激素(glucocorticoid, GC)水平.
结果: 第8周时, 母婴分离大鼠的体质量明显低于正常对照组. 母婴分离大鼠血浆nesfatin-1、GC水平均明显高于正常大鼠, 且血浆nesfatin-1水平与GC水平呈正相关. 当CRD压力为40、60和80 mmHg时, 母婴分离大鼠的AWR评分和EMG曲线下面积均明显高于正常对照. 并且母婴分离大鼠的AWR评分和EMG曲线下面积均与血浆nesfatin-1水平呈正相关关系.
结论: 新生期母婴分离诱导成年大鼠的内脏高敏感性和血浆nesfatin-1水平的升高. 内脏高敏感性可能与血浆nesfatin-1水平的升高有关.
核心提示: 本研究通过母婴分离方法建立内脏高敏感大鼠模型, 发现母婴分离大鼠血浆nesfatin-1水平明显升高, 并且血浆nesfatin-1与大鼠的内脏敏感性呈正相关关系.
引文著录: 周小平, 黄琳, 李学良, 林琳. 母婴分离大鼠血浆nesfatin-1与内脏敏感性的关系. 世界华人消化杂志 2015; 23(13): 2104-2110
Revised: March 20, 2015
Accepted: March 25, 2015
Published online: May 8, 2015
AIM: To explore the effect of neonatal maternal separation on the concentration of serum nesfatin-1 in rats.
METHODS: Newborn male Sprague-Dawley rats were randomly divided into either a maternal separation group or a control group. Rats in the maternal separation group received maternal separation from postnatal days 2-15. At the 8th postnatal week, the abdominal withdrawal reflex (AWR) and electromyographic (EMG) amplitude of the external oblique muscle in response to graded colorectal distension (CRD) were examined. The levels of serum nesfatin-1 and glucocorticoid were detected using ELISA.
RESULTS: At the 8th postnatal week, the body weight of rats in the maternal separation group was significantly lower than that in the normal control group. The levels of serum nesfatin-1 and glucocorticoid in maternal separation group were statistically higher than those in the control group. The level of glucocorticoid was positively correlated with serum nesfatin-1 level. When the balloon pressure was set at 40, 60 and 80 mmHg, AWR score and EMG amplitude in the maternal separation group were significantly higher than those in the normal control group. AWR score and EMG amplitude in the maternal separation group were positively correlated with the level of serum nesfatin-1.
CONCLUSION: Rats subjected to maternal separation showed a higher AWR score and EMG amplitude, as well as elevated levels of serum nesfatin-1. Visceral hypersensitivity induced by neonatal maternal separation may be associated with elevated level of serum nesfatin-1.
- Citation: Zhou XP, Huang L, Li XL, Lin L. Effect of neonatal maternal separation on serum level of nesfatin-1 in rats. Shijie Huaren Xiaohua Zazhi 2015; 23(13): 2104-2110
- URL: https://www.wjgnet.com/1009-3079/full/v23/i13/2104.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i13.2104
肠易激综合征(irritable bowel syndrome, IBS)是一种常见的功能性胃肠疾病, 其特征是腹痛或腹部不适伴有排便习惯的改变, 但缺乏引起这些症状的器质性病变及生物学异常. 到目前为止, IBS的发病机制不完全清楚. 多种因素包括遗传因素、胃肠道动力异常、肠道黏膜的低度炎症、内脏高敏感性、脊髓感觉传入神经功能异常以及脑-肠轴功能失调等均参与了IBS的发病过程[1-3]. 内脏高敏感性是指内脏组织对各种刺激的敏感性增加. 近年来, 有学者将内脏高敏感性作为IBS的生物学标记, 其在IBS的发生发展过程中具有重要的作用[4]. 他的形成包含了中枢和外周机制.
应激在IBS的发生发展中的作用已经得到广泛证实, 既可以导致IBS的发生也可以加重IBS患者的症状; 幼年时期有过精神创伤史的人, 其发生IBS的几率明显增加. 促肾上腺皮质激素释放激素(corticotropin releasing factor, CRF)在IBS内脏高敏感的发生发展过程中具有重要作用[5]. 研究[6]发现, IBS患者存在下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal, HPA轴)的功能异常.
Nesfatin-1是2006年由日本学者新发现的一种摄食调节肽, 他是由核组蛋白2(nucleobindin-2, NUCB2)在激素原转化酶的作用下裂解而来的包含第1-82位的氨基酸残基构成的蛋白分子片段, 在中枢, nesfatin-1主要分布于一些与摄食调节相关的神经核团, 比如下丘脑室旁核、孤束核以及蓝斑等[7,8]. 中枢nesfatin-1可呈剂量依赖性的降低大鼠体质量[7]. 此外, nesfatin-1还参与了应激调节过程, 有文献报道, nesfatin-1可能激活大鼠下丘脑-垂体-肾上腺轴(HPA轴)[9]. 第三脑室内注射nesfatin-1增加大鼠的焦虑和恐惧行为[10]. 另有文献[11]报道, 束缚应激可增加下丘脑视上核、视旁核、孤束核、蓝斑等核团的nesfatin-1免疫阳性细胞数. 在下丘脑中, nesfatin-1与CRF共表达[12], 并且可使下丘脑CRF神经元发生去极化[13]; 以上结果均提示nesfatin-1在应激反应过程中有重要作用.
我们的前期研究[14]发现, 在结直肠灌肠所致IBS内脏高敏感大鼠模型中, 侧脑室注射抗nesfatin-1(anti-nesfatin-1/NUCB2)抗体可明显降低模型鼠的AWR评分以及EMG曲线下面积, 并证实nesfatin-1可能通过CRF/CRFR1途径参与了内脏高敏感的发生. 众所周知, 应激在IBS的发生发展中具有重要的作用, 精神心理应激亦是内脏高敏感发生的重要因素之一. 新生期经过母婴分离处理的大鼠, 成年后可表现为内脏高敏感. 那么新生期母婴分离对大鼠血浆nesfatin-1有何影响? 其是否与大鼠的内脏敏感性有关? 本研究主要探讨新生期母婴分离对血浆nesfatin-1及HPA轴的影响及血浆nesfatin-1与大鼠内脏敏感性的相关性.
健康初产Sprague-Dawley(SD)孕大鼠[南京医科大学实验动物中心, 合格证号: scxk(苏)2008-0004]在明暗各12 h(6:00-18:00)周期, 温度21 ℃-23 ℃, 湿度60%的室温环境中饲养, 大鼠自由饮食及饮水. 分娩后, 根据新生大鼠的肛门距尿道的距离来判断大鼠的性别, 因♂大鼠对各种刺激的耐受性及反应性较好, 故本实验剔除♀大鼠. PowerLab电生理记录分析仪、ML132生物电放大器(澳大利亚AD公司). Nesfatin-1ELISA试剂盒(美国Phoenix Pharmaceuticals公司)、糖皮质激素(glucocorticoid, GC)ELISA试剂盒(美国RD公司).
1.2.1 母婴分离: 参考文献中母婴分离方法[15], 新生♂SD大鼠随机分成母婴分离组(maternal separation, MS)和正常对照组. MS组大鼠, 从出生后第2-16天, 每天早晨8:00-11:00将幼鼠置于单独的老鼠笼内, 每天与母鼠分离3 h. 对照组不与母鼠分离, 其余处理与母婴分离组一致. 第16天以后, 两组大鼠均与母鼠共同饲养至第22天断奶, 待大鼠成年后(第8周)进行下一步实验.
1.2.2 内脏敏感性的检测: 通过检测腹部撤退反射(abdominal withdrawal reflex, WAR)评分和腹外斜肌肌电活动(electromyographic, EMG)来反映大鼠的内脏敏感性. 依据文献中介绍的方法[16], 大鼠用乙醚轻微麻醉后, 将自制的橡胶球囊(约5 cm长)通过肛门插入到直肠和降结肠, 将球囊末端用医用胶布固定于大鼠尾巴根部. 通过观察不同的结直肠扩张(colorectal distension, CRD)压力(20、40、60、80 mmHg)的刺激下大鼠的AWR评分. CRD刺激时, 每个压力持续20 s, 重复3次, 每次之间间隔2 min. AWR的评分标准如下: 1分: CRD刺激时, 无任何反应或仅有头部活动增多; 2分: 腹部肌肉收缩; 3分: 腹部收缩并抬离桌面; 4分: 腹部肌肉明显收缩使身体呈弓形抬起.
用PowerLab电生理记录分析仪和ML132生物电放大器记录在不同压力(20、40、60、80 mmHg)下大鼠腹外斜肌的放电活动(参数设置: 高频滤过3 kHz, 时间常数0.001 s, 采样频率为40 Hz, 灵敏度500 μV, 走纸速度200 ms/div)[17].
1.2.3 血浆nesfatin-1和GC检测: 乙醚轻微麻醉大鼠, 内眦静脉采血约1 mL. 将新采的血离心(3000 r/min, 15 min)后取上清, 放于-80 ℃冰箱保存, 按照ELISA试剂盒说明书检测大鼠血浆nesfatin-1和GC的含量. 每组样品和标准品重复检测两次取平均值, 浓度均以ng/mL表示.
统计学处理 采用SPSS17.0统计软件处理, 所用数据以mean±SD表示, 大鼠AWR评分采用Mann-Whitney秩和检验, EMG数据采用重复测量方差分析, 两组间的其他比较采用独立样本的t检验, 相关性分析采用一般线性回归分析. P<0.05为差异有统计学意义.
在大鼠出生后第20天和第8周分别称其体质量, 观察两组大鼠之间体质量的差别. 结果发现, 出生后20 d, 经过母婴分离处理的大鼠的体质量与正常大鼠相比差异无统计学意义(正常组 vs 模型组: 38.76 g±2.38 g vs 36.35 g±3.49 g), 但是在第8周时, 母婴分离组大鼠的体质量明显低于正常大鼠(正常组 vs 模型组: 309.84 g±5.01 g vs 289.76 g±9.46 g, P<0.01).
2.2.1 AWR评分: CRD压力为20 mmHg时, 母婴分离大鼠的AWR评分与正常对照组相比无差别. 但在扩张压力为40、60和80 mmHg时, 母婴分离大鼠的AWR评分显著高于正常对照组(P<0.05)(表1).
2.2.2 EMG曲线下面积: 在CRD压力为20 mmHg时, 母婴分离组大鼠的EMG曲线下面积与正常对照组没有明显差别. 在压力为40、60和80 mmHg时, 母婴分离大鼠的EMG曲线下面积明显高于正常对照组(P<0.05)(表2).
母婴分离大鼠血浆nesfatin-1水平明显高于正常大鼠(89.32 pg/mL±1.77 pg/mL vs 80.33 pg/mL±5.22 pg/mL, P = 0.0015). 与正常对照组大鼠相比, 母婴分离大鼠血浆GC水平明显升高(130.2 pg/mL±8.64 pg/mL vs 90.44 pg/mL±5.79 pg/mL, P<0.0001).
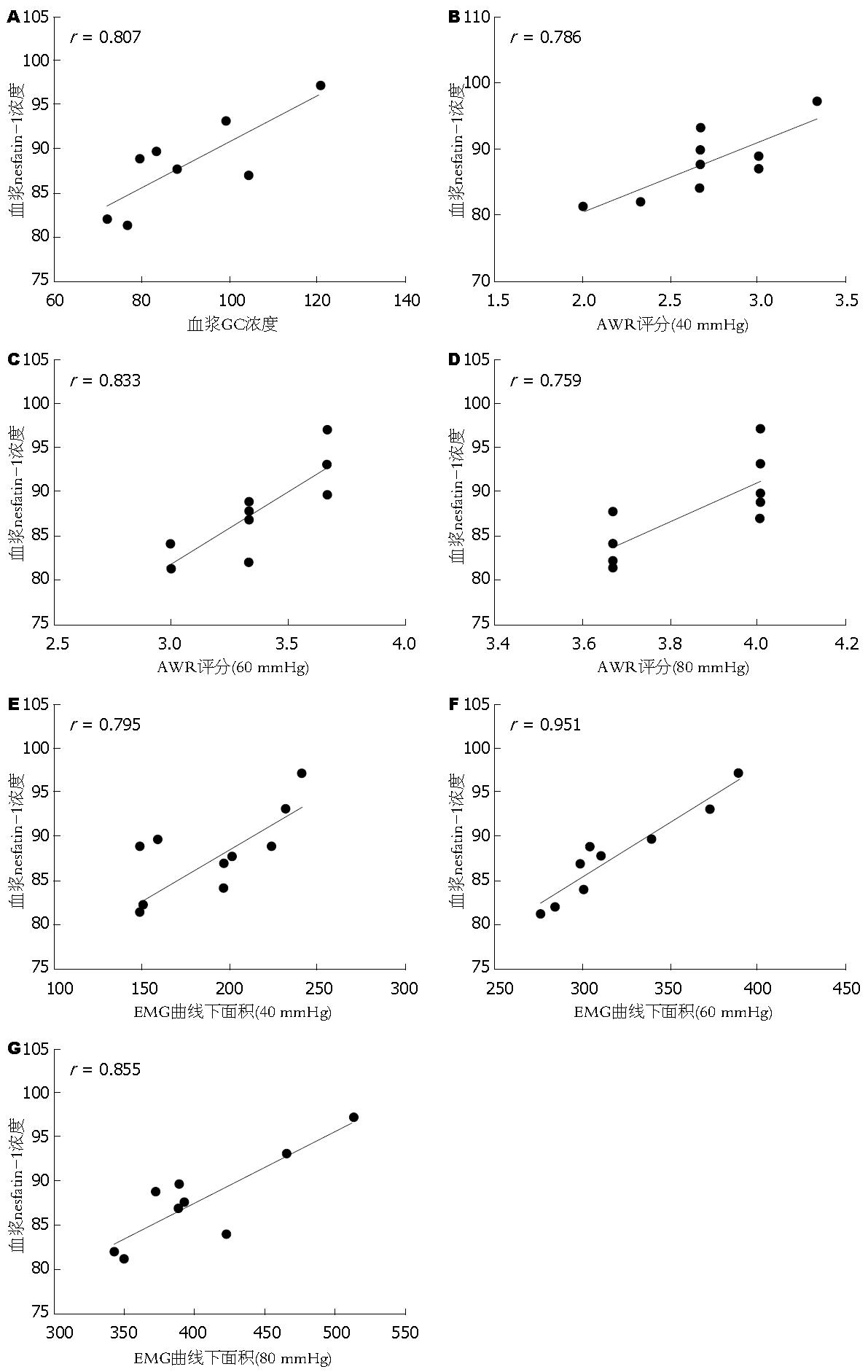
血浆GC水平与nesfatin-1水平之间呈正相关关系(r = 0.807, P = 0.015)(图 1A). 母婴分离大鼠血浆nesfatin-1水平与CRD刺激压力为40、60、80 mmHg时的AWR评分呈正相关(40 mmHg: r = 0.786, P = 0.012; 60 mmHg: r = 0.833, P = 0.005; 80 mmHg: r = 0.759, P = 0.0178)(图1B-D). CRD压力为40、60、80 mmHg时, 母婴分离大鼠血浆nesfatin-1水平与大鼠EMG曲线下面积呈正相关(40 mmHg: r = 0.795, P = 0.011; 60 mmHg: r = 0.951, P<0.0001; 80 mmHg: r = 0.855, P = 0.0033)(图1E-G).
本研究发现, 新生期经过母婴分离处理的大鼠, 成年后其体质量明显低于正常大鼠、内脏敏感性增加、血浆nesfatin-1及GC水平明显升高; 并且在CRD压力为40、60和80 mmHg时, 血浆nesfatin-1水平与大鼠的AWR评分及EMG曲线下面积均呈正相关关系. 提示早期母婴分离可使血浆nesfatin-1水平升高, 并可能与大鼠的内脏高敏感性有关.
IBS是以腹痛或腹部不适为主要表现的功能性胃肠疾病, 其发病机制不完全清楚. 内脏高敏感作为其主要的发病机制之一近年来受到广泛关注[18,19]. 多种因素参与了内脏高敏感的形成, 越来越多的研究提示, 早期的负性生活事件在内脏高敏感的发生发展过程中具有重要作用. 新生期母婴分离可导致成年大鼠内脏高敏感的发生, 这一结果已得到国内外研究[15,20]的证实. 本研究通过新生期母婴分离处理的大鼠, 成年后接受CRD时AWR评分和EMG曲线下面积均明显高于正常对照组.
Nesfatin-1是2006年新发现的一种厌食肽, 在中枢神经系统和外周都有广泛的分布, nesfatin-1主要通过黑皮质激素途径及CRF途径抑制摄食, 可呈剂量依赖性的减少大鼠体质量的增加[7,21]. 本研究发现, 母婴分离大鼠成年后的体质量要明显低于正常大鼠, 但血浆nesfatin-1水平要明显高于正常大鼠, 这可能与nesfatin-1的抑制摄食及降低体质量的增加有关. Nesfatin-1除了参与摄食调节之外, 还可以增加下丘脑CRF神经元c-Fos的表达, 第三脑室注射nesfatin-1可激活下丘脑-垂体-肾上腺轴, 增加血浆皮质酮水平[13,22]. 本研究发现, 母婴分离大鼠血浆GC水平升高, 且与nesfatin-1水平呈正相关关系. 应激是内脏高敏感的形成与症状加重的重要因素之一. 有研究[23,24]报道, 应激可增加中枢nesfatin-1阳性细胞数, 但是关于早期负性生活事件等精神心理应激对nesfatin-1的影响方面的研究较少. 本研究发现, 新生期母婴分离大鼠的内脏敏感性明显增加, 血浆nesfatin-1水平显著高于正常大鼠, 并且血浆nesfatin-1水平与CRD刺激时的AWR评分与EMG曲线下面积均呈正相关, 提示血浆nesfatin-1水平的升高可能与大鼠的内脏高敏感的形成有关.
总之, 新生期母婴分离可诱导大鼠内脏高敏感的发生, 升高血浆nesfatin-1水平, 且nesfatin-1水平的升高可能与母婴分离大鼠的内脏高敏感性有关.
内脏高敏感性是肠易激综合征的重要发病因素, 新生期母婴分离可诱导大鼠成年后的内脏高敏感性. Nesfatin-1参与了应激反应过程. 目前为止, 尚未有关于新生期母婴分离对血浆nesfatin-1的影响及其与内脏敏感性的相关性的报道.
王小众, 教授, 福建医科大学附属协和医院消化内科
内脏高敏感是肠易激综合征的重要的病理生理学基础; nesfatin-1是2006年新发现的摄食调节肽, 参与了应激反应过程, 并且可以激活下丘脑-垂体-肾上腺轴; 目前关于nesfatin-1对大鼠内脏敏感性的影响及机制的研究较少.
目前关于nesfaitn-1与大鼠内脏敏感性的研究较少, 本课题组的前期实验采用醋酸灌肠法造的内脏高敏感大鼠模型, 结果发现nesfatin-1可能通过中枢CRF-CRFR途径影响大鼠的内脏敏感性.
本文章中, 首次探讨了母婴分离大鼠的血浆nesfatin-1水平, 通过检测血浆GC水平来提示下丘脑-垂体-肾上腺轴的状态, 探讨了血浆nesfatin-1水平与大鼠内脏敏感性之间的相关性.
本研究旨在探讨nesfatin-1对大鼠内脏敏感性的影响, 为将来研究其可能的机制打下基础. 以期在将来为可能开发该物质相关药物用于IBS治疗提供理论基础.
本文对母婴分离大鼠内脏敏感性进行研究, 结果证实新生期母婴分离诱导成年大鼠的内脏高敏感性, 血浆nesfatin-1水平升高可能是其机制之一, 对揭示IBS的发病机制具一定意义.
编辑: 郭鹏 电编: 都珍珍
| 1. | Bengtson MB, Rønning T, Vatn MH, Harris JR. Irritable bowel syndrome in twins: genes and environment. Gut. 2006;55:1754-1759. [PubMed] |
| 2. | Fukudo S, Kanazawa M. Gene, environment, and brain-gut interactions in irritable bowel syndrome. J Gastroenterol Hepatol. 2011;26 Suppl 3:110-115. [PubMed] [DOI] |
| 3. | Barbara G, De Giorgio R, Stanghellini V, Cremon C, Salvioli B, Corinaldesi R. New pathophysiological mechanisms in irritable bowel syndrome. Aliment Pharmacol Ther. 2004;20 Suppl 2:1-9. [PubMed] |
| 4. | Mertz H, Naliboff B, Munakata J, Niazi N, Mayer EA. Altered rectal perception is a biological marker of patients with irritable bowel syndrome. Gastroenterology. 1995;109:40-52. [PubMed] |
| 5. | Fukudo S, Saito K, Sagami Y, Kanazawa M. Can modulating corticotropin releasing hormone receptors alter visceral sensitivity? Gut. 2006;55:146-148. [PubMed] |
| 6. | Dinan TG, Quigley EM, Ahmed SM, Scully P, O'Brien S, O'Mahony L, O'Mahony S, Shanahan F, Keeling PW. Hypothalamic-pituitary-gut axis dysregulation in irritable bowel syndrome: plasma cytokines as a potential biomarker? Gastroenterology. 2006;130:304-311. [PubMed] |
| 7. | Oh-I S, Shimizu H, Satoh T, Okada S, Adachi S, Inoue K, Eguchi H, Yamamoto M, Imaki T, Hashimoto K. Identification of nesfatin-1 as a satiety molecule in the hypothalamus. Nature. 2006;443:709-712. [PubMed] |
| 8. | Brailoiu GC, Dun SL, Brailoiu E, Inan S, Yang J, Chang JK, Dun NJ. Nesfatin-1: distribution and interaction with a G protein-coupled receptor in the rat brain. Endocrinology. 2007;148:5088-5094. [PubMed] |
| 9. | Könczöl K, Bodnár I, Zelena D, Pintér O, Papp RS, Palkovits M, Nagy GM, Tóth ZE. Nesfatin-1/NUCB2 may participate in the activation of the hypothalamic-pituitary-adrenal axis in rats. Neurochem Int. 2010;57:189-197. [PubMed] [DOI] |
| 10. | Merali Z, Cayer C, Kent P, Anisman H. Nesfatin-1 increases anxiety- and fear-related behaviors in the rat. Psychopharmacology (Berl). 2008;201:115-123. [PubMed] [DOI] |
| 11. | Goebel M, Stengel A, Wang L, Taché Y. Restraint stress activates nesfatin-1-immunoreactive brain nuclei in rats. Brain Res. 2009;1300:114-124. [PubMed] [DOI] |
| 12. | Foo KS, Brismar H, Broberger C. Distribution and neuropeptide coexistence of nucleobindin-2 mRNA/nesfatin-like immunoreactivity in the rat CNS. Neuroscience. 2008;156:563-579. [PubMed] [DOI] |
| 13. | Price CJ, Hoyda TD, Samson WK, Ferguson AV. Nesfatin-1 influences the excitability of paraventricular nucleus neurones. J Neuroendocrinol. 2008;20:245-250. [PubMed] |
| 14. | Jia FY, Li XL, Li TN, Wu J, Xie BY, Lin L. Role of nesfatin-1 in a rat model of visceral hypersensitivity. World J Gastroenterol. 2013;19:3487-3493. [PubMed] [DOI] |
| 15. | Gosselin RD, O'Connor RM, Tramullas M, Julio-Pieper M, Dinan TG, Cryan JF. Riluzole normalizes early-life stress-induced visceral hypersensitivity in rats: role of spinal glutamate reuptake mechanisms. Gastroenterology. 2010;138:2418-2425. [PubMed] [DOI] |
| 16. | Al-Chaer ED, Kawasaki M, Pasricha PJ. A new model of chronic visceral hypersensitivity in adult rats induced by colon irritation during postnatal development. Gastroenterology. 2000;119:1276-1285. [PubMed] |
| 18. | Xu D, Wu X, Grabauskas G, Owyang C. Butyrate-induced colonic hypersensitivity is mediated by mitogen-activated protein kinase activation in rat dorsal root ganglia. Gut. 2013;62:1466-1474. [PubMed] [DOI] |
| 19. | Azpiroz F, Bouin M, Camilleri M, Mayer EA, Poitras P, Serra J, Spiller RC. Mechanisms of hypersensitivity in IBS and functional disorders. Neurogastroenterol Motil. 2007;19:62-88. [PubMed] |
| 20. | Coutinho SV, Plotsky PM, Sablad M, Miller JC, Zhou H, Bayati AI, McRoberts JA, Mayer EA. Neonatal maternal separation alters stress-induced responses to viscerosomatic nociceptive stimuli in rat. Am J Physiol Gastrointest Liver Physiol. 2002;282:G307-G316. [PubMed] |
| 21. | Gotoh K, Masaki T, Chiba S, Ando H, Shimasaki T, Mitsutomi K, Fujiwara K, Katsuragi I, Kakuma T, Sakata T. Nesfatin-1, corticotropin-releasing hormone, thyrotropin-releasing hormone, and neuronal histamine interact in the hypothalamus to regulate feeding behavior. J Neurochem. 2013;124:90-99. [PubMed] [DOI] |
| 22. | Yoshida N, Maejima Y, Sedbazar U, Ando A, Kurita H, Damdindorj B, Takano E, Gantulga D, Iwasaki Y, Kurashina T. Stressor-responsive central nesfatin-1 activates corticotropin-releasing hormone, noradrenaline and serotonin neurons and evokes hypothalamic-pituitary-adrenal axis. Aging (Albany NY). 2010;2:775-784. [PubMed] |
| 23. | Xu L, Bloem B, Gaszner B, Roubos EW, Kozicz T. Stress-related changes in the activity of cocaine- and amphetamine-regulated transcript and nesfatin neurons in the midbrain non-preganglionic Edinger-Westphal nucleus in the rat. Neuroscience. 2010;170:478-488. [PubMed] [DOI] |