修回日期: 2015-03-05
接受日期: 2015-03-18
在线出版日期: 2015-05-08
目的: 通过检测RhoGTP酶解离抑制因子2(RhoGTPase dissociation inhibitor 2, RhoGDI2)在胃癌和癌旁组织中的表达并结合临床病理特点进行分析, 探讨RhoGDI2的蛋白表达水平与胃癌组织侵袭转移的关系及在肿瘤发生发展中的作用.
方法: 采用免疫组织化学方法检测127例肿瘤组织标本和癌旁标本中RhoGDI2蛋白的表达.
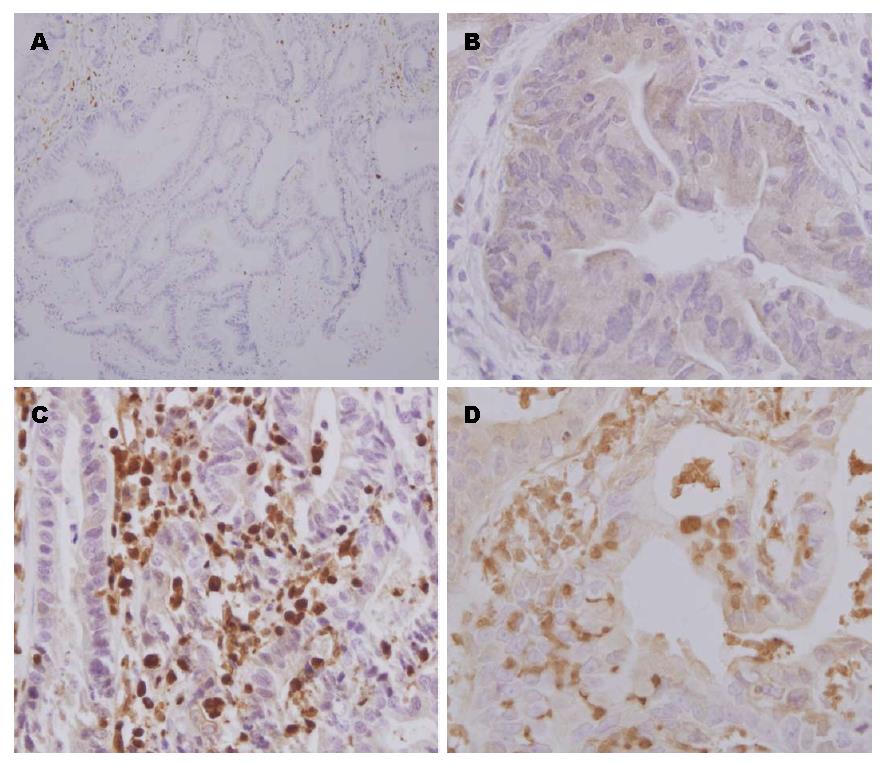
结果: RhoGDI2阳性表达主要在血液淋巴细胞、粒细胞、巨噬细胞. 胃癌细胞中也有表达, 主要为胞浆表达. 实验中发现胃癌组织中RhoGDI2阳性表达率为65.4%(83/127). 且大多数在细胞浆中表达, 低分化癌细胞核也有表达. 在癌旁正常胃黏膜组织中表达阴性, 胃癌组织中RhoGDI2的表达在低分化组显著高于高中分化组(χ2 = 9.702, P<0.05), 随着原发肿瘤的浸润深度阳性表达率增高(浸润深度T3-4, 或T1-2)(χ2 = 8.029, P<0.05), 有淋巴结转移的阳性表达率显著高于无淋巴结转移(χ2 = 18.53, P<0.05), 有远处转移较无远处转移的表达高(χ2 = 24.1, P<0.05)临床分期(Ⅲ-Ⅳ)显著高于临床分期(Ⅰ-Ⅱ)(χ2 = 8.530, P<0.05). RhoGDI2表达与性别(χ2 = 0.126, P>0.05)、年龄(<60岁, ≥60岁)(χ2 = 0.916, P>0.05)、原发灶直径(<5 cm, ≥5 cm)(χ2 = 2.620, P>0.05)无相关性.
结论: RhoGDI2的表达与胃癌的发生发展和转移过程呈正相关, RhoGDI2可能参与胃癌发生发展中的侵袭及转移过程.
核心提示: RhoGTP酶解离抑制因子2(RhoGTPase dissociation inhibitor 2, RhoGDI2)是恶性肿瘤侵袭和转移因子RhoGTP酶的关键调节因子, 其在胃癌中表达明显高于正常胃黏膜组织, 并且与胃癌的组织分化程度、浸润深度、淋巴结转移、远处转移和TNM分期呈正相关. 证实RhoGDI2参与胃癌侵袭和转移.
引文著录: 鲁守堂, 杨建树, 李成军, 徐忠法. RhoGDI2蛋白的高表达促进胃癌的侵袭和转移. 世界华人消化杂志 2015; 23(13): 2064-2070
Revised: March 5, 2015
Accepted: March 18, 2015
Published online: May 8, 2015
AIM: To detect the expression of RhoGTP enzymatic dissociation inhibitory factor 2 (RhoGDI2) in gastric cancer, and to explore the relationship between RhoGDI2 expression and invasion and metastasis of gastric cancer.
METHODS: Immunohistochemistry was used to detect the expression of RhoGDI2 protein in 127 pairs of gastric cancer and adjacent tissue specimens.
RESULTS: RhoGDI2 was expressed mainly in hematopoietic tissues (leukomonocytes, granulocytes, and macrophagocytes). RhoGDI2 was also expressed in gastric cancer, mainly in the cytoplasm of tumor cells. The positive rate of RhoGDI2 protien expression was significantly higher in gastric cancer than in normal gastric tissues (65.4% vs 0.00%, P < 0.05). RhoGDI2 expression in gastric cancer tissue in the low differentiation group was significantly higher than in the high and moderate differentiation group. The expression of RhoGDI2 protein in gastric cancer was significantly correlated with grade of differentiation (χ2 = 9.702, P < 0.05), depth of invasion (χ2 = 8.029, P < 0.05), lymph node metastasis (χ2 = 18.53, P < 0.05), distant metastasis (χ2 = 24.1, P < 0.05) and clinical stage (χ2 = 8.530, P < 0.05). RhoGDI2 expression in gastric cancer was negatively correlated with gender (χ2 = 0.126, P > 0.05), age (<60 years vs ≥60 years; χ2 = 0.916, P > 0.05), and diameter of primary tumor (< 5 cm vs ≥ 5 cm; χ2 = 2.620, P > 0.05).
CONCLUSION: The expression of RhoGDI2 has a positive correlation with the invasion and metastasis of gastric cancer, and RhoGDI2 may participate in the occurrence and development of gastric cancer.
- Citation: Lu ST, Yang JS, Li CJ, Xu ZF. Expression of RhoGDI2 protein in gastric cancer promotes tumor invasion and metastasis. Shijie Huaren Xiaohua Zazhi 2015; 23(13): 2064-2070
- URL: https://www.wjgnet.com/1009-3079/full/v23/i13/2064.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i13.2064
胃癌是消化系最常见的恶性肿瘤, 全世界范围内恶性肿瘤中发病率位于第4位, 是目前癌症死亡的第2位, 据世界卫生组织/国际癌症研究中心公布的统计数据显示中国2012年新发胃癌病例及相关死亡人数占全球的首位, 超过40%. 在我国胃癌的死亡率居恶性肿瘤第2位, 胃癌患者往往就诊时即处于晚期, 约42.4%处于Ⅳ期[1,2]. 影响其治疗和预后的因素中, 侵袭和转移是主要的因素. 近年来关于影响侵袭和转移的基因研究引起了人们的重视. 发现RhoGTP酶在肿瘤细胞骨架和细胞黏附中发挥重要作用, 其高表达通过促进血管生成因子的表达而促进血管生成和肿瘤细胞入血, 从而促进了肿瘤的侵袭和转移[3]. 其中鸟嘌呤核苷酸解离抑制因子2(RhoGTPase dissociation inhibitor 2, RhoGDI2)是RhoGDI家族成员之一, 以往研究[4]发现RhoGDI2是膀胱癌的抑制因子, 但近来研究[5]表明RhoGDI2在不同肿瘤细胞中的表达不同, 并在一些肿瘤组织中具有促进肿瘤生长的侵袭转移功能. 鉴于其在不同肿瘤中的不同作用, 对于其在肿瘤中的作用处于争议中. 目前较少研究RhoGDI2在胃癌组织中的作用及表达水平. 为了研究RhoGDI2在胃癌中的表达水平和参与胃癌细胞侵袭和转移的作用, 探讨其相关作用机制. 我们应用免疫组织化学方法检测RhoGDI2在胃癌组织及癌旁正常组织中的表达, 并分析其与临床病理因素的关系, 研究其在胃癌侵袭和转移的作用机制.
石蜡切片: 样本选取山东省医学科学院附属医院2011-07/2013-07采取手术切除的127例胃癌病例, 所有病例均有完整的临床资料, 均病理证实, 并未接受术前放化疗(病例资料如表1). 胃癌TNM分期依据美国癌症联合会(American Joint Committee on Cancer, AJCC)第七版分期标准. 本试验经山东省医学科学院伦理委员会论证通过, 并全部已与患者签署知情同意书, 标本经石蜡包埋、标准条件存放. 所有病例标本包含肿瘤组织及癌旁组织两部分. 兔抗人RhoGDI2抗体购自ABCAM公司; SP免疫染色试剂盒, DAB显色试剂盒购自北京中杉金桥生物技术有限公司.
| 临床病理特点 | n | RhoGDI2表达 | χ2值 | P值 | ||
| 阳性 | 阴性 | 阳性率(%) | ||||
| 性别 | 0.126 | 0.722 | ||||
| 男 | 72 | 48 | 24 | 66.7 | ||
| 女 | 55 | 35 | 20 | 63.6 | ||
| 年龄(岁) | 0.916 | 0.339 | ||||
| <60 | 68 | 47 | 21 | 69.1 | ||
| ≥60 | 59 | 36 | 23 | 61.0 | ||
| 原发灶直径(cm) | 2.620 | 0.106 | ||||
| <5 | 54 | 31 | 23 | 57.4 | ||
| ≥5 | 73 | 52 | 21 | 71.2 | ||
| 组织学分级 | 9.702 | 0.002 | ||||
| 高-中分化 | 36 | 16 | 20 | 44.4 | ||
| 低分化 | 91 | 67 | 24 | 73.6 | ||
| 原发灶浸润深度 | 8.029 | 0.005 | ||||
| T1-2 | 28 | 12 | 16 | 42.9 | ||
| T3-4 | 99 | 71 | 28 | 71.7 | ||
| 淋巴结转移 | 18.530 | 0.000 | ||||
| N0 | 41 | 16 | 25 | 39.0 | ||
| N1-3 | 96 | 67 | 19 | 77.9 | ||
| 远处转移 | 24.100 | 0.000 | ||||
| M0 | 72 | 34 | 38 | 47.2 | ||
| M1 | 55 | 49 | 6 | 89.1 | ||
| 临床分期 | 8.530 | 0.003 | ||||
| Ⅰ-Ⅱ期 | 23 | 9 | 14 | 39.1 | ||
| Ⅲ-Ⅳ期 | 104 | 74 | 30 | 71.2 | ||
1.2.1 免疫组织化学染色: 切片, 70 ℃ 30 min脱蜡, 二甲苯浸泡5 min×2次, 梯度乙醇脱水, 水洗, PBS冲洗1遍, 枸橼酸浸泡, 热修复, 3%H2O2去离子水避光孵育10 min, PBS冲洗3次×3 min, 滴加一抗(1:200), 4 ℃过夜; PBS洗3次×3 min, 滴加聚合物辅助剂(试剂A)室温孵育20 min, PBS洗3次×3 min, 滴加辣根素过氧化物酶标记羊抗兔/小鼠IgG多聚体(试剂B), 37 ℃孵育20 min, PBS洗3次×3 min, 新鲜配制DAB显色, 蒸馏水洗涤, 苏木素复染, 梯度乙醇脱水, 二甲苯透明, 中性树胶封片. 以PBS替代一抗作为阴性对照, 用已知阳性胎盘切片作为阳性对照.
1.2.2 免疫组织化学染色结果评定: 用光学显微镜观察免疫组织化学切片, 进行半定量评估, 在高倍显微镜下对每张切片随机选择5视野, 判断结果依据Shimizu方法[6]. 对每张切片阳性细胞的阳性强度按无着色、淡黄色、棕黄色和棕褐色分别为0、1、2、3分, 着色阳性细胞比率按无、0%-10%; 11-50%; 51-80%; >80%分别为0、1、2、3、4分, 然后根据两项分数之和判断其结果, 分数≥3分为阳性. 本试验所有切片均由两名有经验的病理科医生采取双盲法评估.
统计学处理 统计学分析借助于SPSS19.0软件, 将病例资料按照性别、年龄、原发灶直径、原发灶浸润深度、组织学分级、淋巴结转移、远处转移、疾病分期分为两组, 分别将RhoGDI2阳性表达率进行χ2检验, P<0.05为差异有统计学意义.
在选取的127例胃癌组织中, RhoGDI2蛋白在胃腺癌的阳性率为65.4%. RhoGDI2蛋白在胃癌旁组织不表达, 两者之间差异有统计学意义. 其中高中分化阳性率44.4%, 低分化阳性率73.6%(χ2 = 9.702, P<0.05). TNM分期Ⅰ、Ⅱ期组阳性率42.9%, Ⅲ、Ⅳ期组阳性率71.7%(χ2 = 8.530, P<0.05). 两者有显著的统计学意义. 有淋巴结转移组阳性率77.9%, 无淋巴结转移阳性率39.0%(χ2 = 18.53, P<0.05), 两者有显著的统计学意义. 原发灶浸润深度(T1-2)阳性率42.9%, T3-4阳性率71.7%(χ2 = 8.029, P<0.05), 两者有统计学意义. RhoGDI2蛋白阳性表达率与性别(P>0.05)、年龄(<60岁, ≥60岁)(P>0.05)原发灶直径(肿瘤直径<5 cm, ≥5 cm)(P>0.05)无关(表1, 图1).
胃癌是消化系最常见的恶性肿瘤, 居于癌症死亡的第2位. 侵袭和转移是影响预后的主要因素. 有关胃癌侵袭和转移的分子机制尚未完全阐明, 探讨和研究导致胃癌发生侵袭和转移的相关基因具有重要的意义.
恶性肿瘤的侵袭和转移的发生是具有遗传不稳定的肿瘤细胞与原发灶外的组织微环境的适应和发展过程, 这一过程涉及肿瘤细胞的选择性和相伴随的原发性肿瘤细胞补充等特性, 包括细胞间黏连的改变、运动侵袭性的获得, 微环境的适应性生存, 进入血管和淋巴管循环, 涉及很多基因的变化和作用[7]. 在诸多基因中, RhoGTP酶超家族参与了很多关键步骤; 控制很多细胞传导通路、调节许多生物过程, 包括基因的表达、细胞生长的控制、细胞骨架的重排, 微管结构、细胞膜内外信号的传导. 主要有RhoA、Rac1和Cdc42[8,9].
RhoGDI2是Rho家族中的一员, 通过调节RhoGTP酶的活性而发挥作用, 是RhoGTP酶家族的关键调节因子[10]. 最初发现RhoGDI2在造血组织及B和T淋巴细胞优先表达[11,12], 其后的研究发现RhoGDI2也在非造血组织肿瘤组织中表达, 并在肿瘤中的作用不尽相同. 2002年, Gildea等[4]发现RhoGDI2在膀胱癌中低表达, 进一步研究中发现RhoGDI2在膀胱癌低侵袭性细胞株中高表达, 而在高侵袭性细胞株中不表达. 在高侵袭性细胞株中强制表达RhoGDI2, 抑制细胞的入侵、运动和转移从而抑制膀胱肿瘤的侵袭和转移[13]. 并且发现降低RhoGDI2蛋白表达与5年无病生存率和疾病相关存活率相关, 是膀胱癌独立的预后预测因子[14]. 也发现在肺癌[15]和霍奇金淋巴瘤中表达下调[16]. 其后Tapper等[17]研究发现RhoGDI2在紫杉醇耐药的卵巢癌中高表达, 可能是紫杉醇化疗耐药的预测指标之一[18]. RhoGDI2在卵巢癌中与Rac活性相关, RhoGDI2高表达增强Rac的活性从而促进肿瘤的生长、侵袭和转移[19]. 在乳腺癌中的研究, Hu等[20]发现伴随乳腺上皮细胞的增殖和癌变, RhoGDI2的表达呈现先升高后降低的两阶段变化模式, 并且表达的降低与淋巴结转移相关, 具有抑制肿瘤转移的作用. RhoGDI2在不同的肿瘤表达水平不尽相同, 也发挥不同的功能: 促进和抑制肿瘤的侵袭和转移. 其在不同肿瘤的表达及作用机制目前尚没有定论, 需要更进一步的研究. 目前国内外关于RhoGDI2在胃癌组织的表达研究较少, Cho等[21]通过蛋白质组学分析152例胃癌组织和正常组织, 发现RhoGDI2在胃癌组织中高表达, 是癌旁正常组织的2.34倍(P<0.001). 其后又通过对26例外科切除胃癌标本进行检测, 发现RhoGDI2在进展期胃癌组织中高表达, 在正常胃组织中低表达或不表达. 在早期胃癌中不表达或低表达. 更发现RhoGDI2表达与淋巴结转移相关. 实验中他们发现RhoGDI2在高侵袭性的细胞系中高表达, 在低侵袭性的细胞系中不表达, RhoGDI2超表达可以增强胃癌细胞的侵袭和转移能力, 抑制RhoGDI2的表达可以抑制胃癌细胞的侵袭和转移能力. 在低侵袭性的细胞系中强制表达RhoGDI2可以促进肿瘤生长, 血管生成和肺转移. 降低RhoGDI2的表达可以降低胃癌入侵静脉系统和淋巴结转移[22]. 在胃癌组织中的作用机制的研究中发现RhoGDI2通过增加细胞生长因子水平, 上调血管内皮生长因子, 促进细胞生长因子介导的胃肿瘤侵袭和转移[23]. RhoGDI2也与促进肿瘤细胞侵袭和转移的血管内皮生长因子(vascular endothelial growth facto, VEGF)-C因子表达呈正相关[24].
国内尚欠缺胃癌组织中RhoGDI2因子的蛋白表达及机制的研究. 本实验通过免疫组织化学染色方法, 检测RhoGDI2在胃癌组织中蛋白水平的表达. 结果表明RhoGDI2蛋白在65.4%胃癌组织中的表达阳性, 而癌旁正常胃黏膜组织中的表达阴性, 进一步分析显示RhoGDI2的表达与胃癌分化程度、浸润深度、淋巴结转移、远处转移、及临床分期密切相关. 在低分化、T3-4期、淋巴结转移、远处转移和TNM分期晚的胃癌组织中显著升高, 且大多数在细胞浆中表达, 低分化癌细胞核也有表达. 实验表明RhoGDI2在胃癌的发生发展和侵袭转移的过程中发挥重要的作用. 但RhoGDI2在胃癌中作用机制及相关因子的关系及信号传导途径仍需进一步研究. 我们可以借鉴RhoGDI2在其他肿瘤中的机制研究的成果. 回顾相关文献, 我们可以看到Schunke等[25]发现RhoGDI2是乳腺癌的肿瘤促进因子Ets1的靶基因, Ets1通过结合RhoGDI2基因的上游启动子调节RhoGDI2的表达, 并且与基质金属酶表达增加和肿瘤侵袭相关[26,27]. Hood等[28]发现RhoGDI2通过调节β1整合蛋白在肿瘤细胞侵袭和转移中发挥重要的作用. Jiang等[29]发现在有阳性淋巴结转移的乳腺癌组织中RhoGDI2的表达水平高于无淋巴结转移乳腺癌组织. 另外出现了相对使人困惑的结果, Hu等[20]发现在乳腺上皮细胞增殖和致癌作用及侵袭转移中RhoGDI2的表达呈现双相性. 但是在大多数恶性上皮细胞中降低RhoGDI2的表达与淋巴结转移具有显著相关性(P<0.01)[30].
RhoGDI2在不同的肿瘤组织中, 对肿瘤侵袭和转移的作用不同, RhoGDI2在肿瘤中的作用机制是否呈现双相性? 其在上下游因子的信号传导途径中具体作用我们仍然不清楚, 需进一步在分子水平检测RhoGDI2的表达, 研究其作用机制, 探讨胃癌组织中参与的信号通路, 对其上下游调节因子进行深入的研究, 有望成为临床上针对胃癌转移治疗的新方法, 同时对其结构和功能的研究也可以为其作用机制进行研究提供依据, 也将可能为未来治疗肿瘤药物的研发提供新的治疗策略.
RhoGTP酶解离抑制因子2(RhoGTPase dissociation inhibitor 2, RhoGDI2)最初在膀胱癌中被发现, 并证实是膀胱癌的转移抑制因子, 其后人们对该因子进行了一系列的研究, 发现RhoGDI2在不同肿瘤细胞的表达不同, 在卵巢癌、乳腺癌、胃癌中正向调节肿瘤进展, 而在膀胱癌、霍奇金淋巴瘤中起负向调节作用.
张小晋, 主任医师, 北京积水潭医院
RhoGDI2在不同的肿瘤类型和肿瘤分期中表达不同, 在肿瘤的侵袭和转移中呈现双重作用, RhoGDI2是乳腺癌的肿瘤促进因子并且与Ets1、基质金属酶表达增加和肿瘤侵袭相关, 通过调节β1整合蛋白在肿瘤细胞侵袭和转移中发挥重要的作用. 在大多数恶性上皮细胞中降低RhoGDI2的表达与淋巴结转移具有显著相关性.
Cho等通过蛋白质组学分析发现RhoGDI2在胃癌组织中高表达.更在进展期胃癌组织中高表达, 并且RhoGDI2表达与淋巴结转移相关. 超表达RhoGDI2可以增强胃癌细胞的侵袭和转移能力, 抑制RhoGDI2的表达可以抑制胃癌细胞的侵袭和转移能力. 在胃癌组织中的作用机制的研究中发现RhoGDI2通过增加细胞生长因子水平, 上调血管内皮生长因子, 促进细胞生长因子介导的胃肿瘤侵袭和转移.
本实验对RhoGDI2在127例胃癌组织中蛋白水平的表达进行检测, 证实大多数胃癌组织中RhoGDI2的表达高于正常胃黏膜组织, 与组织分化程度、浸润深度、淋巴结转移和TNM分期呈正相关, 促进肿瘤侵袭和转移.
RhoGDI2在很多肿瘤中过表达, 并且在一部分肿瘤组织的侵袭和转移呈正相关, 进一步研究其信号传导途径及上下游作用因子, 可以将其作为药物应用的靶点, 作为治疗策略的一种选择.
本文通过免疫组织化学染色方法检测了胃癌组织中的RhoGDI蛋白表达情况, 证实其在肿瘤侵袭和转移中呈相关, 为进一步研究作用机制提供了依据, 具有一定指导意义.
编辑: 郭鹏 电编: 都珍珍
| 1. | Kamangar F, Dores GM, Anderson WF. Patterns of cancer incidence, mortality, and prevalence across five continents: defining priorities to reduce cancer disparities in different geographic regions of the world. J Clin Oncol. 2006;24:2137-2150. [PubMed] [DOI] |
| 2. | World Health Organization. WHO Global status report on noncommunicable diseases 2014. Available from: http://www.who.int/topics/cancer/en/. |
| 3. | Bagheri-Yarmand R, Mazumdar A, Sahin AA, Kumar R. LIM kinase 1 increases tumor metastasis of human breast cancer cells via regulation of the urokinase-type plasminogen activator system. Int J Cancer. 2006;118:2703-2710. [PubMed] [DOI] |
| 4. | Gildea JJ, Seraj MJ, Oxford G, Harding MA, Hampton GM, Moskaluk CA, Frierson HF, Conaway MR, Theodorescu D. RhoGDI2 is an invasion and metastasis suppressor gene in human cancer. Cancer Res. 2002;62:6418-6423. [PubMed] |
| 5. | Cho HJ, Baek KE, Kim IK, Park SM, Choi YL, Nam IK, Park SH, Im MJ, Yoo JM, Ryu KJ. Proteomics-based strategy to delineate the molecular mechanisms of RhoGDI2-induced metastasis and drug resistance in gastric cancer. J Proteome Res. 2012;11:2355-2364. [PubMed] [DOI] |
| 6. | Shimizu M, Saitoh Y, Itoh H. Immunohistochemical staining of Ha-ras oncogene product in normal, benign, and malignant human pancreatic tissues. Hum Pathol. 1990;21:607-612. [PubMed] [DOI] |
| 7. | Steeg PS, Theodorescu D. Metastasis: a therapeutic target for cancer. Nat Clin Pract Oncol. 2008;5:206-219. [PubMed] [DOI] |
| 8. | Nobes CD, Hall A. Rho, rac and cdc42 GTPases: regulators of actin structures, cell adhesion and motility. Biochem Soc Trans. 1995;23:456-459. [PubMed] |
| 9. | Aznar S, Lacal JC. Rho signals to cell growth and apoptosis. Cancer Lett. 2001;165:1-10. [PubMed] [DOI] |
| 10. | Dovas A, Couchman JR. RhoGDI: multiple functions in the regulation of Rho family GTPase activities. Biochem J. 2005;390:1-9. [PubMed] [DOI] |
| 11. | Lelias JM, Adra CN, Wulf GM, Guillemot JC, Khagad M, Caput D, Lim B. cDNA cloning of a human mRNA preferentially expressed in hematopoietic cells and with homology to a GDP-dissociation inhibitor for the rho GTP-binding proteins. Proc Natl Acad Sci USA. 1993;90:1479-1483. [PubMed] |
| 12. | Scherle P, Behrens T, Staudt LM. Ly-GDI, a GDP-dissociation inhibitor of the RhoA GTP-binding protein, is expressed preferentially in lymphocytes. Proc Natl Acad Sci USA. 1993;90:7568-7572. [PubMed] [DOI] |
| 13. | Seraj MJ, Harding MA, Gildea JJ, Welch DR, Theodorescu D. The relationship of BRMS1 and RhoGDI2 gene expression to metastatic potential in lineage related human bladder cancer cell lines. Clin Exp Metastasis. 2000;18:519-525. [PubMed] |
| 14. | Theodorescu D, Sapinoso LM, Conaway MR, Oxford G, Hampton GM, Frierson HF. Reduced expression of metastasis suppressor RhoGDI2 is associated with decreased survival for patients with bladder cancer. Clin Cancer Res. 2004;10:3800-3806. [PubMed] [DOI] |
| 15. | Niu H, Li H, Xu C, He P. Expression profile of RhoGDI2 in lung cancers and role of RhoGDI2 in lung cancer metastasis. Oncol Rep. 2010;24:465-471. [PubMed] [DOI] |
| 16. | Ma L, Xu G, Sotnikova A, Szczepanowski M, Giefing M, Krause K, Krams M, Siebert R, Jin J, Klapper W. Loss of expression of LyGDI (ARHGDIB), a rho GDP-dissociation inhibitor, in Hodgkin lymphoma. Br J Haematol. 2007;139:217-223. [PubMed] [DOI] |
| 17. | Tapper J, Kettunen E, El-Rifai W, Seppälä M, Andersson LC, Knuutila S. Changes in gene expression during progression of ovarian carcinoma. Cancer Genet Cytogenet. 2001;128:1-6. [PubMed] [DOI] |
| 18. | Goto T, Takano M, Sakamoto M, Kondo A, Hirata J, Kita T, Tsuda H, Tenjin Y, Kikuchi Y. Gene expression profiles with cDNA microarray reveal RhoGDI as a predictive marker for paclitaxel resistance in ovarian cancers. Oncol Rep. 2006;15:1265-1271. [PubMed] [DOI] |
| 19. | Stevens EV, Banet N, Onesto C, Plachco A, Alan JK, Nikolaishvili-Feinberg N, Midkiff BR, Kuan PF, Liu J, Miller CR. RhoGDI2 antagonizes ovarian carcinoma growth, invasion and metastasis. Small GTPases. 2011;2:202-210. [PubMed] [DOI] |
| 20. | Hu LD, Zou HF, Zhan SX, Cao KM. Biphasic expression of RhoGDI2 in the progression of breast cancer and its negative relation with lymph node metastasis. Oncol Rep. 2007;17:1383-1389. [PubMed] [DOI] |
| 21. | Cho HJ, Baek KE, Park SM, Kim IK, Choi YL, Cho HJ, Nam IK, Hwang EM, Park JY, Han JY. RhoGDI2 expression is associated with tumor growth and malignant progression of gastric cancer. Clin Cancer Res. 2009;15:2612-2619. [PubMed] [DOI] |
| 22. | Shida A, Fujioka S, Takahashi N, Aoki H, Okamoto T, Mitsumori N, Omura N, Yanaga K. Reduced expression of Rho GDP dissociation inhibitor 2 mRNA is associated with lymph node metastasis in gastric carcinoma. Oncol Lett. 2013;6:463-467. [PubMed] [DOI] |
| 23. | Koh SA, Kim MK, Lee KH, Kim SW, Kim JR. RhoGDI2 is associated with HGF-mediated tumor invasion through VEGF in stomach cancer. Clin Exp Metastasis. 2014;31:805-815. [PubMed] [DOI] |
| 24. | Cho HJ, Kim IK, Park SM, Baek KE, Nam IK, Park SH, Ryu KJ, Choi J, Ryu J, Hong SC. VEGF-C mediates RhoGDI2-induced gastric cancer cell metastasis and cisplatin resistance. Int J Cancer. 2014;135:1553-1563. [PubMed] [DOI] |
| 25. | Schunke D, Span P, Ronneburg H, Dittmer A, Vetter M, Holzhausen HJ, Kantelhardt E, Krenkel S, Müller V, Sweep FC. Cyclooxygenase-2 is a target gene of rho GDP dissociation inhibitor beta in breast cancer cells. Cancer Res. 2007;67:10694-10702. [PubMed] |
| 26. | Puzovic V, Brcic I, Ranogajec I, Jakic-Razumovic J. Prognostic values of ETS-1, MMP-2 and MMP-9 expression and co-expression in breast cancer patients. Neoplasma. 2014;61:439-446. [PubMed] [DOI] |
| 27. | Seth A, Watson DK. ETS transcription factors and their emerging roles in human cancer. Eur J Cancer. 2005;41:2462-2478. [PubMed] [DOI] |
| 28. | Hood JD, Cheresh DA. Role of integrins in cell invasion and migration. Nat Rev Cancer. 2002;2:91-100. [PubMed] [DOI] |
| 29. | Jiang WG, Watkins G, Lane J, Cunnick GH, Douglas-Jones A, Mokbel K, Mansel RE. Prognostic value of rho GTPases and rho guanine nucleotide dissociation inhibitors in human breast cancers. Clin Cancer Res. 2003;9:6432-6440. [PubMed] |
| 30. | Rivera Rosado LA, Rodriguez-Canales J, Zhang B. Association of D4-GDI expression with breast cancer progression. Cancer Biomark 2011-. 2012;10:163-173. [PubMed] [DOI] |