修回日期: 2015-03-10
接受日期: 2015-03-18
在线出版日期: 2015-04-28
目的: 用硫代乙酰胺(thioacetamide, TAA)灌胃法诱导大鼠形成肝纤维化, 建立一种稳定持久实用的大鼠肝纤维化模型.
方法: 将♂SD大鼠随机分为正常组和模型组, 模型组采用质量浓度为3%的TAA对SD大鼠进行隔天灌胃, 灌胃量为160 mg/kg体质量[灌胃体积(mL)为体质量(g)/187.5]; 正常组采用溶剂蒸馏水代替TAA灌胃. 灌胃6 wk后处死大鼠, 采集血清和肝组织, 血清分别进行肝功能(血氨、碱性磷酸酶、总胆红素、白蛋白/球蛋白)和细胞因子[肝细胞生长因子(hepatocyte growth factor, HGF)、肝素结合表皮生长因子(heparin-binding epidermal growth factor, HB-EGF)、白介素-6(interleukin-6, IL-6)、α-平滑肌抗体(α-smooth muscle antibody, α-SMA)]水平检测, 肝组织分别进行HE和Masson染色, 并对纤维化程度进行病理分级. 留取部分成模大鼠, 停止灌服TAA 11 wk后, 取肝组织做HE染色, 观察肝纤维化自愈情况.
结果: TAA灌胃6 wk后, 大鼠肝纤维化形成率为100%. 与对照组相比, 模型组大鼠肝功能变化显著, 其中血氨、碱性磷酸酶和总胆红素浓度显著升高, 白蛋白/球蛋白比值显著降低(P<0.01); 血清中细胞因子HGF与HB-EGF水平显著降低, IL-6、α-SMA水平显著升高(P<0.01). 停用TAA 11 wk后, 与11 wk前相比, HE染色显示肝组织纤维化程度, 未见显著变化.
结论: TAA灌胃6 wk可以形成稳定和持久的肝纤维化, 肝纤维化形成率高且速度快, 是一种简便实用的肝纤维化模型制备方法.
核心提示: 目前, 最为常用的CCl4所导致的肝纤维化模型存在缺陷, 即自愈性, 一旦停药, 肝脏纤维化程度会逐渐减轻, 这个问题在观察药物的长期作用效果时尤为显著. 而硫代乙酰胺(thioacetamide)灌胃诱导的大鼠肝纤维化模型持久稳定, 无自愈性.
引文著录: 薛改, 刘建芳, 闫成, 张庆霞, 郑丽, 侯艳宁. 硫代乙酰胺诱导大鼠持久性肝纤维化模型的制备. 世界华人消化杂志 2015; 23(12): 1937-1942
Revised: March 10, 2015
Accepted: March 18, 2015
Published online: April 28, 2015
AIM: To establish a stable and efficient rat model of thioacetamide (TAA) induced hepatic fibrosis.
METHODS: Male SD rats were randomly divided into a normal group and a model group. The model group was intragastrically administrated 3% TAA at 160 mg/kg body weight and the normal group was administrated distilled water. Serum and hepatic tissue samples were collected after 6 wk. Serum levels of ammonia (BAM), alkaline phosphatase (AKP), total bilirubin (TBIL), albumin/globulin (ALB/GLB) and cell factors including hepatocyte growth factor (HGF), heparin-binding epidermal growth factor (HB-EGF), interleukin-6 (IL-6), and α-smooth muscle antibody (α-SMA) were detected. Histopathological examination of liver tissue was conducted by HE staining and Masson staining, and the degree of liver fibrosis was observed under a microscope. The natural repair of hepatic fibrosis was observed by HE staining 11 wk after stopping administration of TAA.
RESULTS: The rate of hepatic fibrosis was 100% after intragastric administration of TAA for 6 wk. Compared with the control group, the liver function in the model group changed significantly; serum levels of BAM, AKP and TBIL increased significantly, and the ratio of ALB/GLB decreased significantly (P < 0.01). Serum levels of HGF and HB-EGF decreased significantly, and serum IL-6 and α-SMA increased significantly (P < 0.01). The degree of hepatic fibrosis was not changed until 11 weeks after stopping TAA.
CONCLUSION: A stable and persistent rat model of hepatic fibrosis has been successfully prepared by intragastric administration of TAA for 6 wk. This is a convenient and practical method to establish a rat liver fibrosis model with a high rate of hepatic fibrosis formation.
- Citation: Xue G, Liu JF, Yan C, Zhang QX, Zheng L, Hou YN. Establishment of a rat model of thioacetamide induced hepatic fibrosis. Shijie Huaren Xiaohua Zazhi 2015; 23(12): 1937-1942
- URL: https://www.wjgnet.com/1009-3079/full/v23/i12/1937.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i12.1937
肝纤维化在我国为常见肝脏疾病, 发病率高, 由此导致的严重肝硬化、肝功能衰竭等终末期肝病死亡率达到20%-50%, 至今仍是人类健康的沉重负担和五大死因之一[1]. 研究[2-4]认为, 肝纤维化是肝脏对各种原因所致肝损伤的创伤愈合反应, 是进一步向肝硬化发展的重要环节, 也是原发性肝癌发病的危险因素之一. 因此, 阻断肝纤维化的进一步发展是肝病治疗中的一个关键问题. 而制备出标准而理想的肝纤维化模型是肝脏疾病研究的基础. 本实验参考文献[5,6]后进行改良, 拟应用硫代乙酰胺(thioacetamide, TAA)灌胃法制备肝纤维化模型, 以期建立一种简单实用、稳定持久、接近人类肝纤维化形成过程的动物模型, 为肝脏疾病的研究提供实验基础.
清洁级健康成年SD♂大鼠82只(购自河北省实验动物中心, 合格证号: 1305066), 体质量180 g±20 g, 动物适应新环境7 d后再进行实验, 实验过程对动物的处置符合动物伦理学要求. TAA购自Sigma公司; 血氨(blood ammonia, BAM)测试盒(货号: A086)、碱性磷酸酶(alkaline phosphatase, AKP)测试盒(货号: A059-2)及总胆红素(total bilirubin, TBIL)测试盒(货号: C018), 均购自南京建成生物工程研究所; 大鼠血清白蛋白(albumin, ALB)ELISA检测试剂盒, 大鼠球蛋白(globulin, GLB)ELISA检测试剂盒, 均购自ImmunoWay公司; 大鼠肝细胞生长因子(hepatocyte growth factor, HGF)ELISA试剂盒, 大鼠肝素结合表皮生长因子(heparin binding-epidermal growth factor, HB-EGF)ELISA试剂盒, 大鼠白介素-6(interleukin-6, IL-6)ELISA试剂盒, 大鼠α-平滑肌抗体(α-smooth muscle antibody, α-SMA)ELISA试剂盒, 均购自Bmassay公司. VersaMax连续波长多功能酶标仪(美国Molecular Devices公司).
1.2.1 分组与造模: 大鼠按体质量随机分为2组: 第1组: 正常对照组6只: 正常饲养. 第2组: TAA灌胃组76只: TAA灌胃浓度为3%, 灌胃量按160 mg/kg计算, 隔天灌胃1次, 每周称质量1次, 根据体质量变化调整TAA的灌胃量, 调整方法: (1)1 wk内体质量下降5%以内者维持原用量; (2)1 wk内体质量下降5%-10%者用量减少为原用量的1/2; (3)1 wk内体质量下降10%以上者暂停注射, 待体质量停止下降再调整用量, 以避免死亡.
1.2.2 标本采集及指标检测: 造模期间大鼠一般情况的观察指标主要有体质量的监测, 活动情况, 饮食情况, 死亡情况等. TAA灌胃组在灌胃6 wk时麻醉大鼠后心脏取血, 分离血清, 分别测定BAM、AKP、ALB、GLB、TBIL、HGF、HB-EGF、IL-6、α-SMA的浓度. 严格按试剂说明书操作, 步骤从略. 并取同一部位肝组织标本用40 g/L的甲醛溶液固定24 h, 石蜡包埋, 5 μm厚连续切片, 进行常规HE染色和纤维特染Masson染色, 行病理组织学检查. TAA灌胃组大鼠在灌胃6 wk后留存6只大鼠, 继续饲养11 wk后取肝叶做常规HE染色, 观察肝纤维化复原情况.
1.2.3 肝纤维化分期标准: 肝脏胶原纤维染色采用Masson染色法, 主要观察纤维组织增生纤维间隔、假小叶形成情况. 肝纤维化程度病理分期目前普遍采用英国肝脏病理学家Scheuer[7]1994年提出的方案: S0级无纤维化; S1级门管区及其周围星芒状纤维化; S2级纤维间隔形成; S3级众多纤维间隔使肝小叶结构凌乱, 伴假小叶形成趋势; S4级早期肝硬化.
统计学处理 统计结果以mean±SD表示; 用SPSS13.0统计软件, 采用完全随机设计两均数t检验对数据进行统计分析. 统计结果以P<0.05为差异具有统计学意义.
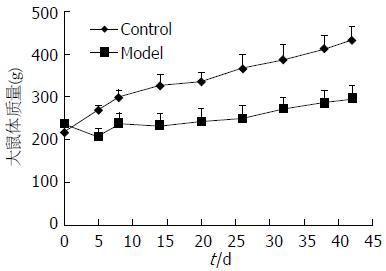
造模期间, 正常大鼠毛发光泽, 活动正常, 而进行TAA灌胃的大鼠则普遍出现皮毛蓬乱无光泽, 精神萎靡, 活动减少, 体质量低于正常组(图1), 并出现死亡现象, 死亡率为19.7%. TAA灌胃组与正常组相比, 饮水量和进食量未见明显变化.
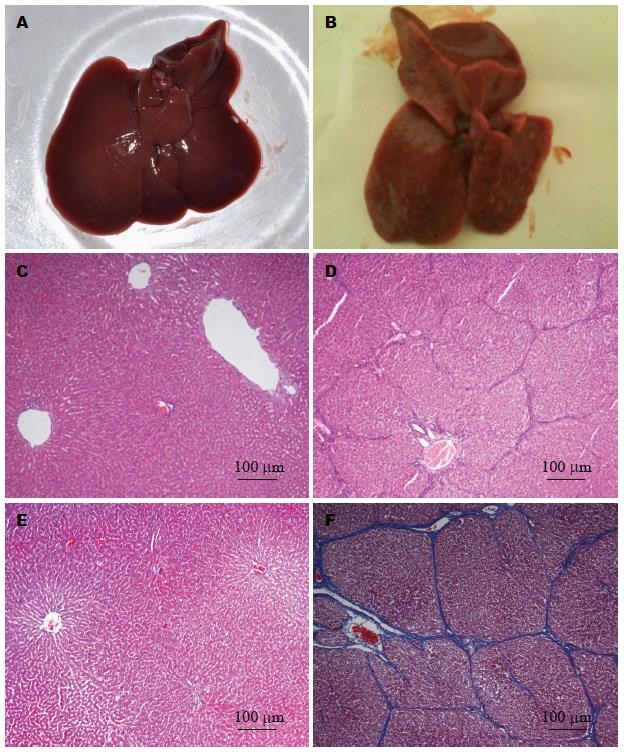
大体观察: 正常肝脏颜色鲜红, 有光泽, 质软, 边缘锐(图2A); TAA灌胃组肝组织颜色灰暗, 无光泽, 表面粗糙, 可见颗粒状结节形成, 质地硬, 边缘钝(图2B). 大鼠肝脏切片常规HE染色可见, 正常组肝脏肝细胞形态正常, 肝小叶结构完整, 肝板以中央静脉为中心, 呈条索状向四周放射样排列, 且排列整齐(图2C); TAA灌胃组肝脏切片可见, 纤维组织增生, 小叶结构破坏; 肝细胞再生形成不具正常结构的假小叶, 存在炎细胞浸润和胆管细胞增生(图2D). Masson染色可见, TAA灌胃组肝脏切片蓝色深染的纤维更加清晰明显(图2F), 进一步验证了肝纤维化的形成, 纤维化形成率达100%. 肝纤维化程度按分期标准所占比例分别为S0级0.0%、S1级21.7%、S2级21.7%、S3级13.1%、S4级43.5%. TAA灌胃6 wk, 停药11 wk后, 处死大鼠观察大体肝脏及肝组织的常规HE染色, 肝纤维化分期均为S4级.
与对照组相比, BAM、TBIL和AKP的血清浓度均显著升高(P<0.01), ALB/GLB的血清浓度显著降低(P<0.01). 其中, AKP的浓度升高为对照组的2.9倍, TBIL的浓度升高超过3倍, 说明伴随肝纤维化的形成, 肝功能已经出现明显的异常(表1).
与对照组相比, HGF和HB-EGF的血清浓度显著降低(P<0.01), IL-6和α-SMA的血清浓度显著升高(P<0.01). 说明肝纤维化的形成, 伴随有相关细胞因子的改变, 这为研究肝纤维化的机制提供了数据(表2).
理想的纤维化动物模型应与人类疾病特征相似, 且造模方法简单, 模型形成率高, 重现性好. 迄今为止, 模型制作尚没有统一的标准, 究其原因, 与肝纤维化的病因多样性、动物和人的种属差异等有关. 在现今常用的动物模型中, CCl4所导致的肝纤维化模型最为常用, 然而CCl4等化学性肝纤维化模型对不同动物致纤维化的程度差异较大, 且肝不良反应剧烈、动物死亡率高[8]. 而且, CCl4所导致的肝纤维化存在自愈性, 即在药物存在的情况下, 可形成肝纤维化, 一旦停药, 肝脏纤维化程度会逐渐减轻, 因此在研究治疗药物治疗作用同时, 可能会引起假阳性的出现, 尤其是观察药物的长期作用效果时, 这个问题尤为显著[9,10]. 研究者[11-14]在研究干细胞对肝纤维化的治疗作用时, 选用CCl4作为形成肝纤维化的药物, 为了避免肝纤维化的自愈性, 通常是在给予干细胞治疗的同时, 继续给予CCl4, 以避免肝纤维化自愈性的干扰. 这样的结果引发了以下思考: CCl4是否在干细胞发挥作用的同时对干细胞存在一定的影响? 是有益的作用还是有害的作用? 答案未知; 而且这种给药方式称之为治疗作用还是预防作用还需要商榷. 因此, 一种稳定而持久的肝纤维化模型的建立, 就显得尤为重要.
TAA诱导慢性肝损伤的机制是影响蛋白合成及肝细胞中酶的代谢, 在组织学和生化代谢的变化上与各种病因引起的人类肝硬化改变很相似, 诱导所产生的肝纤维化更为稳定和持久. 有研究者[15]采用TAA饮水诱导肝硬化的形成, 本研究也选取了一组动物采用此法, 结果显示TAA饮水与灌胃在肝纤维化形成后的持久性无差别, 但是饮TAA水法诱导需要的时间较长, 有文献[16]报道为5 mo, 还有报道为1年[17], 此外因TAA水有特殊的味道, 大鼠拒饮, 饮TAA水法饮水量不能很好地控制, 饮水量约为正常组的1/3, 饮水量的减少使得大鼠血液黏稠, 采血难度加大. 我们在水中加入了甜味剂(0.05%蛋白糖), 增加甜味, 问题仍没有得到显著改善. TAA灌胃法能很好地控制给药量, 且与腹腔注射给药[18]相比, 有不形成黏连的优点, 且更加接近人类肝纤维化的形成途径. 监测大鼠体质量发现, TAA灌胃组大鼠在TAA灌胃1 wk后体质量略有下降, 以后缓慢增长, 增长速度与正常组相比显著降低, 符合肝纤维化大鼠的特征.
在应用TAA灌胃法制备大鼠肝纤维化模型后, 检测了肝功能的变化, 与正常组相比, 模型组的BAM、AKP和TBIL的水平均有显著性升高, 而ALB/GLB比值显著下降, 说明在肝纤维化形成的同时, 肝功能已明显受损. 肝细胞的坏死导致了AKP的外溢、BAM和TBIL的代谢异常以及白蛋白的合成障碍. 因此, 这些肝功能指标为TAA所致肝纤维化的敏感指标.
研究[19]认为, 肝纤维化的形成其实质是细胞外基质(extracellular matrix, ECM)的合成和降解失衡, 导致细胞内基质在肝内的过量沉积. 在肝纤维化的病理发展过程中, 肝星形细胞发挥着重要的作用, 因为他是肝脏内胶原和其他ECM的主要来源细胞, 并调节基质金属蛋白酶的活性. 正常情况下, 肝星形细胞对肝内的基质的调节处于动态的平衡, 当刺激因子刺激肝脏时, 星形细胞会被激活, 进而转变为成肌纤维细胞并分泌α-SMA, α-SMA为激活的肝星形细胞和成肌纤维细胞的共同标志[20,21], α-SMA水平的升高预示了肝纤维化的形成. 本研究结果显示TAA灌胃后α-SMA水平显著升高, 因此α-SMA有望作为肝纤维化的一个血清学指标.
HGF是肝细胞生长和增殖所必需的重要细胞因子之一, 此外HGF还被认为具有诱导肝星形细胞和成肌纤维细胞凋亡的作用[10], 正常情况下, HGF由肝细胞和星形细胞共同分泌, 肝纤维化的形成导致了大量肝细胞的变性和坏死以及ECM的大量堆积, 因此HGF的水平会下降, 本研究结果显示肝纤维化模型组大鼠血清HGF水平显著降低, 一方面是肝细胞严重受损的表现; 另一方面也为治疗提供了检测指标.
总之, 本实验所建立的大鼠肝纤维化模型, 方法简单且稳定持久, 与人类肝纤维化的形成过程类似, 是研究肝纤维化治疗及其机制探讨的理想动物模型.
肝纤维化在我国为常见肝脏疾病, 发病率高, 由此导致的严重肝硬化, 肝功能衰竭等终末期肝病至今仍是人类健康的沉重负担和五大死因之一. 阻断肝纤维化的进一步发展是肝病治疗中的一个关键问题. 而制备出标准而理想的肝纤维化模型是肝脏疾病研究的基础.
高泽立, 副教授, 周浦医院消化科, 上海交通大学医学院九院周浦分院
理想的纤维化动物模型应与人类疾病特征相似, 且造模方法简单, 模型形成率高, 重现性好. 迄今为止, 模型制作尚没有统一的标准, 建立一种稳定而持久的肝纤维化模型, 已成为亟待解决的问题.
本实验所建立的大鼠肝纤维化模型, 与人类肝纤维化的形成过程类似, 并在模型建立后检测了细胞因子肝细胞生长因子(hepatocyte growth factor)、肝素结合表皮生长因子(heparin binding-epidermal growth factor)、白介素-6(interleukin-6)与α-平滑肌抗体(α-smooth muscle antibody)的血清浓度, 为肝脏疾病的治疗及机制研究提供了更多的数据.
本文建立了一种方法简单且稳定持久的肝纤维化模型, 是研究肝纤维化、肝硬化等肝脏疾病治疗及其机制探讨的理想动物模型.
硫代乙酰胺(TAA): 为一种慢性致癌物, 其诱导慢性肝损伤的机制是影响蛋白合成及肝细胞中酶的代谢, 在组织学和生化代谢的变化上与各种病因引起的人类肝硬化改变很相似, 诱导所产生的肝纤维化更为稳定和持久.
本研究紧扣当前危害人民健康的常见病, 实验设计合理, 造模统计分析合理, 参考文献较新. TAA诱导大鼠持久性肝纤维化模型, 是研究肝纤维化治疗及其机制探讨的理想动物模型, 此模型的建立将有助于基础和临床研究者对肝纤维化患者进行早期干预治疗.
编辑: 韦元涛 电编:闫晋利
| 1. | Jia JD, Zhuang H. A winning war against hepatitis B virus infection in China. Chin Med J (Engl). 2007;120:2157-2158. [PubMed] |
| 2. | Fujii T, Fuchs BC, Yamada S, Lauwers GY, Kulu Y, Goodwin JM, Lanuti M, Tanabe KK. Mouse model of carbon tetrachloride induced liver fibrosis: Histopathological changes and expression of CD133 and epidermal growth factor. BMC Gastroenterol. 2010;10:79. [PubMed] [DOI] |
| 3. | Ding BS, Cao Z, Lis R, Nolan DJ, Guo P, Simons M, Penfold ME, Shido K, Rabbany SY, Rafii S. Divergent angiocrine signals from vascular niche balance liver regeneration and fibrosis. Nature. 2014;505:97-102. [PubMed] [DOI] |
| 4. | Ahmad A, Ahmad R. Understanding the mechanism of hepatic fibrosis and potential therapeutic approaches. Saudi J Gastroenterol. 2012;18:155-167. [PubMed] [DOI] |
| 5. | Al-Humadi H, Theocharis S, Dontas I, Stolakis V, Zarros A, Kyriakaki A, Al-Saigh R, Liapi C. Hepatic injury due to combined choline-deprivation and thioacetamide administration: an experimental approach to liver diseases. Dig Dis Sci. 2012;57:3168-3177. [PubMed] [DOI] |
| 6. | Lee TF, Lin YL, Huang YT. Protective effects of kaerophyllin against liver fibrogenesis in rats. Eur J Clin Invest. 2012;42:607-616. [PubMed] [DOI] |
| 7. | Scheuer PJ. In: 4th biennial scientific meeting acial-pacific association for the study of liver. Taxonomy of chronic hepatitis. 1994;26:403. |
| 9. | Esrefoglu M. Role of stem cells in repair of liver injury: experimental and clinical benefit of transferred stem cells on liver failure. World J Gastroenterol. 2013;19:6757-6773. [PubMed] [DOI] |
| 11. | Yan Y, Xu W, Qian H, Si Y, Zhu W, Cao H, Zhou H, Mao F. Mesenchymal stem cells from human umbilical cords ameliorate mouse hepatic injury in vivo. Liver Int. 2009;29:356-365. [PubMed] [DOI] |
| 12. | Tsai PC, Fu TW, Chen YM, Ko TL, Chen TH, Shih YH, Hung SC, Fu YS. The therapeutic potential of human umbilical mesenchymal stem cells from Wharton's jelly in the treatment of rat liver fibrosis. Liver Transpl. 2009;15:484-495. [PubMed] [DOI] |
| 13. | Ren H, Zhao Q, Cheng T, Lu S, Chen Z, Meng L, Zhu X, Yang S, Xing W, Xiao Y. No contribution of umbilical cord mesenchymal stromal cells to capillarization and venularization of hepatic sinusoids accompanied by hepatic differentiation in carbon tetrachloride-induced mouse liver fibrosis. Cytotherapy. 2010;12:371-383. [PubMed] [DOI] |
| 14. | Li T, Yan Y, Wang B, Qian H, Zhang X, Shen L, Wang M, Zhou Y, Zhu W, Li W. Exosomes derived from human umbilical cord mesenchymal stem cells alleviate liver fibrosis. Stem Cells Dev. 2013;22:845-854. [PubMed] [DOI] |
| 15. | Hwang S, Hong HN, Kim HS, Park SR, Won YJ, Choi ST, Choi D, Lee SG. Hepatogenic differentiation of mesenchymal stem cells in a rat model of thioacetamide-induced liver cirrhosis. Cell Biol Int. 2012;36:279-288. [PubMed] [DOI] |
| 17. | Pellicoro A, Aucott RL, Ramachandran P, Robson AJ, Fallowfield JA, Snowdon VK, Hartland SN, Vernon M, Duffield JS, Benyon RC. Elastin accumulation is regulated at the level of degradation by macrophage metalloelastase (MMP-12) during experimental liver fibrosis. Hepatology. 2012;55:1965-1975. [PubMed] [DOI] |
| 18. | Ling H, Roux E, Hempel D, Tao J, Smith M, Lonning S, Zuk A, Arbeeny C, Ledbetter S. Transforming growth factor β neutralization ameliorates pre-existing hepatic fibrosis and reduces cholangiocarcinoma in thioacetamide-treated rats. PLoS One. 2013;8:e54499. [PubMed] [DOI] |
| 19. | Friedman SL. Mechanisms of hepatic fibrogenesis. Gastroenterology. 2008;134:1655-1669. [PubMed] [DOI] |
| 20. | Salguero Palacios R, Roderfeld M, Hemmann S, Rath T, Atanasova S, Tschuschner A, Gressner OA, Weiskirchen R, Graf J, Roeb E. Activation of hepatic stellate cells is associated with cytokine expression in thioacetamide-induced hepatic fibrosis in mice. Lab Invest. 2008;88:1192-1203. [PubMed] [DOI] |
| 21. | Magness ST, Bataller R, Yang L, Brenner DA. A dual reporter gene transgenic mouse demonstrates heterogeneity in hepatic fibrogenic cell populations. Hepatology. 2004;40:1151-1159. [PubMed] [DOI] |